La prematuridad extrema se asocia a altas tasas de mortalidad. Para profesionales y familias, es prioritario establecer de forma individualizada las probabilidades de muerte en diferentes momentos. El objetivo de este estudio es efectuar una revisión sistemática de modelos predictivos de mortalidad en prematuros publicados recientemente.
MétodosDoble búsqueda de artículos publicados en PubMed sobre modelos predictivos de muerte en prematuros. Población estudiada: prematuros con edad gestacional ≤ 30 semanas o peso al nacer ≤ 1.500g. Inclusión: trabajos publicados con nuevos modelos desde junio del 2010 hasta julio del 2019, tras revisión sistemática de Medlock (2011). Se valoran: población, características de modelos, variables utilizadas, medidas de funcionamiento y validación.
ResultadosDe 7.744 referencias (primera búsqueda) y 1.435 (segunda búsqueda), se seleccionaron 31 trabajos, incluyéndose al final 8 nuevos modelos. Cinco modelos (62,5%) se desarrollaron en América del Norte y 2 (25%) en Europa. Un modelo secuencial (Ambalavanan) permite realizar predicciones de muerte al nacer, 7, 28 días de vida y 36 semanas posmenstruales. Análisis de regresión logística múltiple en el 87,5% de modelos. La discriminación poblacional se midió por odds ratio (75%) y área bajo la curva (50%). La «validación» se ha realizado en 5 modelos (interna). Tres modelos disponen de acceso online. No hay modelos predictivos validados en España.
ConclusionesLa toma de decisiones basada en modelos predictivos permite una mayor individualización de la atención dada a un niño prematuro y una mejor utilización de recursos. Es necesario desarrollar modelos de predicción de mortalidad en prematuros de España.
Extreme prematurity is associated with high mortality rates. The probability of death at different points in time is a priority for professionals and parents, and needs to be established on an individual basis. The aim of this study is to carry out a systematic review of predictive models of mortality in premature infants that have been published recently.
MethodsA double search was performed for article published in PubMed on models predicting mortality in premature neonates. The population studied were premature neonates with a gestational age of ≤30 weeks and / or a weight at birth of ≤1500g. Works published with new models from June 2010 to July 2019 after a systematic review by Medlock (2011) were included. An assessment was made of the population, characteristics of the model, variables used, measurements of functioning, and validation.
ResultsOf the 7744 references (1st search) and 1435 (2nd search) found, 31 works were selected, with 8 new models finally being included. Five models (62.5%) were developed in North America and 2 (25%) in Europe. A sequential model (Ambalavanan) enables predictions of mortality to be made at birth, 7, 28 days of life, and 36 weeks post-menstrual. A multiple logistic regression analysis was performed on 87.5% of the models. The population discrimination was measured using Odds Ratio (75%) and the area under the curve (50%). “Internal Validation” had been carried out on 5 models. Three models can be accessed on-line. There are no predictive models validated in Spain.
ConclusionsThe making of decisions based on predictive models can lead to the care given to the premature infant being more individualised and with a better use of resources. Predictive models of mortality in premature neonates in Spain need to be developed.
La prematuridad es la principal causa de mortalidad perinatal y es responsable del 50% de la discapacidad en la infancia1. Cada año nacen en España alrededor de 30.000 niños prematuros. Entre ellos, un 10% tienen una edad gestacional (EG) ≤ 32 semanas o un peso de nacimiento (PN) ≤ 1.500g2,3.
El grupo de recién nacidos prematuros extremos (EG ≤ 28 semanas) y especialmente los nacidos en el límite de la viabilidad (23-25 semanas de EG) suponen un reto para los profesionales responsables de su cuidado y tratamiento. Debido a su gran inmadurez, algunos de estos pacientes pueden presentar situaciones médicas para las que no existe tratamiento curativo alguno, siendo necesario implementar cuidados paliativos. Esta toma de decisiones es un proceso largo y complejo, tanto para los profesionales como para las familias4. La dificultad radica en pronosticar de forma precisa el futuro de un paciente determinado.
Los modelos predictivos estiman la probabilidad o riesgo de que una condición ocurra en el futuro de un individuo tras la combinación de diferentes factores pronósticos5. Así, mientras el diagnóstico de una condición es esencial en la decisión clínica, el empleo de elementos pronósticos incorpora nuevas herramientas que permiten acotar mejor el futuro de esa condición y por tanto dirigir las decisiones para mejorarlo de manera individualizada6. Numerosos factores influyen en el pronóstico de una enfermedad más allá de sus diagnósticos. Por ejemplo, al analizar la EG en prematuros extremos, es posible predecir el nivel y la duración de los cuidados que van a recibir (intensivos, de alta dependencia y especiales), así como las probabilidades de muerte o alta a domicilio a lo largo de su ingreso7.
La prematuridad extrema es una situación con altas tasas de mortalidad cuyo riesgo cambia con relación a las complicaciones asociadas. Es importante, tanto para los clínicos y las familias de estos niños, poder establecer las probabilidades de muerte de forma individualizada en diferentes momentos de su evolución, preferentemente antes del nacimiento, las primeras horas de vida y durante el ingreso hospitalario. En el año 2011, Medlock et al.8 publicaron una revisión sistemática que contenía 41 estudios con modelos predictivos de mortalidad aplicables a prematuros extremos en alguno de estos momentos anteriormente citados.
El objetivo de este trabajo es realizar una revisión sistemática actualizada de los modelos predictivos de mortalidad en prematuros, desarrollados y validados durante los últimos 10años.
Material y métodosBúsqueda y selección de estudiosPara el presente trabajo se ha realizado una búsqueda bibliográfica sobre modelos predictivos de mortalidad que incluyeron a neonatos prematuros, utilizándose la plataforma PubMed, desde junio del 2010 hasta julio del 2019, sin restricciones de lenguaje. Como descriptores para la búsqueda se emplearon los señalados por Geersing et al.9, para realizar revisiones sistemáticas de modelos predictivos. La búsqueda la han efectuado 2revisores independientes (MI y RR) seleccionando los trabajos finalmente incluidos para lectura completa con base en el título y el resumen de cada artículo. En caso de discrepancias entre los 2autores sobre la inclusión de un artículo, este se incluyó para lectura completa. Se han realizado 2búsquedas. En la primera (A) se emplearon los siguientes descriptores: Predict*[tiab] OR Predictive value of tests[mh] OR Scor*[tiab] OR Observ*[tiab] OR Observer variation[mh]) AND (premature (MESH term) OR very low birth weight (MESH term) OR VLBW OR ELBW OR very low-birth-weight OR extremely low-birth-weight OR preterm OR prematur-) AND (mortality OR death OR survival OR viability). En la segunda búsqueda (B) se utilizaron los siguientes descriptores: Stratification OR ROC Curve[Mesh] OR Discrimination OR Discriminate OR c-statistic OR c statistic OR Area under the curve OR AUC OR Calibration OR Índices OR Algorithm OR Multivariable) AND (infant OR premature (MESH term) OR infant OR very low birth weight (MESH term) OR VLBW OR ELBW OR very low-birth-weight OR extremely low-birth-weight OR preterm OR prematur-) AND (mortality OR death OR survival OR viability).
Criterios de inclusión y exclusiónLos criterios de inclusión de los trabajos seleccionados para análisis, fueron:
- –
Población: niños prematuros de menos de 32 semanas de EG o<1.500g de forma parcial o total en la muestra.
- –
Desenlace: mortalidad o supervivencia neonatal (sola o combinada con otra condición), al nacer, al alta de la UCIN o durante el seguimiento.
- –
Medidas de funcionamiento en los modelos predictivos: al menos una medida de un modelo multivariable (discriminación, calibración o predicción).
Se tabulan y enumeran trabajos con los siguientes criterios de exclusión:
- –
Validación de modelos predictivos antiguos (previos a junio del 2010).
- –
Análisis de factores o condiciones asociadas a pronóstico adverso (por ejemplo, muerte en recién nacido <1.500g con sepsis nosocomial).
Los trabajos incluidos se clasificaron como estudios de «desarrollo» (nuevos modelos predictivos, no publicados previamente o antiguos modificados), «validación» (evaluación del funcionamiento de modelos predictivos desarrollados previamente) o «estudios de impacto» (valoración del efecto de un modelo predictivo en la toma de decisiones).
En cada estudio de desarrollo incluido se valoraron la población, las características de los modelos predictivos, las variables utilizadas, las medidas de funcionamiento y validación del modelo predictivo.
- –
Población. Se define como los rangos de EG o PN de los pacientes. Se detalla la edad de los pacientes en el momento de inclusión en el modelo, así como el lugar y los años en los que se ha realizado el estudio.
- –
Características de los modelos predictivos. Incluye el «tiempo» o «momento» en el que se realiza la predicción (prenatal, primeras horas/días de vida, durante el ingreso en la UCIN). Se distinguen diferentes «tipos» de modelos: regresión logística, red neural, categorización «en árbol» u otras. Se registra la «forma» de expresar el modelo (score, algoritmo o ecuación) si se detalla en el artículo.
- –
Variables. Se diferencia la variable de desenlace (dependiente) y las variables de entrada (independientes) de cada modelo.
- –
Medidas de funcionamiento. Se distinguen las siguientes medidas:
- 1.
Discriminación (si el modelo da mayores probabilidades a los pacientes con el evento de desenlace (p. ej., fallecidos) con relación a los que no la presentan (p. ej., vivos), habitualmente medido por el (área bajo la curva (AUC) y la odds ratio (OR).
- 2.
Calibración (mide si la probabilidad preestablecida es aproximadamente correcta (p. ej., cuando el modelo predice un 60% de posibilidades de muerte, se espera que alrededor del 60% de los pacientes fallezcan). Se puede utilizar el test de Hosmer-Lemeshow.
- 3.
Precisión en la predicción: habitualmente es un resultado real que puede expresarse como un porcentaje de probabilidad, clasificarse en 0 o 1 (muerte o no muerte) basado en un punto de corte. Los más utilizados son la sensibilidad, especificidad, valor predictivo positivo y negativo. El score de Brier mide la desviación entre las probabilidades que se predicen y la realidad, sin verse influido por el punto de corte. Las medidas de precisión pueden combinar aspectos de discriminación y calibración.
La R2 de Nagelkerke combina las diferentes formas de medir ya descritas.
- –
Validación. Evalúa el rendimiento del modelo. La validación «interna» se puede realizar con la misma población de desarrollo (validación «aparente»), mediante subpoblaciones de muestreo (p. ej., bootstrap) o reservando una muestra separada para validación. La validación «externa» se realiza con una población diferente de la utilizada en el desarrollo del modelo. Se pueden utilizar la AUC y las pruebas que miden el poder de concordancia.
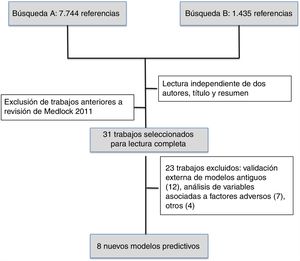
Se encontraron 7.744 referencias en la primera búsqueda y 1.435 en la segunda. Tras la lectura de título y resumen, se seleccionaron para lectura completa 31 trabajos publicados después del mes de mayo del 2010, excluyéndose 23. En este estudio se revisan los 8 nuevos modelos predictivos de mortalidad en prematuros publicados desde 201010-17 (fig. 1).
Los datos poblacionales, el momento de aplicación y el desenlace de los 8 nuevos modelos predictivos se muestran en la tabla 1. De estos, 5 (62,5%) se han desarrollado en América del Norte (3 en Canadá), 2 (25%) en Europa (Holanda e Italia) y uno es multicéntrico afectando a diferentes países. Todos incluyen a prematuros con diferentes PN y EG de forma exclusiva excepto el modelo mexicano14, que también se puede utilizar para recién nacidos a término. El tamaño de muestra es muy variado, siendo los que han analizado más prematuros el italiano17 (Podda et al.., n=23.747), canadiense10 (Shah et al., n=17.048) y el de EE. UU.11 (Ambalavanan et al., n=13.085). Con relación al «momento de aplicación», 2 (25%) son prenatales13,16, 6 (62,5%) se valoran al nacimiento o durante el primer día de vida10-12,14,17 y 2 (25%) hacen valoraciones durante el ingreso en la UCIN11,15. De estos nuevos modelos destaca el modelo secuencial de Ambalavanan et al.11, que permite adaptar el pronóstico según la trayectoria del recién nacido ya ingresado en la Unidad Neonatal al realizar predicciones a los 7, 28 días de vida y 36 semanas de edad posmenstrual. El «desenlace» es diferente en todos los estudios, en 3 (37,5%) se valora muerte exclusiva durante diferentes momentos del ingreso13,14,17 y en el resto se combina la muerte o supervivencia a diferentes grados de morbilidad durante el ingreso o posterior10,15,16.
Datos poblacionales, momento de aplicación y desenlace de los nuevos modelos predictivos de mortalidad en recién nacidos prematuros
| Autor (año) | País | Población | Entrada y salida | ||
|---|---|---|---|---|---|
| Inclusión | Fuente y recogida de datos (años)/(n) | Momento de aplicación | Desenlace | ||
| Podda (2018) | Italia | PN: ≤ 1.500 g, o | Base de datos de Italia (2008-2016) | Al nacimiento | Muerte antes del alta de UCIN |
| EG: < 30 s | n = 23.747 (desarrollo) n = 5.810 (validación) | ||||
| King (2016) | Canadá | EG: 23-28 s | London HS Centre (Ontario) (2001-2011) | Antes de nacer | Morbimortalidad al alta de UCIN |
| N = 766 (644 RN vivos admitidos en UCIN) | |||||
| Schmidt (2015) | Multicéntrico | PN: 500-1.250 g | Pacientes del CAP trial (1999-2004), n = 1.514 | Supervivientes a las 36 s EPM | Muerte tardía (> 36 semanas EPM) o discapacidad a los 5 años |
| Márquez-González (2015) | México | Recién nacidos | Hospital General de Troncoso (2005-2010) | Ingreso en UCIN | Predicción de mortalidad a los 7 días de vida |
| (Incluye prematuros) | n = 224 (desarrollo), n = 189 (validación) | ||||
| Ravelli (2014) | Holanda | EG: 25-31 s | Base de datos de Holanda (1999-2007) | Antes de nacer | Mortalidad primeros 28 días de vida |
| PN: > 500 g | n = 8.500 | ||||
| Ge (2013) | Canadá | EG: 23-30 s | Base de datos de Canadá (2010-2011) | Primer día de vida | Supervivencia sin morbilidad, o con morbilidad leve (HIV 1-2, |
| n = 6.106 | ROP 1-2, ECN 2, DBP solo O2 o 1 sepsis) o grave (HIV 3-4, ROP ≥ 3, | ||||
| ECN 3, DBP con ventilación o > 1 sepsis) al alta de UCIN | |||||
| Ambalavanan (2012) | EE. UU. | PN: ≤ 1.000 g, y | Base de datos EE. UU. (NRN) (1998-2005) | Secuencial: nacimiento, | Predicción de muerte o discapacidad (MDI < 70 en Bayley II, PDI < 70, |
| EG: 23-31 s | n = 13.085 | 7 ddv, 28 ddv y 36 s EPM | PC, ceguera bilateral o sordera con audífonos) a los 18-22 meses | ||
| Shah (2012) | Canadá | PN: < 1.500 g, o | Base de datos de Canadá (2003-2008) | Al nacimiento | Supervivencia sin morbilidad mayor (HIV grado 3-4, ROP ≥ 3, |
| EG: 24-31 s | N = 17.048 | ECN 2-3 o DBP) al alta de UCIN | |||
DBP: displasia broncopulmonar; ddv: días de vida; ECN: enterocolitis necrosante; EG: edad gestacional; EPM: edad posmenstrual; g: gramos; HIV: hemorragia intraventricular; LMPV: leucomalacia periventricular; MDI: Mental Developmental Index; PC: parálisis cerebral; PDI: Psychomotor Developmental Index; PN: peso de nacimiento; ROP: retinopatía; s: semanas; UCIN: Unidad de Cuidados Intensivos Neonatales.
La tabla 2 resume las características estadísticas de los 8 nuevos modelos predictivos. En el 87,5% se utilizan diferentes análisis de regresión logística múltiple y solo en el estudio más reciente17 se ha optado por un sistema de Neural Network. Las formas de mesurar el grado de discriminación entre poblaciones han sido la OR (75%) y el AUC (50%). El test de Hosmer-Lemeshow como medida de calibración, se ha utilizado en 3 estudios10,12,13 (37,5%) y el score de Brier que valora la precisión en 2 de ellos12,13 (25%). Las variables de entrada (dependientes) en los diferentes modelos han sido muy diferentes tanto en tipo como en número (tabla 2).
Características estadísticas de los nuevos modelos predictivos de mortalidad en recién nacidos prematuros
| Autor (año) | Modelo predictivo | |||
|---|---|---|---|---|
| Tipo | Forma de medir (test estadísticos) | Variables de entrada (dependientes) | Validación (test estadísticos) | |
| Podda (2018) | Neural Network | Algoritmo (AUC) | PN, EG, Apgar 1-5, género, modo de parto, raza materna, corioamnionitis, cuidados prenatales, esteroides antenatales, hipertensión materna, parto múltiple Disponible on line | Interna (cohorte específica) (AUC) |
| King (2016) | Regresión logística multivariable | Algoritmo a partir de coeficiente de regresión (OR) | EG, PN estimado, corticoides antenatales (incompleto, completo, no), género, gestación única o múltiple. Disponible on line | no |
| Schmidt (2015) | Modelos de regresión logística | Máxima probabilidad según 0, 1, 2, 3 morbilidades (OR) | ROP severa (estadio 4-5 o tratamiento de un ojo), daño cerebral severo (HIV grado 3-4, LMPV quística, quiste porencefálico, ventriculomegalia) o DBP (O2) a las 36 s EPM | no |
| Márquez-González (2015) | Caso-control y Análisis de regresión logística | Score acumulativo de 9 variables (OR) | Neonatal Mortality Score-9 Mexico. Incluye Apgar 5, PN, acidosis metabólica, lactato, paO2/FiO2, D(A-a) O2, A/a, recuento de plaquetas y glucosa sérica | Interna (cohorte específica). (Análisis de Cox, razón de riesgo: hazard ratio, Kaplan-Meier, validez: S; E; VPP; VPN y AUC) |
| Ravelli (2014) | Regresión logística múltiple (Ataike Information Criterion) | Ecuación (OR, AUC, Brier Score, Brier skill score, Hosmer Lemeshow C-statistic) | EG, corticoides prenatales, nivel de hospital, edad materna, raza materna. Presentación no cefálica, género | Interna (100 muestras de la cohorte de estudio) (Standard bootstrap method-Efron). (Nomograma de mortalidad neonatal) |
| Ge (2013) | Regresión logística múltiple | Algoritmo (OR, Brier Score, Brier skill score, Hosmer Lemeshow Cg-statistic) | EG, PEG, género, interno/externo, corticoides prenatales, SNAP-II mayor a 20, surfactante primer día y ventilación mecánica primer día de vida | Interna (200 muestras de la cohorte de estudio). (Standard bootstrap method-Efron) |
| Ambalavanan (2012) | Regresión logística múltiple | Algoritmo (AUC c-statistic y OR) | Nacimiento: PN, EG, Apgar 5, género, esteroides antenatales; 7 ddv: PN, género, grado de HIV, FiO2 más alta, días CPAP; 28 ddv: PN, FiO2 más alta, episodios de sepsis tardía, días NP, días CPAP; 36 s EPM: FiO2 más alta, episodios de sepsis tardía, DBP, días NP, días CPAP, ECN, LMPV. Disponible on line | No |
| Shah (2012) | Regresión logística múltiple | Ecuación (AUC y Hosmer Lemeshow test) | EG, Z score de peso, género | No |
A/a: índice alvéolo arterial; AUC: área bajo la curva; CPAP: presión continua vía aérea; D(A-a) O2: diferencia alvéolo arterial de O2; DBP: displasia broncopulmonar; ddv: días de vida; E: especificidad; ECN: enterocolitis necrosante; EG: edad gestacional; EPM: edad posmenstrual; g: gramos; HIV: hemorragia intraventricular; LMPV: leucomalacia periventricular; MDI: Mental Developmental Index; NP: nutrición parenteral; OR: odds ratio; paO2/FiO2: índice presión parcial de O2 y fracción inspiratoria de O2; PDI: Psychomotor Developmental Index; PEG: bajo peso; PN: peso de nacimiento; ROP: retinopatía; s: semanas; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La «validación» de los modelos se ha realizado «internamente» en 5 trabajos11-14,17 (62,5%). Dos modelos (25%) mediante cohortes específicas diferentes de las utilizadas en la fase de desarrollo14,17, uno analizando una subpoblación del 30% de la muestra total11 (12,5%) y otros 2(25%) utilizando métodos de «bootstrap» en pequeñas subpoblaciones de análisis12,13. Además, 3 disponen de herramientas on line11,16,17.
Los otros 23 trabajos inicialmente seleccionados tras la lectura completa y que fueron excluidos (tabla 3) incluyen 12 estudios de validación externa de modelos predictivos previamente descritos en la literatura, 7 estudios de análisis de diferentes variables asociadas a mal pronóstico, un estudio de empleo de SNAP para predecir muerte o displasia broncopulmonar (DBP), uno de predicción de tiempo de ingreso, uno de comparación de resultados de diferentes cohortes de niños prematuros y otro de empleo del Respiratory Severity Score para predecir muerte o DBP.
Artículos excluidos de análisis final
| Motivo de exclusión | Autor de artículo excluido, referencia (*modelo validado) |
|---|---|
| Validación externa de modelos antiguos* | Schuit, Pediatrics 2012;129(1):e120-127 (Draper) |
| Wu, Pediatr Neonatol 2015;56(2):108-113 (NITSS) | |
| Boland, Arch Dis Child Fetal Neonatal Ed 2012;0:F1-F4 (Tyson 2008) | |
| Gooden, Am J Perinatol 2014;31:441-446 (CRIB y SAWS) | |
| Reid, J Paediatr Child Health 2015;51(5):524-528 (CRIB II y SNAPPE II) | |
| Guenther, Neonatology 2015;108:172-178 (PREM score) | |
| Groenendaal, J Perinatol. 2017;37(5):547-551 (CRIB II y SNAPPE II) | |
| Yeo, BMJ Paediatrics Open 2017;1:e000205. doi: 10.1136/ bmjpo-2017-000205 (Tyson 2008) | |
| Marrs, Am J Perinatol 2016;33:569-576 (Tyson 2008) | |
| Ozcan, Turk J Pediatr 2017; 59(2):105-112 (SNAPPE II) | |
| Beltempo, The Journal of Maternal-Fetal & Neonatal Medicine 2019;32(16):2694-2701 (SNAP II) | |
| Lee, Neonatology 2019. doi: 10.1159/000500270 (CRIB II) | |
| Análisis de factores asociados a pronóstico adverso | Philips, Arch Dis Child Fetal Neonatal Ed 2011;96:F275-F280 |
| Wehby, Med Care 2012;50:714-721 | |
| Donofrio, JAMA Psych 2013;70(11):1231-1240 | |
| Alleman, Pediatrics 2013; 132 (1): e175-84 | |
| Salas, Arch Dis Child Fetal Neonatal Ed 2016; DOI:10.1136/archdischild- 2015-309670 | |
| Synnes, Arch Dis Child Fetal Neonatal ed. 2017;102(3):F235-F234 | |
| Cupen, Children 2017;4:108; doi: 10.3390/children4120108 | |
| Empleo de SNAP para predecir muerte o DBP | Li, BMC Pediatrics 2013;13:138. doi: 10.1186/1471-2431-13-138 |
| Predicción de tiempo de ingreso | Seaton, PLOS ONE 2016;11(10):e0165202 |
| Comparación de resultados de diferentes cohortes de niños prematuros | Koller-Smith, Pediatrics 2017;17:166. doi 10.1186/s12887-017-0921-x |
| Empleo de Respiratory Severity Score para predecir muerte o DBP | Young, BMC Pediatrics 2019;19:121. doi 10.1186/s12887-019-1492-9 |
Synes, 2017: predictores en Canadá de neurodesarrollo adverso en < 28 semanas. Excluido. Salas, 2016: Evaluate if weight is a better predictor than GA for death or neurodevelopmental outcome at 18-24 months of age. Del Neonatal Research Network. Excluido. D́Onofrio, 2013: Comparar asociación prematuridad con mortalidad y diferentes desenlaces: psiquiátrico, académicos y sociales. Excluido Wehby, 2012: Volumen de ingresos por hospital y mortalidad de VLBW en Nueva Jersey. Excluido. Philips, 2011: Neonatal illness prognosis indicator: Includes highest lactate first 12 hours of life, GA and presence of congenital malformations. Cupen, 2017: Factores de riesgo asociados con mortalidad en niños prematuros de Trinidad y Tobago. Excluido. Koller-Smith, 2017: Comparación de resultados de cohorte canadiense, sueca y australiana-Nueva Zelanda de resultados a corto plazo comparando VLBW (PN < 1.500 g) versus VLGA (EG menor de 32 semanas) resultados similares. Excluido. Li, 2013. Pronosticar BPD o muerte. Incluye SNAP, gestational age, apnea of prematurity, patent ductus arteriosus, and surfactant use en primeras 72 h de vida. Excluido.
Los métodos predictivos se basan en datos epidemiológicos poblacionales sobre el desenlace seleccionado mientras que los profesionales y las familias precisan datos específicos sobre el resultado individual de un niño concreto28. Así, la aplicabilidad del modelo puede verse disminuida por el hecho de que el mismo se desarrolle con base en datos que pueden estar obsoletos una vez el modelo ha sido validado. Al analizar modelos aparecidos tras la revisión de Medlock et al.8, se ve que algunos de ellos se basan en datos poblacionales de prematuros nacidos hasta 15 años antes de su publicación11,13,15,16. Además, algunos de estos modelos clásicos de predicción, como el CRIB19 o el de Draper20, fueron desarrollados con prematuros de la época anterior a la generalización del uso de surfactante, lo que puede condicionar su aplicabilidad actual.
Incluso en modelos recientes hay que considerar que el desarrollo en una determinada población puede no ser aplicable en otra. De ahí la importancia de modelos como el SAW o el SAWS21, diseñados para países en vías de desarrollo donde no tendría sentido aplicar otro tipo de variables. Es, por tanto, fundamental que un modelo predictivo conste no solo de validación interna, sino también de validación externa efectuada en poblaciones diferentes si se pretende que este sea generalizable más allá de la población original. De todos los modelos pronósticos desarrollados hasta la fecha en niños prematuros, menos de la mitad presentan validación interna y solo 4modelos han sido validados de manera externa en más de un estudio (NICHD, CRIB, SNAP II y SNAPPE II)8. Al analizar los 8 trabajos más recientes, la mitad de ellos han sido validados internamente12,17 sin que nos conste validación externa alguna, hecho que limita su aplicación en otras áreas geográficas.
En España, no existen en la actualidad modelos predictivos para niños prematuros basados en datos poblacionales propios, empleándose en la clínica diaria habitual el CRIB18 o el modelo NICHD de Tyson et al.22.
Para que la implementación del modelo sea mayor es útil disponer de herramientas «on line» fácilmente consultables e interpretables por los profesionales como sucede en algunos modelos11,16,17,22. Otro aspecto interesante sería el poder utilizar datos adaptables a las características concretas de un niño. En este sentido, cabe destacar el esfuerzo del modelo de NICHD 201211 para adaptar el pronóstico con base en diferentes sucesos que van ocurriendo durante el ingreso del niño prematuro, al ofrecer modelos predictivos secuenciales durante el nacimiento, 7 y 28 días de vida y 36 semanas posmenstruales. La mayoría de modelos existentes realizan predicciones en un momento determinado, predominando en el momento del nacimiento o en el primer día de ingreso10,12,14,16,17, lo cual limita su utilidad.
Otro aspecto importante es el desenlace o la variable dependiente evaluada. En los estudios más recientes aparte de la mortalidad o supervivencia en diferentes momentos (desde los 7 días de vida hasta el alta hospitalaria), hay estudios que valoran la morbilidad durante el ingreso12,16 o las alteraciones en el neurodesarrollo a los 18-22 meses11.
Los métodos estadísticos utilizados en casi todos los modelos predictivos analizados en este trabajo durante la fase de desarrollo se basan en análisis de regresión logística multivariable10-16, a excepción del trabajo de Podda et al.17, que utiliza un sistema de «red neural». En la validación interna se han utilizado cohortes específicas14,17 y análisis internos por método de «bootstrap» en el mismo número de estudios12,13. La validación mediante cohortes diferentes tiene la ventaja de poder incluir un mayor número de pacientes y de comprobar si el modelo sigue siendo útil tras el paso del tiempo.
Siempre que se utilizan modelos predictivos se debe tener en cuenta el riesgo de caer en la paradoja de las «profecías autocumplidas»11. Al proporcionar a los profesionales la posibilidad de acceder a ellos, se pueden perpetuar las cifras del propio modelo, impidiendo desenlaces diferentes del ya validado en él. Por ejemplo, un hospital con cifras de supervivencia del 10% en niños de 23 semanas probablemente perpetuará esas cifras si las familias y los profesionales actúan con base en ese dato durante los próximos años. Es un hecho conocido que cuando el equipo de profesionales que atiende a un recién nacido tiene una idea pesimista de sus desenlaces, los resultados son peores23. Estas circunstancias obligan a revisar periódicamente los modelos y adaptarlos a los cambios que se observan en la supervivencia de estos pacientes tras el paso de los años, tal como han hecho la NICH11,22 o la red de Canadá10,12.
Es importante evaluar la calidad de cualquier nuevo modelo predictivo. En este sentido, el grupo Cochrane Collaboration Prognosis Reviews methods ha desarrollado una herramienta para la evaluación crítica y extracción de datos en revisiones sistemáticas de modelos predictivos. Esta herramienta, denominada CHARMS (Checklist for critical Appraisal and data extraction for systematic Reviews of prediction Modelling Studies) engloba una lista de elementos para evaluar críticamente cada modelo predictivo24, incluyendo aspectos como la fuente de los datos, pacientes incluidos, desenlaces medidos, predictores empleados, tamaño muestral, gestión de datos ausentes, desarrollo del propio modelo, rendimiento general, aplicabilidad y riesgo de sesgo. Recientemente, se ha publicado la herramienta PROBAST25 que evalúa el riesgo de sesgo y la aplicabilidad de un modelo en los estudios que desarrollan, validan o actualizan modelos predictivos mediante un total de 20 preguntas en 4 dominios (participantes, predictores, resultados y análisis).
Actualmente, no constan estudios sobre el impacto del empleo de modelos predictivos en la toma de decisiones en niños prematuros8 y tampoco existen estudios que señalen qué desenlaces serían los más importantes para las familias a la hora de la toma de decisiones, o cómo querrían estas visualizar los datos disponibles en una red26.
En el ámbito internacional, los principales modelos predictivos existentes en la actualidad11,17,19-22,27-31 se describen en la tabla 4, algunos de ellos desarrollados en poblaciones de más de 2 décadas19,20 y la mayoría no validados en otras poblaciones8.
Principales modelos predictivos existentes en la actualidad
| Modelo | Autor (año) | Población (lugar) | Momento de aplicación | Variables | Desenlace |
|---|---|---|---|---|---|
| CRIB | Cockburn (1993) | EG: < 31 s o PN: < 1.500 g (Reino Unido) | Primeras 12 h de vida | EG, PN, malformaciones congénitas, FiO2 (máximo y mínimo), EB primeras 12 h | Mortalidad hospitalaria |
| DRAPER | Draper (1999) | EG: <32 s (Reino Unido) | Inicio de trabajo de parto, ingreso en UCIN | EG, PN, raza, sexo, embarazo múltiple | Supervivencia en sala de partos, supervivencia al alta UCIN |
| SNAP II y SNAPPE II | Richardson (2001) | PN: < 1.500 g (Canadá) | Primeras 12 h de vida | PA, temperatura, pO2/FiO2, pH, convulsiones, diuresis, PN, SGA, Apgar 5 | Mortalidad hospitalaria |
| NEOMOD | Janota (2001) | PN: < 1.500 g y EG: < 31 s (República Checa) | Día 1 y día 28 | Disfunción multiorgánica de: SNC, coagulación sangre, respiratoria, gastrointestinal, cardíaca, renal, equilibrio ácido-base | Mortalidad neonatal y mortalidad hospitalaria |
| CRIB II | Parry (2003) | EG: ≤ 32 s (Reino Unido) | 1 h de vida | EG, PN, sexo, temperatura de ingreso, EB | Mortalidad al alta hospitalaria |
| NEOCOSUR | Marshall (2005) | PN: < 1.500 g (Cono Sur Network) | Antes de ingreso en UCIN | EG, PN, sexo, corticoides previos, Apgar 1, malformación congénita | Mortalidad hospitalaria |
| SAW y SAWS | Rosenberg (2008) | EG: < 33 s (Bangladesh y Egipto) | 48 h de vida | EG, PN, sexo | Mortalidad neonatal o mortalidad hospitalaria |
| NICHD | Tyson (2008) | EG: 22-25 s y PN: 400-1.000 g (EE. UU.) | Inicio de la ventilación mecánica | EG, PN, sexo, corticoides prenatales, embarazo múltiple Disponible para cálculo online | Mortalidad a los 18 meses de vida |
| PREM score | Cole (2010) | EG: < 32 s (Reino Unido) | Prenatal y al nacimiento | EG, Z score de peso al nacimiento, EB | Supervivencia a la edad de término |
| NICHD | Ambavalan (2012) | EG: 23-31 s y PN: ≤ 1.000 g (EE. UU.) | Tabla 3. Nacimiento, 7 ddv 28 ddv y 36 s EPM | Incluye variables perinatales y posteriormente variables asociadas a soporte respiratorio, infección, DAP, ROP o ECN en los diferentes puntos de medición. Disponible para cálculo on line | Predicción de muerte o discapacidad (MDI < 70 en Bayley II, PDI < 70, parálisis cerebral, ceguera bilateral o sordera que precisa audífonos) a los 18-22 meses de edad |
| PISA | Podda (2018) | PN: ≤ 1.500 g, o EG: < 30 s (Italia) | Al nacimiento | PN, EG, Apgar 1-5, sexo, modo de parto, raza madre, corioamnionitis, cuidados prenatales, esteroides antenatales, hipertensión materna, parto múltiple. Disponible para cálculo on line | Mortalidad antes del alta de UCIN |
DAP: ductus arterioso persistente; ddv: días de vida; ECN: enterocolitis necrosante; EB: exceso de bases; EG: edad gestacional; EPM: edad posmenstrual; g: gramos; MDI: Mental Developmental Index; PA: presión arterial: paO2/FiO2: índice presión parcial de O2 y fracción inspiratoria de O2; PDI: Psychomotor Developmental Index; PN: peso de nacimiento; s: semanas; ROP: retinopatía; SGA: pequeño para edad gestacional.
En nuestro país, la red SEN 1500 recoge datos de los recién nacidos de EG inferior a 30 semanas o PN ≤ 1.500g desde el año 200232,33. Sus objetivos son conocer y contrastar la calidad de la asistencia neonatal en los recién nacidos de muy bajo peso nacidos en España, así como proporcionar datos a los profesionales para poder comparase con otras poblaciones34 y desarrollar proyectos de mejora específicos en sus centros de trabajo35-38. Sin lugar a dudas, esta red constituye una fuente ideal para el desarrollo de modelos predictivos de mortalidad y morbilidad en este grupo poblacional y en España.
Una fortaleza del estudio es que se han realizado 2 búsquedas bibliográficas complementarias en poblaciones de prematuros en los que el desenlace es muerte o supervivencia. Una búsqueda ha seguido criterios predominantemente clínicos y la otra se ha centrado más en métodos estadísticos. Una posible limitación podría ser que los 2criterios de búsqueda se han centrado en la plataforma PubMed exclusivamente.
En conclusión, la toma de decisiones basada en modelos predictivos permite una mayor individualización de la atención recibida por un niño y una mejor utilización de los recursos disponibles. Es importante conocer los riesgos inherentes al empleo de estos modelos. En la actualidad, no existen modelos externos validados sobre los desenlaces de niños prematuros en España, ni modelos desarrollados y validados con datos propios. La red SEN 1500 ofrece una oportunidad para desarrollar modelos de predicción de mortalidad en prematuros españoles aplicados en diferentes momentos de su evolución.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.