Las tiopurinas son fármacos muy empleados para el mantenimiento de la remisión en pacientes con enfermedad inflamatoria intestinal. Se conocen cuáles son los niveles plasmáticos óptimos, y existe controversia acerca de si reducen la necesidad de otros fármacos o son coste-efectivos. El objetivo de nuestro estudio fue describir el uso del tratamiento optimizado con tiopurínicos en pacientes pediátricos con enfermedad inflamatoria intestinal seguidos en nuestra unidad desde la implementación de la determinación de niveles de fármaco.
Material y métodosEstudio descriptivo retrospectivo en el que se analizaron valores en plasma mediante cromatografía líquida de 6-tioguanina (6-TGN), 6-metilmercaptopurina (6-MMP) y sus cocientes, así como estado clínico y variables analíticas y demográficas de pacientes con enfermedad inflamatoria intestinal en seguimiento en nuestra unidad.
ResultadosSe incluyeron 72 pacientes y se realizaron 140 determinaciones de metabolitos. En el 61,5% de las determinaciones los niveles de 6-TGN se encontraban por debajo del rango terapéutico (en 7casos debido a falta de adherencia terapéutica), y en el 7,4% de las de 6-MMP estaban en rango de toxicidad. Tras la determinación de 77 muestras se tomó alguna actitud derivada, procediéndose a la modificación de dosis, al cambio de formulación o a la suspensión del fármaco. Únicamente 9pacientes escalaron a fármaco biológico (13,4% del total que estaban en monoterapia). No se encontró relación entre la actividad de la enfermedad y los niveles de tiopurínicos.
ConclusionesEn nuestra experiencia la monitorización de niveles de tiopurinas ayudó a modificar la dosis de fármaco que recibía el paciente, adecuando sus niveles terapéuticos y evitando potencialmente la adición de nuevos fármacos.
Thiopurines are drugs widely used in patients for the maintenance of remission in inflammatory bowel disease. The optimal plasma levels are known, but there is controversy about whether the need for other drugs is reduced or is cost-effective. The aim of this study is to describe the use of the optimised treatment with thiopurines in paediatric patients with inflammatory bowel disease followed up in this Unit since the introduction of determining the drug levels.
Material and methodsA descriptive retrospective study was conducted in which the plasma values of 6-thioguanine (6-TGN), 6-methyl-mercapto-purine (6-MMP), and their ratios were analysed using liquid chromatography. Other variables were collected, such as clinical status, analytical and demographic variables of patients with inflammatory bowel disease followed up in this Unit.
ResultsA total of 72 patients were included, and 149 determinations of metabolites were performed. The 6-TGN levels were found to below the therapeutic range in 61.5% of patients (in 7 cases due to lack of adherence to therapy), and 6-MMP was in the toxicity range in 7.4%. After the determination of 77 specimens, some action was taken, such as modifying the dose, change of formula, or withdrawing the drug. Only 9 patients were scaled to a biological drug (13.4% of the total on single therapy). No association was found between the activity of the disease and the thiopurine levels.
ConclusionsIn our experience, the monitoring of thiopurine levels helped to modify the drug dose that the patient received, adjusting their therapeutic levels, and potentially avoiding the addition of new drugs.
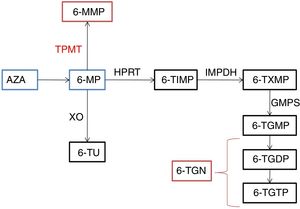
Las tiopurinas son análogos de las purinas que se usan frecuentemente en el mantenimiento de la remisión de la enfermedad inflamatoria intestinal (EII), tanto en la colitis ulcerosa (CU) como en la enfermedad de Crohn (EC). Se incluyen en ellas la azatioprina (AZA) y la 6-mercaptopurina (6-MP)1. La AZA y la 6-MP no presentan efecto terapéutico per se, ya que son considerados profármacos. La AZA es convertida, mediante la enzima glutatión S-transferasa, a 6-MP, que genera los metabolitos 6-tioguanina (6-TGN) y 6-metilmercaptopurina (6-MMP) (fig. 1). El efecto terapéutico es atribuido a la 6-TGN, que al inhibir la enzima RAC1 induce apoptosis de linfocitosT y disminución de la inflamación2. Además, al ser análogos de las purinas, interfieren con la síntesis de proteínas y ácidos nucleicos. Son considerados fármacos inmunomoduladores que ejercen su acción intracelularmente, y su efecto es retardado, consiguiéndose el máximo efecto a las 10-12semanas del inicio3. La acción tóxica es atribuida principalmente a la 6-MMP, pero también puede deberse a la 6-TGN4. La tiopurina-metiltransferasa (TPMT) es una enzima clave en cuanto a toxicidad se refiere, puesto que degrada la 6-MP en 6-MMP, y en función de su actividad habrá mayor o menor cantidad de metabolito tóxico presente. La existencia de alelos de baja actividad en homocigosis se considera factor de riesgo, y no se aconseja el uso de tiopurinas en estos casos3. No obstante, es posible desarrollar mielotoxicidad a pesar de presentar una actividad normal de TPMT5,6, y la cuantificación de su actividad únicamente nos ayudaría a determinar el mayor riesgo de mielosupresión en los pacientes homocigotos de baja actividad para el alelo, que en nuestro medio suponen una cifra inferior al 0,5%7.
Metabolismo de las tiopurinas.
6-MMP: 6-metilmercaptopurina; 6-MP: 6-mercaptopurina; 6-TGDP: 6-tioguanina difosfato; 6-TGMP: 6-tioguanina monofosfato; 6-TGTP: 6-tioguanina trifosfato; 6-TIMP: 6-metiltioinosinato; 6-TU: 6-ácido tioúrico; 6-TXMP: 6-ácido tioxantilico; AZA: azatioprina; GMPS: guanosina monofosfato sintetasa; HPRT: hipoxantina-guanina-fosforribosil-transferasa; IMPDH: inosina 5’-monofosfato deshidrogenasa;TPMT: tiopurina-metiltransfersa; XO: xantina oxidasa.
En lo relativo a los niveles óptimos de 6-TGN en eritrocitos (o hematíes), se considera normal entre 235-450pmol/8×108 eritrocitos, relacionándose con la remisión8. Niveles por debajo serían deficientes, en tanto que por encima de 450pmol/8×108 eritrocitos se considera que podría aumentar el riesgo de mielotoxicidad9. En cuanto a la 6-MMP, niveles por debajo de 5.700pmol/8×108 eritrocitos se consideran óptimos10.
En los últimos años se está llevando a cabo cada vez en más centros la monitorización de tiopurínicos. Se pretende con la medición en sangre de 6-MMP y 6-TGN reducir la mielosupresión, refiriendo algunos estudios que podría evitar hasta una cuarta parte de los casos6, así como de hepatotoxicidad10, y mejorar la eficacia de los fármacos con mayor remisión clínica10,11. Además, otros estudios han demostrado que la monitorización mejora la adherencia a los fármacos11. No obstante, en otros ensayos no se demuestra una clara mejoría con la práctica de monitorización de tiopurínicos frente a no realizarla12.
El objetivo de nuestro estudio fue describir el uso del tratamiento optimizado con tiopurínicos en pacientes pediátricos con EII seguidos en nuestra unidad desde la implementación de la determinación de niveles de fármaco, así como analizar las posibles ventajas derivadas de su monitorización, como el ajuste de dosis, la disminución del riesgo de toxicidad o la optimización de tratamiento sin necesidad de escalar terapéuticamente.
Pacientes, material y métodosPoblaciónSe incluyeron de forma retrospectiva pacientes entre 0 y 14años seguidos en nuestra unidad diagnosticados previamente de EII y que hubiesen precisado durante su seguimiento determinación de niveles de tiopurínicos. Los pacientes tomaban el fármaco desde, al menos, 12semanas antes. Los criterios para determinación de tiopurínicos en sangre fueron: mal control de la enfermedad o subóptimo en la remisión, aparición de efectos adversos o dudas sobre su cumplimiento.
Se recogió mediante revisión de historias clínicas información referente a variables demográficas y de la enfermedad (fenotipo de enfermedad, clínica al inicio, estudio al diagnóstico e índice de actividad), así como determinaciones analíticas (serología, hemograma, PCR, bioquímica) y valoración antropométrica. Se obtuvieron valores de análisis en plasma de niveles de 6-TGN, 6-MMP, cocientes 6-MMP/6-TGN y 6-TGN/6-MMP, actividad de TPMT, dosis de AZA o 6-MP que estuviera tomando el paciente por vía oral, formulaciones utilizadas (comprimidos principalmente, en ocasiones soluciones según la edad), medicación concomitante y actitud terapéutica tras la monitorización de los niveles (aumento de dosis, cambio de fármaco, retirada de medicación o actitud sin cambios). Se definió remisión clínica si el índice ponderado de actividad de la enfermedad de Crohn pediátrica (weighted Paediatric Crohn's Disease Activity Index [wPCDAI]) era <12,5 o si el índice de actividad de la colitis ulcerosa pediátrica (Pediatric Ulcerative Colitis Activity Index [PUCAI]) era <10 para EC y CU, respectivamente.
Determinación de metabolitosSe analizaron los niveles de 6-TGN y 6-MMP (pmol/8×108 eritrocitos) en plasma mediante cromatografía líquida de alta eficacia.
Análisis estadísticoSe realizó un estudio descriptivo de la muestra y de las variables con valores medios, desviación estándar, mediana y rango intercuartil, según se ajustase a un modelo normal o no. Para variables cualitativas se usó el test chi-cuadrado o de Fisher, y se usó el t de Student para muestras independientes para comparar medias, una vez comprobada la normalidad de la muestra y la igualdad de varianzas; en caso contrario, se usó el test de Mann-Whitney o el test de Welch. Los modelos predictivos de respuesta se construyeron mediante pruebas de regresión logística univariante y multivariante. Las variables que presentaron diferencias estadísticamente significativas o una tendencia (p<0,15) en los análisis univariantes entre los pacientes en actividad junto a las variables que, por conocimientos teóricos o empíricos, se consideró que podían estar relacionadas con la variable dependiente se utilizaron para la construcción del modelo. La selección de las variables del modelo se realizó mediante un análisis multivariado y se utilizó como método de inclusión de las variables por pasos «hacia atrás». La magnitud de la asociación entre las variables predictivas del modelo y la variable dependiente se midió mediante las odds ratio (OR) y sus correspondientes IC del 95%. Se consideró significativo un valor de p<0,05.
Consentimiento informadoEl estudio se ha llevado a cabo tras la aprobación del mismo por el CEIC del centro y siguiendo sus directrices. Los autores declaran que han obtenido la información mediante revisión de historias clínicas siguiendo los procesos determinados por el hospital.
ResultadosSe realizaron un total de 140 determinaciones a los 72 pacientes incluidos en el estudio. La media de determinaciones por paciente fue de 1,94±1,09. No hubo diferencias entre las características basales de los pacientes diagnosticados de CU y EC, salvo la necesidad de biológico durante el seguimiento (mayor en EC) y el tratamiento empleado durante el mismo, que varió entre ambas. Las características de los pacientes incluidos se muestran en la tabla 1.
Características de los pacientes incluidos
| Enfermedad de Crohn | Colitis ulcerosa | p | |
|---|---|---|---|
| n | 47 | 25 | |
| Sexo (H/M) | 25/22 | 11/14 | 0,458 |
| Edad al diagnóstico (media±DE) | 9,87±3,36 | 8,21±4 | 0,069 |
| Raza (mediterránea/magrebí) | 41/6 | 20/5 | 0,417 |
| Antropometría al diagnóstico (>5años) (media±DE) | |||
| Peso (kg) | 36,41±13,4 | 31,26±9,63 | 0,183 |
| Z-score peso | −0,54±1 | −0,57±0,72 | 0,298 |
| Talla (cm) | 144,72±16,77 | 137,71±17 | 0,208 |
| Z-score talla | −0,17±1,67 | −0,04±1 | 0,633 |
| IMC (kg/m2) | 17,21±2,86 | 16±2,12 | 0,107 |
| Z-score IMC | −0,72±1,44 | −0,69±0,71 | 0,228 |
| Historia familiar (Sí/No) | 9/38 | 5/20 | 0,931 |
| Actividad TPMT (U/ml RBC) | |||
| <5 | 0 | 0 | |
| 5-13,7 | 4 | 0 | |
| > 13,7 | 38 | 17 | |
| Tiempo seguimiento, años (mediana/RIQ) | 3,95/1,81:3,20-5,01 | 4,30/3,79:2,28-6,07 | 0,762 |
| Necesidad de biológico (Sí/No) | 32/15 | 6/19 | p<0,001 |
| Tiempo hasta inicio biológico en pacientes en monoterapia, meses (mediana/RIQ) | 14,16/19,29:7,74-27,03 | 31,57/44,36:1,82-46,17 | 0,425 |
| Otros fármacos empleados durante el seguimiento (número de pacientes) | |||
| Tacrolimus oral | 0 | 5 | 0,004 |
| Tacrolimus rectal | 1 | 2 | 0,282 |
| Esteroides | 10 | 9 | 0,159 |
| Nutrición enteral | 19 | 2 | 0,004 |
| 5-ASA oral | 3 | 17 | p<0,001 |
| 5-ASA rectal | 0 | 8 | p<0,001 |
DE: desviación estándar; RBC: red blood cell; RIQ: rango intercuartil; TPMT: tiopurina-metiltransferasa.
La dosis de AZA empleada para el tratamiento se ajustó a las recomendaciones de la literatura13, aunque hasta el 61,5% de los pacientes presentaban niveles de 6-TGN por debajo de rango óptimo, y en el 7,4% de las determinaciones los niveles de 6-MMP estaban en rango de toxicidad. Los valores de los metabolitos obtenidos en plasma se muestran en la tabla 2. En la mayoría de casos se incrementó la dosis de tiopurínicos tras la determinación de niveles de los mismos (tabla 3).
Niveles de tiopurínicos medidos en pmol/8×108 eritrocitos en sangre y dosis de AZA empleada vía oral
| Metabolitos en plasma | Mediana | RIQ | Valor en rango | Por encima de rango | Por debajo de rango |
|---|---|---|---|---|---|
| 6-TGN | 211 | 140 (141-281) | 47 (33,8%) | 7 (5%) | 85 (61,5%) |
| 6-MMP | 1.321,5 | 2.299,39 (490,1-2.789,48) | 126 (92,6%) | 10 (7,4%) | |
| 6-MMP/6-TGN | 6,04 | 12,05 (2,67-41,62) | |||
| 6-TGN/6-MMP | 0,15 | 0,30 (0,06-0,36) | |||
| Dosis empleada AZA (mg/kg/día) | 2,54 | 0,53 (2,25-2,77) |
6-MMP: 6-metilmercaptopurina; 6-TGN: 6-tioguanina; AZA: Azatioprina; RIQ: rango intercuartil.
Actitud tras determinación de niveles de tiopurínicos
| Ninguna actitud | 57 (40,7%) | |
| Modificación del tratamiento | 77 (55%) | |
| Aumento de dosis | 62 (45,2%) | |
| Disminución de dosis | 5 (3,6%) | |
| Suspensión de fármaco | 8 (5,8%) | |
| Cambio de formulación (paso de solución a comprimido o viceversa) | 2 (1,4%) | |
| Inicio de otro fármaco (metrotexato) | 1 (1,25%) | |
| Inicio de biológicoa | 9/67 (13,4%) |
El análisis de regresión logística no encontró relación entre la actividad/remisión de la enfermedad y los niveles de 6-TGN, dosis de azatioprina (mg/kg o mg/m2) diaria ni tampoco con los cocientes 6-TGN/6-MMP y 6-MMP/6-TGN. Los niveles de metabolitos en función de la actividad de la enfermedad se muestran en la tabla 4.
Niveles de tiopurínicos medidos en pmol/8×108 eritrocitos en sangre en pacientes en monoterapia en función de la actividad de la enfermedad
| Metabolitos en plasma | 6-TGN | 6-MMP | 6-MMP/6-TGN | 6-TGN/6-MMP | |
|---|---|---|---|---|---|
| Pacientes en remisión | Mediana | 246,08 | 1.235 | 5,89 | 0,17 |
| RIQ | 228,5 (130,4-358,9) | 3.409,55 (581,45-3.991) | 12,46 (2,84-15,29) | 0,28 (0,07-0,35) | |
| Pacientes en actividad | Mediana | 210,5 | 1.321,5 | 7,24 | 0,13 |
| RIQ | 124,58 (141,32-265,9) | 1.853,34 (702,91-2.556,25) | 9,26 (3,42-12,68) | 0,21 (0,07-0,29) |
6-MMP: 6-metilmercaptopurina; 6-TGN: 6-tioguanina; RIQ: rango intercuartil.
La medición de niveles de tiopurínicos permitió detectar 4 casos de no cumplimentación terapéutica, lo que supone una tasa de cumplimentación superior al 95%. Rehistoriando a estos pacientes y a sus familias se identificaron los factores responsables de la falta de cumplimiento.
Efectos secundariosEn 17 casos el paciente estaba sobredosificado (6-TGN>450pmol/8×108 eritrocitos) o metabolizaba por ruta metabólica alternativa (6-TGN<230 y 6-MMP>5.700pmol/8×108 eritrocitos). No obstante, en ninguno de los casos se constató hepatotoxicidad ni mielotoxicidad.
DiscusiónLos resultados de nuestro estudio ponen de manifiesto que un alto porcentaje de casos presentaban niveles de 6-TGN inferiores a los considerados terapéuticos, y hasta el 7,4% tuvieron en el momento del análisis niveles de 6-MMP en rango tóxico3.
Un estudio reciente14 mostró resultados similares en cuanto a infradosificación de tiopurínicos en su serie (45,6%), demostrando que la monitorización de niveles ayuda a detectar casos potenciales en los que el incremento de dosis de AZA pueda ayudar a mantener la remisión sin necesidad de administrar nuevos fármacos, tal y como recomiendan las guías de práctica clínica3,15, ya que estudios previos describen tasas de remisión mayores dependientes de la dosis de AZA y de 6-MMP16.
Otra de las ventajas potenciales de la monitorización de niveles es prevenir la toxicidad relacionada con los fármacos, ya que se comprueba que aproximadamente el 20-30% de los pacientes tienen que abandonar el tratamiento por la aparición de efectos adversos relacionados con él17-19. Cierto tipo de hepatotoxicidad está relacionada con los niveles de 6-MMP, sugiriéndose la presencia de niveles mayores de 5.700pmol/8×108 eritrocitos en sangre de 6-MMP como factor de riesgo de daño hepático7,10. En nuestra serie, 10 determinaciones de 6-MMP (7,4%) presentaban niveles en rango de hepatotoxicidad, cifras similares a las encontradas en otros estudios14. Respecto a la 6-TGN, diversos trabajos apoyan la hipótesis de que sus niveles se correlacionan con el riesgo de presentar mielotoxicidad19,20 incluso precozmente21 y, por tanto, su monitorización y adecuación posterior podrían evitar cierto número de casos. En nuestro estudio, hasta en el 5% de las determinaciones de metabolitos se detectaron cifras superiores a lo recomendado, similar a la incidencia global del 7% descrita por Gisbert y Gomollón22 en una revisión sistemática.
Únicamente 9 pacientes de 67 que estaban en monoterapia con AZA (13,4%) tuvieron que añadir biológicos al tratamiento, dato similar al 12% reportado por Suárez et al.23. El tiempo medio de seguimiento previo de enfermedad al inicio de biológico fue de 4,41años, y 18meses del tratamiento en monoterapia con AZA en pacientes con EC (fenotipo mayoritario que precisa utilización de biológicos en nuestra serie, siendo la diferencia estadísticamente significativa respecto a los pacientes con CU). Con la monitorización de niveles de tiopurínicos el paso a terapia con biológicos u otros tratamientos podría disminuir potencialmente, aunque es cierto que en la actualidad estos fármacos son cada vez más utilizados en pacientes con EII. En nuestra experiencia, la serie de pacientes en tratamiento con biológicos es cada vez mayor, siendo más estrictos con la aparición de ciertos efectos adversos asociados a las tiopurinas. Además, los fármacos biológicos presentan mejor perfil de seguridad24, y es sabido que se consigue curación mucosa en mayor porcentaje de pacientes con estos últimos y también en comboterapia25,26.
No obstante, desde una perspectiva económica creemos que la monitorización de tiopurínicos puede resultar coste-efectiva, situación evaluada por otros autores27, debido en parte al bajo coste en relación con otras opciones terapéuticas, como los fármacos biológicos. No obstante, se precisan más estudios de este tipo para poder realizar una recomendación clara al respecto.
De acuerdo con estudios previos realizados en adultos28,29 y en contra a lo reportado por otros autores8,30,31, no encontramos relación entre los niveles de 6-TGN y la actividad de la enfermedad, probablemente debido al alto número de pérdidas registrado, al tratarse de un estudio retrospectivo y no disponer de puntuación exacta de wPCDAI o PUCAI en el momento de la visita del paciente, motivado en la mayoría de los casos por ausencia de estudio analítico concomitante con el momento de la extracción de niveles. A la hora de interpretar los resultados hay que tener en cuenta las características basales de la población de estudio, lo que puede limitar la validez externa. Así, por ejemplo, en el estudio de Lee et al.30 los niveles de tiopurínicos fueron tomados en pacientes que tomaban azatioprina en comboterapia con mesalazina y no en monoterapia. Además, la dosis media de AZA en dicho estudio es muy inferior a la que tomaban los pacientes en nuestro estudio (media de 1,01mg/kg/día en dicho estudio frente a 2,54mg/kg/día en nuestro centro), lo que puede influir en los resultados, ya que niveles superiores a dicha cifra se correlacionarán más activamente con la remisión, a tenor de diversas guías en las que se recomienda la utilización de cifras superiores a 2mg/kg/día de AZA en la EII3 en pacientes con actividad normal de TPMT6. Otra explicación podría ser que la población de dicho estudio es eminentemente de raza asiática, en tanto que nuestros pacientes son de raza mediterránea o magrebí en su mayoría, y los niveles de AZA necesarios para mantener la remisión pudieran diferir en función de la misma32. En una revisión sistemática, Konidari et al.10 concluyeron que los niveles de tiopurinas no ayudan a predecir la remisión clínica pero facilitan la optimización del tratamiento y pueden prevenir casos de toxicidad, mientras que un metaanálisis reciente concluyó que los niveles de 6-TGN sí presentan asociación con las tasas de remisión, atribuyendo los resultados controvertidos a la heterogeneidad de los estudios publicados33.
En cuanto a las limitaciones, la principal debilidad de nuestro estudio es su carácter retrospectivo. Por el contrario, el alto número de determinaciones y el elevado seguimiento realizado a los pacientes supone una de sus principales fortalezas, así como la ausencia de estudios similares en nuestro medio.
A tenor de la experiencia en nuestro centro podemos concluir que la monitorización de niveles de tiopurínicos en pacientes pediátricos con EII supone un método eficaz para la adecuación terapéutica, que posiblemente ayude a optimizar la terapia y evite en muchos casos la escalada a otros tratamientos, generalmente fármacos biológicos. Asimismo, puede tratarse de una herramienta útil a la hora de detectar niveles elevados del fármaco que potencialmente pudiesen causar toxicidad, consiguiéndose con la determinación de los mismos la posibilidad de prevenir dicha toxicidad y siendo, por tanto, una buena opción a la hora de optimizar el seguimiento médico en dichos pacientes. Creemos que dicha práctica se debería implementar en la mayoría de los centros. Se precisan más estudios que ayuden a delimitar de forma clara el porcentaje de pacientes que se benefician de la monitorización y las circunstancias para realizar la misma, así como estudios farmacogenéticos que delimiten el riesgo individual de cada paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.