El uso de terapias extracorpóreas se ha extendido para el tratamiento de enfermedades en pediatría. La plasmaféresis, una técnica que intercambia componentes del plasma con albúmina o plasma, se ha utilizado en patología reumatológica. Describimos el curso clínico de un niño de 7 años ingresado en la unidad de cuidados intensivos con características clínicas y biológicas de un síndrome de activación macrofágica (SAM) y fracaso multiorgánico (FMO) como forma de presentación de una dermatomiositis juvenil (DMJ), que evolucionó con mala respuesta a metilprednisolona, inmunoglobulinas y ciclosporina. La utilización de una plasmaféresis de rescate a los 4 días de ingreso permitió una evolución favorable, con resolución del FMO y disminución sostenida en parámetros de actividad de DM y SAM. Alta al día 21, sin secuelas y con satisfactoria condición funcional. La plasmaféresis podría ser una terapia de rescate en casos de DMJ complicada de un SAM que no responda a la terapia habitual.
The use of extracorporeal techniques for the treatment of paediatric diseases has expanded dramatically in the past decade. Plasmapheresis, a technique for exchanging plasma components with albumin or plasma, has been used in some rheumatologic conditions. We report the clinical course of a 7 years old boy with clinical and biological features of macrophage activation syndrome and multiorgan failure, at the time of presentation of severe juvenile dermatomyositis, and non responsive to corticosteroids, cyclosporine and immunoglobulin. After 4 days in the paediatric intensive care unit, plasmapheresis was used as rescue therapy. Repeated therapeutic plasmapheresis was effective for improving the multiorgan failure and laboratory abnormalities. The patient was discharged on the 21st hospital day with good functional condition. Plasmapheresis should be considered as rescue treatment in patients with life threatening macrophage activation syndrome and systemic onset of juvenile dermatomyositis.
La plasmaféresis (PF), técnica que realiza una separación del plasma y elementos formes de la sangre por centrifugación o el uso de membranas, ha sido empleada con distintos grados de evidencia en enfermedades infecciosas, reumatológicas, neurológicas y hematológicas. Sus posibles mecanismos de acción incluyen la remoción de factores circulantes, como autoanticuerpos, inmunocomplejos, mediadores inflamatorios y citocinas, siendo este probablemente su mecanismo más importante1. Los síndromes hemofagocíticos, caracterizados por una proliferación incontrolada de macrófagos y linfocitos T con hiperproducción de citocina, se clasifican en primarios/genéticos o secundarios a neoplasias, infecciones virales —fundamentalmente virus de Epstein-Barr—, bacterianas, fúngicas o parasitarias. El síndrome de activación macrofágica (SAM) es una forma de linfohistiocitosis hemofagocítica secundaria, que ha sido reconocida como la complicación más severa y potencialmente fatal en pacientes con artritis idiopática juvenil (AIJ) de inicio sistémico. El SAM también se ha asociado a otras enfermedades autoinmunitarias, como el lupus eritematosos sistémico o la enfermedad de Kawasaki2. Existen escasos reportes de SAM en el contexto de dermatomiositis.
Reportamos el uso exitoso de la PF en un niño con un SAM y fracaso multiorgánico (FMO) como primera manifestación de una forma severa de dermatomiositis juvenil (DMJ).
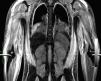
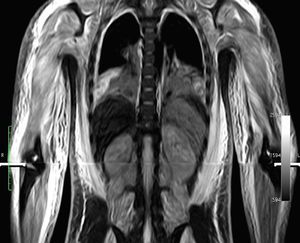
Caso clínicoNiño de 7 años, previamente sano, con una historia de 4 semanas de evolución de fiebre, eritema facial y angioedema, que se trató con corticoides orales y antihistamínicos. Posteriormente, requirió hospitalización por edema facial, cervical, dolor y debilidad muscular, solicitándole traslado a la UCI por inestabilidad hemodinámica a las 24h de su ingreso. A la admisión en la UCI se observó al paciente con una puntuación de Glasgow de 10, Tª 38,3°C, frecuencia cardiaca 160 latidos por minuto, presión arterial media 50mmHg y tiempo de llenado capilar de 5 segundos. Edema facial y de extremidades, heliotropo periorbitario, adenopatía cervical derecha, vasculitis en la zona glútea, con lesiones de pequeño vaso en zona periungueal. El abdomen era sensible difusamente, con hepatoesplenomegalia. Se observó debilidad muscular proximal en las extremidades. La evaluación por el reumatólogo pediatra planteó el diagnóstico de DMJ y SAM secundario. En los exámenes de ingreso destacaron: pH 7,1, EB –9,6, lactato 4.6mmol/l, sodio 129 mEq/l, proteína C reactiva 0,5mg/dl y hallazgos de laboratorio compatibles con SAM y actividad de DM (tabla 1). La ecografía cardiaca demostró una fracción de acortamiento de ventrículo izquierdo del 20%. Se inició tratamiento con volemización, ventilación mecánica, infusión de dobutamina, noradrenalina y antibióticos de amplio espectro. Evolucionó con FMO, insuficiencia respiratoria grave (Pa/FiO2= 80), lesiones purpúricas y anasarca. Los hemocultivos y los cultivos de aspirado bronquial fueron negativos, así como la serología para Mycoplasma pneumoniae, hantavirus y virus de la inmunodeficiencia humana, y la reacción en cadena de la polimerasa para virus de Epstein-Barr, citomegalovirus, parvovirus B19 y enterovirus. La IgM para virus de la hepatitis A y B fue negativa. La inmunofluorescencia directa de aspirado nasofaríngeo para virus influenza, parainfluenza, sincitial, adenovirus y metaneumovirus fue negativa. Los anticuerpos antinucleares fueron positivos. La RM de las extremidades en secuencia STIR (short tau inversion recovery) reveló edema difuso subcutáneo, muscular y de la fascia (fig. 1). La biopsia muscular demostró infiltrados inflamatorios perifasciculares con fibras necróticas y signos de vasculitis inicial. El aspirado de médula ósea fue normal y no fue repetido posteriormente por la condición del paciente. El estudio de citotoxicidad demostró ausencia de citotoxicidad de las natural killer (NK). Al ingreso, se iniciaron bolos de metilprednisolona de 1 g/kg/día por 5 días e infusión de inmunoglobulinas 2 g/kg y en las 24h siguientes se agregó al tratamiento ciclosporina por vía intravenosa 5mg/kg. Sin embargo, el paciente se mantuvo febril, dependiente de fármacos vasoactivos, e inició signos de compromiso encefálico, derrame pleural bilateral y hemorragia de mucosas. La tomografía de cerebro fue normal. Por evolución desfavorable, al cuarto día se inició PF a través de un catéter femoral de doble lumen con un sistema de centrifugación a flujo discontinuo (Haemonetics MCS 8150 Massachusetts, EE. UU.). El procedimiento fue programado para remover una volemia por sesión, usando como solución de remplazo plasma fresco congelado. Después de 4 sesiones de PF, se observó una resolución del FMO, lográndose una suspensión de los fármacos vasoactivos y una disminución sostenida en los parámetros biológicos de actividad de la DMJ y el SAM. Se realizaron 8 sesiones de PF (tabla 1). El procedimiento no presentó complicaciones técnicas y fue bien tolerado por el paciente, que requirió 8 días de ventilación mecánica y fue egresado del hospital al día 21. Actualmente, el niño no presenta secuelas y se encuentra en buenas condiciones funcionales, ya que en la prueba MMT (muscular manual testing) presenta un valor de 88. Sus exámenes de laboratorio son normales y recibe tratamiento con prednisona.
Exámenes de laboratorio al ingreso en UCI y evolución durante plasmaféresis
| Hallazgos de laboratorio (valores normales) | Presentación en UCI | Previo a PF | Post-1 PF | Post-4 PF |
| Hemoglobina | 16,7 | 7,3 | 9,7 | 10,1 |
| (12-16 g/dl) | ||||
| Leucocitos | 50 | 24 | 15,7 | 20,2 |
| (4-10×109) | ||||
| Plaquetas | 111 | 52 | 119 | 145 |
| (150-400×109) | ||||
| VSG | 9 | 8 | 5 | 5 |
| (1-10mm/h) | ||||
| AST | 515 | 846 | 533 | 502 |
| (0-36 U/l) | ||||
| ALT | 241 | 188 | 135 | 126 |
| (0-40 U/l) | ||||
| Albúmina | 2,0 | 1,8 | 3,6 | 3,5 |
| (3,5-5,5 mg/dl) | ||||
| CPK | 16.353 | 25.013 | 8.980 | 7850 |
| (0-170 U/l) | ||||
| LDH | 1.537 | 1.402 | 585 | 450 |
| (100-190 U/l) | ||||
| Ferritina | 1.789 | 1.074 | 264 | 200 |
| (15-300ng/ml) | ||||
| Triglicéridos | 354 | 413 | 283 | 180 |
| (50-200 mg/dl) | ||||
| Fibrinógeno | 180 | 150 | 210 | 250 |
| (200-400 mg/dl) |
ALT: alanino aminotransferasa; AST: aspartato aminotransferasa; CPK: creatincinasa; LDH: lactato deshidrogenasa; PF: plasmaféresis; VSG: velocidad de sedimentación globular.
A nuestro entender, este es el primer caso descrito de un niño que presenta manifestaciones clínicas y de laboratorio de un SAM en el debut de una forma severa de DMJ en el que la PF permitió una buena evolución clínica. Nuestro paciente, ya al ingreso en la UCI, presentó signos clínicos y biológicos de un SAM con fiebre, hepatoesplenomegalia, disfunción hepática, citopenia, aumento de la LDH, triglicéridos y ferritina3. Si bien el aspirado de medula ósea fue negativo para la presencia de hemofagocitosis, se ha establecido que un aspirado de medula ósea realizado precozmente en el curso de la enfermedad podría no demostrar hemofagocitosis, lo que no excluye el diagnóstico de SAM. En este caso, la ausencia de toxicidad de los NK puede ser considerado una confirmación diagnóstica.
El SAM en niños con enfermedades reumatológicas puede presentarse en infecciones, recaídas, periodos de remisión o cambios en el tratamiento de la enfermedad. Se ha diagnosticado hasta en un 13% de pacientes con AIJ de inicio sistémico con una mortalidad que fluctúa entre el 8 y el 22%. Un 10% de los pacientes con AIJ podrían tener un SAM como forma de presentación4,5. Otros autores han descrito el SAM como presentación inicial en niños con enfermedad de Kawasaki y lupus eritematoso sistémico6. En una serie de 24 pacientes adultos con DM, el SAM fue diagnosticado en 4 sujetos durante la fase activa de la enfermedad. En esta serie, los pacientes con SAM requirieron una terapia más agresiva, que incluyó una combinación de pulsos de esteroides, inmunosupresores e inmunoglobulinas, falleciendo el 50%7. La anasarca, presente en este caso, se ha reportado como una forma de presentación ocasional de la DMJ y es característica de pacientes refractarios a tratamientos habituales y de cursos más severos8,9.
La PF ha sido utilizada en casos de DM con resultados mixtos; incluso esta técnica no demostró beneficios en un estudio aleatorizado en adultos con DM crónica. Otra serie describe a 33 pacientes con DM tratados con PF, en los que el 54% de los pacientes con enfermedad aguda presentaron mejoría clínica10,11. Actualmente, se cree que la PF asociada a una terapia inmunosupresora podría tener un rol en casos graves de DM con mala respuesta al tratamiento convencional12. La PF como terapia de rescate también ha sido descrita en una niña con AIJ asociada a SAM refractaria a corticoides y ciclosporina13.
Como ilustra nuestro caso, aun con los criterios diagnósticos conocidos, el SAM puede compartir signos clínicos y de laboratorio similares a la sepsis, el shock séptico y el FMO, por lo que los pediatras intensivistas deben conocer los criterios diagnósticos del SAM y sus distintas presentaciones clínicas para iniciar un tratamiento adecuado14-16.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.