La lucha contra la resistencia a los antimicrobianos es actualmente prioritaria; son necesarios esfuerzos para mejorar la prescripción y reducir la propagación de infecciones en el entorno pediátrico.
MétodosEstudio longitudinal prospectivo sobre el uso de antimicrobianos realizado desde el inicio del programa de optimización del uso de antimicrobianos (PROA) en enero de 2016 hasta diciembre de 2017 (período 2; P2) en el hospital infantil. Los resultados obtenidos se han comparado retrospectivamente con el periodo anterior al inicio del PROA (2014-2015, periodo 1; P1). La población estudiada fueron niños ingresados que recibieron antimicrobianos de amplio espectro, antifúngicos o tratamiento antibiótico intravenoso durante más de 5 días.
ResultadosDurante el P2 se incluyeron un total de 160 pacientes. Los antibióticos más comunes para los que se realizó una recomendación fueron: meropenem (41,6%) y cefotaxima (23,4%). En el 45% de los episodios se recomendó «no cambiar» el antimicrobiano prescrito. La tasa de aceptación de las recomendaciones por parte de los facultativos responsables fue del 89%. Se objetivó una disminución promedio del 27,8 y del 22,9% en los días de tratamiento (DOT)/1.000 días de ingreso y el número de tratamientos iniciados/1.000 ingresos, respectivamente. El uso de carbapenémicos, cefalosporinas y glucopéptidos disminuyó del P1 al P2. El coste medio anual del tratamiento antimicrobiano pasó de 150.356€/año durante en el P1 a 98.478€/año en el P2.
ConclusionesNuestro PROA conllevó una disminución significativa en el uso de antibióticos y antifúngicos de amplio espectro. Los costes asociados con la prescripción de antimicrobianos disminuyeron desde el inicio del PROA y resultó una acción coste-efectiva durante el período de estudio.
Fighting against antimicrobial resistance is a current priority, and further efforts need to be made to improve antimicrobial prescribing and reduce the spread of infections in paediatric care settings.
MethodsWe conducted a prospective longitudinal study on the use of antimicrobials from the time the antimicrobial stewardship programme (ASP) was introduced in January 2016 to December 2017 (period 2 [P2]) in our children's hospital. We compared the obtained results on antimicrobial prescribing with retrospective data from the period preceding the introduction of the ASP (2014–2015, period 1 [P1]). The sample consisted of paediatric in patients who received broad-spectrum antimicrobials, antifungals or intravenous antibiotherapy lasting more than 5 days. We compared the use of antimicrobials in P1 versus P2.
ResultsA total of 160 patients were included during P2. The antibiotics for which a recommendation was made most frequently were meropenem (41.6%) and cefotaxime (23.4%). In 45% of care episodes, the consultant recommended “no change” to the prescribed antimicrobial. The final rate of acceptance of received recommendations by the prescribing physicians was 89%. We found average decreases of 27.8% in the days of treatment per 1000 inpatient days and 22.9% in the number of antimicrobial starts per 1000 admissions in P2. The use of carbapenems, cephalosporins and glycopeptides decreased in P2 compared to P1. The average annual cost of antimicrobial treatment decreased from €150 356/year during P1 to €98 478/year in P2.
ConclusionOur ASP achieved a significant decrease in the use of broad-spectrum antibiotics and antifungals. The costs associated with antimicrobial prescribing decreased following the introduction of the ASP, which was a cost-effective action in this study period.
La carga de la resistencia a los antimicrobianos (RAM) ha sido destacada por las agencias sanitarias y sociales más relevantes, que han incluido la RAM en la lista de las 10 amenazas más importantes a la salud global en 2019 y advirtiendo que podría llegar a causar un daño catastrófico a la economía global1,2. Los países del sur de Europa presentan las tasas de RAM más altas en la Unión Europea (UE)3. Un análisis sistemático reciente y completo ha proporcionado datos sobre la carga global de la resistencia bacteriana a los antimicrobianos en el año 20194. Sus autores estiman que hubo 4,95 millones de muertes asociadas a la RAM bacteriana en ese año4. La población pediátrica se vio muy afectada, ya que las muertes en niños menores de 5 años representaron el 20% del total4. Por añadidura, la UNICEF estima que el 40% de las muertes globales de niños menores de 5 años y neonatos se debió a enfermedades afectadas directamente por la RAM en el año 20165. La evidencia disponible para la UE muestra que los lactantes menores de un año presentaron la carga más alta de años de vida ajustados por discapacidad y muertes atribuibles a infecciones por bacterias resistentes a antibióticos en el año 20153. Las infecciones causadas por bacterias resistentes a antimicrobianos generan una carga elevada de años de vida ajustados por discapacidad y muertes en la población pediátrica, no solo a nivel global sino también en la UE6. El uso irracional de antibióticos en humanos es una de las causas más importantes del aumento en la RAM y se estima que hasta dos tercios de las prescripciones de antibióticos que se realizan globalmente son inapropiadas7. Los antibióticos son los fármacos prescritos más comúnmente en la población pediátrica8,9. En los niños de Europa del Sur, la probabilidad de recibir antibióticos es mayor en comparación con Europa del Norte10. Además, menos del 70% de las prescripciones de antibióticos a nivel comunitario en niños en Italia y Grecia son para antibióticos de espectro reducido, en comparación con, por ejemplo, Eslovenia, Países Bajos o España, donde ascendía a más del 90% de los casos11. Se han objetivado patrones de prescripción similares a nivel hospitalario12.
El aumento en la RAM y la necesidad de contener los costes farmacéuticos han generado un interés considerable en el desarrollo de programas de control del uso de antibióticos13. Los programas de optimización del uso de antimicrobianos (PROA) se entienden como cualquier actividad que promueva la dosificación, vía de administración y duración de tratamiento óptimas de cualquier medicamento empleado para tratar infecciones14. Los beneficios de los PROA se han demostrado extensamente en la atención sanitara al adulto en todo el mundo15,16.
Aunque la lucha contra la RAM se considera una prioridad importante, una revisión sistemática reciente evidenció que en Europa se han desarrollado muy pocos PROA para pacientes pediátricos en comparación con EE. UU.9. No obstante, desde el año 2007 ha habido un aumento significativo en la proporción de hospitales que proporcionan servicios pediátricos con PROA establecidos17. En el año 2005, nuestro hospital instauró un PROA no impositivo denominado Programa de Asesoramiento y Control de Tratamiento Antibiótico (PACTA) en las salas de hospitalización de adultos18. A partir del año 2016 se implantó el programa PACTA pediátrico (PACTA-Ped) en el hospital infantil del centro. El objetivo del estudio fue evaluar el impacto del programa PACTA-Ped en la prescripción de antimicrobianos.
MétodosEstudio longitudinal prospectivo sobre el consumo de antimicrobianos realizado desde el comienzo del programa PACTA-Ped en enero del 2016 hasta diciembre del 2017 (periodo 2; P2) en los servicios pediátricos de un hospital infantil terciario. Los resultados sobre la prescripción antimicrobianos obtenidos en el estudio se compararon retrospectivamente con el periodo previo a la instauración del PROA (2014-2015: periodo 1; P1).
Población de estudioLa población de estudio consistió en los pacientes pediátricos ingresados en nuestro hospital que recibieron antimicrobianos de amplio espectro (definidos a continuación), antifúngicos y antibioterapia intravenosa (IV) durante un mínimo de 5 días. El estudio se llevó a cabo en un hospital infantil terciario de 145 camas. El hospital tiene una unidad de cuidados intensivos neonatales de 19 camas y una unidad de cuidados intensivos pediátricos de 16 camas, atiende 3.000 ingresos al año y ofrece servicios pediátricos de cirugía general, compleja y de cardiopatías congénitas y tratamiento de enfermedades oncológicas. Se registraron las características demográficas, la unidad de ingreso, el tipo y la duración del tratamiento antibiótico/antifúngico, los días de tratamiento (DOT, del inglés days of therapy), los DOT por 1.000 días de ingreso (DOT/1.000), el número de tratamientos iniciados (NTI) para cada antibiótico y el NTI por 1.000 ingresos (NTI/1.000) como datos agregados. La información se recogió y almacenó mediante el sistema de recolección de datos REDCap®19. Los datos se alojaron en un servidor en línea seguro localizado en el Instituto de Investigación del hospital. El estudio no requirió consentimiento informado, toda vez que no entrañaba ningún riesgo a los pacientes y se llevó a cabo en el contexto de la práctica habitual. El estudio fue aprobado por el comité científico del centro (código TP17/0330).
ProcedimientoDesde que se instauró el programa PACTA-Ped, un asesor experto en infectología pediátrica (IP) revisó todas las prescripciones de antimicrobianos realizadas en el hospital infantil, por medio de una herramienta informática diseñada para dicho propósito, 2 días a la semana (martes y jueves). Las unidades de cuidados intensivos (neonatal y pediátrica) no pudieron ser evaluadas porque en el momento del estudio no disponían del sistema de prescripción electrónica. Los antimicrobianos incluidos en la categoría de amplio espectro fueron: amoxicilina-ácido clavulánico, cefotaxima/ceftriaxona, ceftazidima, cefepima, ceftolozano-tazobactam, piperacilina-tazobactam, meropenem, imipenem, teicoplanina, vancomicina, linezolid, quinolonas (IV u oral), colistina, tigeciclina y daptomicina. Esta categoría también incluyó todos los antifúngicos. Otros antibióticos desarrollados más recientemente (ceztazidima-avibactam, cefiderocol) no se utilizaban durante el periodo de estudio, por lo que no se incluyeron en la evaluación. Para cada prescripción, se ajusta la dosis por la edad, el peso y la función renal. La monitorización de concentraciones plasmáticas no se lleva a cabo rutinariamente.
Como complemento a la vigilancia de la prescripción de antimicrobianos, todos los días se celebró una reunión con el servicio de microbiología donde se discutieron todos los resultados positivos de hemocultivos y cultivos de líquido cefalorraquídeo, abscesos, catéteres, prótesis y otros dispositivos.
El asesor de IP revisó las prescripciones de pacientes en los que se habían indicado los antibióticos/antifúngicos de interés y mantuvo entrevistas con los médicos responsables de estos pacientes, emitiendo una recomendación sobre el tratamiento antimicrobiano más apropiado.
Análisis estadísticoPara describir la población de estudio, se resumieron los datos de las variables seleccionadas en tablas pivote con el paquete estadístico Statistical Package for the Social Sciences (SPSS®)20. Las variables categóricas se expresaron como frecuencias absolutas y porcentajes, y las continuas como mediana y rango intercuartílico (RIC). Se comparó el consumo de antimicrobianos (DOT, DOT/1.000 días de ingreso, NTI y NTI/1.000 ingresos) en los periodos P1 y P2. También se calculó la diferencia en el gasto promedio en los periodos P1 y P2, expresándose en términos de ahorro total y porcentaje de cambio.
ResultadosDurante el P2, se incluyó a un total de 160 pacientes en el estudio. El 55,6% eran varones, y la mayoría estaban ingresados en oncología (31,2%), cirugía (22,1%) y las salas de hospitalización de pediatría general (10%).
Con respecto a los factores de riesgo para infección, el 65,2% de los pacientes tenían alguna enfermedad subyacente significativa, como linfoma o leucemia (25,8%), tumor sólido (13,8%) o cardiopatía congénita (11,9%). El 37% de los pacientes eran portadores de un catéter central (Port-a-Cath [57,6%], acceso venoso femoral [13%] o central de inserción periférica [10,8%]).
Las recomendaciones PACTA-Ped provistas por el asesor de IP fueron las siguientes: en el 45% de los episodios, se recomendó «no cambiar» el antimicrobiano prescrito, en el 35% reducir el espectro antimicrobiano, en el 6,9% interrumpir alguno de los antimicrobianos prescritos, en el 6,9% cambiar la administración del tratamiento a vía oral y en el 3,1% ampliar el espectro antimicrobiano. La tasa de aceptación de las recomendaciones por parte de los médicos responsables fue del 89%.
Los antibióticos para los que se realizó una recomendación con mayor frecuencia fueron el meropenem (41,6%), la cefotaxima (23,4%), la ceftazidima (7,4%), la vancomicina (6,5%), la piperacilina-tazobactam (6,5%) y la teicoplanina (5,2%). Los antibióticos recomendados más frecuentemente como alternativas fueron la ciprofloxacina (11,9%) y la gentamicina (11,9%). En cuanto a los antifúngicos, los revisados con mayor frecuencia fueron la anfotericina B liposomal (60%), el fluconazol (25%) y el voriconazol (10%). En el 83,3% de los episodios de tratamiento antifúngico, el asesor de IP estaba de acuerdo con la prescripción y no recomendó ningún cambio.
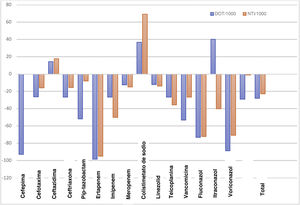
Uso de antimicrobianosLas tablas 1 y 2 presentan los datos de consumo de antibióticos según los DOT, los DOT/1.000, el NTI y el NTI/1.000 en el P1 y el P2. Se objetivó una disminución promedio del 27,8% en los DOT/1.000 días de ingreso en el P2 tras el inicio del PROA. Hubo una disminución del 22,9% en el NTI/1.000 ingresos en el P2 en comparación con el P1. El uso de carbapenémicos, cefalosporinas y glucopéptidos disminuyó del P1 al P2 (en términos de los DOT/1.000 días de ingreso y el NTI/1.000 ingresos). El porcentaje de cambio en los DOT/1.000 y el NTI/1.000 para cada antibiótico/antifúngico en cada periodo se muestra en la figura 1. Hubo un aumento en el consumo de ceftazidima y de colistina en el P2.
Días de tratamiento (DOT) y DOT por 1.000 días (DOT/1.000) para cada antimicrobiano y en cada año
| Total P1 | Total P2 | Cambio | Cambio porcentual (%) | |||||
|---|---|---|---|---|---|---|---|---|
| DOT | DOT/1.000 | DOT | DOT/1.000 | DOT | DOT/1.000 | DOT | DOT/1.000 | |
| Aztreonam | 0 | 0 | 73 | 3,80 | 73 | 3,8 | − | − |
| Cefepima | 13 | 0,68 | 3 | 0,05 | −10 | −0,63 | −76,92 | −92,60 |
| Cefotaxima | 3.198 | 165,90 | 1.916 | 122 | −1.282 | −43,50 | −40,09 | −26,20 |
| Ceftazidima | 500 | 25,91 | 450 | 29,70 | −50 | 3,76 | −10 | 14,51 |
| Ceftriaxona | 231 | 11,93 | 124 | 8,78 | −107 | −3,15 | −46,32 | −26,40 |
| Piperacilina-tazobactam | 1.196 | 62,13 | 465 | 30,10 | −731 | −32,10 | −61,12 | −51,60 |
| Ertapenem | 310 | 16,18 | 6 | 0,31 | −304 | −15,90 | −98,06 | −98,10 |
| Imipenem/cilastatina | 59 | 3,07 | 31 | 2,26 | −28 | −0,81 | −47,46 | −26,40 |
| Meropenem | 3.105 | 161 | 2.155 | 141 | −950 | −20,10 | −30,60 | −12,50 |
| Colistimetato de sodio | 243 | 12,61 | 230 | 17,20 | −13 | 4,62 | −5,35 | 36,64 |
| Linezolid | 295 | 15,37 | 186 | 13,5 | −109 | −1,86 | −36,95 | −12,10 |
| Teicoplanina | 1.183 | 61,44 | 701 | 45 | −482 | −16,40 | −40,74 | −26,70 |
| Vancomicina | 1.987 | 103,20 | 775 | 48,40 | −1.212 | −54,70 | −61 | −53,10 |
| Fluconazol | 1.125 | 58,44 | 246 | 15,70 | −879 | −42,80 | −78,13 | −73,20 |
| Itraconazol | 231 | 12,07 | 279 | 16,90 | 48 | 4,85 | 20,78 | 40,18 |
| Voriconazol | 164 | 8,54 | 19 | 0,99 | −145 | −7,55 | −88,41 | −88,40 |
| Anfotericina B | 690 | 35,86 | 464 | 25,50 | −226 | −10,40 | −32,75 | −29,00 |
| Total | 14.542 | 754,90 | 8.403 | 545 | −6.139 | −210 | −42,22 | −27,80 |
Número de tratamientos iniciados y tratamientos iniciados por 1.000 ingresos (NTI/1.000) para cada antibiótico y cada período de estudio
| Total P1 | Total P2 | Cambio | Cambio porcentual (%) | |||||
|---|---|---|---|---|---|---|---|---|
| NTI | NTI/1.000 | NTI | NTI/1.000 | NTI | NTI/1.000 | NTI | NTI/1.000 | |
| Aztreonam | 0 | 0 | 10 | 2,10 | 10 | 2,10 | — | — |
| Cefepima | 2 | 0,48 | 2 | 0,40 | 0 | −0,08 | 0 | 0 |
| Cefotaxima | 727 | 173,90 | 612 | 125,84 | −115 | −48,06 | 18,79 | −15,8 |
| Ceftazidima | 79 | 18,78 | 93 | 19,05 | 14 | 0,27 | −15,05 | 17,7 |
| Ceftriaxona | 71 | 16,82 | 60 | 11,98 | −11 | −4,84 | 18,33 | −15,5 |
| Piperacilina-tazobactam | 112 | 26,83 | 103 | 21,11 | −9 | −5,72 | 8,737 | −8,04 |
| Ertapenem | 58 | 14,38 | 3 | 0,67 | −55 | −13,71 | 1.833,30 | −94,8 |
| Imipenem/cilastatina | 8 | 1,92 | 4 | 0,81 | −4 | −1,11 | 100 | −50 |
| Meropenem | 362 | 86,44 | 308 | 63,19 | −54 | −23,25 | 17,53 | −14,9 |
| Colistimetato de sodio | 13 | 3,12 | 22 | 4,35 | 9 | 1,23 | −40,91 | 69,2 |
| Linezolid | 36 | 8,66 | 31 | 6,19 | −5 | −2,47 | 16,12 | −13,9 |
| Teicoplanina | 327 | 78,59 | 211 | 43,72 | −116 | −34,87 | 54,97 | −35,5 |
| Vancomicina | 222 | 53,21 | 163 | 33,73 | −59 | −19,48 | 36,19 | −26,6 |
| Fluconazol | 140 | 33,62 | 39 | 8,28 | −101 | −25,34 | 258,97 | −72,1 |
| Itraconazol | 30 | 7,46 | 18 | 3,85 | −12 | −3,61 | 66,66 | −40 |
| Voriconazol | 17 | 4,12 | 5 | 1,12 | −12 | −3 | 240 | −70,6 |
| Anfotericina B | 86 | 21,06 | 85 | 17,61 | −1 | −3,45 | 1,17 | −1,16 |
| Total | 2.293 | 550,12 | 1.769 | 364 | −524 | −186,12 | 29,62 | −22,9 |
El coste medio anual del tratamiento antimicrobiano disminuyó de 150.356€/año durante el P1 a 98.478€/año en el P2, lo que correspondía a un ahorro medio de 51.878€ anuales. Cuando el coste se ajustó según los días de ingreso, el coste del tratamiento antimicrobiano resultó ser de 7821€ por 1.000 días de ingreso en el P1 y de 6.644€ por 1.000 días de ingreso en el P2 (ahorro de 1.177€ por 1.000 días de ingreso) (tablas 3 y 4). El número de pacientes pediátricos tratados con antimicrobianos de interés por 1.000 ingresos se redujo de 349,9/1.000 ingresos en el P1 a 247/1.000 ingresos en el P2, and y la reducción total en el número de pacientes tratados con antibióticos de amplio espectro fue de 102,9/1.000 ingresos (29,4%) (tabla 3).
Coste anual medio del tratamiento antimicrobiano por periodo en euros y cambio porcentual entre los 2 periodos
| P1 | P2 | Cambio absoluto | Cambio porcentual (%) | |
|---|---|---|---|---|
| Coste anual medio del tratamiento antimicrobiano (€) | 150.356,57 | 98.478,07 | 51.878 | 34,5 |
| Coste de antimicrobianos (€) por 1.000 días/paciente | 7.821 | 6.644 | 1.177 | 15 |
| Número de niños tratados con antimicrobianos por 1.000 ingresos | 349,9 | 247 | 102,9 | 29,40 |
La implementación de un PROA en un hospital terciario ha contribuido a reducir el uso de antimicrobianos de amplio espectro y su uso indebido. Los PROA han sido evaluados previamente en distintos entornos en EE. UU., donde la práctica clínica y los patrones de prescripción difieren de los de la UE6,21–23. En los últimos años, se han publicado informes sobre el desempeño de los PROA en pacientes pediátricos hospitalizados en entornos sanitarios europeos24,25. Aun así, la evidencia científica sobre el impacto de la implementación de este tipo de programas en pacientes pediátricos continúa siendo insuficiente, con escasos datos publicados en Europa26.
En nuestra muestra, el 55% de las prescripciones podían mejorarse (solo se recomendó «no cambiar» el antimicrobiano prescrito en el 45% de los episodios), lo que sugiere la necesidad de implementar estrategias que ayuden al facultativo prescriptor a mejorar la prescripción antimicrobiana. No obstante, la tasa de aceptación de las recomendaciones del equipo del PROA fue una de las más altas reportadas en estudios pediátricos, que oscilan entre el 78 y el 89%14,23,25,27–29. La auditoría prospectiva se fundamenta en el diálogo abierto e individual entre los miembros del equipo del PROA y los facultativos responsables30. El acrónimo PACTA también se puede interpretar en el sentido de acuerdo o trato entre individuos. Consideramos que este término refleja el espíritu de este tipo de intervención, centrada en el diálogo y la formación de los prescriptores. Los asesores de IP han observado que privar a los facultativos de su autonomía puede suponer un obstáculo al desarrollo de los PROA31. Por este motivo, el asesoramiento por parte de nuestro equipo no es de naturaleza impositiva, sino que se hacen recomendaciones llegando a un acuerdo con el facultativo prescriptor. Gross et al. atribuyeron las diferencias en las tasas de aceptación a la competencia del equipo médico del PROA y el nivel de confianza establecido con el equipo32. Es indiscutible que conseguir una tasa alta de aceptación de las recomendaciones de prescripción antimicrobiana requiere un diálogo estrecho, instructivo y consensual con el prescriptor.
En los primeros años de la década de los 80, la Organización Mundial de la Salud (OMS) adoptó y recomendó el uso de la dosis diaria definida (DDD) para medir el consumo de antimicrobianos de manera estandarizada33. Aunque se considera el estándar de referencia para los pacientes adultos, el DDD no puede aplicarse con facilidad a la medición del consumo de antimicrobianos en menores por la considerable variación de peso en la población pediátrica34. Nuestro análisis se basa en los DOT y el NTI, ajustados por 1.000 días de ingreso y 1.000 ingresos,
respectivamente, una estrategia que nos parecía más apropiada para la población pediátrica y apoyada por distintos estudios35,36. Otros autores ya han utilizado los DOT/1.000 días de ingreso para medir el consumo de antimicrobianos en entornos pediátricos23. La DDD de antimicrobianos se ha aplicado en algunos entornos específicos (neonatología) en base a la reducida variación en el peso de estos pacientes37,38. No obstante, los DOT/1.000 días de ingreso y el NTI/1.000 ingresos son indicadores precisos del uso de antimicrobianos en la población pediátrica. Observamos una disminución de los DOT en los antibióticos/antifúngicos de interés tras el inicio del PROA. El control directo de los hábitos de prescripción de antimicrobianos podría contribuir a limitar la duración inapropiada del tratamiento antimicrobiano de amplio espectro, con una reducción en los DOT/1.000. El aumento en los DOT/1.000 de antibióticos alternativos de espectro más reducido (como la ceftazidima) refleja una tendencia a la sustitución de antibióticos con un espectro más amplio, como el meropenem y la piperacilina-tazobactam, en el P2. En cuanto a la colistina, se observó un aumento en los DOT/1.000 en el P2; se trata de un antibiótico con indicación muy limitada en pediatría, recibiéndolo solo 3 niños por 1.000 ingresos (NTI/1.000) en el P1 y 4 por 1.000 ingresos en el P2. A pesar de ello, la existencia de un número reducido de pacientes con infecciones multirresistentes que requirieron tratamiento prolongado con colistina, causó un aumento en los DOT/1.000.
El antibiótico con respecto al que se realizó el mayor número de recomendaciones fue el meropenem. El uso excesivo de carbapenémicos a nivel hospitalario se asocia a un riesgo aumentado de infecciones por bacterias con resistencia a los carbapenémicos (RC)39. La RC es un problema creciente y muy alarmante en EE. UU. y en Europa, y han de tomarse medidas contra el uso indebido de carbapenémicos en todos los ámbitos7.
También se observó un descenso global en el NTI en el P2 tras el inicio del PROA. La entrevista personal con el prescriptor proporcionaba una buena oportunidad educativa, ya que los facultativos aprendían sobre la base de sus propios hábitos de prescripción. La disminución en el NTI podría deberse en parte al cambio en los hábitos de prescripción resultante de las actividades educativas directas que formaban parte del PROA, pero también a una concienciación mayor en las instituciones sanitarias sobre el problema de la RAM.
Las cefalosporinas de tercera generación también se encuentran entre los antibióticos de interés, con una reducción importante en su utilización (26%). El uso inapropiado de cefalosporinas se ha asociado al desarrollo bacteriano de resistencias4. En los últimos años, la presencia de bacterias productoras de beta-lactamasas de espectro extendido se ha convertido en un problema alarmante4.
En los distintos ámbitos sanitarios de EE. UU., la vancomicina suele ser el antibiótico para el que más recomendaciones se realizan dentro de los PROA23,27. Dada su importancia, Di Pentima et al. implementaron un PROA específico centrado en el uso de vancomicina en un hospital infantil universitario23,27. En nuestro estudio, solo el 6,5% del total de recomendaciones del PROA concernían a la vancomicina. La prevalencia de Staphylococcus aureus resistente a la oxacilina en la población pediátrica española es menor que en Estados Unidos, hecho que podría explicar las diferencias en los hábitos de prescripción entre ambos países. Aun así, tras el comienzo del PROA hubo una reducción en la prescripción de vancomicina de hasta el 53% en términos de los DOT/1.000.
Encontramos un descenso notable en la prescripción de antifúngicos en el P2 (NTI/1.000), así como una disminución en la duración de los tratamientos antifúngicos (DOT/1.000) para el voriconazol, el fluconazol y la anfotericina liposomal. Para el itraconazol, en el P2 se observó un descenso en el NTI/1.000, mientras que los DOT/1.000 aumentaron. Esta diferencia estaba relacionada con un paciente ingresado en el P2 con una infección fúngica invasiva que requirió tratamiento a largo plazo con itraconazol.
Globalmente, hubo una reducción progresiva en el uso de antibióticos de amplio espectro desde los 349,9 pacientes tratados con antibióticos de interés por 1.000 ingresos en el P1 a 247 en el P2. Esta tendencia decreciente en el uso de antimicrobianos comenzó en el año 2015, antes de la implantación del programa PACTA-Ped, por lo que la prescripción de antibióticos podría haberse visto influenciada por otros factores. Antes del año 2016, la unidad de IP introdujo un programa de monitorización diaria de los pacientes pediátricos con cultivos positivos (sangre, líquido cefalorraquídeo), llevándose a cabo reuniones diarias con el servicio de microbiología, en las que se hacían recomendaciones para el tratamiento de dichos pacientes. Las reuniones han continuado más allá del año 2016 hasta el día de hoy. Consideramos sumamente importante mantener una comunicación diaria con el servicio de microbiología. Esta cultura de respuesta rápida tras un resultado positivo en el cultivo guía a los clínicos en la toma de decisiones terapéutica, contribuye a la desescalada rápida del tratamiento antimicrobiano y limita el uso inapropiado de antimicrobianos, y debería considerarse un pilar fundamental del PROA. En esta misma línea, cabe enfatizar que, en nuestra muestra, la estrategia de combinar auditorías prospectivas con los facultativos responsables con las reuniones diarias con el servicio de microbiología ha promovido una tendencia decreciente progresiva en el consumo de los antimicrobianos de interés.
En línea con la disminución en el uso de antibióticos de amplio espectro observado en el P2, se produjo una reducción en el coste medio anual del tratamiento antimicrobiano, de 150.356€ en el P1 a 98.478€ en el P2 (ahorro de 51.878€). Esto corresponde a un ahorro del 34,5% en los costes anuales asociados al tratamiento antimicrobiano en las salas de hospitalización. También hubo una reducción en el coste del tratamiento antimicrobiano por 1.000 días/paciente de 7.821 a 6.644€ (reducción del 15%). Conviene subrayar que antes de la implementación del programa PACTA-Ped hubo una reducción del año 2014 al 2015 en el coste del tratamiento antimicrobiano por 1.000 días de ingreso (de 8.196 a 5.091€). Como ya comentamos, esto sugiere que además del programa PACTA-Ped en sí, otras estrategias para mejorar la prescripción de antimicrobianos que ya existían previamente, como las reuniones diarias con el servicio de microbiología, contribuyen muy positivamente a la reducción del consumo de antimicrobianos.
Los pacientes ingresados en las unidades de cuidados intensivos pediátrica o neonatal y en el servicio de urgencias no se incluyeron en este análisis de costes porque el sistema de prescripción electrónica no estaba disponible en estos entornos en el momento del estudio. Los ahorros futuros podrían ser aún mayores una vez se incluya a estas unidades en el programa PACTA-Ped. En este PROA, un asesor de IP dedicaba 2 días a la semana a revisar las prescripciones y realizar las entrevistas con los facultativos, lo que suponía un coste para el centro de 24.000€ al año. En nuestro hospital, el PROA parece ser una medida coste-efectiva, aunque se requieren más estudios de coste-efectividad del programa con un periodo de seguimiento más prolongado.
El estudio presenta varias limitaciones. En primer lugar, no se habían establecido indicadores estandarizados para la medición del uso de antimicrobianos en pacientes pediátricos. Como ya comentamos, la aplicación de la DDD, el indicador estándar en adultos, no sería apropiada en la población pediátrica sin adaptación previa. A pesar de la experiencia limitada con los DOT/1.000 y el NTI/1.000, nos parecieron parámetros sencillos y fiables para medir el uso de antimicrobianos en niños y fáciles de aplicar en un PROA pediátrico. Otra limitación es que no se evaluaron otras variables que podrían haber contribuido al descenso observado en el consumo de antibióticos de amplio espectro además del PROA. Es poco probable que la complejidad de los pacientes disminuyera en el P2, pues no hubo cambios relevantes en la actividad del hospital. En el centro se llevaron a cabo otras actividades educativas sobre la RAM y el consumo de antimicrobianos (charlas, trabajos de investigación). Esta concienciación creciente entre los prescriptores podría contribuir al descenso en el uso inapropiado de antimicrobianos independientemente del programa. El PROA es un paquete de acciones que contribuyen a mejorar la cultura de prescripción con efecto a largo plazo. Es muy complicado cuantificar la medida en que los componentes del PROA contribuyen al resultado global, por lo que es posible que el PACTA-Ped tenga un impacto menor del que le atribuimos. En cualquier caso, el PROA es un programa combinado de diferentes acciones y hay que evaluar sus resultados a nivel global.
En conclusión, la implementación de un PROA basado en la revisión periódica de las prescripciones de antimicrobianos y auditorías individuales con los prescriptores se asoció a un descenso significativo en el uso de antibióticos de amplio espectro y antifúngicos en un hospital infantil terciario. Los costes asociados con la prescripción antimicrobiana disminuyeron desde el inicio del PROA, que resultó ser una intervención coste-efectiva en el periodo bajo estudio.
Disponibilidad de datos y recursosLos datos se alojaron en un servidor en línea seguro localizado en el Instituto de Investigación Hospital 12 de Octubre. Se puede acceder a los conjuntos de datos utilizados y analizados durante el estudio a través del autor para correspondencia presentando una petición razonable. De disponer de acceso: https://redcap.imas12.es
Consideraciones éticasEl estudio fue aprobado por el Comité de Ética en Investigación Clínica del Hospital Universitario 12 de Octubre (código: TP17/0330).
FinanciaciónTrabajo financiado por el Ministerio de Ciencia e Innovación de España, Instituto de Salud Carlos III y el Fondo Europeo de Desarrollo Regional (FEDER) (contrato Río Hortega CM20/00173 con SV y INT20/00086 con DBG)], y por el Instituto de Investigación del Hospital 12 de Octubre (imas12).
AutoríasSerena Villaverde y Daniel Blázquez-Gamero concibieron y diseñaron el estudio. Daniel Blázquez-Gamero y José Manuel Caro prepararon el material, recogieron los datos y realizaron el análisis. Serena Villaverde escribió el primer borrador del manuscrito. Todos los autores revisaron y comentaron versiones previas. Todos los autores leyeron y aprobaron la versión definitiva del manuscrito.
Conflicto de interesesSV, JMC, SD, MAO y PR no tienen conflictos de intereses que declarar.
DBG ha recibido honorarios de MSD como ponente en actividades docentes.
CE ha recibido ayuda económica de Viiv y Gilead para asistir a reuniones científicas.
Agradecimientos al grupo de investigación PACTA-Ped: Luis Prieto, Cinta Moraleda, Ángela Manzanares, Elisa Fernández-Cooke, María Fernanda Guzmán, David Lora, Cristofer Izquierdo y Francisco López-Medrano.