Aunque actualmente se tiende a un abordaje terapéutico menos agresivo, la osteomielitis hematógena aguda (OHA) sigue suponiendo un reto, con una morbilidad significativa a nivel mundial. El objetivo del estudio fue evaluar si se alcanzó una adherencia del 80% con el protocolo vigente, identificar las complicaciones y riesgos asociados y analizar las tendencias en la etiología y el manejo de la OHA en la población pediátrica.
MétodosEstudio observacional longitudinal unicéntrico en pacientes menores de 18años con OHA ingresados en un hospital pediátrico entre 2008 y 2018 divididos en 2 cohortes (antes y después de 2014). Se analizaron datos demográficos, clínicos y concernientes a la evolución de la enfermedad.
ResultadosEl estudio incluyó a 71 niños con OHA, 56% varones, con una edad mediana de 3años (rango intercuartílico, 1-11). Se observó una incidencia 1,8 veces mayor en los últimos 5 años. El agente causal se identificó en el 37% de los casos: SASM (54%), SARM (4%), Streptococcus pyogenes (19%), Kingella kingae (12%), Streptococcus pneumoniae (8%) y Neisseria meningitidis (4%). Se identificaron complicaciones en el 45% y secuelas en 3,6% de los pacientes. En los últimos años aumentó la incidencia de miositis (30% vs. 7%; p=0,02) y de artritis séptica (después de 2015, 68% vs. 37,2%, p=0,012), así como la proporción de pacientes con tratamiento inferior a 4 semanas (37% vs. 3,5%; p=0,012), con tasas de secuelas similares. Los factores de riesgo de complicaciones fueron la edad ≥3años, nivel de PCR≥20mg/l, duración de los síntomas al ingreso de 5 o más días y cultivo positivo, aunque en el análisis multivariado solo se validó el cultivo positivo. La presencia de complicaciones se identificó como factor de riesgo de secuelas a los 6 meses.
ConclusionesEl presente estudio confirma que la OHA puede ser agresiva. La identificación de los factores de riesgo es fundamental para su abordaje.
Despite the current trend towards less aggressive therapeutic approaches, acute haematogenous osteomyelitis (AHO) continues to be a challenge and is associated with significant morbidity worldwide. Our aim was to determine if 80% compliance with current protocol was achieved, identify complications and associated risk factors and analyse trends in aetiology and management of AHO in children.
MethodsWe conducted a longitudinal, observational, single-centre study in patients with AHO aged less than 18 years admitted to a paediatric hospital, between 2008 and 2018, divided into 2 cohorts (before and after 2014). Demographic, clinical data and disease progression were analysed.
ResultsThe study included 71 children with AHO, 56% male, with a median age of 3 years (interquartile range, 1–11). We found a 1.8-fold increase of cases in the last 5 years. The causative agent was identified in 37% of cases: MSSA (54%), MRSA (4%), Streptococcus pyogenes (19%), Kingella kingae (12%), Streptococcus pneumoniae (8%), and Neisseria meningitidis (4%). Complications were identified in 45% of patients and sequelae in 3.6%. In recent years, there was an increase in myositis (30% vs. 7%; p=0.02), septic arthritis (68% vs. 37.2%; p=0.012) and in the proportion of patients treated for less than 4 weeks (37% vs. 3.5%; p=0.012), with a similar sequelae rates. The risk factors for complications were age 3 or more years, CRP levels of 20mg/l or higher, time elapsed between onset and admission of 5 or more days and positive culture, although on multivariate analysis only positive culture was significant. The presence of complications was a risk factor for sequelae at 6 months.
ConclusionsOur study confirms that AHO can be aggressive. The identification of risk factors for complications may be fundamental for management.
La osteomielitis hematógena aguda (OHA) continúa suponiendo un reto, asociándose a una mortalidad significativa a nivel mundial y requiriendo tratamiento prolongado en gran número de casos1,2. En Europa, su incidencia oscila entre 2 y 13 casos por 100.000 habitantes2–4. Su etiología es variable, pero Staphylococcus aureus continúa siendo el agente causal más frecuente en niños pequeños, implicado en el 36,5-70% de casos positivos1,2,5, seguido de Kingella kingae (14-22,2%)6,7.
En Europa, la antibioterapia empírica en el manejo de la OHA está bien establecida3, pero la indicación de cirugía continúa causando controversia, dándose una tendencia hacia tratamientos menos agresivos y de menor duración1,8–11. No obstante, en casos de infección por S. aureus, especialmente por cepas productoras de leucocidina Panton-Valentine (PVL, por sus siglas en inglés) o S.aureus resistente a meticilina (SARM)3,12–14, el tratamiento es más prolongado y agresivo en comparación con los causados por K. kingae6,7,15. Los casos de OHA con artritis séptica (AS) concomitante, abscesos o (pio)miositis también suelen requerir cursos de tratamiento prolongados y múltiples intervenciones quirúrgicas1–3,13,16,17. Dicho lo cual, pocos estudios han analizado los predictores de complicaciones, que son extremadamente importantes en series heterogéneas16,18,19.
En 2014 se introdujo un protocolo revisado para el manejo de la OHA en nuestro hospital. Los objetivos del estudio fueron identificar a los pacientes con riesgo de OHA complicada, analizar tendencias etiológicas y prácticas habituales en la atención sanitaria (con el objetivo de alcanzar una adherencia al protocolo vigente del 80%) y comparar las diferencias entre las infecciones por S. aureus y por otros patógenos.
Pacientes y métodosEstudio observacional y longitudinal en pacientes menores de 18años con OHA ingresados en un hospital terciario entre enero de 2008 y diciembre de 2018. Los pacientes se incluyeron de manera retrospectiva hasta el 2014 y de manera prospectiva a partir de ese año. Un equipo multidisciplinar estuvo a cargo del manejo de los pacientes a partir de 2014. Se recogieron datos demográficos, clínicos, microbiológicos, de imagen, terapéuticos y de evolución de los historiales clínicos. Se excluyó a pacientes menores de 3 meses y a pacientes con antecedentes de cirugía o traumatismo en la zona infectada.
El diagnóstico de OHA y de AS se basó en la presentación clínica (incapacidad de cargar peso, disminución del rango de movilidad, dolor, signos inflamatorios locales, fiebre) en un período inferior a 14 días con hallazgos de imagen compatibles, con o sin aislamiento microbiológico1,2. La respuesta clínica favorable durante el seguimiento se consideró indicativa de AS. Los abscesos, (pio)miositis, trombosis venosa profunda (TVP), infección diseminada, fracturas patológicas, dislocación de articulaciones, necrosis avascular o la osteomielitis crónica se consideraron complicaciones de la OHA. El dolor residual, la cojera, el rango de movilidad disminuido, la rigidez, la deformidad angular o la discrepancia en la longitud de las extremidades causadas por la OHA con duración de más de 6 meses se consideraron secuelas de la OHA1,16.
El antibiótico de primera línea recomendado en niños ≤3años es la flucloxacilina (150-200mg/kg/día cada 6h) o la cefuroxima (150mg/kg/día cada 8h). El cambio a terapia oral se puede considerar tras un mínimo de 3 días si el paciente se encuentra afebril con mejoría de los síntomas y con una reducción del 50% en el nivel de proteína C reactiva (PCR) (PCR≤20mg/l)3,10.
Las pruebas de identificación bacteriana y de susceptibilidad a antimicrobianos se realizaron en el laboratorio de microbiología del hospital. Las muestras de fluido sinovial para cultivo se inocularon en frascos de hemocultivo. A partir de 2014, cuando el método estaba disponible, se realizaron pruebas de detección de K. kingae en muestras de líquido articular y óseas mediante reacción en cadena de la polimerasa en tiempo real (RT-PCR) en pacientes ≤4años.
Análisis estadísticoLas variables cualitativas se expresan como porcentajes y las continuas como media y desviación estándar o mediana y rango intercuartílico (RIC). Las variables continuas se compararon por medio de las pruebas t de Student, U de Mann-Whitney o de Kruskal-Wallis, y las categóricas por medio de la prueba chi cuadrado o la prueba exacta de Fisher. La asociación entre 2 variables continuas se analizó mediante la correlación de Pearson. Se realizó análisis de regresión logística multivariado para identificar posibles factores de riesgo asociados al desarrollo de complicaciones y secuelas. El análisis de datos se realizó con el paquete SPSS Statistics® versión 24 (IBM Corp, Nueva York, EE.UU.). La significación estadística se estableció en p<0,05. La recogida y el manejo de los datos se adhirieron al Reglamento (UE) 2016/679 del 27 de abril de 2016 sobre la protección de datos personales, y el estudio fue aprobado por el comité de ética local.
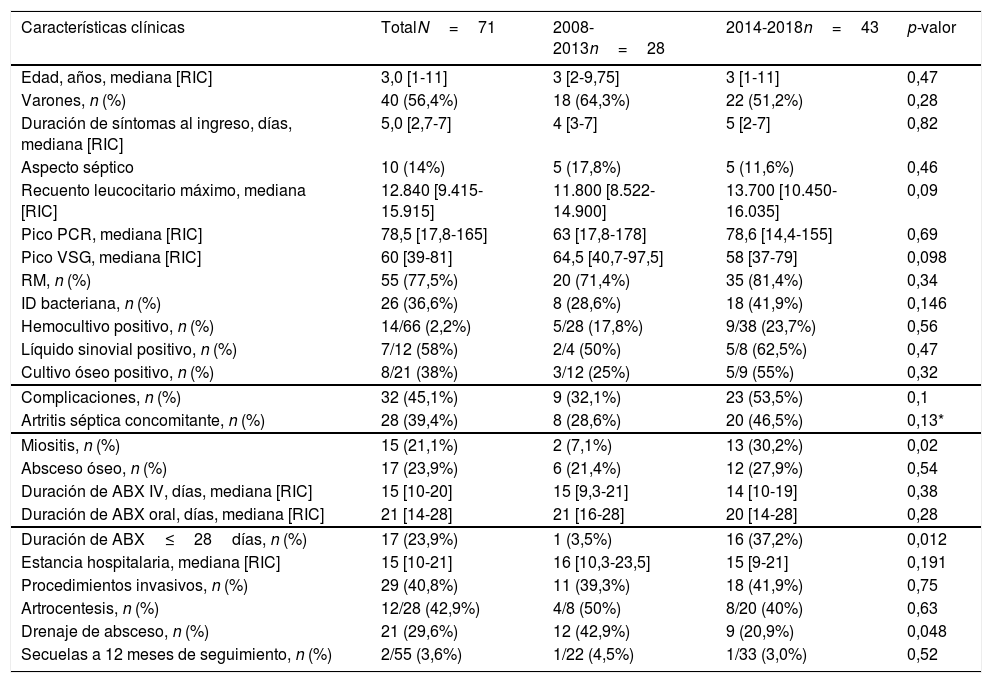
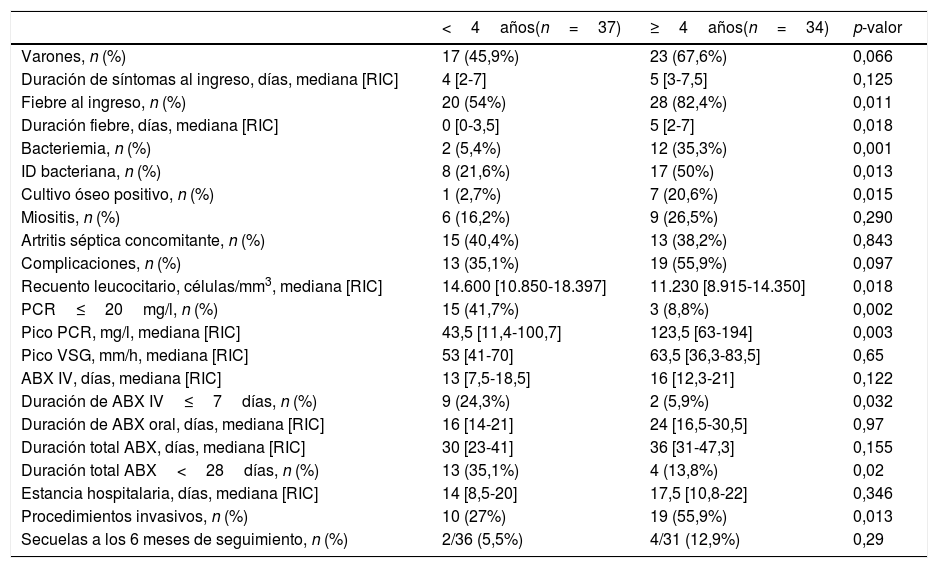
ResultadosMuestra totalSe identificaron 71 casos de OHA, correspondiendo a una incidencia anual media de 11,4 casos por 100.000 menores (rango, 3-10casos/año), de los que el 42% se diagnosticaron en los meses invernales. La incidencia observada aumentó 1,8 veces en los últimos 5 años. La tabla 1 resume las características clínicas de los casos. Doce pacientes (16,9%) reportaron lesiones cutáneas previas (3 con antecedente de varicela) y 8 enfermedades crónicas (7 drepanocitosis y 1 enfermedad renal crónica). La tabla 2 compara las características clínicas en niños menores y mayores de 4años.
Características demográficas, clínicas y de laboratorio en la muestra total
| Características clínicas | TotalN=71 | 2008-2013n=28 | 2014-2018n=43 | p-valor |
|---|---|---|---|---|
| Edad, años, mediana [RIC] | 3,0 [1-11] | 3 [2-9,75] | 3 [1-11] | 0,47 |
| Varones, n (%) | 40 (56,4%) | 18 (64,3%) | 22 (51,2%) | 0,28 |
| Duración de síntomas al ingreso, días, mediana [RIC] | 5,0 [2,7-7] | 4 [3-7] | 5 [2-7] | 0,82 |
| Aspecto séptico | 10 (14%) | 5 (17,8%) | 5 (11,6%) | 0,46 |
| Recuento leucocitario máximo, mediana [RIC] | 12.840 [9.415-15.915] | 11.800 [8.522-14.900] | 13.700 [10.450-16.035] | 0,09 |
| Pico PCR, mediana [RIC] | 78,5 [17,8-165] | 63 [17,8-178] | 78,6 [14,4-155] | 0,69 |
| Pico VSG, mediana [RIC] | 60 [39-81] | 64,5 [40,7-97,5] | 58 [37-79] | 0,098 |
| RM, n (%) | 55 (77,5%) | 20 (71,4%) | 35 (81,4%) | 0,34 |
| ID bacteriana, n (%) | 26 (36,6%) | 8 (28,6%) | 18 (41,9%) | 0,146 |
| Hemocultivo positivo, n (%) | 14/66 (2,2%) | 5/28 (17,8%) | 9/38 (23,7%) | 0,56 |
| Líquido sinovial positivo, n (%) | 7/12 (58%) | 2/4 (50%) | 5/8 (62,5%) | 0,47 |
| Cultivo óseo positivo, n (%) | 8/21 (38%) | 3/12 (25%) | 5/9 (55%) | 0,32 |
| Complicaciones, n (%) | 32 (45,1%) | 9 (32,1%) | 23 (53,5%) | 0,1 |
| Artritis séptica concomitante, n (%) | 28 (39,4%) | 8 (28,6%) | 20 (46,5%) | 0,13* |
| Miositis, n (%) | 15 (21,1%) | 2 (7,1%) | 13 (30,2%) | 0,02 |
| Absceso óseo, n (%) | 17 (23,9%) | 6 (21,4%) | 12 (27,9%) | 0,54 |
| Duración de ABX IV, días, mediana [RIC] | 15 [10-20] | 15 [9,3-21] | 14 [10-19] | 0,38 |
| Duración de ABX oral, días, mediana [RIC] | 21 [14-28] | 21 [16-28] | 20 [14-28] | 0,28 |
| Duración de ABX≤28días, n (%) | 17 (23,9%) | 1 (3,5%) | 16 (37,2%) | 0,012 |
| Estancia hospitalaria, mediana [RIC] | 15 [10-21] | 16 [10,3-23,5] | 15 [9-21] | 0,191 |
| Procedimientos invasivos, n (%) | 29 (40,8%) | 11 (39,3%) | 18 (41,9%) | 0,75 |
| Artrocentesis, n (%) | 12/28 (42,9%) | 4/8 (50%) | 8/20 (40%) | 0,63 |
| Drenaje de absceso, n (%) | 21 (29,6%) | 12 (42,9%) | 9 (20,9%) | 0,048 |
| Secuelas a 12 meses de seguimiento, n (%) | 2/55 (3,6%) | 1/22 (4,5%) | 1/33 (3,0%) | 0,52 |
ABX: antibioterapia; ID: identificación; IV: intravenosa; PCR: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
Distribución de características clínicas por grupo de edad
| <4años(n=37) | ≥4años(n=34) | p-valor | |
|---|---|---|---|
| Varones, n (%) | 17 (45,9%) | 23 (67,6%) | 0,066 |
| Duración de síntomas al ingreso, días, mediana [RIC] | 4 [2-7] | 5 [3-7,5] | 0,125 |
| Fiebre al ingreso, n (%) | 20 (54%) | 28 (82,4%) | 0,011 |
| Duración fiebre, días, mediana [RIC] | 0 [0-3,5] | 5 [2-7] | 0,018 |
| Bacteriemia, n (%) | 2 (5,4%) | 12 (35,3%) | 0,001 |
| ID bacteriana, n (%) | 8 (21,6%) | 17 (50%) | 0,013 |
| Cultivo óseo positivo, n (%) | 1 (2,7%) | 7 (20,6%) | 0,015 |
| Miositis, n (%) | 6 (16,2%) | 9 (26,5%) | 0,290 |
| Artritis séptica concomitante, n (%) | 15 (40,4%) | 13 (38,2%) | 0,843 |
| Complicaciones, n (%) | 13 (35,1%) | 19 (55,9%) | 0,097 |
| Recuento leucocitario, células/mm3, mediana [RIC] | 14.600 [10.850-18.397] | 11.230 [8.915-14.350] | 0,018 |
| PCR≤20mg/l, n (%) | 15 (41,7%) | 3 (8,8%) | 0,002 |
| Pico PCR, mg/l, mediana [RIC] | 43,5 [11,4-100,7] | 123,5 [63-194] | 0,003 |
| Pico VSG, mm/h, mediana [RIC] | 53 [41-70] | 63,5 [36,3-83,5] | 0,65 |
| ABX IV, días, mediana [RIC] | 13 [7,5-18,5] | 16 [12,3-21] | 0,122 |
| Duración de ABX IV≤7días, n (%) | 9 (24,3%) | 2 (5,9%) | 0,032 |
| Duración de ABX oral, días, mediana [RIC] | 16 [14-21] | 24 [16,5-30,5] | 0,97 |
| Duración total ABX, días, mediana [RIC] | 30 [23-41] | 36 [31-47,3] | 0,155 |
| Duración total ABX<28días, n (%) | 13 (35,1%) | 4 (13,8%) | 0,02 |
| Estancia hospitalaria, días, mediana [RIC] | 14 [8,5-20] | 17,5 [10,8-22] | 0,346 |
| Procedimientos invasivos, n (%) | 10 (27%) | 19 (55,9%) | 0,013 |
| Secuelas a los 6 meses de seguimiento, n (%) | 2/36 (5,5%) | 4/31 (12,9%) | 0,29 |
ABX: antibioterapia; ID: identificación; IV: intravenosa; PCR: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
Las manifestaciones clínicas más frecuentes fueron: dolor (95,8%), disminución del rango de movilidad (85,9%), fiebre (temperatura timpánica ≥38,2°C; 67,6%), signos inflamatorios locales (91,5%), irritabilidad (7%) y apariencia séptica (14,1%). Los huesos afectados más comúnmente fueron el fémur (22,5%), la tibia (19,7%), el húmero (14,1%), el íleo (11,3%) y los tarsianos (11,3%). Las articulaciones afectadas con mayor frecuencia fueron la cadera (12,7%), la rodilla (5,6%), el codo (5,6%), el tobillo (5,6%) y el hombro (4,2%). Seis pacientes (8,5%) tuvieron afectación multifocal. Se realizó radiografía simple en el 93% de los pacientes, cuyos resultados fueron normales en el 66,7%. Se realizó resonancia magnética (RM) en el 77,5% de los pacientes, con un rendimiento diagnóstico elevado (98%). El uso de la RM no incrementó de manera significativa con la implementación del protocolo.
MicrobiologíaEn el 36,6% se identificó el agente etiológico mediante cultivo positivo (24/65) o por amplificación molecular (2/7). Se realizó hemocultivo en el 98,5% de los pacientes, con resultados positivos en el 21,2%. La RT-PCR para detección de K. kingae solo se realizó en 5 pacientes: en muestra ósea en 3 (todas negativas), en líquido sinovial en uno (positiva) y en frotis orofaríngeo en 2 (1 positiva). También se realizaron pruebas de RT-PCR para la detección del gen 16S ARN bacteriano en 2 pacientes, negativas en ambos. En 6 pacientes, los cultivos permanecieron positivos para S. aureus (con aislamiento en muestra de sangre [3] o de absceso óseo [3]) tras la antibioterapia (rango, 5-22 días). En estos pacientes, la OHA se asoció a abscesos óseos (4), miositis (3), fascitis (2), sepsis/enfermedad diseminada (2) y TVP (1). Todos requirieron procedimientos invasivos y al menos 14 días de antibioterapia intravenosa.
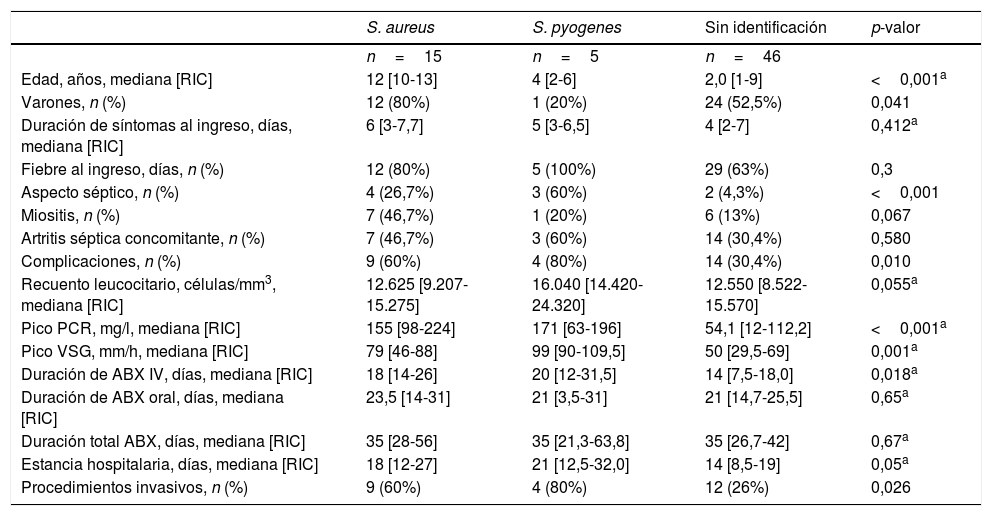
Las bacterias identificadas con mayor frecuencia fueron S. aureus (15/26; 57,7%), Streptococcus pyogenes (5/26; 19,2%), K. kingae (3/26; 11,5%), Streptococcus pneumoniae (2/26; 7,7%) y Neisseria meningitidis (1/26; 3,8%). Del total de aislados de S. aureus, el 93,3% fueron S. aureus sensible a la meticilina (SASM). Las características clínicas de los casos con aislamiento de S. aureus, aislamiento de S. pyogenes y sin identificación bacteriana se comparan en la tabla 3. Los casos sin identificación microbiológica fueron más comunes en niños menores de 4años, con diferencias significativas en la duración de la fiebre (3,1 vs. 5,3 días; p=0,05) y la proporción de pacientes con apariencia séptica (93,5% vs. 72%, p=0,013), con niveles de PCR≤20mg/l (35,6% vs. 8%; p=0,011) y con duración de antibioterapia intravenosa ≤7días (23,9% vs. 0%, p=0,008).
Características clínicas según el agente etiológico
| S. aureus | S. pyogenes | Sin identificación | p-valor | |
|---|---|---|---|---|
| n=15 | n=5 | n=46 | ||
| Edad, años, mediana [RIC] | 12 [10-13] | 4 [2-6] | 2,0 [1-9] | <0,001a |
| Varones, n (%) | 12 (80%) | 1 (20%) | 24 (52,5%) | 0,041 |
| Duración de síntomas al ingreso, días, mediana [RIC] | 6 [3-7,7] | 5 [3-6,5] | 4 [2-7] | 0,412a |
| Fiebre al ingreso, días, n (%) | 12 (80%) | 5 (100%) | 29 (63%) | 0,3 |
| Aspecto séptico, n (%) | 4 (26,7%) | 3 (60%) | 2 (4,3%) | <0,001 |
| Miositis, n (%) | 7 (46,7%) | 1 (20%) | 6 (13%) | 0,067 |
| Artritis séptica concomitante, n (%) | 7 (46,7%) | 3 (60%) | 14 (30,4%) | 0,580 |
| Complicaciones, n (%) | 9 (60%) | 4 (80%) | 14 (30,4%) | 0,010 |
| Recuento leucocitario, células/mm3, mediana [RIC] | 12.625 [9.207-15.275] | 16.040 [14.420-24.320] | 12.550 [8.522-15.570] | 0,055a |
| Pico PCR, mg/l, mediana [RIC] | 155 [98-224] | 171 [63-196] | 54,1 [12-112,2] | <0,001a |
| Pico VSG, mm/h, mediana [RIC] | 79 [46-88] | 99 [90-109,5] | 50 [29,5-69] | 0,001a |
| Duración de ABX IV, días, mediana [RIC] | 18 [14-26] | 20 [12-31,5] | 14 [7,5-18,0] | 0,018a |
| Duración de ABX oral, días, mediana [RIC] | 23,5 [14-31] | 21 [3,5-31] | 21 [14,7-25,5] | 0,65a |
| Duración total ABX, días, mediana [RIC] | 35 [28-56] | 35 [21,3-63,8] | 35 [26,7-42] | 0,67a |
| Estancia hospitalaria, días, mediana [RIC] | 18 [12-27] | 21 [12,5-32,0] | 14 [8,5-19] | 0,05a |
| Procedimientos invasivos, n (%) | 9 (60%) | 4 (80%) | 12 (26%) | 0,026 |
ABX: antibioterapia; ID: identificación; IV: intravenosa; PCR: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
En el grupo de pacientes con infección por S. aureus confirmada, había una mayor proporción con edad superior a 5años (86,7% vs. 35,7%; p<0,001), niveles de PCR≥20mg/l (100% vs. 67,2%; p=0,010) y con miositis (46,7% vs. 14,3%; p=0,0006), y la duración de la antibioterapia intravenosa fue mayor (18 vs. 14días; p=0,04). Solo uno de estos pacientes, con OHA producida por SARM, tuvo secuelas a los 6 meses. Dicho paciente tenía una infección multifocal y multisistémica por SARM LPV-negativo (única cepa en la que se realizó la prueba de detección de LPV) y fue tratado con vancomicina+rifampicina, y posteriormente con linezolid por persistencia de la bacteriemia. A los 24 meses de seguimiento, persistía el rango de movimiento limitado en las caderas. Las infecciones por estreptococos del grupo A (SGA) también fueron graves, presentando fiebre, apariencia séptica (60%), elevación de marcadores inflamatorios y complicaciones como la miositis (1), abscesos subperiósticos/intraóseos (2) y fascitis/síndrome compartimental (1). Sin embargo, ninguno de estos pacientes tenía secuelas a los 12 meses de seguimiento. El único aislado de SGA en el que se estudió el genotipo correspondió al tipo emm4.
Los 3 pacientes en los que se diagnosticó infección por K. kingae eran menores de 2años y se presentaron afebriles y con niveles bajos de PCR. K. kingae se identificó mediante amplificación molecular en 2 casos y mediante cultivo óseo en uno. Uno de estos pacientes presentó subluxación de cadera, aunque las alteraciones se habían resuelto a los 12 meses de seguimiento.
En el grupo de pacientes con bacteriemia se observaron más casos de infección por S. aureus (75% vs. 10%; p<0,000), mayor duración de la fiebre (6 vs. 3,4días; p=0,053) y mayor frecuencia de niveles de PCR≥20mg/l (100% vs. 70%; p=0,019).
En el grupo de pacientes con AS concomitante, hubo más casos con diagnóstico después de 2015 (68% vs. 37,2%; p=0,012), elevación de la VSG (68,5% vs. 50%; p=0,023), identificación bacteriana (50% vs. 25,5%; p=0,035) y miositis (35,7% vs. 11,6%; p=0,015). En el grupo de pacientes con miositis se observó una proporción mayor de casos con infección por S. aureus (46,7% vs. 14,3%; p=0,006), AS, recuento leucocitario >15.000células/mm3 (53,3% vs. 26,8%; p=0,05), nivel de PCR≥20mg/l (93% vs. 67,8%; p=0,05), y duración de antibioterapia intravenosa >7días (100% vs. 26,8%; p=0,02), sin diferencias en la frecuencia de procedimientos invasivos.
ManejoEl uso de artrocentesis fue similar en ambos períodos de estudio, realizándose en 12/28 pacientes con AS (42,9%). En los restantes (16/28) la cantidad de líquido no era suficiente para realizar drenaje, aunque en 4 se realizó biopsia de hueso. Las biopsias de hueso y los drenajes de abscesos fueron menos frecuentes después de 2014. En 7 pacientes (6 de ellos tras el 2014) no se drenaron los abscesos, y solo se realizó biopsia ósea en 2 pacientes para el diagnóstico, en ambos casos antes de 2014.
En nuestra muestra, 11/71 pacientes (15,5%) requirieron más de una intervención invasiva: el 72,7% con edad ≥4años, el 100% con cultivo positivo, 11 con AS concomitante, 5 con abscesos y 4 con miositis.
Complicaciones y secuelasEl 45,1% de los pacientes desarrollaron complicaciones, incluyendo abscesos intraóseos o subperiósticos (23,9%), miositis (21,1%), necrosis avascular (2,8%), subluxación (1,4%), fractura patológica (1,4%), fascitis (4,2%), sepsis (1,4%) y TVP (1,4%). Cuatro pacientes (5,6%) requirieron soporte intensivo y 3 tuvieron enfermedad diseminada (1,4%). Al alta, el 16,9% tenía síntomas residuales, mayoritariamente limitación del rango de movilidad (14,1%) y rigidez (2,8%).
Cuatro pacientes (5,6%) se perdieron durante el seguimiento tras el tratamiento inicial, aunque ninguno tenía síntomas al alta. A los 6 meses de seguimiento, 6/67 pacientes (9%) tenían secuelas: rango de movilidad disminuido (2), discrepancia en la longitud de las extremidades (1), rigidez (1), deformidad angular (1) y dolor residual (1). A los 12 meses de seguimiento, 2/55 pacientes (3,6%) tenían secuelas: rango de movilidad disminuido (1, el paciente con SARM) y rigidez articular (1).
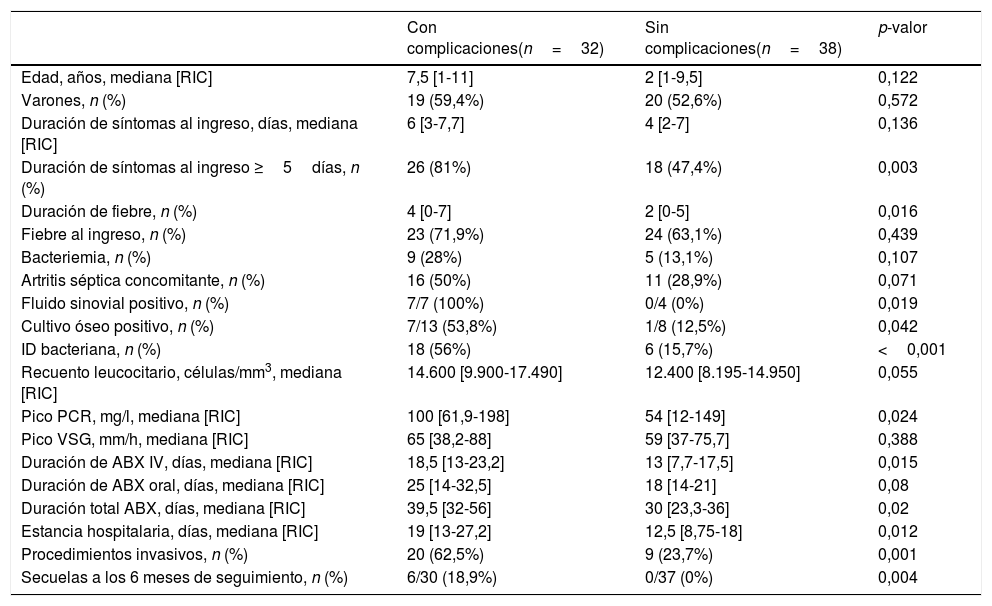
Predictores de evolución adversaLa estancia hospitalaria se asoció a la duración de la fiebre (r=0,3; p=0,06), los niveles de marcadores inflamatorios al ingreso, como la PCR (r=0,53; p<0,001) o la VSG (r=0,41; p<0,001) y el número de procedimientos quirúrgicos (r=0,5; p<0,001). Los factores de riesgo de complicaciones identificados fueron: edad ≥3años (OR: 3,37 [1,25-9,08]), tiempo de evolución hasta el diagnóstico ≥5días (OR: 4,8 [1,61-14,3]), nivel de PCR≥20mg/l (OR: 4,26 [1,23-14,7]) y aislamiento microbiológico (OR: 6,8 [2,2-20,9]) (tabla 4). En el análisis multivariado, el aislamiento positivo fue el único factor que continuó asociado al desarrollo de complicaciones. La presencia de secuelas a los 6 meses también se asoció a la presencia de complicaciones (OR: 4,4 [1,66-11,6]).
Comparación de pacientes con complicaciones y sin complicaciones
| Con complicaciones(n=32) | Sin complicaciones(n=38) | p-valor | |
|---|---|---|---|
| Edad, años, mediana [RIC] | 7,5 [1-11] | 2 [1-9,5] | 0,122 |
| Varones, n (%) | 19 (59,4%) | 20 (52,6%) | 0,572 |
| Duración de síntomas al ingreso, días, mediana [RIC] | 6 [3-7,7] | 4 [2-7] | 0,136 |
| Duración de síntomas al ingreso ≥5días, n (%) | 26 (81%) | 18 (47,4%) | 0,003 |
| Duración de fiebre, n (%) | 4 [0-7] | 2 [0-5] | 0,016 |
| Fiebre al ingreso, n (%) | 23 (71,9%) | 24 (63,1%) | 0,439 |
| Bacteriemia, n (%) | 9 (28%) | 5 (13,1%) | 0,107 |
| Artritis séptica concomitante, n (%) | 16 (50%) | 11 (28,9%) | 0,071 |
| Fluido sinovial positivo, n (%) | 7/7 (100%) | 0/4 (0%) | 0,019 |
| Cultivo óseo positivo, n (%) | 7/13 (53,8%) | 1/8 (12,5%) | 0,042 |
| ID bacteriana, n (%) | 18 (56%) | 6 (15,7%) | <0,001 |
| Recuento leucocitario, células/mm3, mediana [RIC] | 14.600 [9.900-17.490] | 12.400 [8.195-14.950] | 0,055 |
| Pico PCR, mg/l, mediana [RIC] | 100 [61,9-198] | 54 [12-149] | 0,024 |
| Pico VSG, mm/h, mediana [RIC] | 65 [38,2-88] | 59 [37-75,7] | 0,388 |
| Duración de ABX IV, días, mediana [RIC] | 18,5 [13-23,2] | 13 [7,7-17,5] | 0,015 |
| Duración de ABX oral, días, mediana [RIC] | 25 [14-32,5] | 18 [14-21] | 0,08 |
| Duración total ABX, días, mediana [RIC] | 39,5 [32-56] | 30 [23,3-36] | 0,02 |
| Estancia hospitalaria, días, mediana [RIC] | 19 [13-27,2] | 12,5 [8,75-18] | 0,012 |
| Procedimientos invasivos, n (%) | 20 (62,5%) | 9 (23,7%) | 0,001 |
| Secuelas a los 6 meses de seguimiento, n (%) | 6/30 (18,9%) | 0/37 (0%) | 0,004 |
ABX: antibioterapia; ID: identificación; IV: intravenosa; PC: proteína C reactiva; RIC: rango intercuartílico; VSG: velocidad de sedimentación globular.
Aunque el estudio se realizó en un solo centro, incluyó una de las cohortes de pacientes con OHA más grandes para describir las tendencias temporales en la etiología y el manejo de la OHA en Lisboa y el sur de Portugal. Nuestros datos muestran que (1) el SASM continúa siendo el agente etiológico más frecuente de la OHA, sin variaciones en los distintos años de estudio; (2)K. kingae continúa siendo una causa de OHA detectada con poca frecuencia, y las pruebas moleculares para su detección siguen sin realizarse sistemáticamente; (3) el abordaje de la OHA en nuestro entorno es tradicional, con antibioterapia y estancias hospitalarias prolongadas y una frecuencia mayor de procedimientos quirúrgicos, aunque esta tendencia ha disminuido en los últimos años, y (4) se da una frecuencia inesperadamente alta de AS concomitante y de complicaciones, fundamentalmente de miositis, lo que podría explicar algunos de nuestros resultados. La mayor accesibilidad y precisión de la RM en los últimos años también podrían ser factores contribuyentes. No obstante, en nuestro estudio no se observó un aumento en el uso de RM a lo largo del tiempo.
La incidencia de la OHA ha aumentado en años recientes2. Gafur et al. reportan un aumento de 2,8 veces en los últimos 20 años4, mientras que Samara et al. describen un aumento del 79% en la incidencia anual media7, aunque solo en niños pequeños. De manera similar, en nuestro estudio se observó un aumento de 1,8 veces en los últimos 5 años, aunque sin diferencias en la distribución por edades. Un mayor conocimiento de la OHA, el reclutamiento prospectivo a partir de 2014 y las mejoras en las pruebas de imagen, en combinación con un aumento real de la incidencia, podrían explicar esta tendencia. El uso de técnicas de detección molecular, que fue mínimo en nuestro estudio, no puede explicar este aumento.
En el presente estudio, el agente etiológico se identificó en tan solo el 36,6% de los pacientes, lo que fue consistente con los hallazgos de Filleron et al. en Francia (40,7%)20 o Calvo et al. en España (33%)16. En cambio, fue significativamente inferior al 62,7% descrito por Samara et al. en Ginebra7, en el que se emplearon rutinariamente técnicas moleculares para la detección de K. kingae, o al 76% descrito por McNeil et al. en Estados Unidos21. Además, la proporción de hemocultivos positivos en nuestra muestra fue de tan solo el 21%, inferior a la descrita en la literatura previa1,2,10, aunque similar a la reportada por Samara et al.7. En nuestra casuística, las infecciones sin identificación microbiológica fueron más comunes en niños <4años, con niveles de PCR<20mg/l y una incidencia menor de complicaciones. Es muy probable que K. kingae fuera el agente causal en un porcentaje significativo de estas infecciones en niños pequeños. En nuestra muestra, solo 2 de los 5 pacientes en los que se empleó reacción en cadena de la polimerasa para la detección de K. kingae tuvieron resultados positivos, con detección en líquido sinovial en uno y en frotis faríngeo en el otro. A pesar de que se recogieron muestras de líquido sinovial en 7 casos más, la pequeña cantidad obtenida impidió la realización de este ensayo. Aunque el diagnóstico basado en resultados positivos de muestras de frotis faríngeo es cuestionable dada la prevalencia de colonización faríngea por K. kingae en niños pequeños (8-12%), el frotis faríngeo parece ofrecer una sensibilidad adecuada (90,5%) para el diagnóstico de K. kingae en infecciones osteoarticulares7,22. El uso sistemático de técnicas moleculares aumentaría la incidencia reportada de infección por K. kingae7,23, sobre todo teniendo en cuenta que la incidencia de la AS está aumentando. En cualquier caso, la biopsia ósea se realizó con menor frecuencia después de 2014, asociándose a una reducción en el diagnóstico microbiológico.
S. aureus fue la bacteria aislada más comúnmente (57,7%), como era de esperar en base a su detección en el 36,5-63% de los casos descrita en la literatura1,10,13,14. La mayoría de los casos en nuestro estudio fueron casos de SASM (93,3%), mientras que el SARM seguía siendo poco común (6,6%), con una frecuencia similar a la observada en otros países europeos (7,8%)12 y muy inferior a la de Estados Unidos (18,5-70%)13,17,24. En un estudio previo realizado en nuestro hospital entre 2005 y 2008, las infecciones por S. aureus adquiridas en la comunidad correspondieron a cepas productoras de LPV en el 23% de los casos, con aislamiento de SARM en el 4,3%25. Aunque las infecciones por SARM se asocian a complicaciones y evolución menos favorable, el SASM puede ser igualmente agresivo, independientemente de la producción de LPV o el genotipo USA30012–14,17. La mayoría de los estudios describen una frecuencia mayor de fiebre, niveles más altos de PCR, más complicaciones, cursos de antibioterapia más prolongados y estancias más largas en pacientes con infección por S. aureus13,14,17,24. Las complicaciones más comunes de estas infecciones son la AS concomitante, los abscesos subperiósticos, la piomiositis y la TVP13,14,17. En nuestra serie, aunque solo se investigó la producción de LPV en un caso, con resultado negativo, las infecciones por S. aureus también se asociaron a una elevación superior de los marcadores inflamatorios, tratamientos más prolongados, estancias más largas y una incidencia mayor de complicaciones (60%).
La incidencia de infecciones por S. pneumoniae (8%) y SGA se mantuvo estable en nuestra serie (19%). No obstante, en Europa, y en el Reino Unido en particular, se ha detectado un aumento en la incidencia de la enfermedad invasiva por SGA, especialmente por el tipo emm126. En nuestra muestra, la única cepa de SGA susceptible de estudio fue del tipo emm4, que no es uno de los tipos emm más prevalentes en las infecciones invasivas en Portugal (emm1, emm89 y emm3)27. No obstante, esto fue consistente con los hallazgos de un estudio realizado en España, donde los tipos emm involucrados con mayor frecuencia en las infecciones osteoarticulares pediátricas fueron emm1, emm12 y emm428. En nuestra cohorte, aunque no hubo un aumento en la incidencia de las infecciones por SGA, estas fueron graves y no solo requirieron antibioterapia intravenosa prolongada y estancias más largas, sino también múltiples intervenciones quirúrgicas.
En nuestro estudio, el 39,4% de los pacientes tenían AS concomitante, con mayor frecuencia a partir de 2015 (54,3%). Esta proporción es comparable al 35,2% reportado por McNeil et al.21 o al 39,8% reportado por Schallert et al.29, pero superior al 12% descrito en la cohorte española16. A pesar de la alta sensibilidad de la RM en el diagnóstico de la OHA y de la AS, factores de virulencia específicos podrían explicar esta diferencia3,13,14,26. En nuestra serie hubo un claro aumento en la OHA con AS concomitante a partir de 2015, con una frecuencia mayor en pacientes con cultivo positivo, fiebre al ingreso y niveles más altos de marcadores inflamatorios, asociándose a una duración mayor del tratamiento, como ya se había observado en otros estudios17,18,29.
La incidencia de miositis está aumentando, una circunstancia que se especula podría ir asociada al aumento en las infecciones complicadas por SARM y cepas productoras de LPV. En 2006, Bocchini et al. reportaron que las cepas de S. aureus productoras de LPV se asociaban significativamente a una probabilidad mayor de miositis concomitante y enfermedad más grave13. Por otro lado, Dohin et al. consideraron la miositis una complicación musculoesquelética14. En nuestro estudio, la miositis se asoció a niveles superiores de marcadores inflamatorios, infección por S. aureus, AS y antibioterapia intravenosa prolongada, lo que sugiere una respuesta inflamatoria local intensa contribuyente a una mayor gravedad.
Se observó cumplimiento con el protocolo del hospital en el 80% de los casos, aunque la duración de la antibioterapia fue excesivamente larga: a pesar de una disminución modesta en los últimos años, aún distaba mucho del curso breve de antibioterapia intravenosa propuesto por Peltola y Paakkonen.10. Por otro lado, en la serie presentada por estos autores solo hubo un 3,8% de pacientes con afectación de la cadera, en comparación con el 12,7% en nuestra muestra, y los autores no describieron complicaciones, mientras que el 45,1% de nuestros pacientes tuvieron complicaciones, con mayor frecuencia a partir del 2015 (54,2%). Estas diferencias podrían explicar en parte la duración más prolongada del tratamiento y el abordaje más tradicional empleado en nuestro hospital3,17,19. Los pacientes con infecciones osteoarticulares complicadas de alto riesgo o con evolución tórpida pueden requerir cursos más prolongados de antibioterapia intravenosa y oral3,19.
Según las guías europeas, debería evitarse la cirugía en casos de OHA no complicada3. En apoyo a esta recomendación, Peltola y Pääkkönen mencionaron que el manejo puede ser conservador en hasta el 90% de los casos de OHA precoz10. No obstante, en la serie publicada previamente por dichos autores, el porcentaje de niños con OHA que no requirieron cirugía fue de tan solo el 24%31. Calvo et al. reportaron que tan solo el 20% de los pacientes con OHA requirieron intervenciones quirúrgicas, la mayoría de las cuales (46%) se debieron a complicaciones, que solo aparecieron en el 13,4% de los pacientes16. En nuestro estudio se realizaron procedimientos invasivos en el 40,8% de los pacientes, con mayor frecuencia en pacientes con OHA complicada (62,5%), lo que fue consistente con la literatura previa11,21,24. Efectivamente, el drenaje de abscesos solo debería realizarse en caso de persistencia de fiebre, síntomas, elevación pronunciada de la PCR o bacteriemia3. En nuestro estudio se observó una tendencia hacia un manejo menos agresivo de la OHA en los últimos años, con una frecuencia menor de punción ósea y drenaje de abscesos a pesar de que la frecuencia de los abscesos fue similar.
Entre el 1,1 y el 4,5% de los pacientes desarrollan secuelas, que se asocian a la virulencia de la cepa (mayor frecuencia en las infecciones por SAMR, 4,7-8,6%)17,24, la gravedad del curso, el retraso en el tratamiento y la infección concomitante de cadera o de hombros3,21,31. En nuestra serie, el 3,6% de los pacientes tuvieron una evolución adversa a largo plazo, con secuelas leves y asociadas al desarrollo previo de complicaciones (OR: 4,4). Es probable que las diferencias entre cepas y en la susceptibilidad del huésped expliquen una pequeña parte de la variabilidad en la evolución.
Es esencial identificar a los menores con riesgo de desarrollar complicaciones. En nuestro estudio, los factores que mejor predijeron la OHA complicada fueron la edad ≥3años, tiempo de evolución al ingreso ≥5días, nivel de PCR≥20mg/l y el aislamiento del agente etiológico. El aislamiento microbiológico fue el único factor que se mantuvo significativo en el análisis de regresión logística. La presencia de secuelas a los 6 meses se asoció a la presencia de complicaciones. Sin embargo, no se pudieron identificar predictores clínicos y de laboratorio de las secuelas de la OHA debido al reducido tamaño de la muestra. Otras limitaciones del estudio incluyeron su diseño parcialmente retrospectivo y su realización en un único centro.
La OHA continúa siendo un problema de salud importante. El agente etiológico más frecuente sigue siendo el SASM, que causa infecciones más graves. El diagnóstico microbiológico en nuestro entorno aún puede mejorarse, principalmente mediante el uso de pruebas moleculares. La duración del tratamiento debería reducirse mediante el uso de escalas validadas para la identificación de pacientes con menor riesgo de complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: estudio presentado en la 19.a Reunión Anual de la Sociedade Portuguesa de Pediatria.