La aparición de infecciones por estafilococo dorado resistente a meticilina en la comunidad es un problema de creciente importancia.
Presentamos el caso de una niña que padeció una osteomielitis aguda complicada con una neumonía no necrotizante. Cobra interés la buena evolución del proceso neumónico que contrasta con la refractariedad en la resolución del foco óseo. Destacamos la importancia del correcto drenaje del acúmulo séptico como pilar de una adecuada evolución. Revisamos la literatura médica sobre este patógeno emergente.
The appearance of a community-acquired methicillinresistant Staphylococcus aureus (CA-MRSA) is a increasingly important problem.
We describe the case of a child suffering a CA-MRSA osteomyelitis complicated with a non-necrotizing pneumonia. The fast resolution of the pulmonary infection contrasts with the poor evolution of the septic bone. We emphasise the importance of correct surgical drainage to clear the infection. We review the literature on this emergent pathogen.
Staphylococcus aureus es la causa más común de infecciones musculoesqueléticas en el niño. Es un claro ejemplo de patógeno con una elevada plasticidad para el desarrollo de cepas con nuevas propiedades de virulencia y resistencia a los antibióticos.
El estudio de su genoma muestra la gran capacidad que posee para incorporar material genético de otros S. aureus, otras especies estafilocócicas e incluso otros géneros de bacterias, y dotarlo de nuevas características infectivas1.
Desde la década de 1990 el estafilococo dorado resistente a meticilina es un patógeno plenamente establecido en la comunidad. Codifica para una proteína (PBP2) con baja afinidad por los betalactámicos, que le proporciona su característica definitoria: resistencia a meticilina. Dicho gen se encuentra ubicado en un islote o cassette cromosómico denominado SCCmec. Hasta la fecha, se conocen cinco tipos de SCCmec.
Se está convirtiendo en una causa importante de infecciones tanto en el ámbito de la pediatría como en la adultez. Difiere del S. aureus hospitalario resistente a la meticilina (SARMH) en su origen, trasfondo genético, susceptibilidad antibiótica y patrones de infección2:
- –
Incorpora, con mayor frecuencia, el gen mecA tipo IV.
- –
No se asocia a factores de riesgo típicos del SARMH como son la edad avanzada, hospitalizaciones recientes, diálisis, catéteres intravasculares o inmunodepresión, sino que infecta a pacientes sanos.
- –
No es sólo sensible a vancomicina, linezolid o quinopristina/dalfopristina como el SARMH, sino que también es susceptible a tetraciclinas, clindamicina, rifampicina, sulfametoxazol-trimetroprim, fluorquinolonas y, en ocasiones, macrólidos.
- –
Presenta con frecuencia una proteína conocida como estreptogramina macrólido-lincosamina (MLSB) que le da resistencia a macrólidos y, en aquellas cepas que presentan un D-test positivo, resistencia también a clindamicina, lo que limita el arsenal terapéutico y sobre todo la posibilidad de ofrecer un tratamiento por vía oral.
- –
Presentan otro elemento que se ha asociado a infecciones más graves y profundas: la leucocidina Panton-Valentine (LPV), común en las cepas americanas pero excepcional en Europa1–6.
- –
Causa especialmente infecciones de los tejidos blandos y del sistema músculo-esquelético, con tendencia a la formación de colecciones sépticas. Está claramente demostrada la eficacia del desbridamiento quirúrgico como el tratamiento más eficaz, y en muchas ocasiones exclusivo, para resolver este tipo de infecciones. Más allá, inhabilita un correcto tratamiento antibiótico si no se acompaña de un correcto drenaje y potencia la eficacia de éste7,8.
Niña de 10 años de edad con residencia habitual en Rumanía que consultó por fiebre y dolor en el brazo izquierdo de instauración progresiva en las últimas 48h. No presentaba ningún antecedente familiar ni personal de interés salvo una contusión leve en ese mismo brazo hacía 2 días.
En la exploración física destacó una paciente febril, pálida y con afectación del estado general. Presentaba signos inflamatorios en el brazo izquierdo y el resto de la exploración resultó anodina.
Se realizaron las siguientes exploraciones complementarias: analítica: hemoglobina 9g/dl; leucocitos 11/μl (82% neutrófilos, 10% linfocitos, 6% monocitos, 2% eosinófilos); proteína C reactiva (PCR) 24mg/dl. Radiografía del brazo izquierdo: sin lesión ósea ni aumento de partes blandas. Se cursó hemocultivo.
Ingresó con la sospecha diagnóstica de osteomielitis aguda de húmero izquierdo. Se realizó un desbridamiento quirúrgico y se inició cobertura antibiótica con amoxicilina-ácido clavulánico.
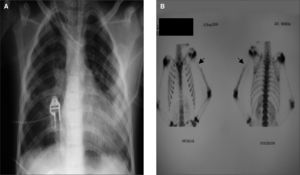
A las 72h del ingreso, la paciente presentó un cuadro de dificultad respiratoria e hipoxemia (requerimientos máximos de oxígeno del 30%). Radiológicamente, se observó una imagen compatible con un proceso neumónico bilateral (fig. 1A) motivo por el cual fue derivada a nuestro centro. Con anterioridad al traslado se nos informó del aislamiento en el hemocultivo de un S. aureus resistente a meticilina y sensible a eritromicina portador del gen de la LPV (por técnica de reacción en cadena de la polimerasa), por lo que se sustituyó la antibioticoterapia inicial por vancomicina y se adoptaron medidas de aislamiento.
Se realizó gammagrafía ósea, que confirmó el diagnóstico inicial (fig. 1B).
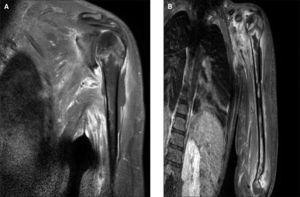
El proceso respiratorio evolucionó favorablemente, pero persistía el cuadro febril, por lo que se realizó resonancia mágnetica (RM) que demostró zonas de abcesificación (fig. 2A).
Se decidió añadir clindamicina y seAreintervino. Dada la tórpida evolución posterior y el crecimiento en el exudado subperióstico de un S. aureus sensible a la meticilina y, pese a la improbable etiología mixta de la infección, se decidió asociar cloxacilina. Pese a la politerapia, la fiebre no cedía. Se repitió la RM, y continuaban apreciándose colecciones purulentas (fig. 2B).
Se decidió trasladar a hospital de referencia, donde se desbridó nuevamente y se completó tratamiento antibiótico exclusivamente con vancomicina durante 6 semanas más. A los 5 meses la paciente continúa tratamiento con clindamicina oral (que inició inmediatamente tras el período de hospitalización) y es controlada periódicamente; su evolución es adecuada.
DISCUSIÓNLa emergencia en la última década de S. aureus resistente a la meticilina como patógeno adquirido en la comunidad (SARMAC) ha complicado el tratamiento de las infecciones musculoesqueléticas en niños, tradicionalmente susceptibles a los betalactámicos.
El S. aureus resistente a la meticilina (SARM) fue inicialmente descrito como un patógeno nosocomial, asociado claramente a determinados factores de riesgo como la hospitalización en unidades de cuidados intensivos, la exposición a procedimientos o dispositivos invasivos, la presencia de inmunosupresión o enfermedad de base graves o la antibioticoterapia prolongada o recurrente. Sin embargo, en los últimos años, el SARM está adquiriendo cada vez más importancia como patógeno fuera del medio hospitalario.
Aunque algunos autores sugieren que los factores de riesgo de adquisición de infecciones por S. aureus son los mismos independientemente de su susceptibilidad a la meticilina, otros concluyen que podrían existir factores predisponentes específicos: como el contacto domiciliario con trabajadores del medio sanitario o con adultos portadores o con infección probada por SARM o el tratamiento prolongado con antibióticos.
El S. aureus es un microorganismo con una excepcional plasticidad que le permite adquirir determinantes genéticos de otras cepas y especies para mejorar sus características biológicas. Los SARMAC derivan de cepas comunitarias de estafilococos sensibles a meticilina a las que se han incorporado nuevos genes de resistencia y virulencia que le confieren unas características específicas diferentes de las de los SARMH. La resistencia a los betalactámicos viene dada por la adquisición del gen mecA, que codifica una proteína ligadora de la penicilina con baja afinidad para dicho antibiótico. Los genes mecA residen en elementos genéticos móviles denominados cassettes cromosómicos estafilocócicos (SCCmec). Las cepas de SARMAC presentan una forma alélica nueva, el SCCmec tipo IV, que no incorpora genes de multirresistencia, por lo que la mayoría de cepas son susceptibles a la clindamicina, la rifampicina, el trimetoprim-sulfametoxazol y las tetraciclinas, y algunas, a la eritromicina y las quinolonas7-8.
Otra característica típica de las cepas de SARMAC es la presencia de determinados factores de virulencia, como la leucocidina Panton-Valentine (una toxina ergohimenotrópica capaz de inducir lesiones inflamatorias graves) o la fnbB o proteína ligadora de la fibronectina (determinante de la invasión celular endotelial)9. Aunque las infecciones por SARMAC suelen ser superficiales y de fácil control, también se han descrito infecciones diseminadas graves (aproximadamente en el 16% de los casos), que parecen estar favorecidas por la presencia de dichos factores de virulencia. Concretamente, en el caso de las infecciones musculoesqueléticas, se han asociado al desarrollo de osteomielitis crónica y trombosis venosa profunda10. El desbridamiento tardío o insuficiente de las lesiones favorece la bacteriemia persistente y la diseminación de la infección, lo que complica el curso de la enfermedad y alarga la duración de la antibioticoterapia (incluso tandas de 6 o más meses), por lo que es fundamental el abordaje quirúrgico precoz. De hecho, las infecciones superficiales moderadas por SARMAC suelen evolucionar favorablemente sólo con desbridamiento quirúgico, independientemente de la efectividad teórica del tratamiento antibiótico utilizado.
Debido a que los SARMAC suelen ser sensibles a la clindamicina, en algunas zonas con alta prevalencia de dichas cepas, ésta se ha convertido en uno de los antibióticos de primera línea en los pacientes con sospecha de infección por S. aureus. Sin embargo, en las cepas sensibles a clindamicina pero resistentes a eritromicina, es posible el rápido desarrollo durante el tratamiento de una resistencia inducible a la clindamicina (MLSB o resistencia macrólido-lincosamida-estreptogramina tipo B) que comporte un fracaso del mismo. La identificación en el laboratorio de dicha resistencia MLSB se realiza mediante el denominado D-test, y debería aplicarse a todos los aislamientos resistentes a la eritromicina y sensibles a la clindamicina. Por todo ello, en pacientes críticamente enfermos y sobre todo en áreas con alta prevalencia del fenotipo MLSB la vancomicina debería ser la terapia empírica de elección a la espera del antibiograma1,11.
El control de la propagación de las infecciones por SARM en la comunidad representa un reto emergente. La elevada frecuencia de infecciones banales que evolucionan favorablemente únicamente con desbridamiento quirúrgico y que no requieren hospitalización, hace que en muchos casos no se realice diagnóstico microbiológico y no debemos olvidar que, aunque infrecuentes, las infecciones graves por SARMAC no son excepcionales y que nos enfrentamos a un microorganismo que ha demostrado a lo largo de los años una gran capacidad para mejorar sus condiciones de virulencia y resistencia.