La retinopatía del prematuro (ROP) se caracteriza por el desarrollo vascular insuficiente en la retina que, en los casos severos precisa tratamiento precoz para evitar secuelas visuales. Es actualmente la segunda causa mundial de ceguera infantil prevenible.
Pacientes y métodosEstudio observacional, retrospectivo, de casos-controles sobre 233 recién nacidos prematuros explorados entre 1999-2019.
ResultadosLa ganancia de peso posnatal en las primeras 4 semanas, el peso al nacer, la edad gestacional, la ventilación mecánica, las transfusiones recibidas y la presencia de sepsis, ductus arteriovenoso persistente, enterocolitis necrosante, hemorragia intraventricular o leucomalacia periventricular, mostraron diferencias significativas entre el grupo de ROP no susceptible de tratamiento frente al grupo candidato a tratamiento. La ganancia ponderal media fue 12,75±5,99g/día en el grupo no susceptible de tratamiento y 9,50±5,45g/día en el susceptible de tratamiento. El riesgo de ROP candidata a tratamiento se redujo progresivamente con el aumento de ganancia ponderal. La reducción del riesgo fue de 2,76 - 8,35% en ganancias de 10g/día, y alcanza el 7,17 - 12,76% en ganancias de 20g/día.
ConclusionesEl riesgo de presentar ROP severa candidata a tratamiento disminuye con el aumento de la ganancia de peso posnatal en las primeras 4 semanas. Esta relación se mantiene en ganancias de peso >14g/día. Sin embargo, se deben tener en cuenta la edad gestacional y peso al nacer del recién nacido, la duración de la ventilación mecánica y su comorbilidad para la evaluación global del riesgo de ROP que precisa tratamiento.
Retinopathy of prematurity (ROP) is characterised by insufficient vascular development in the retina, and requires early treatment to avoid visual disability in severe cases. ROP is currently the second leading cause of preventable child blindness in the world.
Patients and methodsThis was an observational, retrospective, case-control study including 233 preterm infants examined between 1999 and 2019.
ResultsPostnatal weight gain in the first 4 weeks of life, birth weight, gestational age, mechanical ventilation, transfusion, presence of sepsis, persistence of arterial ductus, necrotising enterocolitis, intraventricular haemorrhage, or periventricular leukomalacia were found to be significantly different between the ROP groups requiring and not requiring treatment. The mean postnatal weight gain in the ROP group not requiring treatment was 12.75±5.99g/day, whereas it was 9.50±5.45g/day in the ROP group requiring treatment. The risk of developing ROP that required treatment decreased with an increase in weight gain. The risk reduction was 2.76 - 8.35% in preterm infants gaining 10g/day, and 7.17 - 12.76% in infants gaining 20g/day.
ConclusionsThe risk of developing ROP requiring treatment decreased with increasing weight gain in the first 4 weeks of life. This was applicable in infants with postnatal weight gain ≥ 14g/day. However, gestational age, birth weight, time of mechanical ventilation, and comorbidity should be taken into account when evaluating the risk of ROP requiring treatment.
La retinopatía del prematuro (ROP) es una patología infantil de alta prevalencia y es actualmente la segunda causa mundial de ceguera infantil prevenible1. La ROP se caracteriza por el retraso en el desarrollo vascular retiniano, y su manifestación «plus», por la tortuosidad y dilatación vascular rápidamente progresivas en el polo posterior. La clasificación internacional de ROP comprende 5 estadios de severidad, que varían desde leves anomalías vasculares periféricas en el estadio 1, la aparición de una línea de demarcación en el estadio 2 y la neovascularización extrarretiniana en el estadio 3, hasta el desprendimiento de retina parcial o total en los estadios 4 y 52.
La vascularización de la retina se inicia en la semana 16 de gestación y se completa entre las semanas 36-40. El desarrollo de la ROP depende tanto de factores intrínsecos de la enfermedad, como de factores iatrogénicos3. Algunos de estos factores son: baja edad gestacional, bajo peso al nacimiento, oxigenoterapia, displasia broncopulmonar, sepsis, hemorragia intraventricular, enterocolitis necrosante y anemia4,5. La inmadurez del recién nacido valorada por el bajo peso al nacer y la baja edad gestacional, así como la duración prolongada de la ventilación mecánica, son los principales factores de riesgo implicados en la aparición de ROP y el desarrollo de sus estadios avanzados6,7. Otros factores dependientes del desarrollo del recién nacido prematuro, como la ganancia de peso en las primeras 4 semanas de vida tras el parto han cobrado cada vez más importancia en los algoritmos de detección precoz de ROP6,8,9.
Los niveles de factor de crecimiento del endotelio vascular (VEGF), implicado en el desarrollo vascular, se encuentran íntimamente relacionados con los niveles de factor de crecimiento insulínico tipo I (IGF-I). De este modo, el déficit prolongado de IGF-1 en el recién nacido prematuro y el escaso aumento de peso posnatal se asocian con mayor riesgo de ROP severa4,5,10,11.
Filho5 determinó un nivel de corte para la ganancia de peso posnatal de 7,28 g/día, por debajo del cual se observó un notable aumento del riesgo de ROP. Sin embargo, en los últimos años, debido a la implementación de mejoras en las técnicas de nutrición y ventilación mecánica en las unidades de cuidados intensivos, cada vez nos enfrentamos a una menor incidencia de ganancias de peso posnatales extremadamente bajas, a excepción de los recién nacidos con alta comorbilidad12–14. Por ello, surge la necesidad de analizar la influencia de las ganancias de peso medias y altas en la retinopatía del prematuro.
El objetivo de este estudio es analizar el efecto de la ganancia de peso posnatal en las primeras 4 semanas sobre la ROP susceptible de tratamiento, y evaluar su efecto protector sobre la misma.
Pacientes y métodosEste estudio fue aprobado por el Comité de Ética de Investigación Biomédica de Andalucía y fue realizado en concordancia con los principios éticos para investigación médica de la Declaración de Helsinki. Todos los datos médicos fueron recopilados de modo anónimo tras la aceptación del consentimiento informado y la autorización expresa de los padres o tutores legales de los participantes en el estudio.
Sujetos de estudioSe realizó un estudio observacional, retrospectivo, de casos-controles sobre 233 recién nacidos prematuros explorados entre 1999 y 2019 en el Hospital San Cecilio de Granada, España. Un solo ojo de cada paciente fue incluido en el estudio.
Los criterios de inclusión fueron1: recién nacidos con peso al nacer<1500g o edad gestacional (GA) ≤32 semanas de gestación2, peso al nacer entre 1501-2000g y GA ≥ 32 semanas con aporte de oxígeno>72 h o curso clínico inestable determinado por el neonatólogo de las unidades de cuidados intensivos (apneas, acidosis neonatal, muerte gemelar, hemorragia intraventricular, ductus persistente, sepsis, enterocolitis necrosante e intervenciones quirúrgicas intercurrentes)3 y recién nacidos pretérmino que pudieron ser explorados durante la cuarta semana posnatal, con al menos 3 exploraciones realizadas. Los criterios de exclusión fueron1: imposibilidad de exploración durante la cuarta semana posnatal o de finalización del seguimiento (seguimiento realizado hasta la vascularización retiniana completa, 45 semanas de edad posmenstrual sin enfermedad preumbral, 36 semanas con vascularización en zona III sin signos de ROP, o cuando se observa regresión de ROP con seguridad de no reactivación)2, opacidad de medios3 y ganancia de peso por circunstancias no fisiológicas (ejemplo: hidrocefalia).
Exámenes clínicosTodos los pacientes fueron explorados por el mismo oftalmólogo especialista en oftalmopediatría durante la cuarta semana posnatal, mediante oftalmoscopia indirecta con indentación, bajo midriasis farmacológica y anestesia tópica, empleando una lente de 20 dioptrías (que aporta un campo de visión aproximado de 8 diámetros de disco, que equivale a 45°). En cada exploración fueron recogidos: el estadio ROP según la Clasificación Internacional de Retinopatía del Prematuro2, la zona retiniana afecta (I, II, III), la extensión horaria y la presencia de enfermedad preplus y plus. Se realizaron exploraciones cada 2 semanas hasta que la retina estuvo completamente vascularizada, excepto en aquellos casos con enfermedad preplus o plus, o vascularización limitada en zona I o en zona II posterior, o en estadio 3 en cualquier zona. En estos casos la exploración se realizó semanalmente.
La variable ROP que requiere tratamiento fue descrita como variable dependiente. Como variables independientes se recogieron: peso al nacer (gramos) y edad gestacional (semanas de gestación), estadio ROP2, ganancia de peso posnatal en las primeras 4 semanas de vida (medida de forma semanal, y expresada como promedio en gramos/día), duración de la ventilación mecánica (días), fracción inspirada de oxígeno máxima (FiO2), presencia/ausencia de sepsis, ductus arteriovenoso persistente, displasia broncopulmonar, hemorragia intraventricular, leucomalacia periventricular o enterocolitis necrosante, número de transfusiones recibidas y puntaje en el test de Apgar15.
Análisis estadísticoEl análisis estadístico se realizó mediante el programa Statistical Package for Social Sciences (SPSS 25.0, IBM Corp. Armonk, NY: IBM Corp). Se realizó el análisis descriptivo de las variables y se comprobó la normalidad de los datos mediante el test de Kolmogorov-Smirnov.
Las variables fueron comparadas mediante la U de Mann Whitney y la χ2 de Pearson. El modelo predictivo fue realizado mediante regresión logística binaria entre la variable dependiente (ROP que requiere tratamiento) y la ganancia de peso posnatal en las primeras 4 semanas de vida, así como con todas las variables independientes indicadas anteriormente.
ResultadosAnálisis descriptivoDoscientos treinta y tres recién nacidos prematuros fueron incluidos en el estudio. Se exploraron un total de 688 recién nacidos prematuros, de los que 455 fueron excluidos de acuerdo con los criterios citados anteriormente.
La ganancia de peso posnatal en las primeras 4 semanas de vida, el peso al nacer, la edad gestacional, la duración de la ventilación mecánica, el número de transfusiones recibidas, la FiO2 máxima y la presencia de sepsis, ductus arteriovenoso persistente, hemorragia intraventricular, leucomalacia periventricular o enterocolitis necrosante, mostraron diferencias estadísticamente significativas (p<0,05) entre el grupo de ROP que no requirió tratamiento frente al de ROP que sí precisó ser tratado. No se hallaron diferencias estadísticamente significativas (p> 0,05) en la presencia/ausencia de displasia broncopulmonar ni el puntaje en el test de Apgar entre ambos grupos (tablas 1-3 y fig. 1).
Estudio descriptivo de las variables cuantitativas de estudio. Media y desviación estándar, mínimo (Mín) y máximo (Máx) y diferencia de medias (U de Mann Whitney). La ganancia de peso se muestra en g/día, y ajustada por la edad gestacional, g/semana/día
| Total | ROP tratada | p | ||
|---|---|---|---|---|
| No | Sí | |||
| N | 233 | 193 | 40 | |
| % | 100 | 82,8 | 17,2 | |
| Ganancia peso (g/día) | 12,19±6,015(Mín 0,10 /Máx 39,71) | 12,75±5,99(Mín 0,14 /Máx 39,71) | 9,50±5,45(Mín 0,10 /Máx 24,00) | ** |
| Ganancia peso (g/semanas/día) | 0,422± 0,204(Mín 0,004/Máx 1,348) | 0,437±0,201(Mín 0,004 / Máx 1.348) | 0,350±0,209(Mín 0,004 / Máx 0,899) | * |
| Peso al nacer (g) | 1096,33±266,90(Mín 537 /Máx 1.970) | 1129,07±256,32(Mín 596 /Máx 1970) | 938,35±263,45(Mín 537 /Máx 1546) | *** |
| Edad gestacional (semanas) | 28,82±1,98(Mín 24 /Máx 34) | 29,11±1,87(Mín 24 /Máx 34) | 27,43±1,91(Mín 24,70 /Máx 31,15) | *** |
| Días ventilación mecánica | 9,40±13,61(Mín 0 /Máx 100) | 6,73±8,62(Mín 0 /Máx 43) | 22,41±23,07(Mín 0 /Máx 100) | *** |
| Número de transfusiones | 0,64±0,67(Mín 0 /Máx 5) | 0,58±0,60(Mín 0 /Máx 4) | 0,95±0,90(Mín 0 /Máx 5) | * |
| FiO2 máxima (%) | 32,58±16,64(Mín 21 / Máx 100) | 42,00±20,96(Mín 21 / Máx 100) | 31,09±16,22(Mín 21 / Máx 100) | * |
FiO2: fracción inspirada de oxígeno.
Estudio descriptivo de las variables cualitativas dicotómicas de estudio. Porcentajes (%) y diferencia de porcentajes (χ2 de Pearson)
| Total | ROP tratada | p | ||
|---|---|---|---|---|
| No | Sí | |||
| N | 233 | 193 | 40 | |
| % | 100 | 82,8 | 17,2 | |
| Sepsis | 39,9% | 35,23% | 62,5% | ** |
| Ductus arteriovenoso | 20,6% | 15,79% | 44,74% | *** |
| Displasia broncopulmonar | 79,8% | 78,12% | 87,5% | a |
| Hemorragia intraventricular | 14,0% | 10,5% | 31,6% | ** |
| Leucomalacia periventricular | 24,1% | 19,5% | 47,4% | *** |
| Enterocolitis necrosante | 23,6% | 18,7% | 47,5% | *** |
| Estadio ROP[N (%)] | No ROP | ROP 1 | ROP 2 | ROP 3 | ROP 4 | ROP 5 | Mín | Máx | p |
|---|---|---|---|---|---|---|---|---|---|
| 129 (55,4%) | 36 (15,5%) | 18 (7,7%) | 49 (21,0%) | 1(0,4%) | 0(0%) | 0 | 4 | ** | |
| Apgar 1 minuto[N (%)] | 0 | 1-2 | 3-4 | 5-6 | 7-8 | 9-10 | Mín | Máx | |
| 5 (2,1%) | 25 (10,7%) | 46 (19,7%) | 56 (24,0%) | 66 (28,3%) | 35(15,0%) | 0 | 10 | * | |
| Apgar 5 minutos[N (%)] | 0 | 1-2 | 3-4 | 5-6 | 7-8 | 9-10 | Mín | Max | |
| 0(0%) | 3(1,3%) | 11(4,7%) | 30(12,9%) | 63(27,0%) | 126(54,1%) | 1 | 10 | * |
La ganancia de peso posnatal en las primeras 4 semanas simple y ajustada, mostró diferencias estadísticamente significativas (p <0,05) en una subcohorte del estudio que excluye a los neonatos de <1000g de peso al nacimiento (tabla 4).
Análisis de la diferencia de medias en una subcohorte que excluye a los recién nacidos de <1000g al nacimiento. Media y desviación estándar, mínimo (Mín) y máximo (Máx), diferencia de medias (U de Mann Whitney)
| Variable | Total | ROP no tratada | ROP tratada | p |
|---|---|---|---|---|
| Ganancia peso (g/día) | 12,53±6,31(Mín 0,14 / Máx 39,71) | 12,947±6,388(Mín 0,14 / Máx 39,71) | 8,275±3,230(Mín 4,38 / Máx 13,46) | 0,003 |
| Ganancia peso ajustada por edad gestacional (g/semana/día) | 0,424±0,213(Mín 0,004 / Máx 1,348) | 0,438±0,216(Mín 0,004/Máx 1,348) | 0,284±0,115(Mín 0,145 / 0,491) | 0,004 |
| Ganancia peso ajustada por peso al nacer (g/kg/día) | 0,010±0,006(Mín 0,0001 / Máx 0,037) | 0,011±0,006(Mín 0,001/Máx 0,037) | 0,007±0,003(Mín 0,003 / Máx 0,013) | 0,007 |
| Ganancia peso ajustada por edad gestacional y peso al nacer (g/kg/semana/día) | 0,306±0,166(Mín 0,003 /Máx 1,095) | 0,3168±0,168(Mín 0,003/Máx 1,095) | 0,200±0,087(Mín 0,085 / Máx 0,356) | 0,005 |
Análisis del efecto protector de la ganancia de peso posnatal sobre la necesidad de tratamiento en la ROP
Tras el análisis bivariante de la ganancia de peso en las primeras 4 semanas de vida ajustada con las diferentes variables de estudio, la ganancia de peso mantuvo sus diferencias entre el grupo de ROP tratada y no tratada, sin mostrar efectos de confusión por el resto de variables (p<0,05). La odds ratio (OR) de la ganancia de peso no ajustada por el resto de variables (OR ganancia de peso no ajustada: 0,830 [IC95%: 0,831 - 0,960], p: 0,002) no perdió potencia al ajustar por peso al nacer (OR ganancia de peso ajustada por peso al nacer: 0,879 [IC 95%: 0,811 - 0,952], p: 0,002).
En la regresión logística global (que incluyó todas las variables independientes con p<0,2 en el análisis bivariante), se halló que el riesgo de presentar ROP susceptible de tratamiento fue indirectamente proporcional a la ganancia de peso del recién nacido prematuro en las primeras 4 semanas de vida. Se observó que el 62,8% (R2 Nagelkerke: 62,8%, p<0,001) de las variaciones en el desarrollo de ROP que precisa o no recibir tratamiento se explicaron por las variables de estudio: edad gestacional, peso al nacer, duración de la ventilación mecánica, número de transfusiones recibidas, FiO2 máxima, presencia/ausencia de ductus arteriovenoso, sepsis, hemorragia intraventricular, leucomalacia periventricular y enterocolitis, y puntaje del test de Apgar. La OR de la ganancia de peso en el modelo de regresión logística global fue 0,797 (IC 95%: 0,684 - 0,929, p=0,004).
En cuanto al papel de los factores de riesgo evitables en el modelo global, con tan solo la ganancia ponderal en las primeras 4 semanas (p=0,004) y la duración de la ventilación mecánica (p=0,043) se logró explicar el 26,9% de las variaciones en la severidad de ROP que condiciona la necesidad de recibir o no tratamiento (R2 Nagelkerke: 26,9%, p <0,001).
De este modo, la ecuación de probabilidad de desarrollo de ROP que requiere tratamiento en función de la ganancia de peso es:
Prob=1 / (1+e − [-1.596 + (-0,078· g/día)])
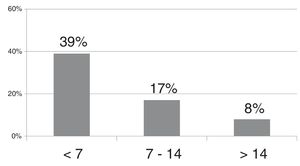
La probabilidad de presentar ROP que requiere tratamiento, en función de la ganancia de peso posnatal (g/día) en las primeras 4 semanas de vida, suponiendo que el resto de las variables independientes permanecieran constantes, fue de entre el 16,85% y el 11,26% en ganancias ponderales menores de 7g/día, entre el 10,51% y el 6,85% en ganancias entre 7-14g/día y continuó disminuyendo progresivamente a partir de los 14g/día.
La reducción del riesgo de presentar ROP candidata a tratamiento fue de hasta el 8,35% en el caso de ganancias posnatales de 10g/día, y hasta del 12,76% en ganancias de 20g/día (tabla 5).
Reducción de la probabilidad de ROP severa candidata a recibir tratamiento, en función de la ganancia de peso posnatal (g/día) en las primeras 4 semanas de vida. Reducción del riesgo suponiendo que el resto de los factores independientes permanecieran constantes p<0,005
| g/día | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| Reducción probabilidad | 0,75 - 6,34% | 1,46 -7,05% | 2,13 - 7,72% | 2,76 -8,35% | 3,35 - 8,94% | 3,90 - 9,49% | 4,41 - 10% |
| g/día | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| Reducción probabilidad | 4,89 - 10,48% | 5,34 - 10,93% | 5,76 - 11,35% | 6,15 - 11,74% | 6,52 - 12,11% | 6,86 - 12,45% | 7,17 - 12,76% |
Entre las variables independientes analizadas, destacaron con mayor fuerza de significación estadística los factores descritos clásicamente en numerosos estudios previos como factores de riesgo de ROP: peso al nacer, edad gestacional, tiempo de duración de la ventilación mecánica y comorbilidad del recién nacido prematuro6,16,17.
El peso al nacer y la edad gestacional son dos características imprescindibles que reflejan el grado inmadurez del recién nacido prematuro18 y, por tanto, la severidad en el déficit de desarrollo vascular retiniano. Principalmente, la edad gestacional es la que será indicadora del tiempo de desarrollo vascular que ha faltado para el desarrollo retiniano completo. A mayor área vascular de la retina, mayor será la velocidad de desarrollo vascular requerida para alcanzar la vascularización completa19,20. La supresión de los factores de crecimiento, por la fase hiperóxica y la pérdida de los aportes placentarios tras el parto, provoca un retraso en el desarrollo vascular retiniano que más tarde, debido al aumento de la actividad metabólica en la retina poco vascularizada, se traducirá en hipoxia retiniana, que estimula la secreción de factores de crecimiento proliferativos, como el VEGF. Este hecho da lugar a una proliferación vascular descontrolada, responsable de los estadios más severos de la enfermedad20.
Al igual que en numerosos algoritmos de screening descritos en la literatura21,22, entre los que destaca WINROP4, la unidad de medida empleada para la ganancia de peso posnatal fue g/día y no g/kg/día. En la literatura, el bajo peso al nacer se ha relacionado con factores gestacionales y de comorbilidad23–25, como ocurre en el concepto de neonato pequeño para su edad gestacional (PEG), en el que se considera el tamaño del neonato, adaptado a la edad gestacional. En la patogenia del PEG y del crecimiento intrauterino retardado se debe considerar el retraso en el crecimiento fetal provocado por causas maternas, placentarias y fetales y por la priorización (mediada por el IGF-1) del desarrollo de órganos vitales, como los del sistema nervioso24,11 La IGF-1 y su efecto permisivo sobre el VEGF son dos de los puntos de mayor relevancia en la fisiopatología de la ROP26,27. Así, en los recién nacidos de <28 semanas, los niveles de IGF-1 son muy inferiores a los del recién nacido a término (principalmente por la privación temprana del aporte placentario)28. Hellström et al. describieron que el efecto de los bajos niveles de IGF-1 sobre la ROP es al menos tan fuerte como el de la edad gestacional29. Los niveles de IGF-1, que fueron empleados en algoritmos de screening como WINROP30, posteriormente pasaron a ser sustituidos por la ganancia de peso (g/día), dada la correlación directa y estrecha entre ambos niveles31,32.
Dada la importancia de la nutrición intrauterina en la ganancia de peso durante el período neonatal y la menor ganancia de peso, peor crecimiento intrauterino, peor estado nutricional a las 36 semanas posmenstruales y retraso en el desarrollo, observados en recién nacidos de ≤ 30 semanas de gestación23–25, la ganancia de peso (g/día) siempre debe ser considerada de forma conjunta con la edad gestacional, el peso al nacer y la comorbilidad del recién nacido prematuro. Su efecto fue estudiado adicionalmente en función de la edad gestacional, y excluyendo a los neonatos con <1000g al nacimiento33.
A los factores intrínsecos del recién nacido prematuro debemos añadir los factores yatrogénicos derivados de los tratamientos precisos por su inmadurez o su comorbilidad. El factor de riesgo de mayor protagonismo en los últimos años es la duración del tiempo de ventilación mecánica del recién nacido. Entre los años 2009 y 2012, los ensayos clínicos BOOST II34, SUPPORT35 y ELGAN36, entre otros, demostraron el incremento del riesgo de ROP severa tras la exposición a altas cifras de saturación de oxígeno durante las primeras semanas de vida7.
Las mejoras en el tratamiento de las patologías concomitantes de los recién nacidos, así como las medidas de implementación de la terapia con oxígeno y el control estrecho del aporte nutricional, máxime en los casos de la lactancia materna precoz, han hecho que cada vez encontremos en la práctica clínica habitual ganancias ponderales mayores13,14. Si bien el impacto negativo de la ganancia de peso más notable se observa en las ganancias de peso extremadamente bajas <7g/día, en los niveles de ganancia ponderal medios, entre 7 y 14g/día y aún más en las ganancias>14g/día, se continúa observando una relación estrecha indirectamente proporcional a la severidad de la ROP. El 75% de los casos con ganancia de peso <7g/día en este estudio correspondieron a prematuros con <31 SG, nacidos de parto múltiple, o con patologías asociadas. En el estudio se detectó un recién nacido con una ganancia ponderal extremadamente alta (40,1g/día) en el contexto de hidrocefalia, por lo que fue excluido del estudio. La ganancia de peso mínima en la muestra, de 0,10g/día, fue hallada en 3 recién nacidos de 24, y 27 SG, un nacido de parto simple, y dos de parto múltiple, con abundante comorbilidad y 753, 900 y 820g de peso al nacimiento, respectivamente.
Entre los factores de comorbilidad hallados en la muestra de estudio destacó la displasia broncopulmonar, descrita por Bancalari en 197937, y presente en el 79,8% de los recién nacidos prematuros de la muestra.
Además de los factores intrínsecos y extrínsecos anteriormente citados, Flynn et al. propuso la existencia de un componente de heredabilidad de ROP38, que ha sido manifestada en diferentes grupos étnicos39 y en los nacidos de parto múltiple11.
El estudio presenta algunas debilidades y limitaciones, como su propio carácter retrospectivo y la exposición a diferentes protocolos de oxigenoterapia entre los años anteriores y posteriores a 2009-2012. Debemos destacar que en el año 2009, se realizaron cambios relevantes en los protocolos de cuidado de los neonatos prematuros, como la incorporación de protocolos de administración de oxígeno y el programa Oxygen With Love (OWL)7 en el centro y el incremento de la atención en la ganancia de peso durante el periodo neonatal31. Los niveles de FiO2 en la muestra total se recogen en el manuscrito, sin embargo, no se dispone de análisis de los datos de la incorporación de técnicas de ventilación no invasiva, ni de las cifras de saturación de la hemoglobina durante el periodo previo y posterior a 2009. Por otro lado, la monitorización y recogida de los aportes nutricionales, así como del tipo de lactancia de cada recién nacido, no fue llevada a cabo de manera uniforme, que permitiera su análisis en este estudio. En cuanto a la recogida de las imágenes, esta fue realizada mediante un sistema de vídeo acoplado al oftalmoscopio binocular40, que permite el almacenaje de las exploraciones realizadas y su reevaluación posterior, pero su resolución fue insuficiente para extraer imágenes estáticas de calidad que permitieran la medición objetiva del avance vascular en cada exploración del neonato, como permite RetCam®.
ConclusionesLa ganancia de peso posnatal en las primeras 4 semanas de vida del recién nacido prematuro muestra una correlación inversa con la probabilidad de presentar ROP severa que requiere tratamiento. Esta relación estrecha entre ganancia de peso y ROP susceptible de tratamiento es importante no solo en las ganancias ponderales bajas, sino que el riesgo de ROP susceptible de tratamiento continúa decreciendo a medida que aumenta la ganancia de peso en las primeras 4 semanas de vida. Esta probabilidad de riesgo de ROP severa ayuda a orientar al clínico en la práctica clínica y adaptar la frecuencia de los seguimientos al nivel de riesgo, pero no debe ser considerada de forma individual. A dicha probabilidad de riesgo debe añadirse aquella asociada a los factores de inmadurez del recién nacido: edad gestacional y peso al nacer, así como sus factores yatrogénicos, destacando la duración de la terapia con ventilación mecánica, y la comorbilidad del recién nacido prematuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación parcial en congresos: 3.° Congreso Sociedad Española de Oftalmopediatría (SEDOP), 23 de septiembre de 2016, Málaga, España. World Summit on Pediatrics (WSP), 24 de junio de 2016, Oporto, Portugal.