El raquitismo carencial es una enfermedad emergente en nuestro medio y se describe especialmente en lactantes y niños inmigrantes de raza negra o piel oscura procedentes de países en vías de desarrollo. El objetivo de este trabajo está dirigido a conocer el estado nutricional de vitamina D en lactantes y niños inmigrantes de diferentes etnias de edad inferior a 6 años y compararlo con una población infantil autóctona.
Población y métodosEstudio prospectivo efectuado en un Centro de Asistencia Primaria de la localidad de Salt (Girona). Población: 307 niños con la siguiente distribución por origen y etnia: caucásicos (n=85; 28%), subsaharianos (n=101; 32,5%); magrebíes (n=87, 28,0%); centroamericanos (n=20; 6,4%) e indopakistaníes (n=14; 4,5%). Parámetros bioquímicos evaluados: calcemia, fosforemia, fosfatasa alcalina, 25-hidroxivitamina D y parathormona. Encuesta nutricional para estimar la ingesta de calcio, el aporte de vitamina D y el grado de exposición solar.
ResultadosPresentan déficit de vitamina D (< 20ng/ml) el 8% de los niños de origen caucásico, el 18% de los subsaharianos, el 20% de los centroamericanos, el 34,5% de los magrebíes y el 64% de los niños de origen indopakistaní. El 2,9% de los niños estudiados (n=9) presentan déficit grave de vitamina D (< 10ng/ml), de los que tan solo un niño de origen subsahariano reúne criterios bioquímicos de raquitismo clásico. La prevalencia de la deficiencia de vitamina D es significativamente más elevada en los niños sin suplementación con vitamina D durante el primer año de vida.
ConclusionesEl 22,5% de los niños menores de 6 años de edad presenta concentraciones plasmáticas en rango deficitario de vitamina D, siendo más prevalente en los niños de origen indopakistaní y magrebí.
Nutritional rickets is an emergent disease in Spain, and occurs particularly in black and dark-skinned infants and children from immigrant populations. The aim of this work was to ascertain the vitamin D reserve in a population of native and immigrant children under the age of 6 years.
Population and methodsA prospective study was conducted at a Primary Healthcare Centre in Salt (Girona). Patients: 307 children with the following origin and race distribution: Caucasian (n=85; 28%), Sub-Saharan (n=101; 32.5%); Maghrebí (n=87, 28.0%); Central-American (n=20; 6.4%) and Indo-Pakistani (n=14; 4.5%). The biochemistry blood parameters studied were: calcium, phosphorus, alkaline phosphatase, 25-hydroxivitamin D, and parathormone. A nutritional survey was used to estimate calcium and vitamin D intake and degree of sun exposure.
ResultsVitamin D deficiency (<20ng/ml) was detected in Caucasians (8%), Sub-Saharans (18%), Central-Americans (20%), Maghrebís (34.5%), and Indo-Pakistanis (64%). Of the children studied (n=9), 2.9% had serious vitamin D deficiency (< 10ng/ml); only one child of Sub-Saharan origin met the biochemical criteria for classical rickets. The prevalence of vitamin D deficiency was significantly higher in children not receiving vitamin D supplements in the first year of life.
ConclusionsPlasma vitamin D concentrations were deficient in 22.5% of children under the age of six, being more prevalent in children of Indo-Pakistani and Maghrebí origin.
La vitamina D tiene un papel destacado en la regulación del metabolismo fosfocálcico y el metabolismo óseo, de forma que su deficiencia determina el desarrollo de raquitismo y osteomalacia. Junto a estas funciones, en el transcurso de los últimos años se ha acumulado un gran número de evidencias acerca de su importancia para otras funciones diferentes del metabolismo fosfocálcico. Diversos estudios de base epidemiológica han puesto de manifiesto la asociación de concentraciones plasmáticas disminuidas de 25-hidroxivitamina D (25(OH)D) y el desarrollo de diversas enfermedades crónicas, como la osteoporosis, y mayor riesgo de presentar fracturas óseas, el asma, las infecciones respiratorias, la diabetes tipo 1 y la obesidad entre otras1-5.
Los estándares de referencia que definen el umbral de suficiencia de vitamina D en niños no están bien establecidos, aunque la guía de la Academia de Ciencias Médicas Americana y la Academia Americana de Pediatría estiman que 20ng/ml (50 nmol/l) de 25(OH)D en suero sería el umbral que cubriría los requerimientos de prácticamente todas las personas sanas6-9.
La principal fuente de vitamina D proviene de la exposición de la piel a la luz solar. Solo una pequeña parte proviene de la ingesta. De forma que los factores que limitan la exposición cutánea a la luz solar como consecuencia de condiciones meteorológicas o geográficas desfavorables, la polución atmosférica, la vestimenta y los factores raciales (hiperpigmentación cutánea) o los que implican un aporte alimentario insuficiente de vitamina D llevan implícito el riesgo de desarrollar estados carenciales de vitamina D10-13.
En la actualidad, el déficit grave de vitamina D de origen nutricional se considera muy poco frecuente en la mayoría de los países industrializados, aunque se estima que un porcentaje significativo de la población, tanto infantil como adulta, presenta cierto grado de hipovitaminosis D. En España, el raquitismo carencial en la población autóctona es realmente excepcional; sin embargo, datos clínicos y epidemiológicos ponen de manifiesto el resurgir de esta enfermedad, que se describe en lactantes y niños inmigrantes de piel oscura o de raza negra procedentes de países en vías de desarrollo que son amamantados con lactancia materna exclusiva durante períodos prolongados sin seguir suplementación con vitamina D y con escasa exposición solar14-20.
El aumento de la población infantil nacida o procedente de familias inmigrantes de países en vías de desarrollo en nuestro medio, con hábitos alimentarios, culturales y estilos de vida muy diferentes de los nuestros y que pueden llevar implícito un riesgo más elevado de desarrollo de estados de deficiencia de vitamina D, justifica este estudio, que tiene como objetivo principal determinar cuál es el estado nutricional y de reserva de la vitamina D en lactantes y niños inmigrantes de diferentes etnias de edad inferior a 6 años y compararlo con una población infantil autóctona.
Población y métodosEl estudio de carácter prospectivo se ha efectuado durante los años 2008 y 2010 en un Centro de Asistencia Primaria de la localidad de Salt (Girona). Se ha incluido a 307 lactantes y niños menores de 5 años (139 niñas y 168 niños), que acuden de forma regular u ocasional a la consulta ambulatoria de pediatría, siendo elegidos al azar y con la siguiente distribución por origen y etnia: origen caucásico, n=85 (32 niñas y 53 niños); origen magrebí, n=87 (41 niñas y 46 niños); origen subsahariano, n=101 (48 niñas y 53 niños), y con la siguiente distribución de nacionalidades: Gambia (n=52), Senegal (n=13), Nigeria (n=10), Mali (n=10), Guinea Conakry (n=6), Ghana (n=4), Costa de Marfil (n=2), Mauritania (n=1), Angola (n=1), Mozambique (n=1) y Camerún (n=1); de origen centroamericano, n=20 (13 niñas y 7 niños), fundamentalmente de Honduras, y finalmente de origen indopakistaní, n=14 (5 niñas y 9 niños).
La medida de la longitud en los niños menores de 2 años se ha realizado en posición horizontal, con un tallímetro de aluminio que discrimina hasta 1mm colocado sobre la camilla. Con el niño en posición de decúbito supino, se mantiene la cabeza con los ojos mirando en posición vertical y las piernas bien extendidas, con los pies en ángulo recto; se realizan 3 mediciones seguidas y se recoge el promedio. La medida de la talla en los niños mayores de 2 años se ha realizado con un tallímetro que discrimina hasta 1mm, adaptado a la pared en un plano vertical. El niño desnudo, descalzo, con los pies juntos. Pegado todo el cuerpo y la cabeza al soporte, de forma que pase un plano imaginario denominado de Frankfurt, entre el borde inferior de la órbita y el margen superior del orificio auditivo externo. Se realizan 3 mediciones seguidas y se escoge el promedio.
Se ha utilizado para la medida del peso de lactantes una báscula pesa-bebés que discrimina hasta 10g, colocando al niño desnudo en el centro de la báscula. Para los niños mayores de 2 años, se utilizó una báscula de adultos que discrimina hasta 100g.
Los parámetros antropométricos evaluados de los niños han sido comparados con los valores de peso, longitud o talla e IMC (kg/m2) obtenidos del estudio transversal de crecimiento español y se ha calculado el valor z-score con relación a la edad y el sexo21,22.
La evaluación de la ingesta diaria de calcio y de vitamina D se ha efectuado mediante la Encuesta Nutricional de Garabédian, que estima la frecuencia de consumo semanal de alimentos que los contienen. Para evaluar el grado de exposición solar, se han considerado la superficie corporal, la franja horaria, el tiempo, el lugar, la utilización de crema solar y la estación del año, puntuando estos parámetros de 0 a 3 con un máximo de 9 puntos, según las tablas de Garabédian en función del color de la piel23. También se ha recogido la información relativa al tipo de suplementación de vitamina D (dosis y vía de administración) recibida durante el primer año de vida.
El protocolo del estudio fue aprobado por el Comitè Étic d’ Investigació Clinica del l’IDIAP Jordi Gol i Gurina-Barcelona y se obtuvo el consentimiento informado de los padres o el tutor legal.
Evaluación de parámetros bioquímicos y hormonales del metabolismo fosfocálcico. Calcio: rango de valores de normalidad entre 8,6 y 10,2mg/dl. Fósforo: rango de valores de normalidad entre 2,7 y 4,5mg/dl. Fosfatasa alcalina: rango de valores de normalidad entre 30-281 U/l. La determinación de ellos se realiza por espectrofotometría. Método substrato 4-nitrofenol-fosfato y técnica colorimétrica. Aparato autoanalizador modular Cobas C 711. Reactivos y aparato de Roche Diagnósticos. PTH: rango de valores de normalidad entre 15-65pg/ml. Se utilizó método ECLIA (Roche) para determinar la PTH mediante el aparato modular E-170. Vitamina D: se ha utilizado un método ELISA (Vitro) para determinar la 25(OH)D. El estado nutricional de la vitamina D se ha estratificado en las siguientes categorías: deficiencia grave: concentraciones plasmáticas de 25(OH)D<10ng/ml; deficiencia moderada: 25(OH)D ≥ 10ng/ml y<20ng/ml; suficiencia: 25(OH)D ≥ 20ng/ml, y elevado: 25(OH)D ≥ 100ng/ml.
Procedimientos estadísticos: los resultados de las variables cuantitativas se expresan como media±desviación estándar (DE). El análisis de distribución de estas variables se ha realizado mediante el test de Kolmogorov-Smirnov. El análisis de las diferencias entre las poblaciones para cada parámetro cuantitativo se ha realizado según su distribución: test de ANOVA y t de Student para aquellos parámetros cuya distribución es normal (talla-SDS) y test no paramétrico de Wilcoxon/Kruskal-Wallis con la aproximación de la chi al cuadrado para aquellos cuya distribución no es normal (resto de parámetros cuantitativos). Las diferencias de distribución de las variables nominales entre poblaciones se han analizado mediante el test de la chi al cuadrado de Pearson. Para determinar las correlaciones estadísticamente significativas entre los parámetros cuantitativos, se ha aplicado un análisis de regresión lineal simple. Para analizar qué parámetros clínicos y bioquímicos del metabolismo fosfocálcico influyen en la determinación de los niveles séricos de 25(OH)D se ha aplicado un análisis de regresión lineal múltiple ajustado por mínimos cuadrados. Se ha considerado que existen diferencias estadísticamente significativas cuando en el resultado de cualquiera de los análisis mencionados anteriormente la p ha sido<0,05. El programa estadístico utilizado ha sido JMP® 7.0.1 (SAS, Cary, NC, EE. UU.).
ResultadosLa edad cronológica decimal media de los niños en el momento de ser incluidos en el estudio es de 1,8±0,9 años (media±DE) (límites: 0,2-5,6 años) sin observarse diferencias estadísticamente significativas con relación a la edad en los diferentes grupos étnicos evaluados. El 90% de los niños son menores de 3 años. El 8% de ellas tienen edades comprendidas entre 3 y 4 años, y el 2% restante entre 4 y 5,6 años. El valor medio del IMC en el momento de efectuar la exploración es de 16,2±1,7kg/m2 y expresado en DE de –0,50±1,1, sin que se hayan observado diferencias estadísticamente significativas con relación al grupo racial.
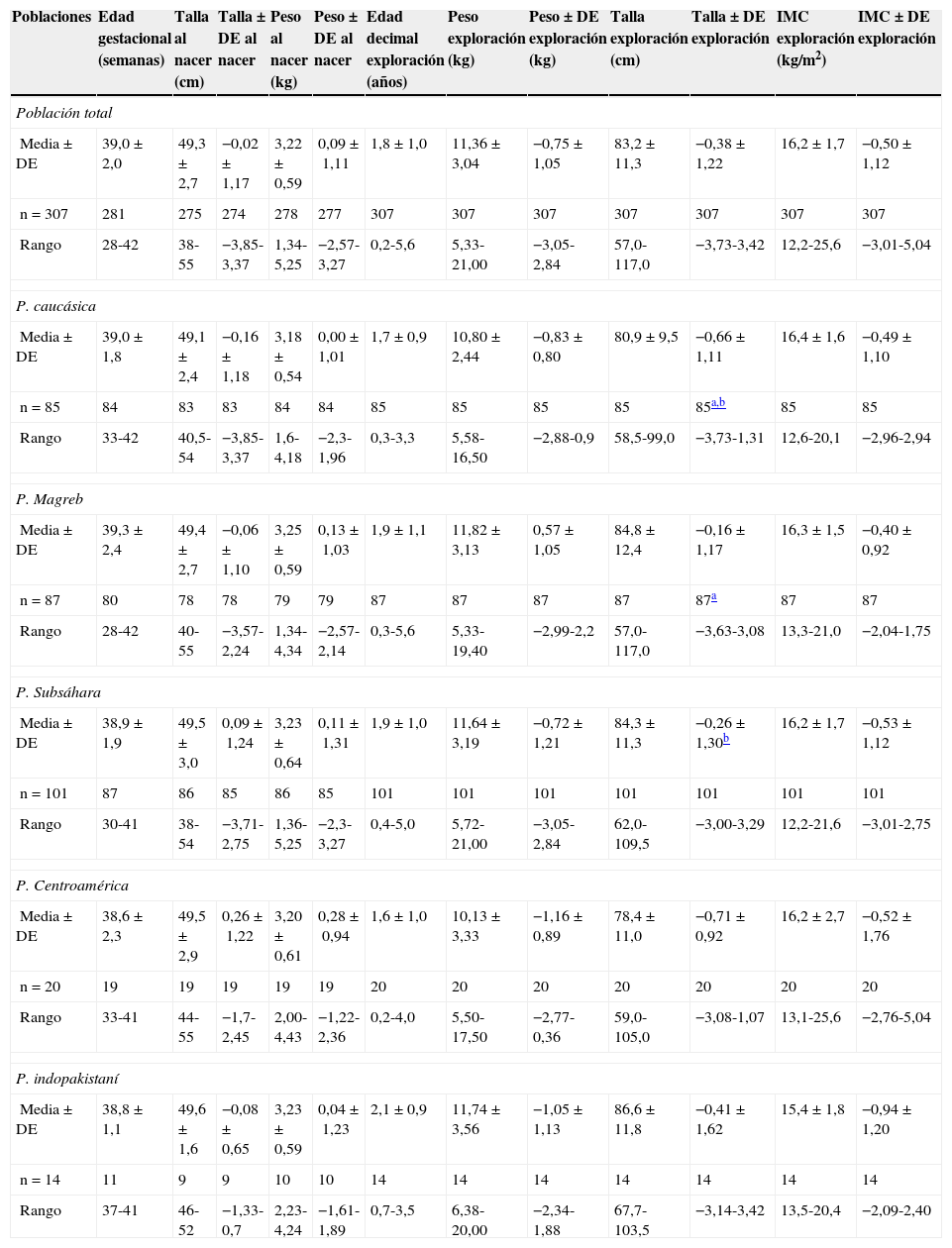
La tabla 1 muestra los valores medios expresados como media ± DE de la edad gestacional, los parámetros antropométricos neonatales (peso y longitud), los valores de los parámetros antropométricos (peso, longitud o talla [niños mayores de 2 años de edad] y del IMC [kg/m2] en valores absolutos y en DE) en el momento de ser incluidos en el estudio y agrupados en relación con su origen étnico, sin que se hayan observado diferencias estadísticamente significativas en estos parámetros entre las diferentes etnias.
Edad gestacional, antropometría neonatal (peso y talla) y edad y antropometría (peso, talla e IMC) de la población en el momento de ser incluidos en el estudio estratificados por origen étnico (n=307)
| Poblaciones | Edad gestacional (semanas) | Talla al nacer (cm) | Talla ± DE al nacer | Peso al nacer (kg) | Peso ± DE al nacer | Edad decimal exploración (años) | Peso exploración (kg) | Peso ± DE exploración (kg) | Talla exploración (cm) | Talla ± DE exploración | IMC exploración (kg/m2) | IMC ± DE exploración |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Población total | ||||||||||||
| Media±DE | 39,0±2,0 | 49,3±2,7 | −0,02±1,17 | 3,22±0,59 | 0,09±1,11 | 1,8±1,0 | 11,36±3,04 | −0,75±1,05 | 83,2±11,3 | −0,38±1,22 | 16,2±1,7 | −0,50±1,12 |
| n=307 | 281 | 275 | 274 | 278 | 277 | 307 | 307 | 307 | 307 | 307 | 307 | 307 |
| Rango | 28-42 | 38-55 | −3,85-3,37 | 1,34-5,25 | −2,57-3,27 | 0,2-5,6 | 5,33-21,00 | −3,05-2,84 | 57,0-117,0 | −3,73-3,42 | 12,2-25,6 | −3,01-5,04 |
| P. caucásica | ||||||||||||
| Media±DE | 39,0±1,8 | 49,1±2,4 | −0,16±1,18 | 3,18±0,54 | 0,00 ± 1,01 | 1,7±0,9 | 10,80±2,44 | −0,83 ± 0,80 | 80,9±9,5 | −0,66±1,11 | 16,4±1,6 | −0,49±1,10 |
| n=85 | 84 | 83 | 83 | 84 | 84 | 85 | 85 | 85 | 85 | 85a,b | 85 | 85 |
| Rango | 33-42 | 40,5-54 | −3,85-3,37 | 1,6-4,18 | −2,3-1,96 | 0,3-3,3 | 5,58-16,50 | −2,88-0,9 | 58,5-99,0 | −3,73-1,31 | 12,6-20,1 | −2,96-2,94 |
| P. Magreb | ||||||||||||
| Media±DE | 39,3±2,4 | 49,4±2,7 | −0,06±1,10 | 3,25±0,59 | 0,13±1,03 | 1,9±1,1 | 11,82±3,13 | 0,57±1,05 | 84,8±12,4 | −0,16±1,17 | 16,3±1,5 | −0,40±0,92 |
| n=87 | 80 | 78 | 78 | 79 | 79 | 87 | 87 | 87 | 87 | 87a | 87 | 87 |
| Rango | 28-42 | 40-55 | −3,57-2,24 | 1,34-4,34 | −2,57-2,14 | 0,3-5,6 | 5,33-19,40 | −2,99-2,2 | 57,0-117,0 | −3,63-3,08 | 13,3-21,0 | −2,04-1,75 |
| P. Subsáhara | ||||||||||||
| Media±DE | 38,9±1,9 | 49,5±3,0 | 0,09±1,24 | 3,23±0,64 | 0,11±1,31 | 1,9±1,0 | 11,64±3,19 | −0,72±1,21 | 84,3±11,3 | −0,26±1,30b | 16,2±1,7 | −0,53±1,12 |
| n=101 | 87 | 86 | 85 | 86 | 85 | 101 | 101 | 101 | 101 | 101 | 101 | 101 |
| Rango | 30-41 | 38-54 | −3,71-2,75 | 1,36-5,25 | −2,3-3,27 | 0,4-5,0 | 5,72-21,00 | −3,05-2,84 | 62,0-109,5 | −3,00-3,29 | 12,2-21,6 | −3,01-2,75 |
| P. Centroamérica | ||||||||||||
| Media±DE | 38,6±2,3 | 49,5±2,9 | 0,26±1,22 | 3,20±0,61 | 0,28±0,94 | 1,6±1,0 | 10,13±3,33 | −1,16±0,89 | 78,4±11,0 | −0,71±0,92 | 16,2±2,7 | −0,52±1,76 |
| n=20 | 19 | 19 | 19 | 19 | 19 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| Rango | 33-41 | 44-55 | −1,7-2,45 | 2,00-4,43 | −1,22-2,36 | 0,2-4,0 | 5,50-17,50 | −2,77-0,36 | 59,0-105,0 | −3,08-1,07 | 13,1-25,6 | −2,76-5,04 |
| P. indopakistaní | ||||||||||||
| Media±DE | 38,8±1,1 | 49,6±1,6 | −0,08±0,65 | 3,23±0,59 | 0,04±1,23 | 2,1±0,9 | 11,74±3,56 | −1,05±1,13 | 86,6±11,8 | −0,41±1,62 | 15,4±1,8 | −0,94±1,20 |
| n=14 | 11 | 9 | 9 | 10 | 10 | 14 | 14 | 14 | 14 | 14 | 14 | 14 |
| Rango | 37-41 | 46-52 | −1,33-0,7 | 2,23-4,24 | −1,61-1,89 | 0,7-3,5 | 6,38-20,00 | −2,34-1,88 | 67,7-103,5 | −3,14-3,42 | 13,5-20,4 | −2,09-2,40 |
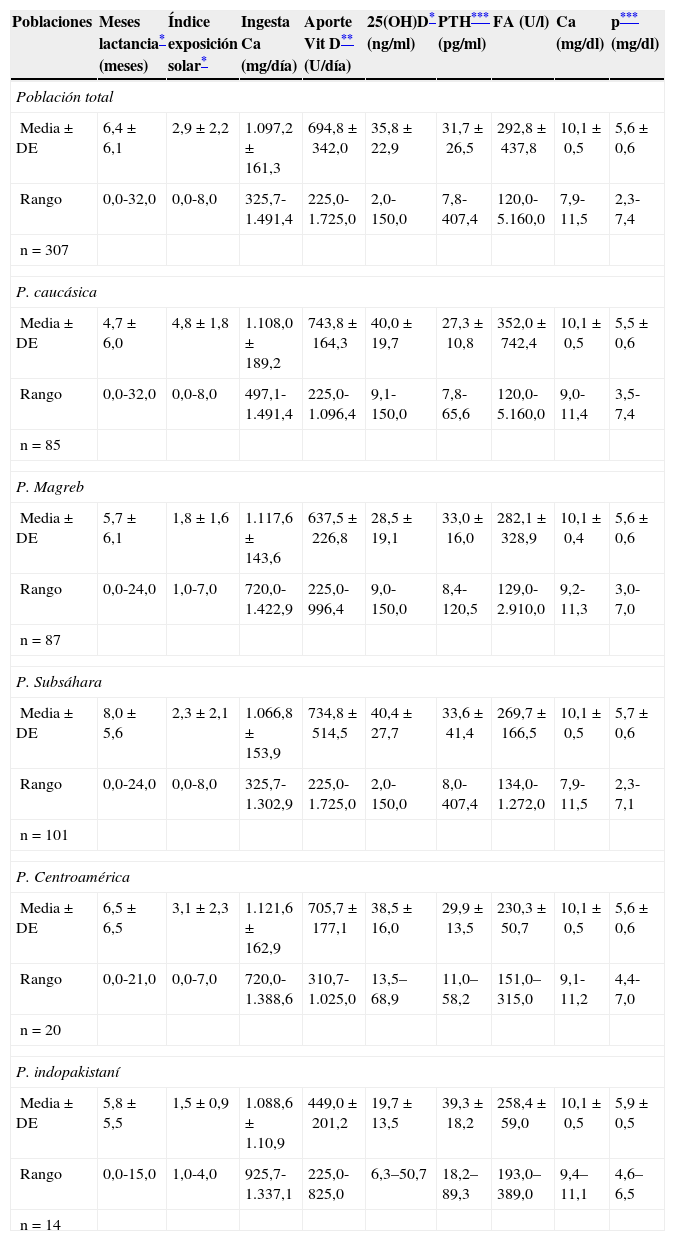
En la tabla 2 se muestran los resultados relativos a la edad (años) en la que se efectuó el estudio, el tiempo de lactancia materna (meses), los resultados de la encuesta alimentaria de Garabédian que estima la ingesta diaria de calcio (mg/día), el aporte de vitamina D (U/día), el índice de exposición corporal al sol y, finalmente, se muestran los resultados de los parámetros bioquímicos del metabolismo fosfocálcico evaluados para el conjunto de la población y para los diferentes grupos étnicos.
Tiempo de lactancia materna (meses), índice de exposición solar, ingesta estimada de calcio (mg/día), aporte estimado de vitamina D (U/día) y parámetros bioquímicos de metabolismo fosfocálcico
| Poblaciones | Meses lactancia* (meses) | Índice exposición solar* | Ingesta Ca (mg/día) | Aporte Vit D** (U/día) | 25(OH)D* (ng/ml) | PTH*** (pg/ml) | FA (U/l) | Ca (mg/dl) | p*** (mg/dl) |
|---|---|---|---|---|---|---|---|---|---|
| Población total | |||||||||
| Media±DE | 6,4±6,1 | 2,9±2,2 | 1.097,2±161,3 | 694,8±342,0 | 35,8±22,9 | 31,7±26,5 | 292,8±437,8 | 10,1±0,5 | 5,6±0,6 |
| Rango | 0,0-32,0 | 0,0-8,0 | 325,7-1.491,4 | 225,0-1.725,0 | 2,0-150,0 | 7,8-407,4 | 120,0-5.160,0 | 7,9-11,5 | 2,3-7,4 |
| n=307 | |||||||||
| P. caucásica | |||||||||
| Media±DE | 4,7±6,0 | 4,8±1,8 | 1.108,0±189,2 | 743,8±164,3 | 40,0±19,7 | 27,3±10,8 | 352,0±742,4 | 10,1±0,5 | 5,5±0,6 |
| Rango | 0,0-32,0 | 0,0-8,0 | 497,1-1.491,4 | 225,0-1.096,4 | 9,1-150,0 | 7,8-65,6 | 120,0-5.160,0 | 9,0-11,4 | 3,5-7,4 |
| n=85 | |||||||||
| P. Magreb | |||||||||
| Media±DE | 5,7±6,1 | 1,8±1,6 | 1.117,6±143,6 | 637,5±226,8 | 28,5±19,1 | 33,0±16,0 | 282,1±328,9 | 10,1±0,4 | 5,6±0,6 |
| Rango | 0,0-24,0 | 1,0-7,0 | 720,0-1.422,9 | 225,0-996,4 | 9,0-150,0 | 8,4-120,5 | 129,0-2.910,0 | 9,2-11,3 | 3,0-7,0 |
| n=87 | |||||||||
| P. Subsáhara | |||||||||
| Media±DE | 8,0±5,6 | 2,3±2,1 | 1.066,8±153,9 | 734,8±514,5 | 40,4±27,7 | 33,6±41,4 | 269,7±166,5 | 10,1±0,5 | 5,7±0,6 |
| Rango | 0,0-24,0 | 0,0-8,0 | 325,7-1.302,9 | 225,0-1.725,0 | 2,0-150,0 | 8,0-407,4 | 134,0-1.272,0 | 7,9-11,5 | 2,3-7,1 |
| n=101 | |||||||||
| P. Centroamérica | |||||||||
| Media±DE | 6,5±6,5 | 3,1±2,3 | 1.121,6±162,9 | 705,7±177,1 | 38,5±16,0 | 29,9±13,5 | 230,3±50,7 | 10,1±0,5 | 5,6±0,6 |
| Rango | 0,0-21,0 | 0,0-7,0 | 720,0-1.388,6 | 310,7-1.025,0 | 13,5–68,9 | 11,0–58,2 | 151,0–315,0 | 9,1-11,2 | 4,4-7,0 |
| n=20 | |||||||||
| P. indopakistaní | |||||||||
| Media±DE | 5,8±5,5 | 1,5±0,9 | 1.088,6±1.10,9 | 449,0±201,2 | 19,7±13,5 | 39,3±18,2 | 258,4±59,0 | 10,1±0,5 | 5,9±0,5 |
| Rango | 0,0-15,0 | 1,0-4,0 | 925,7-1.337,1 | 225,0-825,0 | 6,3–50,7 | 18,2–89,3 | 193,0–389,0 | 9,4–11,1 | 4,6–6,5 |
| n=14 | |||||||||
Comparación entre las diferentes poblaciones.
El tiempo de lactancia materna medio para el conjunto de la población es de 6,4±6,1 meses, observándose diferencias estadísticamente significativas (p<0,0001) entre los grupos étnicos, siendo la población subsahariana la que efectúa lactancia materna más prolongada (8,0±5,6 meses) y la población caucásica la más breve (4,7±6,0 meses). La ingesta diaria estimada de calcio para el conjunto de la población es de 1.100±155mg/día, sin observarse diferencias estadísticamente significativas con relación al grupo étnico y el aporte estimado de vitamina D es de 124±105 U/día, observándose diferencias estadísticamente significativas entre la población de origen indio (57±97 U/día) y el resto de las etnias (p<0,001). Con relación al grado de exposición solar para la población total, el valor medio es de 2,9±2,2, que se estima como deficitario. Existen diferencias estadísticamente significativas (p<0,0001) entre los grupos étnicos, siendo la población caucásica la que presenta un valor medio superior (4,8±1,8), que se estima como grado de exposición medio, mientras que la población de origen indio muestra los valores mínimos (1,5±0,9), seguida de la población magrebí (1,8±1,6), en que se estima como deficitario.
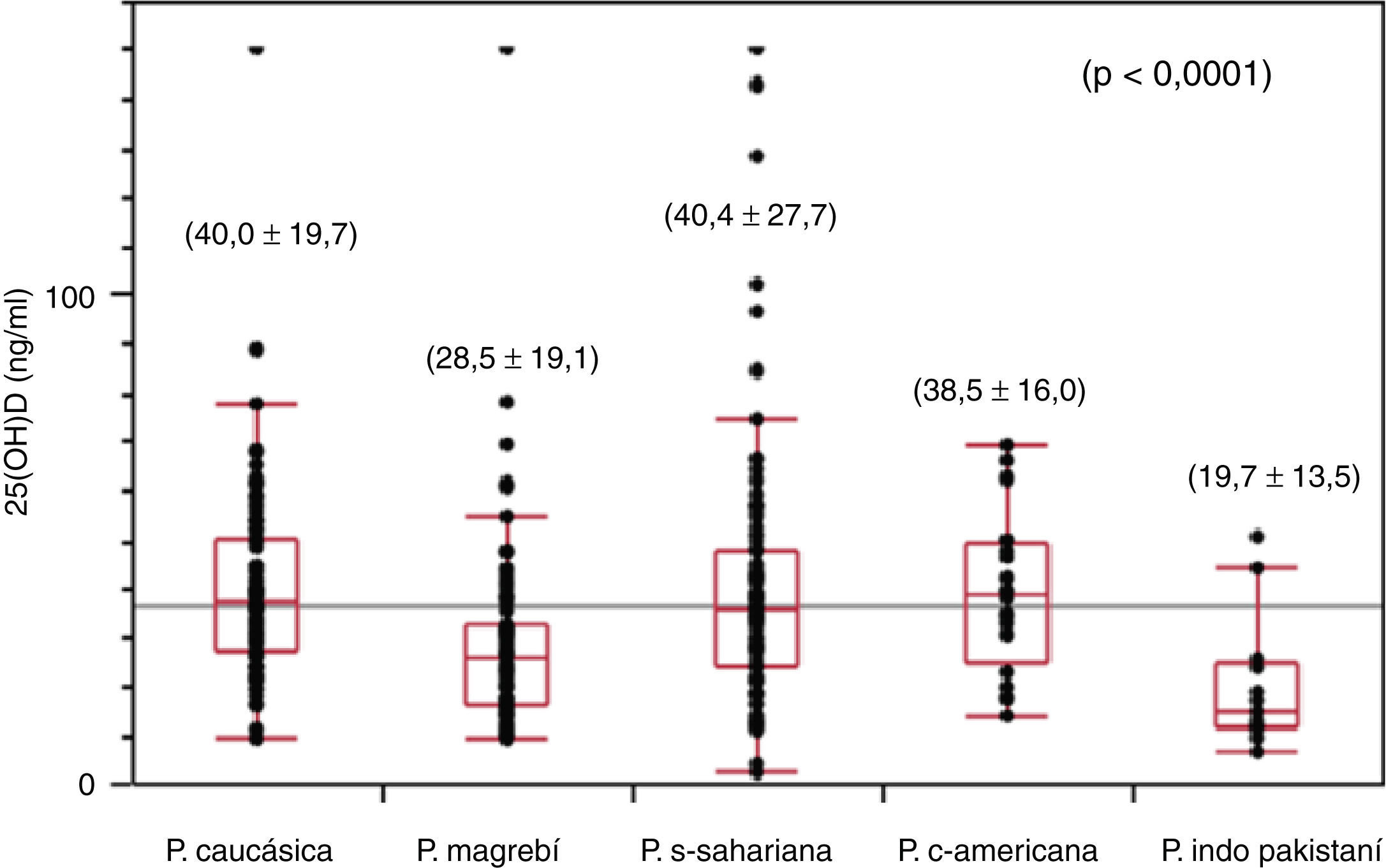
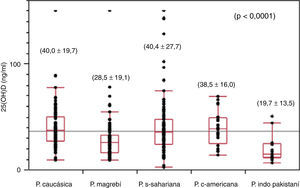
Los niveles plasmáticos de 25(OH)D para el conjunto de la población presentan un valor medio de 35,8±22,9ng/ml (límites: 2,0-150,0). Existen diferencias estadísticamente significativas (p<0,0001) entre los diferentes grupos étnicos, siendo la población de origen caucásico (40,0±19,7ng/ml) y la subsahariana (40,4±27,7ng/ml) las que presentan los valores medios más elevados, seguidas de la población centroamericana (38,5±16,0ng/ml), mientras que la población magrebí (28,5±19,1ng/ml) y la población de origen indopakistaní (19,7±13,5ng/ml) son las que presentan los valores mínimos (fig. 1). El 24,5% de la población total presenta niveles de 25(OH)D en rango deficitario (< 20ng/ml), observándose diferencias estadísticamente significativas (p<0,0001) con relación al origen racial (caucásicos: 8,2%; subsahariana: 17,8%; centroamericana: 20%; magrebí: 34,4%, e india 64,2%). Un niño de origen subsahariano presenta un valor de 25(OH)D de 3,7ng/ml y criterios bioquímicos de raquitismo clásico (PTH: 407pg/ml, fosfatasa alcalina: 1.204 U/l, calcemia: 9,3mg/dl y fosforemia: 2,3mg/dl), 5 niños de origen magrebí, 2 niños de origen indopakistaní y uno de origen caucásico presentan concentraciones plasmáticas deficitarias de vitamina D severa (< 10ng/ml) sin características bioquímicas de raquitismo, presentando tan solo 3 pacientes elevaciones moderadas de la PTH y de la fosfatasa alcalina sérica. El 68,7% de las muestras se han obtenido en las épocas de invierno y primavera, que son consideradas las épocas de menor exposición solar, y el 31,3% restante se ha recogido en el período de verano y otoño. No se han observado diferencias estadísticamente significativas en las concentraciones plasmáticas de 25(OH)D entre las muestras recogidas en los 2 períodos mencionados anteriormente. Solo cabe destacar que en todos los déficits graves de suficiencia en vitamina D la extracción de sangre se realizó en la estación de invierno o primavera.
Las concentraciones plasmáticas de PTH para la población total presentan una media de 31,7±26,5pg/ml (límites: 7,8-407,4pg/ml). Existen diferencias estadísticamente significativas (p<0,05) entre los grupos étnicos, siendo las poblaciones caucásica (27,3±10,8pg/ml) y la centroamericana (29,9±13,5pg/ml) las que presentan unos valores medios inferiores, seguidas de la población magrebí (33,0±16,0pg/ml) y la subsahariana (33,6±41,4pg/ml), mientras que la población de origen indopakistaní (39,3±18,2ng/ml) es la que presenta los valores más elevados. Se ha observado una correlación negativa y estadísticamente significativa entre las concentraciones plasmáticas de 25(OH)D y PTH (r2 ajustada=−0,19; p=0,001).
Las concentraciones plasmáticas medias de calcio (mg/dl), fósforo (mg/dl) y fosfatasas alcalinas (U/l) están comprendidas dentro del rango de la normalidad, no muestran diferencias estadísticamente significativas entre los grupos étnicos evaluados y no han sido de utilidad para identificar a los pacientes con hipovitaminosis D.
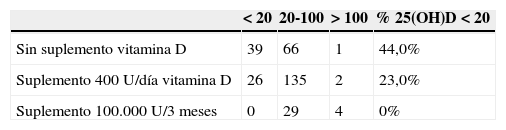
Con relación a la suplementación con vitamina D, se ha recogido la recomendación efectuada por los pediatras durante el primer año de vida. El 64% de la población ha recibido profilaxis con vitamina D3 por vía oral (400 U/día) y con la siguiente distribución por etnias: población de origen caucásico 92%, población centroamericana 85%, población magrebí 69%, población indopakistaní 29%, y subsahariana 5%. El 32% de los niños de origen subsahariano recibieron una dosis masiva por vía oral de 100.000 U cada 3 meses también a lo largo del primer año de vida, con objeto de asegurar su cumplimiento. El porcentaje de niños con concentraciones plasmáticas de 25(OH)D<20ng/ml es significativamente más elevada (chi al cuadrado p<0,0001) en los niños que no han recibido suplementación (44%) con relación a los que han recibido suplemento de vitamina D de 400 U/día (23%), mientras se constata que ninguno de los niños que recibieron dosis masivas vía oral de 100.000 U cada 3 meses presentan déficit de vitamina D en el momento de ser evaluado, aunque 4 niños presentan concentraciones elevadas de 25(OH)D (< 150ng/ml) sin que se haya constatado la existencia de hipercalcemia en el momento de ser evaluados (tabla 3).
Categorización y distribución de los niños con relación al suplemento de vitamina D recibido y las concentraciones plasmáticas de 25(OH) (ng/ml)
| < 20 | 20-100 | > 100 | % 25(OH)D<20 | |
|---|---|---|---|---|
| Sin suplemento vitamina D | 39 | 66 | 1 | 44,0% |
| Suplemento 400 U/día vitamina D | 26 | 135 | 2 | 23,0% |
| Suplemento 100.000 U/3 meses | 0 | 29 | 4 | 0% |
p<0,0001.
Finalmente, el análisis de regresión múltiple entre las concentraciones plasmáticas de 25(OH)D y los diferentes parámetros clínicos y bioquímicos implicados en el metabolismo fosfocálcico muestra que el 43,9% (r2 ajustada=0,439; p<0,0001) de este parámetro puede ser explicado por el aporte de vitamina D (p<0,0001), el índice de exposición solar (p=0,0004), por la ingesta diaria de calcio (p=0,0005), por los niveles de PTH (p=0,006) y por la edad en el momento de efectuar la exploración (p=0,02).
DiscusiónLa determinación de la concentración plasmática de 25(OH)D proporciona la mejor medida del estado de reserva de la vitamina D y, por tanto, debe ser el ensayo preferible para su evaluación. Este consenso se basa en los siguientes hechos: a) tanto la vitamina D ingerida como la producida en la piel se convierte, casi totalmente, en 25(OH)D en el hígado, aunque solo una parte de esta es transformada a su metabolito activo. Por lo tanto, la 25(OH)D refleja tanto la ingesta dietética como la producción endógena a través de la piel; b) la producción de 25(OH)D no está regulada de forma significativa y depende, fundamentalmente, de la disponibilidad de vitamina D, y c) la vida media de la 25(OH)D es de 3-4 semanas, siendo un metabolito estable y el mayoritario en suero. No obstante, hay que tener presente que la evaluación del estado de vitamina D mediante la determinación de 25(OH)D proporciona una medida del aporte y no de la función de la vitamina D. Sin embargo, existe controversia sobre las concentraciones séricas de 25(OH)D que se asocian a déficit (riesgo para desarrollar raquitismo), salud ósea adecuada o estado de salud óptimo y los niveles de corte no se han desarrollado por un proceso de consenso específico. Muchas publicaciones recientes consideran el nivel de 30ng/ml como punto de corte para establecer nivel suficiente, y valores entre 21 y 29ng/ml de 25(OH)D como déficit relativo8. Sin embargo, en el año 2011, y tras la revisión de la literatura científica disponible, el Instituto de Medicina de EE. UU. (IOM) concluye que las concentraciones plasmáticas de 25(OH)D de 20ng/ml cubrirían los requerimientos del 97,5% de la población y este nivel de corte de 20ng/ml sería el valor útil para los profesionales sanitarios en el manejo de los pacientes en la práctica clínica24-29.
En España, el déficit grave de vitamina D o el raquitismo carencial en la población autóctona infantil es excepcional; sin embargo, datos clínicos y epidemiológicos ponen de manifiesto el resurgir de esta enfermedad pero con unas características muy bien definidas. En un estudio previo y en el que se analizaron las características clínicas y epidemiológicas de 62 lactantes y niños diagnosticados de raquitismo carencial, observamos que este incide especialmente en lactantes de edades comprendidas entre los 3 y los 12 meses de vida, de piel negra o oscura y que siguen una dieta escasamente diversificada a partir de los 6 meses de vida y basada fundamentalmente en el consumo de leche materna. Los lactantes de menor edad son los que presentaron una clínica de mayor gravedad, siendo asistidos en los hospitales por presentar crisis de tetania y convulsiones hipocalcémicas, mientras que las deformidades óseas y esqueléticas son más evidentes cuando el niño ya ha iniciado la deambulación20.
El municipio de Salt (Girona), al cual pertenece el Centro de Asistencia Primaria en el que se ha efectuado el estudio, acoge a una población de origen inmigrante que supone el 38% del total de la población y que procede de 71 países distintos. Fundamentalmente, recibe extranjeros de Marruecos, África subsahariana, América Central y la India. En el momento de iniciar el estudio, se contabilizan en esta localidad 6.643 niños menores de 15 años, de los cuales 1.586 tenían menos de 2 años de edad. Nuestro estudio pone de manifiesto que el estado nutricional de la población infantil autóctona y de la población inmigrante menores de 6 años de edad que residen en el mismo municipio es similar, sin mostrar diferencias estadísticamente significativas y sin haberse detectado estados de desnutrición. La evaluación nutricional de la ingesta diaria de calcio para los diferentes grupos étnicos evaluados pone de manifiesto que su aporte está dentro del rango de aportes recomendados para esta época de la vida, mientras que el aporte nutricional de vitamina D mediante la dieta y exposición solar es especialmente deficitaria en las poblaciones inmigrantes.
Con relación al estado de reserva de vitamina D evaluado mediante el estudio de las concentraciones plasmáticas de vitamina D, el 24,5% de la población analizada presenta concentraciones plasmáticas en rango deficitario, es decir, inferiores a 20ng/dl, incidiendo especialmente en los niños de origen indopakistaní (64%), magrebí (34,5%) y subsaharianos (18%), mientras que solo el 8% de los niños de raza blanca presentan déficit de vitamina D. Tenemos que destacar que el 2,9% de la población estudiada presenta déficit grave de vitamina D (< 10ng/dl), de los que un niño de origen subsahariano presenta criterios de raquitismo bioquímico clásico y 5 niños de origen magrebí, 2 de origen indopakistaní y uno de origen caucásico presentan concentraciones plasmáticas de deficiencia de vitamina D grave, sin presentar características bioquímicas de raquitismo carencial.
La ausencia de manifestaciones clínicas y de alteraciones de los parámetros bioquímicos del metabolismo fosfocálcico en los lactantes y niños con deficiencia grave de vitamina D nos lleva a considerar la existencia de mecanismos de adaptación al déficit de vitamina D en estas poblaciones, pudiendo tener un papel relevante el aporte adecuado-elevado de calcio que reciben estas poblaciones y una posible activación de mecanismos de regulación intestinal local no dependientes de la vitamina D (calcistato intestinal) o de la PTH a nivel renal.
Entre los factores que pudieran contribuir a esta mayor y significativa prevalencia de hipovitaminosis D en las poblaciones infantiles inmigrantes con relación a la población autóctona, estimamos que el uso habitual de indumentarias tradicionales que cubren la mayor parte del cuerpo, un estilo de vida social que transcurre fundamentalmente en el interior de las viviendas y con escasa actividad al aire libre, y el fomento de la lactancia materna, que suele ser exclusiva y muy prolongada sin una adecuada suplementación de vitamina D, son los principales factores responsables17-19.
Nuestro estudio recoge la pauta de suplementación con vitamina D aconsejada o efectuada por los pediatras responsables de la salud de estos niños durante el primer año de vida y pone de relieve su eficacia con objeto de conseguir unas concentraciones plasmáticas de 25(OH)D adecuadas en una elevada proporción de los niños que las efectúan, especialmente cuando se administran dosis masivas de vitamina D, aunque debe tenerse en cuenta que puede provocar situaciones de hipervitaminosis D subclínica. De todas formas, creemos que, antes de generalizar y recomendar estas actuaciones, sería conveniente llevar a cabo en nuestro país definitivamente estudios controlados y aleatorizados que permitan definir si es preciso y bajo qué condiciones (estación, latitud, origen racial, fototipo cutáneo y práctica de lactancia materna exclusiva) efectuar una suplementación sistemática con vitamina D durante la infancia9,20,30-32.
En resumen, nuestro estudio pone de relieve que el 22,5% de los niños menores de 6 años de edad presentan concentraciones plasmáticas en rango deficitario de vitamina D, siendo más prevalente en los niños de origen indopakistaní y magrebí no sujetos a suplementación con vitamina D. Estimamos recomendable efectuar un estudio sistemático del metabolismo fosfocálcico y determinar especialmente las concentraciones plasmáticas de PTH y de 25(OH)D en los lactantes y niños inmigrantes de piel oscura que siguen lactancia materna exclusiva no suplementada con vitamina D.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.