En la actualidad, las alteraciones del neurodesarrollo son la complicación más frecuente en los pacientes con cardiopatía congénita (CC) en edad escolar. Analizamos la incidencia de eventos neurológicos agudos (ENA) en pacientes con CC sometidos a cirugía cardiaca y la utilidad de los neuromarcadores para predecir el neurodesarrollo.
MétodosEstudio prospectivo observacional en recién nacidos (RN) con CC diagnosticada prenatalmente, y sometidos a cirugía el primer año de vida. Se evaluaron: 1) biomarcadores sanguíneos de lesión cerebral (S100B, enolasa neuronal específica) en sangre de cordón y periquirúrgicos; 2) datos clínicos y analíticos perinatales y periquirúrgicos; 3) tratamientos y complicaciones, y 4) neurodesarrollo (escala de Bayley III) a los 2 años.
ResultadosSe incluyeron 84 RN con CC de diagnóstico fetal, confirmada posnatalmente, sometidos a cirugía cardiaca en el primer año de vida. Diecisiete pacientes tenían corazón univentricular, 20 pacientes obstrucción izquierda y 10 síndromes genéticos. Fallecieron en el periodo posquirúrgico 5 pacientes (5,9%) y 9 pacientes presentaron ENA (10,7%). Las puntuaciones medias en el test de Bayley III fueron normales, pero el 31% tuvieron alteración cognitiva, motora o en el lenguaje. Los pacientes con síndromes genéticos, ENA y CC univentriculares tuvieron peor neurodesarrollo. La elevación de S100B en el postoperatorio inmediato se correlacionó con peores puntuaciones.
ConclusionesLos pacientes con CC sometidos a cirugía tienen mayor riesgo de sufrir alteraciones del neurodesarrollo. Los pacientes con síndromes genéticos o corazones univentriculares presentan peores resultados. Presentar ENA posquirúrgico puede contribuir a peores resultados. Niveles de S100B elevados en el postoperatorio se correlacionan con peores resultados en los test de neurodesarrollo a los 2 años. Series con más pacientes y con seguimiento a largo plazo nos ayudarán a definir el papel de estos biomarcadores de lesión cerebral en la predicción del neurodesarrollo en pacientes sometidos a cirugía de CC.
At present, neurodevelopmental abnormalities are the most frequent type of complication in school-aged children with congenital heart disease (CHD). We analysed the incidence of acute neurologic events (ANEs) in patients with operated CHD and the usefulness of neuromarkers for the prediction of neurodevelopment outcomes.
MethodsProspective observational study in infants with a prenatal diagnosis of CHD who underwent cardiac surgery in the first year of life. We assessed the following variables: (1) serum biomarkers of brain injury (S100B, neuron-specific enolase) in cord blood and preoperative blood samples; (2) clinical and laboratory data from the immediate postnatal and perioperative periods; (3) treatments and complications; (4) neurodevelopment (Bayley-III scale) at age 2 years.
ResultsThe study included 84 infants with a prenatal diagnosis of CHD who underwent cardiac surgery in the first year of life. Seventeen had univentricular heart, 20 left ventricular outflow obstruction and 10 genetic syndromes. The postoperative mortality was 5.9% (5/84) and 10.7% (9/84) patients experienced ANEs. The mean overall Bayley-III scores were within the normal range, but 31% of patients had abnormal scores in the cognitive, motor or language domains. Patients with genetic syndromes, ANEs and univentricular heart had poorer neurodevelopmental outcomes. Elevation of S100B in the immediate postoperative period was associated with poorer scores.
ConclusionsChildren with a history of cardiac surgery for CHD in the first year of life are at risk of adverse neurodevelopmental outcomes. Patients with genetic syndromes, ANEs or univentricular heart had poorer outcomes. Postoperative ANEs may contribute to poorer outcomes. Elevation of S100B levels in the postoperative period was associated with poorer neurodevelopmental outcomes at 2 years. Studies with larger samples and longer followups are needed to define the role of these biomarkers of brain injury in the prediction of neurodevelopmental outcomes in patients who undergo surgery for management of CHD.
La mortalidad en cardiopatía congénita (CC) ha disminuido en las últimas décadas. Más del 85% de estos pacientes alcanzan la edad adulta. Este aumento de la supervivencia ha puesto de manifiesto comorbilidades que impactan de forma negativa en su calidad de vida1. Las alteraciones del neurodesarrollo se han convertido en la comorbilidad más frecuente en pacientes con CC en edad escolar2. Los eventos neurológicos agudos (ENA) o complicaciones neurológicas se han identificado como una de las comorbilidades más temidas en pacientes con CC, pero no está bien identificado su papel pronóstico en el neurodesarrollo a largo plazo3.
Las alteraciones en el neurodesarrollo responden a etiología multifactorial con factores prenatales, neonatales y perioperatorios contribuyendo al pronóstico neurológico final4–6. En las últimas décadas se han estudiado diversas herramientas con el fin de determinar precozmente el mal pronóstico neurológico, entre ellas el estudio de biomarcadores de daño cerebral en relación a eventos neurológicos y a alteraciones neurológicas a largo plazo7,8.
Presentamos los resultados de nuestro estudio diseñado para identificar los factores de riesgo de las alteraciones del neurodesarrollo en los recién nacidos (RN) con CC y sometidos a cirugía cardiaca. Los objetivos de este estudio son: a) evaluar la incidencia de los ENA en los pacientes con CC compleja y sometidos a cirugía cardiaca, b) evaluar el neurodesarrollo a los 2 años de vida de una cohorte de niñas y niños con CC compleja sometidos a cirugía cardiaca y c) analizar la utilidad de biomarcadores de daño cerebral medidos durante el periodo perioperatorio de cirugía cardiaca para predecir la aparición de los ENA en el postoperatorio y el mal pronóstico en el neurodesarrollo.
Pacientes y métodosSe trata de un estudio prospectivo observacional en el que se incluyeron a RN con CC diagnosticada durante el periodo fetal y sometidos a cirugía cardiaca en el primer año de vida en el Hospital Universitari Vall d’Hebrón. El periodo de reclutamiento fue de 4 años (de 2012 a 2016 para las gestantes y de 2013 a 2017 para los RN). Se excluyeron: óbitos fetales, alteraciones genéticas prenatales y RN con otras malformaciones congénitas mayores.
La cohorte estudiada está incluida en un estudio multicéntrico, en el que se reclutaron y analizaron gestantes con fetos sanos y gestantes con fetos con CC, cuya metodología de estudio ha sido previamente definida9. Se analizaron datos demográficos, variables clínicas, datos analíticos, variables relacionadas con el tratamiento, se registraron complicaciones posquirúrgicas y se midieron biomarcadores de lesión cerebral en sangre. La evaluación del neurodesarrollo se realizó a los 2 años de vida mediante un test de desarrollo neuroconductual (test de Bayley III).
Variables clínicas y demográficasSe recogieron variables clínicas y analíticas relacionadas con el periodo posnatal y periquirúrgico: género, edad gestacional, prematuridad, somatometría, percentiles y Z score de peso y perímetro craneal, tipo de corrección quirúrgica, edad a la cirugía, puntuaciones en las escalas de mortalidad quirúrgica, tiempo de circulación extracorpórea (CEC) y alteraciones genéticas de diagnóstico posnatal. En todos los casos se realizó una ecocardiografía posnatal para confirmación del diagnóstico prenatal. Los RN fueron clasificados en función de su anatomía y comportamiento fisiológico (univentricular [UV] o biventricular [UV]) y en función de si existía obstrucción al flujo sistémico (OS vs. No OS), en 4 grupos. Además, fueron clasificados según el grado de cianosis, en 3 grupos: 1) no cianosis, 2) cianosis neonatal moderada (o no TGA) y 3) cianosis correspondiente a la cianosis de la transposición de grandes arterias (TGA), tal y cómo ha sido previamente publicado por otros autores5,8,10.
Tratamientos, complicaciones y eventos neurológicos agudosSe recogieron las variables relacionadas con los cuidados postoperatorios, los tratamientos recibidos y las complicaciones posquirúrgicas, incluyendo los ENA. Se recogieron las puntuaciones de los pacientes en la escala de riesgo de mortalidad al ingreso en la UCI, la duración de la ventilación mecánica, el uso de fármacos vasoactivos, la estancia en la UCI, la estancia hospitalaria, el requerimiento de oxigenación por membrana extracorpórea (ECMO, por sus siglas en inglés) tras la cirugía, las complicaciones durante el postoperatorio y la mortalidad posquirúrgica.
Los ENA fue definido como la aparición de hemorragia intracraneal, infarto cerebral, trombosis de senos venosos, presencia de convulsiones clínicas, eléctricas o ambas, o muerte encefálica. Para el diagnóstico de los ENA se utilizaron las pruebas de diagnóstico por la imagen realizadas según el criterio del equipo clínico. No se incluyeron cambios crónicos en la definición de los ENA. Cuando estuvo disponible, se compararon con imágenes previas para verificar el momento de los hallazgos radiológicos.
Se recogieron diagnósticos de sospecha o confirmación de alteraciones genéticas posnatales y su relación descrita previamente o no con alteraciones en el neurodesarrollo.
Biomarcadores de daño cerebralSe analizaron los valores de 2 biomarcadores de lesión cerebral: proteína S100B y enolasa neuronal especifica (NSE). Se recogieron muestras sanguíneas en 4 periodos: 1) posnatal inmediato (sangre de cordón), 2) inmediatamente antes de la cirugía, 3) al ingreso en la UCI tras la cirugía y 5) a las 24h del ingreso en la UCI tras la cirugía. Las muestras se obtuvieron de un catéter central o arterial existente y se extrajo la mínima cantidad necesaria (tubo de EDTA, 0,5ml). Las muestras se procesaban separando el plasma mediante centrifugación a 1.400g/durante 10min/a 4°C. Inmediatamente después se congelaban a −80°C hasta realizar las determinaciones. Los ensayos de inmunoabsorción ligados a enzimas (ELISA) se realizaron por duplicado utilizando kits comerciales (BlueGene Biotech CO. Ltd, Shangai, China). Los valores mínimos detectables en los ensayos fueron 50pg/ml para S100B y 0,5ng/ml para NSE.
Seguimiento mediante test neuroconductualSe analizaron los resultados de los test neuroconductuales realizados a los 2 años (test de Bayley III). El test de Bayley III evalúa 5 áreas del desarrollo: cognitiva, lenguaje, motora, socioemocional y comportamiento adaptativo. Ofrece unas puntuaciones según la respuesta o comportamiento del niño que se transforman a escalas y puntuaciones compuestas que son ajustadas para la edad del paciente. Los resultados se comparan con puntuaciones normativas que van de 40 a 160 puntos, con la media en 100 puntos y una desviación estándar (DE) de 15 puntos. Los valores por debajo de 85 para cada dominio son indicadores de retraso y se clasifican en: leve (<1-2 DE), moderado (<2-3 DE) y grave (<3 DE).
Almacenamiento de los datos y análisisSe almacenaron los datos en una base de datos diseñada para el estudio. Los resultados del estudio se evaluaron y analizaron conjuntamente por el equipo investigador y miembros de la unidad de apoyo a la investigación del centro.
Las características de la muestra se describen por medio de frecuencias y porcentajes para las variables cualitativas y de medias (desviaciones típicas) y medianas (intervalo intercuartílico) para las variables cuantitativas.
Para comparar resultados de variables cualitativas se utiliza la prueba Chi-cuadrado o la prueba exacta de Fisher y para comparar las variables cuantitativas la prueba de Kruskal-Wallis. Para el estudio de correlación, se utiliza la prueba de correlación de Spearman (r). El valor de la significación estadística aceptada fue un valor de p inferior al 0,05. Se utilizó el paquete estadístico Stata® con la versión 15.1 (StataCorp. 2017. Stata Statistical Software: Release 15. College Station, TX: StataCorp LLC)
Aprobación ética y consentimiento para participarSe obtuvo la aprobación del Comité de Ética en Investigación del centro el 13 de febrero de 2014 (PR (AMI) 317/2012). Todas las gestantes incluidas dieron su consentimiento informado por escrito.
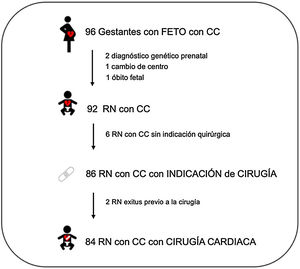
ResultadosSe incluyeron 96 gestantes con fetos con CC. Cuatro de estas gestantes fueron excluidas durante la gestación: 2 síndromes genéticos prenatales, un óbito fetal y una pérdida por cambio de centro. En los 92 RN de las gestantes incluidas se confirmó la CC posnatalmente y de estos, 86 RN tuvieron indicación quirúrgica. De estos, 2 RN fallecieron antes de realizarse la cirugía; los 84 RN que se sometieron a cirugía cardiaca en el primer año de vida fueron incluidos para el análisis (fig. 1).
Los diagnósticos de CC confirmados posnatalmente se recogen en la tabla 1. La CC más frecuente fue la transposición de grandes arterias (TGA) (29 pacientes), seguida de la coartación de aorta con o sin hipoplasia de cavidades izquierdas (17 pacientes), tetralogía de Fallot con atresia pulmonar (16 pacientes) y canal auriculoventricular (8 pacientes). La distribución de las CC en 4 grupos según la anatomía y en 3 grupos según el grado de cianosis se recoge en las tablas 2A y 2B.
Tipos de cardiopatía
| Cardiopatía | n° casos | frecuencias (%) |
|---|---|---|
| TGA | 29 | 34,5 |
| HCI-CoA | 17 | 20 |
| TF/AP | 16 | 19 |
| CAV | 8 | 9,5 |
| Otras | 14 | 17 |
AP: atresia pulmonar; CAV: canal auriculoventricular; CoA: coartación de aorta; HCI: hipoplasia de cavidades izquierdas; TGA: transposición de grandes arterias; TF: tetralogía de Fallot.
Clasificación de los pacientes según las características anatómicas y fisiológicas de su cardiopatía. Clasificación A. En función de la anatomía/fisiología de la CC y de la presencia de obstrucción del tracto de salida izquierdo
| Anatomía/Fisiología de la cardiopatía | |
|---|---|
| Univentricular (UV) | Biventricular (BV) |
| 17 (20%) | 67 (80%) |
| Obstrucción tracto salida izquierdo (OS) | |||
|---|---|---|---|
| Sí | No | Sí | No |
| 6(35%) | 11(65%) | 14(20.9%) | 53(79.1%) |
Clasificación de los pacientes según las características anatómicas y fisiológicas de su cardiopatía. Clasificación B. Fsiológica en función del grado de cianosis
| Grado de cianosis de la cardiopatía | ||
|---|---|---|
| No | Cianosis moderada | Cianosis grave (TGA) |
| 32 (38,1%) | 23 (27,4%) | 29 (34,5%) |
TGA: transposición de grandes arterias.
Los resultados globales y por grupo anatómico de cardiopatía pueden verse en la tabla 3.
Características de los pacientes por grupo anatómico de cardiopatía
| Variable | Grupo cardiopatía | Total | Valor de p | |||
|---|---|---|---|---|---|---|
| Univentricular | Biventricular | |||||
| No OS | OS | No OS | OS | |||
| Total | 11 | 6 | 53 | 14 | 84 | |
| Sexo: varón | 54,5% | 66,7% | 54,7% | 28,6% | 51,2% | 0,2995* |
| Edad gestacional (semanas) | 38 (37-39) | 38,5 (37-40) | 39 (38-40) | 39,5 (38-40) | 39 (38-40) | 0,0880** |
| Prematuridad | 0 | 0 | 9,4% | 7,1% | 7,1% | 0,8891* |
| Peso (g) | 3.250 (2.900-3.380) | 3.095 (2.780-3.650) | 2.920 (2.700-3.400) | 3.130 (2.920-3.520) | 2.997,50 (2.760-3.480) | 0,5808** |
| Perímetro craneal (cm) | 34 (33-34,5) | 33,5 (33-34) | 33,5 (33-34,5) | 34,25 (33-36) | 34 (33-34,5) | 0,3448** |
| Cirugía neonatal | 54,55% | 100% | 62,26% | 92,3% | 69,1% | 0,0502* |
| Edad a la cirugía (días) | 31 (18-182) | 9 (8-15) | 14 (7-158) | 12 (7-24) | 14 (8-130) | 0,0116** |
| Estancia en la UCI (días) | 25 (8-35) | 38,5 (23-60) | 16 (9-24) | 25 (11-38) | 19 (9-29,5) | 0,040** |
| Estancia hospitalaria (días) | 27 (23-50) | 56,5 (23-64) | 26 (17-36) | 41,5 (26-48) | 27,5 (18,5-46) | 0,2029** |
| Aristóteles | 7 (6-9) | 10,75 (6-14,5) | 10 (8-10) | 8 (8-10) | 9 (7-10) | 0,0970** |
| STAT alto (4 o más) | 63,6% | 83,3% | 22,6% | 28,6% | 33,3% | 0,0025* |
| Minutos de CEC | 46 (0-96) | 69,5 (0-137) | 141 (108-165) | 92,5 (0-143) | 129,5 (67,5-159,5) | 0,0025** |
| CEC larga (>150min) | 9,1% | 16,7% | 39,6% | 21,4% | 30,1% | 0,1624* |
| VIS máx 24h | 15 (8-19) | 61,5 (20-66) | 20 (11-32,5) | 17 (5-27) | 19 (10-32) | 0,0102** |
| Vis máx 24h alto (>20) | 18,2% | 66,67% | 49,1% | 28,6% | 42,9% | 0,1086* |
| PRISM III 24h | 9,5 (5-11) | 12 (3-22) | 10 (7-14) | 7 (4-16) | 10 (7-14) | 0,4169** |
| PRISM III 24h alto (>20) | 0% | 33,3% | 1,9% | 0% | 3,6% | 0,0338* |
| Ventilación mecánica (días) | 2 (1-4) | 6 (2-12) | 3 (2-4) | 3 (2-5) | 3 (2-5) | 0,3893** |
| Diagnóstico genético confirmado/sospecha | 36,4% | 0 | 7,6% | 14,3% | 12% | 0,0640* |
Variables cualitativas expresadas en frecuencias; variables cuantitativas en mediana, con el rango intercuartílico entre paréntesis (P25; P75).
CEC: circulación extracorpórea; OS: obstrucción sistémica; UCI: unidad de cuidados intensivos; VIS: escala de vasoactivos inotrópicos.
Seis pacientes nacieron pretérmino (se corresponde con un 7,1% del total) y todos presentaban anatomía biventricular. No hubo diferencias en la distribución de sexos, edad gestacional media, peso ni perímetro craneal cuando se clasificaron a los pacientes por anatomía. La mayoría de los pacientes (69,1%) fueron operados en los primeros 28 días de vida.
Los pacientes con anatomía univentricular tuvieron mayor necesidad de soporte vasoactivo, más requerimiento de ECMO posquirúrgica (11,8 vs. 0%) y mayor mortalidad (29 vs. 0%); el grupo univentricular con OS obtuvo significación estadística para mayor estancia en la UCI (38,5 días [23-60] vs. 19 días [9-29,5]; p=0,04), mayor necesidad de soporte vasoactivo (VIS máximo 61,5 [20-66] vs. 19 [10-32]; p=0,01), más requerimiento de ECMO posquirúrgica (16,7 vs. 2,4%; p 0,04) y mayor mortalidad (66,67 vs. 5,95%; p<0,01) (tabla 2). Diez pacientes (12% del total de pacientes) presentaron diagnóstico de síndrome genético posnatal o una alta sospecha en espera de confirmación.
Complicaciones y eventos neurológicos agudosLas complicaciones generales, así como los ENA, de todos los pacientes de la cohorte y por grupo anatómico de cardiopatía diagnosticadas se presentan en las tablas 4 y 5, respectivamente. No hubo diferencias entre grupos para las variables estudiadas a excepción del uso de insulina por hiperglucemia que fue más frecuente en el grupo BV no OS.
Complicaciones generales tras la cirugía (no neurológicas)
| Complicaciones generales | Grupo cardiopatía | Total | Valor de p | |||
|---|---|---|---|---|---|---|
| UV No OS | UV OS | BV No OS | BV OS | |||
| Total incluidos | 11 | 6 | 53 | 14 | 84 | |
| Arritmia | 36,4% | 50% | 54,7% | 42,9% | 50% | 0,6710* |
| Marcapasos definitivo | 9,1% | 0 | 1,9% | 7,1% | 3,6% | 0,3987* |
| Síndrome de abstinencia | 45,4% | 50% | 45,3% | 50% | 46,4% | 0,9815* |
| Parálisis diafragmática | 0 | 0 | 11,3% | 0 | 7,2% | 0,5577* |
| Hiperglucemia que requiere insulina | 18,2% | 33,3% | 79,3% | 35,7% | 60,7% | <0,0001* |
| Paro cardiorrespiratorio recuperado | 0 | 33,3% | 7,6% | 0 | 7,1% | 0,0950* |
| VAD/ECMO | 9,1% | 16,7% | 0% | 0% | 2,4% | 0,0390* |
| Exitus posquirúrgico | 9,09% | 66,67% | 0% | 0% | 5,95% | 0,0001* |
Variables cualitativas expresadas en frecuencias.
BV: biventricular; OS: obstrucción sistémica; VAD: ventricular assist device (dispositivo de asistencia ventricular)/ECMO: oxigenación por membrana extracorpórea; UV: univentricular.
Eventos neurológicos agudos y epilepsia: resultados totales y por grupo anatómico de cardiopatía
| Complicaciones | Grupo cardiopatía | Total | Valor de p | |||
|---|---|---|---|---|---|---|
| UV No OS | UV OS | BV No OS | BV OS | |||
| ENA | 9,1% | 16,7% | 13,2% | 14,3% | 15,4% | 0,8231* |
| Tipo de ENA | ||||||
| Infarto arterial | 0 | 0 | 3,8% (2) | 14,3% (2) | 4,8% | 0,6368* |
| Infarto SG central aislado | 0 | 0 | 3,8% (2) | 0 | 2,4% | |
| Trombosis venosa | 0 | 0 | 1,9% (1) | 0 | 1,2% | |
| Hemorragia | 9,1% (1) | 0 | 0 | 0 | 1,2% | |
| Muerte encefálica | 0 | 16,7% (1) | 0 | 0 | 1,2% | |
| Crisis comicial | 9,1% (1) | 0 | 3,8% (2) | 7,1% (1) | 4,8% | |
| ENA (excluye convulsión) | 9,1% | 16,7% | 9,3% | 14,3% | 12% | 0,6368* |
| Tiempo evento si lesióna | ||||||
| Antes de la cirugía | 0 | 0 | 7,1% (1) | 1,2% | <0,001* | |
| Después de la cirugía | 100% (1) | 100% (1) | 100% (5) | 92,3% (1) | 98,8% | |
| Epilepsia/FAE tras la cirugía (5) | 0 | 0 | 5,7% (4) | 7,1% (1) | 6% | 0,8672* |
Variables cualitativas expresadas en frecuencias (número total entre paréntesis).
BV: biventricular; FAE: requerimiento de fármacos antiepilépticos; ENA: eventos neurológicos agudos; OS: obstrucción sistémica; UV: univentricular.
La mortalidad posquirúrgica fue del 5,9%, que corresponde a 5 pacientes, todos pertenecientes al grupo UV y 4/5 tenían formas anatómicas de OS.
En cuanto a las complicaciones neurológicas detectadas en la cohorte de pacientes, se diagnosticaron 13 ENA. Dos de los 13 eventos fueron diagnosticados durante el periodo prequirúrgico en 2 pacientes distintos.
Se diagnosticaron 11 ENA postoperatorios en 9 pacientes: 5 infartos isquémicos, 3 episodios de convulsión, una trombosis de senos venosos, una hemorragia extraaxial grave y una encefalopatía hipóxico/isquémica severa con muerte encefálica). De los 9 pacientes con ENA postoperatorio (10,7%), 6 tuvieron cirugía en el periodo neonatal (9,5 días [7,5-12,5]) y uno a los 36 días.
No hubo diferencias en la aparición de los ENA para los diversos grupos anatómicos; en cambio, la aparición de los ENA posquirúrgico fue más frecuente en el grupo de cianosis moderada (26,1 vs. 10,7%; p=0,04). Fallecieron 2 pacientes con ENA.
Durante el seguimiento, 5 pacientes requirieron fármacos antiepilépticos, 3 sufrieron infarto isquémico postoperatorio; otro paciente se diagnosticó de síndrome genético caracterizado por cardiopatía, epilepsia y retraso del neurodesarrollo. Los 5 pacientes tenían anatomía BV.
Los pacientes que requirieron ECMO posquirúrgica tuvieron una mayor incidencia de ENA que el resto (100 vs. 9,76%; p=0,01) y los 2 pacientes fallecieron.
De los pacientes que sufrieron una parada cardiorrespiratoria recuperada en el postoperatorio (n=6), 3 sufrieron ENA y uno de ellos fallece como consecuencia de la complicación neurológica.
Los pacientes del grupo de cianosis no TGA, aquellos que requirieron ECMO postoperatoria y los que sufrieron una PCR en el postoperatorio inmediato tuvieron mayor incidencia de ENA. No observamos diferencias significativas en base a edad gestacional, peso o perímetro craneal, STAT alto, minutos de CEC, VIS máximo a las 24h, puntuaciones de escala PRISM III u otras variables.
Biomarcadores de daño cerebralEn el análisis de ambos biomarcadores, se detectaron niveles presentes en las muestras de sangre de cordón (S100B: 48,27 [16,89-171,12]; NSE: 0,46 [0,42-0,53]). S100B aumentó respecto a los valores preoperatorios en el postoperatorio, con valores superiores en el postoperatorio inmediato y tendencia a disminuir a las 24h (136,19 [72,68-211,14] vs. 169,90 [67,5-284,07] vs. 162,75 [62,12-278,10]; p≤0,01). NSE no aumentó en el postoperatorio respecto a precirugía (0,88 [0,73-1,06] vs. 0.86 [0,70-0,98] vs. 0,62 [0,54-0,86]; p=0,241).
Los resultados de los biomarcadores en los diferentes tiempos y por grupos de cardiopatía se muestran en la tabla 6. S100B aumentó de manera significativa en el postoperatorio inmediato de los pacientes con OS (tanto BV como UV). Para el resto de tiempos periquirúrgicos y grupos de cardiopatía no hubo diferencias significativas.
Biomarcadores según momento de obtención y según tipo de cardiopatía
| Marcadores | Grupo de cardiopatía (anatomía) | Total | Valor de p | |
|---|---|---|---|---|
| Univentricular | Biventricular | |||
| S100B PRE | 175,11 (45,05-211,14) | 128,60 (76,81-224,67) | 136,19 (72,68-211,14) | 0,8692** |
| S100B POST1 | 217,05 (37,81-284,07) | 164,54 (67,50-298,36) | 169,90 (67,50-284,07) | 0,9193** |
| S100B POST2 | 172,78 (7,17;248,70) | 162,01 (62,12-350,13) | 162,75 (62,12-278,10) | 0,5995** |
| NSE PRE | 0,93 (0,83-0,97) | 0,86 (0,73-1,06) | 0,88 (0,73-1,06) | 0,5854** |
| NSE POST1 | 0,83 (0,70-0,95) | 0,88 (0,69-0,99) | 0,86 (0,70-0,98) | 0,6384** |
| NSE POST2 | 0,68 (0,56-0,91) | 0,62 (0,50-0,83) | 0,62 (0,54-0,86) | 0,3246** |
| Marcadores | UV No OS | UV OS | BV No OS | BV OS | Total | Valor de p |
|---|---|---|---|---|---|---|
| S100B PRE | 128,76 (9,57-211,14) | 196,80 (118,92-247,53) | 130,19 (85,38-210,97) | 127,02 (63,81-257,87) | 136,19 (72,68-211,14) | 0,8311* |
| S100B POST1 | 73,55 (6,71-217,05) | 284,07 (258,11-341,29) | 131,06 (54,77-245,17) | 207,08 (138,29-406,03) | 169,9 (67,50-284,07) | 0,0537** |
| S100B POST2 | 68,54 (4,53-154,53) | 248,7 (196,0-296,72) | 161,34 (62,12-275,54) | 214,55 (113,06-395,99) | 162,75 (62,12-278,10) | 0,0996* |
| NSE PRE | 0,88 (0,72-0,95) | 0,95 (0,89-1,06) | 0,84 (0,73-1,08) | 0,90 (0,77-1,02) | 0,88 (0,73-1,06) | 0,8231* |
| NSE POST1 | 0,81 (0,70-0,95) | 0,84 (0,76-0,86) | 0,88 (0,69-1,06) | 0,87 (0,66-0,95) | 0,86 (0,70-0,98) | 0,7784** |
| NSE POST2 | 0,71 (0,54-0,90) | 0,68 (0,59-0,91) | 0,61 (0,51-0,82) | 0,62 (0,42-0,87) | 0,62 (0,54-0,86) | 0,7915** |
| Marcadores | Grupo de cardiopatía (grado de cianosis) | Total | Valor de p | ||
|---|---|---|---|---|---|
| No cianosis | Cianosis moderada | Cianosis TGA | |||
| S100B PRE | 151,12 (80,95-248,08) | 130,19 (45,05-238,36) | 104,03 (72,45-189,77) | 136,19 (72,68-211,14) | 0,6783* |
| S100B POST1 | 87,60 (40,49-217,05) | 231,64 (37,81-353,51) | 164,54 (105,64-298,36) | 169,90 (67,50-284,07) | 0,4274* |
| S100B POST2 | 154,53 (22,32-266,06) | 184,39 (6,04-320,92) | 162,01 (107,05-264,04) | 162,75 (62,12-278,10) | 0,8446* |
| NSE PRE | 0,86 (0,64-1,02) | 0,93 (0,83-1,09) | 0,84 (0,73-1,06) | 0,88 (0,73-1,06) | 0,4432* |
| NSE POST1 | 0,74 (0,61-0,94) | 0,84 (0,75-0,99) | 0,90 (0,78-1,06) | 0,86 (0,70-0,98) | 0,0729* |
| NSE POST2 | 0,56 (0,40-0,71) | 0,65 (0,55-0,92) | 0,65 (0,58-0,84) | 0,62 (0,54-0,86) | 0,0772* |
Mediana y rango intercuartílico entre paréntesis (P25; P75).
PRE: inmediatamente antes de la cirugía; POST1: inmediatamente al acabar la cirugía; POST2: a las 24 h del ingreso en UCI tras la cirugía.
Los niveles de S100B fueron más altos en el postoperatorio inmediato de los pacientes que tuvieron ENA tras la cirugía en comparación al resto (284,07 [167,74-483,50] vs. 164,54 [67,50-273,01]; p=0,20), pero sin significación estadística; los niveles de NSE fueron similares entre ENA y el resto (0,75 [0,75-0,76]) vs. 0,87 [0,70-0,98]; p=0,578).
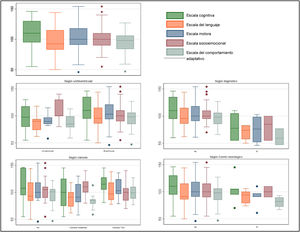
Seguimiento a largo plazoCinco de los 84 pacientes fallecieron durante el seguimiento y de otros 5 se perdió el seguimiento. De los 74 pacientes restantes, se pudo realizar el test de Bayley III a los 2 años a 55 pacientes (74%). Las medianas de puntuaciones en los 5 dominios estuvieron dentro de la normalidad (85-115) (fig. 2).
Treinta y ocho pacientes tuvieron puntuaciones normales (≥85) en los dominios cognitivo, motor y del lenguaje; 30 obtuvieron puntuaciones normales en todos los dominios del test. De los pacientes con algún dominio alterado, 16 tuvieron solo uno de los 5 con puntuaciones bajas. Encontramos dos o más dominios por debajo de la normalidad en 9 pacientes. De los 6 pacientes que tuvieron 3 o más dominios alterados, 4 tuvieron algún grado de cianosis neonatal, 2 eran UV y el que obtuvo los 5 dominios alterados era un paciente con síndrome genético que se asociaba a alteraciones en el neurodesarrollo.
Obtuvimos un total de 260 puntuaciones de los dominios evaluados en los 55 pacientes (todos los pacientes tuvieron al menos 3 dominios evaluados con un máximo de 5 posibles); en 43 de las 260 evaluaciones las puntuaciones obtenidas estuvieron por debajo de la normalidad: 27 se correspondían con retraso leve, 13 con retraso moderado y 3 con retraso grave.
Los pacientes con anatomía UV presentaron peores puntuaciones en los dominios cognitivo, motor, lenguaje y comportamiento adaptativo con significación estadística para los valores obtenidos en la valoración motora (89,5 [85-97] vs. 103 [94-121]; p=0,02).
No se observaron diferencias significativas cuando se estudiaron las puntuaciones de los pacientes según el grado de cianosis (gráfico 1).
Los pacientes con ENA obtuvieron puntuaciones por debajo de la normalidad en al menos un dominio del test de Bayley III (2 lo hicieron en 3 o más) aunque estas diferencias no fueron estadísticamente significativas: cognitivo (95 [81-105] vs. 110 [95-130]; p=0,5; lenguaje (79 [78-94] vs. 91 [86-115]; p=0,5); motor (91 [85-91] vs. 100 [91-118]; p=0,13); socioemocional (100 [90-110] vs. 100 [90-115]; p=0,8) y comportamiento adaptativo (82 [75-25; 89,25] vs. 98 [85-106]; p=0,07), expresado en el gráfico 1.
Los pacientes con diagnóstico de epilepsia presentaron puntuaciones significativamente más bajas en la valoración motora (100 [91-118] vs. 53,5 [46-61]; p=0,02).
Los pacientes que sobrevivieron a un episodio de parada cardiocirculatoria posquirúrgica obtuvieron puntuaciones más bajas que el resto en cuatro de los 5 dominios: cognitivo (82,5 [67,5-101,25] vs. 110 [97,5-1.032,25]; p≤0,01), lenguaje (82,5 [77,75-88] vs. 95,5 [86-115]; p≤0,01); motor (89,5 [81,25-100] vs. 100 [92,5-118]; p≤0,01) y comportamiento adaptativo (76,5 [71,75-81,25] vs. 98 [85-106]; p≤0,01).
Los pacientes con diagnóstico genético confirmado o sospecha presentaron puntuaciones inferiores en todos los dominios con significación estadística en el lenguaje, la motricidad y en el comportamiento adaptativo. Las puntuaciones obtenidas fueron las siguientes en comparación a los pacientes sin diagnóstico genético: lenguaje: 74 [57,5-83] vs. 92,5 [83-115]; p=0,006; motricidad: 76 [52-98,6] vs. 100 [91-118]; p=0,0057); comportamiento adaptativo 59 [47-77] vs. 98 [84-106]; p=0,007; cognitivo 77,5 [55-105] vs. 110 [95-130]; p=0,051 y socioemocional 85 [55-100] vs. 100 [90-110]; p=0,069.
Excluyendo del análisis a los pacientes con síndrome genético, 21 obtuvieron puntuaciones inferiores a 85 en alguno de los dominios, 15 un dominio afectado, 2 dos dominios y 4 tres dominios. Nueve pacientes presentaban retraso del lenguaje (7 leve, 2 moderado), 9 del comportamiento adaptativo (5 leve, 4 moderado), 5 cognitivo (todos leve), 4 socioemocional (todos leve) y 3 motor (2 leve, uno moderado).
Realizamos el estudio de correlación entre los valores obtenidos para los biomarcadores de daño cerebral en cada uno de los tiempos y las puntuaciones que tuvieron los pacientes en los diversos dominios del test de Bayley III. Encontramos correlación entre valores más altos S100B en el postoperatorio inmediato y peores puntuaciones en las valoraciones cognitiva (r=0,336 [0,023-0,589]; p=0,036), lenguaje (r=0,337 [0,020-0,593]; p=0,038) y motora (r=0,424 [0,125-0,652]; p≤0,01). No encontramos correlación entre los valores de NSE en los diversos tiempos periquirúrgicos y los resultados en los dominios del test de Bayley III.
Detectamos, por tanto, peores puntuaciones en el test de Bayley III en los pacientes que presentaban ENA en el postoperatorio, sin que las diferencias entre estas y las puntuaciones de los pacientes sin ENA alcanzasen valores significativos. En nuestra cohorte, obtuvimos peores puntuaciones en el test de Bayley III en aquellos pacientes con CC sometidos a cirugía cardiaca en el primer año de vida que tenían anatomía univentricular, aquellos en los que se identificaron alteraciones genéticas, los que sufrieron un episodio de PCR recuperada en el postoperatorio y aquellos con valores más elevados de S100B en el postoperatorio inmediato.
DiscusiónEn nuestra cohorte de RN con CC sometidos a cirugía cardiaca y seguidos desde el periodo fetal, encontramos que, a los 2 años de vida, más de la mitad de los pacientes evaluados presentan un neurodesarrollo global dentro de la normalidad, resultados similares a lo publicado en la literatura reciente11–14. No obstante, un 45,4% de los pacientes obtuvieron puntuaciones <85 en alguna de los 5 dominios del test de Bayley III y un 31% en los dominios cognitivo, lenguaje o motor. Un 34,5% del total presentó alteraciones en uno o 2 dominios del neurodesarrollo y un 10,9% en 3 o más dominios.
Se calcula que un 30-50% de pacientes con CC complejas padecen alteraciones del neurodesarrollo que van desde alteraciones neurocognitivas leves hasta déficits graves en las funciones ejecutivas2,8,15. En la actualidad, las dificultades en el aprendizaje son el problema de salud más prevalente en pacientes con CC en edad escolar2,11,16–19.
En nuestra cohorte, todos los pacientes que fallecieron en el postoperatorio tenían anatomía UV y el 80% formas anatómicas con obstrucción al tracto de salida izquierdo. Tal y como ha sido descrito en la literatura, en nuestro estudio, los pacientes con formas anatómicas UV tuvieron más gravedad postoperatoria (medido por escala de riesgo [PRISM III]), requiriendo estancias hospitalarias más largas, mayor soporte vasoactivo y más ECMO que el resto16,20,21.
Los pacientes con anatomía UV obtuvieron peores puntuaciones en el test de Bayley; en concreto, tuvieron peores resultados que el resto de pacientes en la valoración cognitiva, lenguaje, motora y el comportamiento adaptativo. Sin embargo, no encontramos diferencias estadísticamente significativas por grupos según la cianosis.
En nuestra serie, los RN con diagnóstico de síndrome genético obtuvieron puntuaciones más bajas en el test de Bayley III, tal y como está descrito en la literatura6,22,23. A pesar de que existe una amplia base científica para incluir estudios genéticos en los protocolos de rutina, en nuestro medio no se realizan de manera universal15.
Los pacientes con ENA postoperatorio presentaron puntuaciones más bajas en los dominios cognitivo, motor y del comportamiento adaptativo, tal y como está reportado en la literatura24–29 aunque en nuestra serie estos resultados no fueron estadísticamente significativos. Los pacientes de menor edad a la cirugía presentaron más riesgo de ENA y aquellos que sufrieron una parada cardiorrespiratoria posquirúrgica tuvieron mayor mortalidad y peor neurodesarrollo.
El análisis de biomarcadores de lesión cerebral demostró incremento de los niveles de S100B en el postoperatorio inmediato de la misma manera que se ha descrito en otras series7,8,30,31 sin embargo, en nuestro estudio, este incremento en los valores de S100B postoperatorios no se asoció con presentar ENA tras la cirugía de una manera significativa.
Valores elevados de S100B en adultos se han correlacionado con accidente cerebrovascular, más mortalidad y estancia hospitalaria, delirio, peores resultados neuropsicológicos y disminución de la memoria después de cirugía cardiaca32,33. En la edad pediátrica, valores elevados de S100B se han encontrado en pacientes con complicaciones neurológicas siendo asistidos con ECMO34, tras cirugía extracorpórea31, en contexto de asfixia perinatal y en traumatismo craneoencefálico (TCE) con lesiones intracraneales32.
En el estudio de correlación, valores más elevados de S100B en el postoperatorio inmediato parecen correlacionarse con peores puntuaciones en los dominios cognitivo, lenguaje y motor del test de Bayley III a los 2 años. En referencia a la capacidad pronóstica de S100B en la población pediátrica, existe menor evidencia que la acumulada en adultos, pero sí encontramos estudios que identifican una correlación entre valores de S100B más elevados tras TCE y mal pronóstico neurológico35, así como valores de S100B más elevados tras cirugía cardiaca en pacientes con CC con peores resultados en el neurodesarrollo8,30.
En nuestra serie, los niveles de NSE no aumentaron tras la cirugía como se describe en otras series7,30,31,33. En adultos sometidos a cirugía de derivación coronaria y tras parada cardiaca NSE es un marcador fiable de resultados neurológicos adversos36; en edad pediátrica ha demostrado ser útil como marcador de daño cerebral medida en LCR en RN con encefalopatía hipóxico/isquémica en hipotermia37. En nuestra cohorte, no se asoció con la aparición de ENA postoperatorio y no ha mostrado correlación con peores resultados en el neurodesarrollo temprano.
LimitacionesLa escasa población en algunos de los subgrupos, concretamente el grupo UV y el porcentaje de exitus en este subgrupo han condicionado los resultados globales en la valoración de neurodesarrollo, aunque ha traducido su mayor complejidad.
Realizamos un análisis estadístico descriptivo debido a la escasa población en alguno de los subgrupos no pudiendo plantear un análisis multivariable sin sesgo; esperamos poder realizar este análisis en futuros estudios que incluyan una mayor población.
Los déficits en el neurodesarrollo son evolutivos y algunos aparecen únicamente a edades más avanzadas por lo que la valoración del neurodesarrollo temprano no las puede detectar. Es necesario continuar el seguimiento y evaluación del neurodesarrollo a edades más avanzadas con el fin de detectar otras posibles alteraciones.
ConclusionesA pesar de que la evaluación media del neurodesarrollo a los 2 años de los pacientes con CC de diagnóstico prenatal e intervenida en el primer año de vida se encuentra dentro de la normalidad, uno de cada tres pacientes obtiene resultados alterados en las evaluaciones de los dominios motor, lenguaje y cognitivo.
En nuestro estudio, los pacientes con síndromes genéticos y aquellos con anatomía univentricular muestran peores resultados en el neurodesarrollo a los dos años respecto al resto. Presentar un evento neurológico agudo durante el postoperatorio puede contribuir a obtener peores resultados en el neurodesarrollo a los 2 años.
En nuestra serie, los valores más elevados de S100B en el postoperatorio inmediato se encuentran en pacientes con peor neurodesarrollo a los dos años. Próximos estudios serán necesarios con el fin de esclarecer la capacidad predictora de S100B posquirúrgica de malos resultados en el neurodesarrollo de pacientes con CC compleja.
La identificación precoz de síndromes genéticos y de ENA postoperatorio, así como una atención estandarizada y diferenciada para los RN con CC univentricular es importante para mejorar su pronóstico neurológico final.
Es necesaria la sistematización del seguimiento neuroconductual de los pacientes con CC para avanzar hacia un modelo de atención global enfocado en favorecer un correcto neurodesarrollo y la mejor calidad de vida posible para ellos y sus familias.
AgradecimientosNuestro agradecimiento a la Unidad de Estadística y Bioinformática del Vall d’Hebrón Institut de Recerca, en especial a su responsable, el Dr. Santiago Pérez-Hoyos, por su colaboración en la evaluación y análisis de los resultados del estudio y al Departamento de Bioinformática y Farmacología Clínica del Hospital Universitari Vall Hebrón por su trabajo en el diseño y mantenimiento de la base de datos del estudio.
FinanciaciónEste estudio ha sido parcialmente financiado por el Instituto de Salud Carlos III a través de los proyectos de investigación en salud PI13/01449 (Impacto de las cardiopatías congénitas en el desarrollo del sistema nervioso central: factores pre y posnatales relacionados con el neurodesarrollo temprano) y PI17/02198 (Utilidad de la neuromonitorización integrada como predictor del neurodesarrollo en pacientes sometidos a cirugía cardiaca en edad pediátrica: de la clínica al modelo animal pediátrico).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación en reuniones: parte de este estudio fue presentado en el XXVII Congreso de Neonatología y Medicina Perinatal/VII Congreso de Enfermería Neonatal que tuvo lugar del 2 al 4 de octubre de 2019 en Madrid.