La asistencia perinatal a recién nacidos (RN) extremadamente inmaduros constituye un problema clínico y ético de gran trascendencia para profesionales y familias, y hace necesaria una información actualizada de la máxima calidad acerca de las posibilidades de supervivencia del niño. El objetivo de este estudio fue conocer las tasas específicas de supervivencia al alta hospitalaria y de supervivencia sin morbilidad mayor conocida en RN con una edad gestacional (EG)≤26 semanas en España.
Pacientes y métodosSe incluyeron los RN vivos de≤26 semanas que ingresaron en los centros colaboradores de la red SEN1500 (2004-2010). Se excluyeron los nacidos extramuros, los fallecidos en el paritorio y los que tenían malformaciones incompatibles con la vida.
ResultadosEn total 3.236 pacientes fueron incluidos. La supervivencia específica por EG fue de 12,5, 13,1, 36,9, 55,7 y 71,9% a las 22, 23, 24, 25 y 26 semanas de EG, respectivamente. La supervivencia sin hemorragia intracraneal grave, leucomalacia periventricular, displasia broncopulmonar y/o retinopatía de la prematuridad fue del 1,5, 9,5, 19,0 y 29,9% a las 23, 24, 25 y 26 semanas, respectivamente.
ConclusionesLa supervivencia sin morbilidad mayor en menores de 23 semanas de EG es excepcional, y en RN de 23 y 24 semanas, muy baja. Los RN≥25 semanas de EG tienen posibilidades razonables de supervivencia y, en ausencia de malformaciones mayores u otras complicaciones relevantes, se les debería ofrecer reanimación activa y cuidados intensivos. Es fundamental la actualización continua de los datos propios de cada centro y su comparación con los resultados poblacionales de referencia.
Perinatal care in extremely immature newborns is a clinical and ethical problem of great importance for professionals and families, and requires that the available information on the chances of child survival is of the highest quality. The aim of this study was to determine the specific rates of survival at hospital discharge, and survival without major morbidity in newborns with a gestation age (GA)≤26 weeks in Spain.
Patients and methodsWe included live newborns≤26 weeks admitted to the collaborating centers of the SEN1500 network (2004-2010). Out born patients, infants who died in delivery room, and those with congenital anomalies incompatible with life were excluded.
ResultsA total of 3,236 patients were included. GA specific survival was 12.5, 13.1, 36.9, 55.7, and 71.9% at 22, 23, 24, 25, and 26 weeks of GA, respectively. Survival without severe intracranial hemorrhage, periventricular leukomalacia, bronchopulmonary dysplasia, and/or retinopathy of prematurity was 1.5, 9.5, 19.0, and 29.9% at 23, 24, 25 and 26 weeks GA, respectively.
ConclusionsSurvival without major morbidity in infants less than 23 weeks GA is exceptional, and scarce in newborns with 23 and 24 weeks GA. Infants≥25 weeks GA have reasonable chances of survival and, in the absence of major malformations or other relevant complications, should be offered active resuscitation and intensive care. The continuous updating of the results of individual centers is of utmost importance, as well as their comparison with the reference population-based results.
Debido a los avances en los cuidados obstétricos y neonatales, el número de niños que nacen prematuramente y su supervivencia se han incrementado significativamente durante las últimas décadas. La disminución de la mortalidad sin aumentar la morbilidad y sus secuelas constituye uno de los retos más importantes de la medicina perinatal, sobre todo en el grupo de menor edad gestacional (EG): 22-26 semanas.
En este grupo de recién nacidos (RN), al límite de la viabilidad, las decisiones acerca de los cuidados obstétricos y neonatales continúa siendo un problema clínico y ético de gran trascendencia para profesionales y familias. La inclusión de los padres en el proceso de toma de decisiones, cuando estos así lo deseen, requiere una información de la máxima calidad, basada en datos fiables y actualizados, sobre las posibilidades de supervivencia del RN y, sobre todo, de supervivencia sin morbilidad mayor que pudiera dar lugar a alteraciones en su futuro desarrollo. Habitualmente estas decisiones suelen tomarse en base a los datos del propio centro donde se lleva a cabo la asistencia obstétrica y neonatal. Sin embargo, aspectos no solo técnicos, sino culturales y sociales pueden contribuir a la amplia variabilidad observada en los resultados entre distintos centros y países1–6.
En España no existen estudios que hayan analizado la morbimortalidad específica por EG, ofreciéndose habitualmente los resultados globales para todo el grupo de RN al límite de la viabilidad. Por otra parte, la variabilidad en las definiciones operativas, junto con el hecho de que habitualmente sean datos procedentes de un solo centro, hacen que los resultados sean difícilmente generalizables. El conocimiento de los resultados de una amplia área con un similar entorno cultural y organizativo podría constituir una base ideal para la toma de decisiones, así como una útil referencia para los programas de mejora continua de la calidad asistencial.
El objetivo de este estudio fue conocer las tasas específicas por EG de supervivencia al alta hospitalaria y de supervivencia sin morbilidad mayor conocida en una amplia cohorte de base poblacional de RN con EG≤26 semanas en España.
Pacientes y métodosLa base de datos española SEN1500 recoge y analiza sistemáticamente los datos de los RN vivos de muy bajo peso (RNMBP) nacidos en los centros colaboradores de la red, o ingresados en ellos durante los primeros 28 días de vida7. Para el presente estudio se analizan los RN vivos de≤26 semanas que ingresaron durante el periodo 2004-2010. Se excluyeron los RN con malformaciones congénitas incompatibles con la vida y los nacidos extramuros debido al potencial sesgo de selección en los pacientes trasladados, así como a la posible influencia del traslado en la morbimortalidad.
La EG se estimó en semanas y días en base a la fecha de la última regla, parámetros obstétricos y ecografía prenatal reflejados en la historia materna. Cuando fue necesario, el neonatólogo estimó la EG en base a la exploración física del RN.
Se consideró reanimación cardiopulmonar (RCP) avanzada la necesidad de intubación endotraqueal, compresiones torácicas o medicación.
Por morbilidad mayor se consideró la presencia de una o más de las siguientes: hemorragia intraventricular (HIV) grave (grados 3 y 4 de Papile) 8; lesión de la sustancia blanca: leucomalacia periventricular quística y/o hiperecogenicidades persistentes; displasia broncopulmonar (DBP) definida como dependencia de oxígeno a las 36 semanas de edad posmenstrual; enterocolitis necrosante (NEC)≥estadio 2 de Bell9; sepsis bacteriana temprana y/o meningitis (cultivo positivo<72h) o sepsis y/o meningitis tardía (cultivo positivo>72h); y retinopatía de la prematuridad (ROP)≥grado 310, y/o tratamiento mediante laserterapia.
El análisis estadístico se llevó a cabo con el programa SPSS® v. 1911. Las medidas de tendencia central y dispersión de las variables cuantitativas se expresan como media y desviación estándar, y las de las variables cualitativas, como frecuencias absolutas y/o relativas, o mediana y rango intercuartílico. Las diferencias entre grupos para variables continuas se examinó mediante la t de Student o el test de la U de Mann-Whitney, o la ANOVA o el test de Kruskal-Wallis cuando se compararon más de 2 grupos. Para el contraste de hipótesis de las variables cualitativas se empleó el test de la Chi-cuadrado o el test de Fisher, cuando fue necesario. El nivel de significación estadística se estableció en p<0,05 para todas las comparaciones.
Las características de la base de datos electrónica, el control de calidad y el sistema de garantía de la confidencialidad de los datos ya fueron publicadas con anterioridad, y la participación en dicha base de datos había sido aprobada previamente por los comités de ética e investigación clínica de los centros participantes7.
ResultadosDurante el periodo de estudio se registraron en la base de datos SEN1500 un total de 19.482 RNMBP, de los que 3.915 (20,1%) eran niños de 22 a 26 semanas de EG. El número de unidades que participaron en la recogida de datos varió entre 49 y 63, estimándose una inclusión de aproximadamente dos tercios de todos los RNMBP de España (según datos del Instituto Nacional de Estadística). La distribución de las unidades participantes fue: nivel i (<50 ingresos de RNMBP/año): 72%; nivel ii (50-100 ingresos/año): 18%; y nivel iii (>100 ingresos/año): 10%.
La procedencia de los pacientes fue: intrahospitalarios 3.518 (89,9%) y extrahospitalarios 397 (10,1%). Tras descartar los niños con anomalías congénitas incompatibles con la vida (n=204), un total de 3.377 pacientes fueron incluidos en el estudio. La tabla 1 muestra las características demográficas y somatométricas de los pacientes por EG, junto con el control de la gestación y algunas intervenciones obstétricas.
Características demográficas y somatométricas
| Características | 22 semanas | 23 semanas | 24 semanas | 25 semanas | 26 semanas | Total |
| Total de RNV | 31 | 261 | 728 | 1.045 | 1.312 | 3.377 |
| Fallecidos en la sala de partos, n (%) | 23 (74,2) | 62 (23,8) | 34 (4,7) | 16 (1,5) | 6 (0,5) | 141 (4,2) |
| Ingresados vivos en la UCIN | 8 | 199 | 694 | 1.029 | 1.306 | 3.236 |
| PRN (g), media±DE (rango)a | n=8;600±104(485-780) | n=199;609±87(400-920) | n=694;676±98(413-1.030) | n=1.029;759±129(350-1.310) | n=1.306;864±154(340-1.410) | n=3.236;774±156(340-1.410) |
| Longitud (cm), media±DE (rango)a | N=6; 30,5±2,3 (28,0-34,0) | N=145; 30,2±2,2 (22,0-40,0) | n=560;31,5±2,0(22,5-40,0) | n=869;32,8±2,2(21,2-43,0) | n=1.162;34,1±2,3(20,0-45,0) | n=2.742;32,9±2,5(20,0-45,0) |
| PC (cm), media±DE (rango)a | n=4;20,5±2,0(18,5-23,0) | n=143;21,3±1,5(18,0-27,0) | n=570;22,2±1,5(19,0-34,0) | n=875;23,0±1,6(18,0-34,0) | n=1.172;24,0±1,6(19,0-36,0) | n=2.764;22,2±1,8(18,0-36,0) |
| Sexo masculino, n (%) | 5 (62,5) | 118 (59,3) | 409 (58,9) | 567 (55,1) | 688 (52,7) | 1.878 (55,2) |
| Raza, n (%) | ||||||
| Blanca | 6 (85,7) | 142 (82,1) | 497 (82,1) | 765 (85,8) | 1.015 (88,3) | 2.425 (85,8) |
| Gitana | 0 | 6 (3,5) | 17 (2,8) | 21 (2,4) | 23 (2) | 67 (2,4) |
| Negra | 0 | 6 (3,5) | 23 (3,8) | 26 (2,9) | 21 (1,8) | 76 (2,7) |
| Asiática | 0 | 1 (0,6) | 10 (1,7) | 9 (1) | 7 (0,6) | 27 (1) |
| Latina | 1 (14,3) | 17 (9,8) | 53 (8,8) | 58 (6,5) | 60 (5,2) | 189 (6,7) |
| No especificada | 1 (14,3) | 27 (13,6) | 94 (13,5) | 150 (14,6) | 180 (13,8) | 452 (14,0) |
| Gestación múltiple, n (%) | 1 (12,5) | 67 (33,7) | 207 (29,8) | 306 (29,8) | 364 (27,9) | 945 (29,2) |
| Control prenatal, % | 87,5 | 79,5 | 85,3 | 86,5 | 88,1 | 86,5 |
| Corticoides prenatales (al menos una dosis), % | 57,1 | 58,8 | 80,3 | 84,8 | 85,8 | 82,6* |
| Corioamnionitis, n (%)a,b | - | 55 (43,3) | 254 (39,0) | 383 (37,9) | 523 (29,1) | 1.217 (34,5)** |
| Parto mediante cesárea, % | 37,5 | 17,6 | 35,6 | 46,5 | 58,0 | 47,0* |
DE: desviación estándar; PC: perímetro craneal; PRN: peso del recién nacido; RNV: recién nacido vivo; UCIN: Unidad de Cuidados Intensivos Neonatales.
En la tabla 2 se muestra la vitalidad al nacimiento en función del test de Apgar, así como las medidas de RCP aplicadas. La depresión neonatal grave y la necesidad de RCP avanzada disminuyeron progresivamente con el aumento de la EG. No obstante, algunos de los pacientes más inmaduros no fueron reanimados en relación con decisiones de adecuación de esfuerzos diagnósticos y terapéuticos (AEDT). Entre los pacientes que precisaron adrenalina durante la reanimación (n=199) la supervivencia fue inferior a la de los que no la necesitaron (37,7 vs. 62,3%; p<0,001) y los supervivientes (n=75) presentaron con mayor frecuencia lesión cerebral mayor (LCM) (HIV grave y/o lesión de la sustancia blanca) (7,9 vs. 3,5%; p<0,001). Resultados similares se observaron en los pacientes que precisaron compresiones torácicas (n=264) frente a los que no las necesitaron: supervivencia 34,1 vs. 65,9% (p<0,001) y LCM en los supervivientes (n=90): 10,3 vs. 4% (p<0,001).
Situación al nacimiento, reanimación en la sala de partos, temperatura al ingreso en la Unidad de Cuidados Intensivos Neonatales, Clinical Risk Index for Babies y mortalidad en las primeras 24h de vida
| 22 semanas | 23 semanas | 24 semanas | 25 semanas | 26 semanas | Total | |
| Apgar≤3, na | 8 | 196 | 683 | 1.019 | 1.292 | 3.197 |
| Al minuto, %* | 62,5 | 44,9 | 31,1 | 25,6 | 22,3 | 26,7 |
| A los 5min, %* | 25,0 | 17,6 | 6,3 | 3,8 | 3,9 | 5,3 |
| RCP, na | 8 | 197 | 694 | 1.027 | 1.304 | 3.230 |
| Oxígeno, % | 100 | 86,3 | 94,5 | 93 | 89,7 | 91,6 |
| Ventilación con mascarilla, %b | 100 | 68,0 | 76,8 | 76,2 | 76,0 | 75,8 |
| Intubación, % | 62,5 | 80,2 | 86,6 | 78,5 | 69,8 | 76,8 |
| Adrenalina, % | 0 | 7,1 | 7,9 | 6,1 | 5,2 | 6,2 |
| Masaje cardiaco, % | 12,5 | 8,1 | 10,6 | 8,2 | 6,9 | 8,2 |
| RCP avanzada, %c,* | 62,5 | 80,2 | 86,6 | 78,7 | 70,1 | 77,0 |
| Surfactante en sala de partos, n (%)a | n=7;1 (14,3) | n=188;32 (17,0) | n=659;147 (22,3) | n=988;191 (19,3) | n=1.247;229 (18,4) | n=3.089; 600 (19,4) |
| Temperatura al ingreso (°C), media±DE(rango)a,d | n=4;34,8±0,4(34,2-35,0) | n=96;34,8±1,1(31,1-37,8) | n=380;35,3±1,1(32,0-38,6) | n=537;35,5±0,9(32,0-38,0) | n=732;35,7±0,8(31,5-39,0) | n=1.749;35,5±0,9(31,1-39,0) |
| Temperatura al ingreso<36,5°C, N (%)** | 4 (100) | 91 (94,8) | 329 (86,6) | 469 (87,3) | 608 (83,1) | 1.501 (85,8) |
| Índice CRIB, mediana (RIQ)a,* | n=6;10 (8-11,25) | n=159;10 (8-13) | n=574;8 (6-11) | n=857;6 (4-8) | n=1.098;4 (2-7) | n=2.694; 6 (3-9) |
| Mortalidad en las primeras 24h, n (%)a,* | n=8;3 (37,5) | n=199;69 (34,7) | n=694;108 (15,6) | n=1.029;95 (9,2) | n=1.306;92 (7,0) | n=3.236; 367 (11,3) |
DE: desviación estándar; CRIB: Clinical Risk Index for Babies; RCP: reanimación cardiopulmonar; RIQ: rango intercuatílico.
Una elevada proporción de pacientes ingresó con temperatura inferior a 36,5°C (85,8%), y aunque disminuyó significativamente con el aumento de la EG, a las 26 semanas involucró aún a más del 80%. Finalmente, un menor índice de riesgo en base al puntaje del Clinical Risk Index for Babies12 se observó en los niños más maduros, así como una menor mortalidad en las primeras 24h de vida (tabla 2).
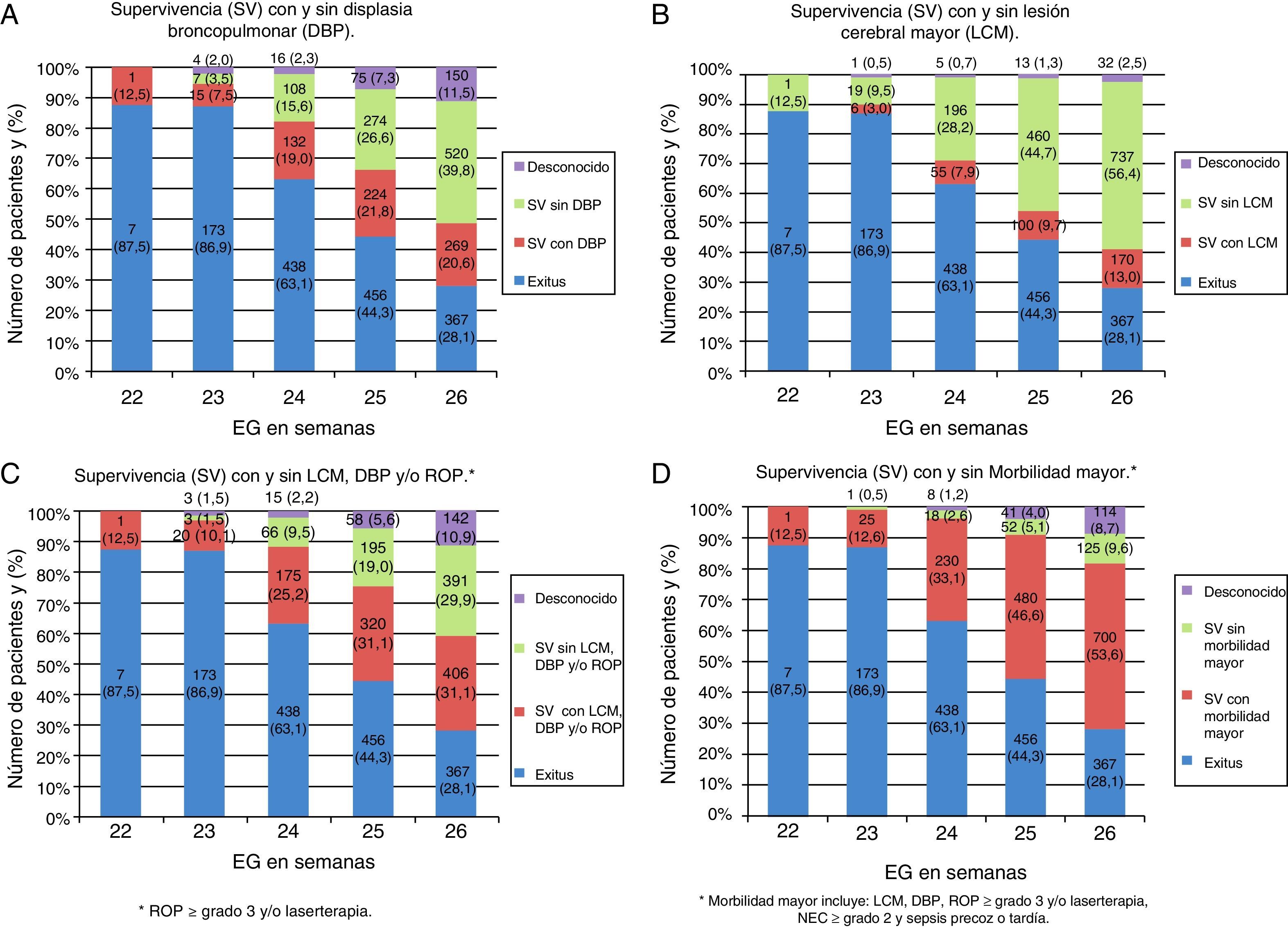
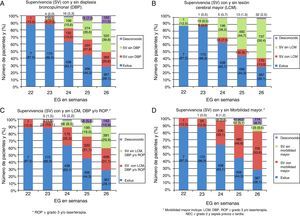
En la tabla 3 se muestra la incidencia de síndrome de distrés respiratorio y ductus arterioso permeable, junto con algunos indicadores de práctica clínica y algunas de las complicaciones observadas. La figura 1A muestra la supervivencia con y sin DBP.
Morbilidad respiratoria e indicadores de práctica clínica
| EG(ingresados vivos en UCIN) | 22 semanas (N=8) | 23 semanas (N=199) | 24 semanas (N=694) | 25 semanas (N=1.029) | 26 semanas (N=1.306) | Total (N=3.236) | p |
| SDR, n/total (%)a | 6/7 (85,7) | 164/187 (87,7) | 599/659 (90,9) | 866/986 (87,8) | 1.048/1.238 (84,7) | 2.683/3.077 (87,2) | 0,004 |
| Surfactante en algún momento, n/total (%)b | 6/8 (75,0) | 175/198 (88,4) | 632/692 (91,3) | 903/1.028 (87,8) | 1.080/1.304 (82,8) | 2.796/3.230 (86,6) | <0,001 |
| DAP, n/total (%) | 2/7 (28,6) | 90/186 (48,4) | 398/645 (61,7) | 599/980 (61,1) | 708/1.238 (57,2) | 1.797/3.056 (58,8) | <0,001 |
| Cierre quirúrgico del DAP, n/total (%) | 1/8 (12,5) | 27/198 (13,6) | 126/691 (18,2) | 166/1.021 (16,3) | 166/1.299 (12,8) | 486/3.217 (15,1) | 0,016 |
| Neumotórax, n/total (%) | 2/8 (25,0) | 27/195 (13,8) | 90/691 (13,0) | 111/1.023 (10,9) | 81/1.302 (6,2) | 311/3.219 (9,7) | <0,001 |
| Esteroides para BDP, n/total (%) | 0 | 14/198 (7,1) | 128/692 (18,5) | 159/1.017 (15,6) | 180/1.295 (13,9) | 481/3.210 (15,0) | 0,001 |
| Muerte o dependencia de oxígeno a los 28 días, n/total (%) | 8/8 (100) | 199/199 (100) | 669/690 (97,0) | 919/1.006 (91,4) | 1.011/1.278 (79,1) | 2.806/3.181 (88,2) | <0,001 |
| Supervivencia sin dependencia de oxígeno a las 36 semanas EPM, n/total (%) | 0 | 7/195 (3,6) | 108/678 (15,9) | 274/954 (28,7) | 520/1.156 (45,0) | 909/2.991 (30,4) | <0,001 |
DAP: ductus arterioso permeable; DBP: displasia broncopulmonar; EPM: edad posmenstrual; SDR: síndrome de distrés respiratorio; UCIN: Unidad de Cuidados Intensivos Neonatales.
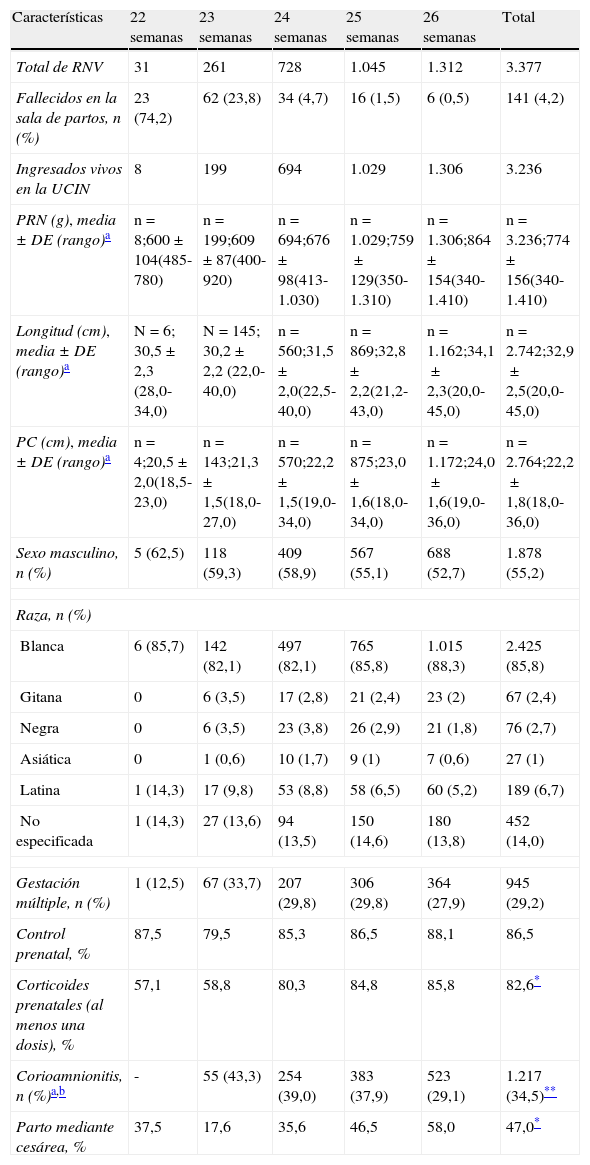
La proporción de pacientes con al menos un estudio ultrasonográfico cerebral tras su ingreso en UCIN fue del 90,7%, variando entre el 50% en los de 22 semanas de EG y el 92,8 y 93,6% en los de 25 y 26 semanas (p<0,001), respectivamente. La incidencia de HIV grave descendió progresivamente desde las 23 a las 26 semanas de EG, siendo del 31,2, 25,1, 22,8 y 17,9%, respectivamente. Algún tipo de lesión de la sustancia blanca se detectó en el 8,8% de los pacientes, sin diferencias relevantes por EG. La supervivencia específica sin LCM se muestra en la figura 1B.
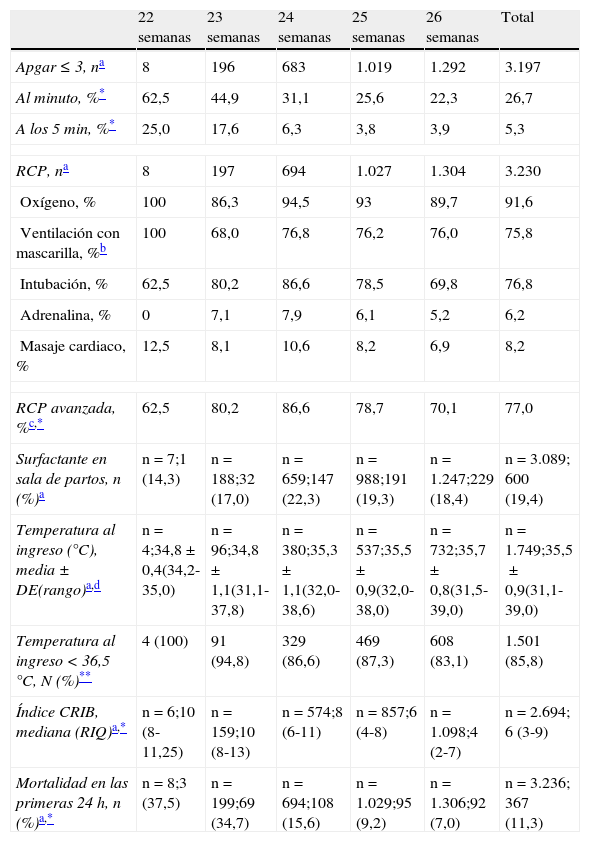
De los 1.796 pacientes que sobrevivieron, a 1.690 (94,1%) se les realizó un examen del fondo de ojo antes del alta o traslado. De ellos, 279 (16,5%) presentaron ROP≥grado 3, y 289 (17,1%) recibieron tratamiento mediante laserterapia. La figura 1C muestra la supervivencia específica por EG sin DBP, LCM, ROP y/o laserterapia.
La incidencia de NEC fue del 13,3%, sin diferencias significativas por EG. Precisaron tratamiento quirúrgico 254 pacientes (7,8%). En 184 niños (5,7%) se observó una perforación gastrointestinal focal (PGIF).
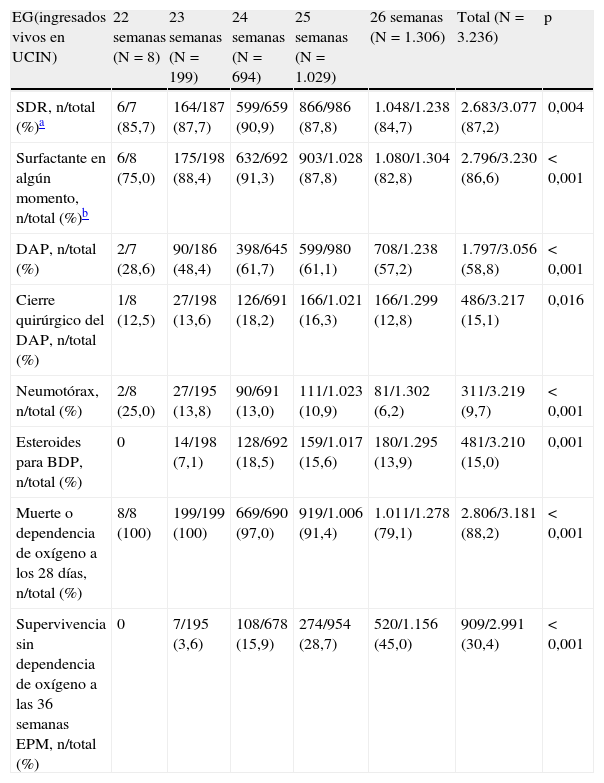
Por otra parte, 226 RN (7,0%) presentaron sepsis precoz y 1.635 (50,5%) al menos un episodio de sepsis tardía, siendo más frecuentes las producidas por Staphylococcus epidermidis (29,3%). Infecciones fúngicas se observaron en 287 pacientes (8,9%). La figura 1D muestra la supervivencia específica por EG sin morbilidad mayor.
La supervivencia específica por EG sobre el total de RN vivos se incrementó con el aumento de la EG: 3,2% (22 semanas), 10% (23 semanas), 35,8% (24 semanas), 54,8% (25 semanas) y 71,2% (26 semanas). En la tabla 4 se detalla la supervivencia específica por EG con respecto a los RN ingresados en UCIN. En ella puede apreciarse, además, la estancia media hospitalaria de los pacientes dados de alta a domicilio, así como el peso y el perímetro craneal al alta. La mortalidad descendió progresivamente desde las 22 semanas de EG (87,5%) hasta las 26 (28,1%) (p<0,001), ocurriendo el fallecimiento a una edad (mediana y rango intercuartílico) de 5 (1-15) días, siendo significativamente más precoz en los pacientes más inmaduros: 2 (0-13) días, 3 (1-10) días, 5 (2-12,25) días, 6 (2-16) días y 6 (1-22) días, de las 22 a las 26 semanas, respectivamente (p<0,001). El 58,2% falleció en la primera semana, y el 86,5%, en los primeros 28 días.
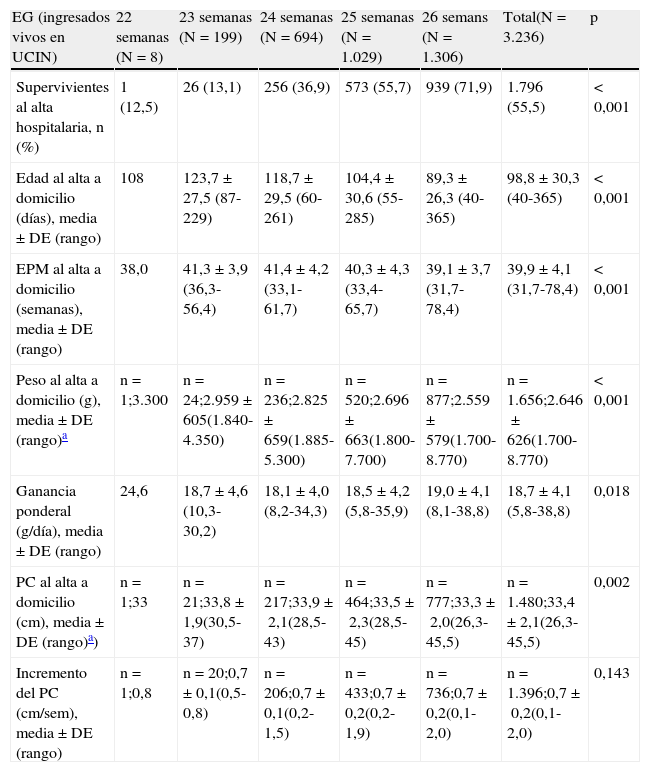
Supervivencia, estancia hospitalaria y somatometría al alta a domicilio en los supervivientes
| EG (ingresados vivos en UCIN) | 22 semanas (N=8) | 23 semanas (N=199) | 24 semanas (N=694) | 25 semanas (N=1.029) | 26 semans (N=1.306) | Total(N=3.236) | p |
| Supervivientes al alta hospitalaria, n (%) | 1 (12,5) | 26 (13,1) | 256 (36,9) | 573 (55,7) | 939 (71,9) | 1.796 (55,5) | <0,001 |
| Edad al alta a domicilio (días), media±DE (rango) | 108 | 123,7±27,5 (87-229) | 118,7±29,5 (60-261) | 104,4±30,6 (55-285) | 89,3±26,3 (40-365) | 98,8±30,3 (40-365) | <0,001 |
| EPM al alta a domicilio (semanas), media±DE (rango) | 38,0 | 41,3±3,9 (36,3-56,4) | 41,4±4,2 (33,1-61,7) | 40,3±4,3 (33,4-65,7) | 39,1±3,7 (31,7-78,4) | 39,9±4,1 (31,7-78,4) | <0,001 |
| Peso al alta a domicilio (g), media±DE (rango)a | n=1;3.300 | n=24;2.959±605(1.840-4.350) | n=236;2.825±659(1.885-5.300) | n=520;2.696±663(1.800-7.700) | n=877;2.559±579(1.700-8.770) | n=1.656;2.646±626(1.700-8.770) | <0,001 |
| Ganancia ponderal (g/día), media±DE (rango) | 24,6 | 18,7±4,6 (10,3-30,2) | 18,1±4,0 (8,2-34,3) | 18,5±4,2 (5,8-35,9) | 19,0±4,1 (8,1-38,8) | 18,7±4,1 (5,8-38,8) | 0,018 |
| PC al alta a domicilio (cm), media±DE (rango)a) | n=1;33 | n=21;33,8±1,9(30,5-37) | n=217;33,9±2,1(28,5-43) | n=464;33,5±2,3(28,5-45) | n=777;33,3±2,0(26,3-45,5) | n=1.480;33,4±2,1(26,3-45,5) | 0,002 |
| Incremento del PC (cm/sem), media±DE (rango) | n=1;0,8 | n=20;0,7±0,1(0,5-0,8) | n=206;0,7±0,1(0,2-1,5) | n=433;0,7±0,2(0,2-1,9) | n=736;0,7±0,2(0,1-2,0) | n=1.396;0,7±0,2(0,1-2,0) | 0,143 |
DE: desviación estándar; EG: edad gestacional; EPM: edad posmenstrual; PC: perímetro craneal; UCIN: Unidad de Cuidados Intensivos Neonatales.
Este es el primer estudio de base poblacional sobre supervivencia y supervivencia sin morbilidad mayor conocida, específicas por EG, en RN al límite de viabilidad, que se lleva a cabo en España. La supervivencia global de esta amplia cohorte de pacientes≤26 semanas de EG, representativa de la mayoría de las comunidades españolas, fue del 55,5%, similar a la de otros estudios de países de nuestro entorno13–15.
Otros estudios han referido una gran variabilidad en cuanto a los resultados entre diferentes centros y países, sobre todo en los niños más inmaduros (22-24 semanas). En general, el número de niños incluidos en estos grupos suele ser pequeño, como ocurre en los estudios de centro único, lo cual puede contribuir a esta variabilidad. Otra posible razón pudiera ser las elecciones que toman los profesionales respecto a las intervenciones en pacientes particulares. Estos aspectos no suelen estar claramente definidos en los estudios, por lo que no es posible un análisis acerca de cómo dichas preferencias influyen en las diferencias entre centros. En nuestro estudio, una actitud más activa por parte de los obstetras hacia los pacientes de mayor EG puede deducirse de la mayor utilización de esteroides prenatales y de la tasa de partos mediante cesárea conforme avanza la EG (tabla 1). La mayor parte de estos niños necesitaron RCP avanzada. Sin embargo, una actitud más conservadora por parte de los neonatólogos hacia los RN de 22 semanas de EG es evidente por la menor frecuencia de intubación y RCP avanzada, a pesar de una mayor depresión neonatal en este grupo de pacientes, y por el mayor porcentaje de ellos fallecidos en la sala de partos (tablas 1 y 2).
La mayoría de los niños incluidos en este estudio (87,2%) presentaron síndrome de distrés respiratorio (tabla 3). En algunas ocasiones el diagnóstico no pudo establecerse con certeza debido a la no realización de radiografía de tórax en aquellos que fallecieron muy precozmente. Asimismo, la mayor parte de ellos (86,6%) recibieron surfactante (SF) en algún momento. Aunque el beneficio de la administración de SF por debajo de las 26 semanas de EG ha sido cuestionado en base a razones fisiológicas, en la práctica ha mostrado ser beneficioso en este grupo de pacientes16,17. La frecuencia de su utilización en estudios recientes es similar a la nuestra: 84% (EPICure)14 y 78% (EPIBEL)13.
El tratamiento con SF, tanto profiláctico como de rescate, reduce el riesgo de síndrome de escape aéreo y la mortalidad neonatal18. En nuestro estudio la incidencia de neumotórax fue del 9,7% (tabla 3), con una disminución significativa a medida que aumenta la EG. La incidencia de neumotórax no suele ser referida de forma sistemática en la literatura. No obstante, nuestros resultados son muy similares a los de la VON: 12, 10, 7,5 y 6%, a las 23, 24, 25 y 26 semanas, respectivamente19.
Entre las estrategias recientemente recomendadas para disminuir la incidencia de DBP se encuentran evitar la intubación, una menor utilización de SF profiláctico y el uso de estrategias de soporte respiratorio no invasivo20. En el momento actual se recomienda administrar el SF tras la estabilización inicial del RN, excepto en el caso de prematuros extremos cuyas madres no recibieron corticoides para maduración pulmonar fetal y en los que necesiten intubación en la sala de partos, en cuyo caso se debería administrar en ese momento21. Llama la atención en nuestro estudio que la frecuencia global de intubación durante la RCP fue del 76,8% (tabla 2), pero la administración de SF en la sala de partos fue solo del 19,4%. Estos datos contrastan ampliamente con los de otros estudios, como el EPICure2, con un 95% de intubaciones y un 72% de administración de SF en la sala de partos22. Razones de índole organizativa o diferente protocolización de la asistencia en los distintos centros podrían ser la explicación de este hallazgo. A pesar de estas diferencias en el manejo inicial, la supervivencia sin dependencia de oxígeno a las 36 semanas de edad posmenstrual fue mayor en nuestro medio (30,4 vs. 19,9%), y la utilización de esteroides posnatales para prevención o tratamiento de la DBP, algo inferior (15,0 vs. 21%).
Las variables que más fuertemente se asocian con un resultado adverso en el neurodesarrollo del paciente son la HIV grave y la leucomalacia periventricular quística23,24. En nuestro estudio la incidencia de HIV grave fue del 21,8% sobre el total de RN ingresados en UCIN (24,3% del total con ecografía realizada), similar a la del estudio EPIBEL (24,9%)13. Es posible que estas lesiones hayan tenido un papel importante en la mortalidad directa o como resultado de la AEDT, ya que su incidencia entre los niños que sobrevivieron fue del 11,6%. La supervivencia sin LCM combinada aumentó progresivamente con la EG (fig. 1B).
La incidencia de ROP en nuestro medio no fue elevada, sin embargo, su reducción sigue siendo un objetivo terapéutico de primer orden, ya que la ROP severa se ha asociado con alteraciones visuales posteriores25 y discapacidad funcional26. En el reciente trabajo de Farooqi et al.24 la lesión cerebral, la DBP y la ROP, de forma independiente o combinadas, se asociaron con resultados adversos a los 11 años de vida. Concretamente, para la ROP severa la proporción de pacientes con resultado adverso a los 11 años fue del 50% en comparación con el 20% entre los pacientes que no la habían presentado (OR 3,9 [IC 95% 1,5-10,1], p=0,004). Tras ajustar por morbilidad, sexo y EG, la lesión cerebral y la ROP severa, pero no la DBP, continuaron fuerte e independientemente asociadas con el riesgo de resultado adverso a los 11 años.
La incidencia de sepsis nosocomial aumenta a menor EG, habiéndose reportado incidencias de alrededor del 50-60% en menores de 26 semanas5. En nuestro estudio la incidencia de sepsis tardía fue del 50,5%, y se asoció con una estancia hospitalaria más prolongada entre los supervivientes (media±desviación estándar): 103,8±36 frente a 85,8±28 días en los que no la presentaron.
La incidencia de NEC y PGIF fue similar a otras reportadas en la literatura. Holman et al. han referido incidencias de NEC del 11,5% en los menores de 750g27. En el estudio EPIBEL, por otra parte, la proporción de pacientes que precisó intervención quirúrgica por NEC o perforación intestinal fue del 14,5% de los ingresados en UCIN o del 15,9% de los supervivientes, algo superior a la encontrada en nuestro estudio13. La mortalidad entre los pacientes que presentaron NEC fue mayor que entre los que no la presentaron: 53,5 vs. 43,0% (p<0,001), así como entre los que precisaron intervención quirúrgica (53,9%) frente a los que no (43,9%) (p=0,002). Además, los pacientes con NEC presentaron con mayor frecuencia al menos un episodio de sepsis tardía: 19,4 vs. 7,1% (p<0,001).
La estancia media de nuestros pacientes fue de 98,8±30,3 días, disminuyendo con el aumento de la EG (tabla 4), lo que indica, junto con la menor edad posmenstrual y el menor peso al alta, que los niños con mayor EG alcanzan antes la estabilidad necesaria para poder ser dados de alta.
A diferencia de otros grupos poblacionales, los prematuros que fallecen lo hacen de forma relativamente temprana, como pudimos observar en nuestro estudio. Las causas del exitus fueron: respiratoria 39,4%, infecciosa 23,8%, neurológica 15,8%, otras 19% y desconocida 2%. En cuanto a la AEDT, se recogieron datos en 1.204 pacientes (83,6% de todos los fallecidos), declarándose alguna forma de AEDT en 432 pacientes (35,9%), siendo más frecuente entre los de menor EG: 42,9% (22 semanas), 51,1% (23 semanas), 39,1% (24 semanas), 33,2% (25 semanas) y 28,8% (26 semanas) (p<0,001).
En el estudio EPIBEL, en el 50% de los pacientes fallecidos se mantuvieron todas las medidas de soporte vital hasta el exitus, en el 39% se llevó a cabo algún tipo de limitación y en el 11% restante no se registraron datos13. En contraste, en el estudio EPICure (21-25 semanas) la terapia intensiva se retiró de forma activa en el 55,3% de los pacientes14.
Nuestro estudio presenta algunas limitaciones. Aunque es el análisis más amplio llevado a cabo hasta la fecha en España, estimamos que aproximadamente un tercio de los niños de esta categoría pudieran no haber sido incluidos. Por otra parte, en algunos pacientes trasladados a otros centros los datos sobre morbimortalidad no pudieron ser completados. No obstante, estas pérdidas fueron relativamente pequeñas en comparación con el tamaño de la población estudiada.
En conclusión, la supervivencia de niños menores de 23 semanas de EG en nuestro medio es excepcional. Las posibilidades de supervivencia sin morbilidad mayor en RN de 23 y 24 semanas de EG son escasas, y los padres deberían participar, cuando sea posible y después de un apropiado consejo no directivo, en la toma de decisiones. Los RN≥25 semanas de EG tienen posibilidades razonables de supervivencia y, en ausencia de malformaciones mayores u otras complicaciones relevantes, se les debería ofrecer reanimación completa y cuidados intensivos. Finalmente, creemos que es fundamental la actualización continua de los datos propios de cada centro y su comparación con los resultados poblacionales de referencia, como se muestran en este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.