La bronquiolitis aguda (BA) del lactante tiene una evolución grave entre el 6 y el 16% de los casos ingresados. Su patogenia y evolución está relacionada con la respuesta de los linfocitos T. El objetivo del presente estudio es comprobar si la menor respuesta linfocitaria sistémica está relacionada con una peor evolución de la BA en lactantes ingresados.
Pacientes y métodoEstudio observacional-analítico retrospectivo de casos-controles anidados en una cohorte de ingresados por BA-VRS en el periodo de octubre del 2010 a marzo del 2015. Se incluyó a aquellos con hemograma en las primeras 48 h de dificultad respiratoria. Se excluyó a los lactantes con patología de base, sobreinfección bacteriana y prematuros ≤ 32 semanas de gestación. La variable principal dicotómica fue ingreso UCIP. Otras variables fueron: sexo, edad, edad posmenstrual, exposición gestacional y posnatal al tabaco, mes de ingreso, tipo de lactancia y días de evolución del distrés respiratorio. Las cifras de linfocitos fueron categorizadas por cuartiles. Se realizó un análisis bivariante con la variable principal y posteriormente regresión logística para analizar factores de confusión.
ResultadosEl estudio incluyó a 252 lactantes. El 6,6% (17) precisó UCIP. La diferencia de media±DE de linfocitos para pacientes ingresados y no ingresados en UCIP fue de 4.044±1.755 y 5.035±1.786, respectivamente (t de Student, p<0,05). Se encontró asociación entre ingreso UCIP y la cifra de linfocitos < 3.700/ml (Chicuadrado p=0,019; OR: 3,2), que se mantuvo en la regresión logística con independencia de la edad y del resto de factores estudiados (Wald 4,191 p=0,041; OR: 3,8).
ConclusionesExiste relación entre la linfocitosis<3.700/ml en los primeros días de la dificultad respiratoria y una peor evolución en lactantes < 12 meses previamente sanos y edad gestacional mayor de 32 semanas con BA-VRS.
Acute bronchiolitis (AB) of the infant has a serious outcome in 6-16% of the hospital admitted cases. Its pathogenesis and evolution is related to the response of the T lymphocytes. The objective of the present study is to determine if the lower systemic lymphocytic response is related to a worse outcome of AB in hospitalised infants.
Patients and methodRetrospective observational-analytical study of cases-controls nested in a cohort of patients admitted due to RSV-AB between the period from October 2010 to March 2015. Those with a full blood count in the first 48hours of respiratory distress were included. Infants with underlying disease, bacterial superinfection, and premature infants <32 weeks of gestation were excluded. The main dichotomous variable was PICU admission. Other variables were: gender, age, post-menstrual age, gestational and post-natal tobacco exposure, admission month, type of lactation, and days of onset of respiratory distress. Lymphocyte counts were categorised by quartiles. Bivariate analysis was performed with the main variable and then by logistic regression to analyse confounding factors.
ResultsThe study included 252 infants, of whom 6.6% (17) required PICU admission. The difference in mean±SD of lymphocytes for patients admitted to and not admitted to PICU was 4,044±1755 and 5,035±1786, respectively (Student-t test, P<.05). An association was found between PICU admission and lymphocyte count <3700/ml (Chi-squared, P=.019; OR: 3.2) and it was found to be maintained in the logistic regression, regardless of age and all other studied factors (Wald 4.191 P=.041, OR: 3.8).
ConclusionsA relationship was found between lymphocytosis <3700/ml in the first days of respiratory distress and a worse outcome in previously healthy infants <12 months and gestational age greater than 32 weeks with RSV-AB.
La bronquiolitis aguda (BA) del lactante tiene una evolución grave precisando cuidados especiales en una unidad de cuidados intensivos pediátricos (UCIP) entre el 6 y el 16% de los casos ingresados en hospital1-3. Diversos estudios han tratado de aproximarse a los factores implicados en una evolución grave de la enfermedad2,4-8, aunque cuando se trata de niños sanos sin factores predisponentes, las conclusiones no acaban de delimitar con cierta verosimilitud qué lactantes tienen mayor riesgo9. Existe acuerdo en considerar a los prematuros y a los de menor edad como los de mayor propensión para precisar un nivel superior de cuidados2, y al virus respiratorio sincitial (VRS) como el de mayor incidencia y virulencia entre los lactantes5,10,11. El mes de nacimiento también se ha relacionado con la gravedad de la BA12,13. No está claro si la presencia de coinfecciones virales aumenta la gravedad del cuadro, aunque cada vez está más admitido que en un porcentaje importante de casos, la sobreinfección bacteriana aumenta la estancia y la necesidad de cuidados especiales2,14,15.
Los lactantes son muy susceptibles a complicaciones graves de las infecciones virales respiratorias. Es conocido que la patogenia de la BA está relacionada con la respuesta de los linfocitos Th (linfocitos T-helper), reclutados a nivel del epitelio respiratorio por las diversas citoquinas y quimiocinas que se desencadenan tras la infección, y concretamente con la relación aumentada CD8/CD4 tanto mayor cuanto más grave el cuadro clínico16. En este sentido, se ha indicado la posibilidad de que el nivel cuantitativo de la respuesta linfocitaria sistémica, muy en relación con la elevación de interferón-gamma (INF-γ) al inicio de la infección, esté asociada con una peor evolución de la BA como expresión de un disbalance inmunológico hacia una mayor respuesta Th2 alérgica-inflamatoria17,18.
El objeto del presente estudio es comprobar si la respuesta linfocitaria sistémica en la infección por el VRS está relacionada con una peor evolución en nuestra serie de lactantes ingresados por BA sin otras complicaciones.
Pacientes y métodoEstudio observacional analítico retrospectivo de casos y controles anidados en una cohorte de ingresados con diagnóstico de BA en el periodo del 1 de octubre del 2010 al 31 de marzo del 2015. El estudio fue posible al tratarse de una patología frecuente y estandarizada donde la historia clínica informatizada utilizada en nuestro hospital recoge de forma activa las principales variables del estudio, tanto en las anotaciones de enfermería como en los evolutivos clínicos.
Durante estas 5 epidemias, consideramos a aquellos pacientes menores de 12 meses con criterios clásicos de BA19 y presencia del antígeno VRS en el aspirado nasofaríngeo al ingreso, según técnicas previamente descritas20. Se revisaron, desde el ingreso hasta el alta, los registros diarios de todos los lactantes previamente sanos con BA por VRS para incluir aquellos que en las primeras 48 h de distrés respiratorio hubieran precisado un hemograma por cualquier criterio clínico. Se excluyó del estudio a aquellos pacientes con patología de base, los tratados previamente con corticoides o palivizumab y los nacidos prematuros por debajo de la semana 32 de gestación, por presentar estos casos, por sí mismos, una demostrada propensión hacia una evolución más grave y podrían estar tratados con palivizumab21. Se excluyó también a aquellos cuya analítica hiciera comprobar o sospechar una sobreinfección bacteriana considerando tal situación en caso de hemocultivo o urocultivo positivo, leucocituria y/o nitrituria, así como elevación de la cifra de reactantes de fase aguda, como proteína C reactiva superior a 70 mg/l y/o procalcitonina superior a 0,5 ng/ml y también en aquellos casos donde el clínico sospechara una sobreinfección bacteriana con independencia de las pruebas complementarias, según criterios previamente publicados14,15.
La variable principal fue la necesidad de «ingreso en UCIP» durante la estancia hospitalaria para el empleo de ventilación mecánica, considerando esta cualquier modalidad de tipo invasivo (ventilación mecánica convencional o de alta frecuencia) o no invasivo (presión positiva no invasiva ya fuera CPAP o BiPAP), sin incluir la modalidad de cánulas de alto flujo. Esta variable fue categorizada de forma binaria: sí/no. Los criterios habituales seguidos para el ingreso en UCIP se muestran en la tabla 1.
Además, de cada paciente se recogieron las variables al ingreso que pudieran actuar como variables de confusión: sexo, edad, edad posmenstrual, exposición gestacional y posnatal al tabaco, mes de ingreso, tipo de lactancia, presencia de apneas y días de evolución del distrés respiratorio. Asimismo, las cifras de hemoglobina, neutrófilos, linfocitos, eosinófilos, basófilos y monocitos, que fueron categorizadas por cuartiles para su análisis. La variable edad posmenstrual se categorizó según hubiera alcanzado el lactante la cifra de 44 semanas, considerada esta como el límite del periodo neonatal en condiciones de igualdad con independencia de la edad gestacional.
Tras el seguimiento retrospectivo de la cohorte, se consideró casos a aquellos lactantes que durante el ingreso hubieran precisado los cuidados incluidos en la variable principal. Los restantes fueron considerados controles. El análisis estadístico se realizó mediante el programa PSPP GNU de software libre. Los resultados se expresaron como porcentajes para las variables cualitativas, con intervalo de confianza (IC) para la variable principal y media con desviación estándar para las variables cuantitativas.
Para examinar los posibles factores de relación se realizó una prueba t de Student para las variables cuantitativas respecto del ingreso en UCIP y un análisis bivariante mediante la prueba chi al cuadrado o exacta de Fisher, según conveniencia, entre la variable principal (ingreso en UCIP) y la cifra de linfocitos, así como con las distintas variables independientes del estudio. Para evitar sesgos de confusión, se realizó análisis multivariante de la variable principal mediante regresión logística binomial con la cifra de linfocitos, junto al resto de los factores asociados, incluyendo en el modelo las variables con una p < 0,20 en el análisis bivariante y aquellos clínicamente posibles según estudios previos. Se consideró estadísticamente significativa cualquier p < 0,05 y todos los IC se calcularon al 95%.
El estudio fue aprobado por el comité de ética de nuestro hospital y no se consideró necesario el consentimiento informado al tratarse de un estudio observacional retrospectivo cuya obtención de datos fue disociada anónimamente.
ResultadosDe un total de 1.197 casos ingresados por bronquiolitis durante el periodo de estudio, en 901 se constató la presencia de VRS en el aspirado nasofaríngeo. De ellos, en 434 se comprobó la obtención de una analítica en las primeras 48h del distrés respiratorio realizada por criterios clínicos. En 127 se descartó su inclusión pues recibieron el diagnóstico de infección bacteriana grave asociada según los criterios previamente expuestos. Además, fueron descartados los lactantes con enfermedades de base, los mayores de 12 meses y los pretérminos de menos de 32 semanas de gestación. Al final fueron incluidos en el estudio 252 lactantes con BA por VRS, previamente sanos y sin evidencia de complicación infecciosa bacteriana. Las características demográficas de la muestra se presentan en la tabla 2.
Estadísticos numéricos descriptivos de lactantes con bronquiolitis por VRS previamente sanos menores de 12 meses
| N | Mínimo | Máximo | Media | DE | |
|---|---|---|---|---|---|
| Peso al nacimiento (g) | 243 | 1.440 | 5.000 | 3.162 | 565 |
| Edad gestacional (semanas) | 252 | 33,0 | 42,0 | 38,41 | 1,83 |
| Edad (meses) | 252 | 0,16 | 10,12 | 2,42 | 1,64 |
| Edad posmenstrual (semanas) | 247 | 36,14 | 85,00 | 48,87 | 7,35 |
| Edad madre (años) | 187 | 15 | 44 | 29,32 | 6,24 |
| Estancia hospitalaria (días) | 252 | 1 | 25 | 6,34 | 3,30 |
| Hemoglobina (g/dl) | 252 | 8,2 | 17,3 | 11,25 | 1,69 |
| Neutrófilos/ml | 252 | 900 | 17.989 | 5.497 | 3.141 |
| Linfomonocitos/ml | 252 | 280 | 19.430 | 6.969 | 2.749 |
DE: desviación estándar.
La incidencia de ingresos en UCIP durante la estancia hospitalaria de la muestra fue de 17 pacientes, el 6,6% (IC del 95%: 4-10%). El análisis de las variables numéricas se presenta en la tabla 3, donde se muestra la significación estadística en la diferencia de la cifra de linfocitos y la edad posmenstrual respecto al ingreso en la UCIP. La cifra global de frecuencias y la distribución según la necesidad de ingreso en la UCIP de las variables cualitativas, junto al nivel de significación alcanzado en el análisis bivariante, se muestran en la tabla 4. En ella destaca la asociación de la variable principal con la cifra de linfocitos categorizada, con la edad posmenstrual < 44 semanas, con la presencia de apneas y con la fiebre. No hubo relación entre los principales tramos etarios y la distribución por cuartiles de linfocitos (tabla 5).
Prueba t de Student de variables cuantitativas en lactantes con bronquiolitis aguda
| UCIP sí/no = 1/0 | N | Media | Desviación estándar | Prueba t (p) | |
|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 0 | 235 | 11,39 | 1,92 | 0,637 |
| 1 | 17 | 11,62 | 2,08 | ||
| Leucocitos (n/ml) | 0 | 235 | 12.576 | 4.314 | 0,083 |
| 1 | 17 | 1.0691 | 4.182 | ||
| Neutrófilos (n/ml) | 0 | 234 | 5.652 | 3.141 | 0,357 |
| 1 | 17 | 4.932 | 2.570 | ||
| Linfocitos (n/ml) | 0 | 232 | 5.035 | 1.786 | 0,028 |
| 1 | 17 | 4.044 | 1.765 | ||
| Eosinófilos (n/ml) | 0 | 229 | 116 | 148 | 0,319 |
| 1 | 17 | 80 | 63 | ||
| Monocitos (n/ml) | 0 | 229 | 1.142 | 484 | 0,896 |
| 1 | 17 | 1.158 | 488 | ||
| Basófilos (n/ml) | 0 | 228 | 134 | 117 | 0,206 |
| 1 | 17 | 98 | 61 | ||
| Plaquetas (n/ml) | 0 | 231 | 475.601 | 159.151 | 0,320 |
| 1 | 17 | 435.764 | 160.240 | ||
| Peso al nacimiento (g) | 0 | 228 | 3.167 | 574 | 0,647 |
| 1 | 15 | 3.098 | 397 | ||
| Semana de gestación | 0 | 241 | 38,42 | 1,85 | 0,770 |
| 1 | 17 | 38,28 | 1,68 | ||
| Edad posmenstrual (semanas) | 0 | 232 | 49,19 | 7,42 | 0,001 |
| 1 | 15 | 43,84 | 3,45 | ||
Frecuencia de las variables cualitativas en pacientes menores de 12 meses sin patología de base con edad gestacional > 32 semanas, ingresados por bronquiolitis aguda por el VRS
| Total% (n = 252) | UCIP % (n= 17) | No UCIP % (n= 235) | p (chi al cuadrado) | |
|---|---|---|---|---|
| Sexo varón | 50,4 | 52,9 | 50,2 | 0,828 |
| Peso en p < 3% | 4,5 | 6,4 | 4,6 | 0,646 |
| Edad gestacional | 0,859 | |||
| > 37 semanas | 86,8 | 88,2 | 86,7 | |
| 32-36 semanas | 13,2 | 11,8 | 13,3 | |
| Nacimiento riesgo estacional | 36,8 | 64,7 | 34,9 | 0,019 |
| Evolución distrés < 48 h | 77,0 | 81,3 | 76,7 | 0,911 |
| Linfocitos (primer cuartil), n/ml | 0,034 (EF) | |||
| < 3.700 | 23,7 | 47,1 | 22,0 | |
| ≥ 3.700 | 24,8 | 11,8 | 25,7 | |
| Lactancia materna | 43,5 | 50,0 | 43,0 | 0,585 |
| Edad posmenstrual < 44 semanas | 27,5 | 66,7 | 25,0 | < 0,001 |
| Tabaquismo gestacional | 14,6 | 5,9 | 15,2 | 0,292 |
| Tabaquismo ambiental | 33,5 | 29,4 | 38,8 | 0,713 |
| Fiebre > 38° C | 53,9 | 25,0 | 55,8 | 0,017 |
| Apneas | 8,2 | 35,3 | 6,3 | <0,001 |
EF: exacta de Fisher; UCIP: unidad de cuidados intensivos pediátricos; VRS: virus respiratorio sincitial.
Edad en tramos respecto a la distribución por cuartiles en lactantes con bronquiolitis aguda por VRS
| Linfocitos (cuartiles de la distribución de linfocitos) | Total | ||||||
|---|---|---|---|---|---|---|---|
| ≤ 3700,00 | 3.701,00-4.900,00 | 4.901,00–6.180,00 | 6.181,00+ | ||||
| Edad tramos | < 1 mes | Recuento | 14 | 11 | 9 | 10 | 44 |
| % | 31,8 | 25,0 | 20,5 | 22,7 | 100,0 | ||
| 1-3 meses | Recuento | 33 | 32 | 36 | 29 | 130 | |
| % | 25,4 | 24,6 | 27,7 | 22,3 | 100,0 | ||
| > 3 meses | Recuento | 16 | 19 | 17 | 23 | 75 | |
| % | 21,3 | 25,3 | 22,7 | 30,7 | 100,0 | ||
| Total | Recuento | 63 | 62 | 62 | 62 | 249 | |
| % | 25,3% | 24,9 | 24,9 | 24,9 | 100,0 | ||
Chi al cuadrado, n = 258; p = 0,736.
El análisis multivariante por regresión logística binomial de la variable principal necesidad de cuidados en la UCIP con las variables independientes incluidas en el modelo se presenta en la tabla 6. Alcanzaron significación estadística la edad posmenstrual menor de 44 semanas y los casos con linfocitosis en el cuartil 1 de la cohorte, en concreto aquellos con una cifra de linfocitos menor de 3.700/ml.
Análisis de regresión logística binomial de la muestra de lactantes con bronquiolitis por VRS respecto a la necesidad de cuidados en UCIP
| B | Error estándar | Wald | Sig. | Exp(B) | IC del 95% para EXP(B) | ||
|---|---|---|---|---|---|---|---|
| Inferior | Superior | ||||||
| Linfocitos < 3.700/ml | 1,332 | ,651 | 4,191 | ,041 | 3,790 | 1,058 | 13,571 |
| Fiebre < 38°C | ,666 | ,677 | ,967 | ,325 | 1,946 | ,516 | 7,338 |
| Nacimiento de riesgo | 1,977 | ,677 | 8,528 | ,003 | 7,224 | 1,916 | 27,234 |
| E. posmenstrual < 44 semanas | 1,384 | ,660 | 4,398 | ,036 | 3,991 | 1,095 | 14,547 |
| Apnea previa a UCIP | 1,792 | ,973 | 3,393 | ,065 | 6,001 | 0,892 | 40,395 |
Los hallazgos encontrados en nuestro trabajo indican la asociación entre una menor respuesta linfocitaria sistémica y la evolución más grave de la enfermedad. Puede interpretarse, por tanto, como un factor de riesgo de peor evolución, con independencia del mes de nacimiento, la fiebre, la edad, los menores de 44 semanas de edad posmenstrual o la presencia de apneas (tabla 6). En el análisis bivariante se ha establecido, asimismo, la independencia de factores como el tabaquismo, el tiempo de evolución del distrés respiratorio y la modalidad de lactancia (tabla 4).
La BA por el VRS supone la primoinfección en un huésped que no tiene mecanismos de inmunidad contra este agente y su desarrollo tiene implicaciones en la patogenia que es distinta de las sucesivas reinfecciones que acontecerán a lo largo de la vida9. La probabilidad de que una BA provoque una mayor afectación está condicionada por la virulencia del agente causante y la susceptibilidad individual del paciente, lo que involucra la madurez y el comportamiento de su sistema inmunitario.
En cuanto a la virulencia, parece que el VRS es el de mayor incidencia y gravedad entre los lactantes5,10,11 en cuanto a estancia total, necesidad de cuidados respiratorios y generales se refiere22. La incidencia de ingresos en UCIP del 6,6% se refiere a lactantes sanos sin complicaciones bacterianas asociadas ni otros factores de riesgo previos. Es, por tanto, una cifra atribuible a la bronquiolitis per se y por ello es algo menor que las cifras globales publicadas en los estudios previos1,2,23,24.
La inmadurez inmunológica del lactante implica una preponderancia de linfocitos T inespecíficos circulantes producidos en el timo frente al adulto. La regulación y la producción de células T de memoria acontecen en epitelio intestinal y bronquial25. La patogenia de la BA se caracteriza por una respuesta balanceada de citoquinas Th1/Th2 además del efecto citopático. El mejor representante Th1 es el IFN-γ que, como exponente de la respuesta innata inicial, limita la replicación viral y contrarresta la acción de citocinas Th2 relacionada muy directamente con el nivel de interleucina 4 (IL-4). El desequilibrio hacia una respuesta Th2 se ha asociado a los casos más graves de BA26 y a un menor número de linfocitos, como en nuestro estudio. Para el análisis de dicha polarización, lo más correcto sería usar índices entre representantes de ambas vías, como puede ser el índice IL-4/IFN-γ. Se ha descrito que un déficit de IFN-αβ y de INF- γ tras la infección viral refleja el desarrollo insuficiente de la respuesta celular T, la mayoría de los circulantes, y con menor capacidad de eliminación de células infectadas, y explicaría la gravedad de la BA27.
Asimismo, se han hallado niveles plasmáticos bajos de IFN-γ y de linfocitos T en niños con BA moderada-grave, explicado por un posible efecto inhibitorio del virus sobre la respuesta innata, ya de por sí inmadura17. Este efecto sería además característico de la infección por VRS respecto de otros patógenos para el mismo periodo de la vida28. Tras la primoinfección por el VRS acontecen los mecanismos tanto de proliferación como de apoptosis que modularán la respuesta inmunitaria y que tendrán reflejo en el hemograma una vez establecida la enfermedad29. Además, recientemente se ha demostrado que el VRS reduce parcialmente la respuesta Th1 al inhibir genéticamente al IFN en la fase aguda y meses después de la infección que se ha denominado como «inmunodisregulación» por VRS30,31. La maduración del lactante con la edad confiere demostrada eficacia contra la infección32,33.
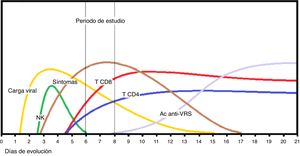
La mayor fortaleza del estudio es haber podido delimitar en perspectiva la cohorte de casos de BA sin complicaciones asociadas que pudieran influir en la evolución grave, con una selección cuidadosa de lactantes previamente sanos y de un tiempo de evolución homogéneo, que generalmente coincide con la llegada del lactante al hospital en el inicio del distrés respiratorio con la enfermedad claramente establecida y en su periodo de estado, como se muestra en la figura 1. La cifra escogida como límite de 3.700 linfocitos/ml puede parecer arbitraria, pero es orientativa y resulta del análisis de la distribución de la muestra. Representa el primer cuartil de los ingresados por BA con los mencionados criterios de inclusión. Aunque la escasa respuesta linfocitaria ha sido referida con anterioridad en casos graves de BA17,18, nuestro análisis ofrece esta cifra orientativa como valor práctico de uso clínico. La conveniencia de proponer un análisis de sangre en determinados casos de BA para anticipar el mayor riesgo de evolución grave está dentro de las consecuencias de nuestros hallazgos.
Secuencia de eventos de la inmunidad en la primoinfección por VRS en lactantes con bronquiolitis aguda. Tras la incubación prodrómica, el pico de carga viral acontece en torno al 4.° día asociado a la activación de células natural killer (NK) que liberan interferón-γ, seguida del reclutamiento de linfocitos T CD4 y CD8. Los síntomas catarrales aparecen entre el 3 y 5 desde la infección y el distrés respiratorio sobreviene sobre las 48 h de los síntomas catarrales. La formación de anticuerpos neutralizantes contra las proteínas de superficie (Ac anti-VRS) es tardía, a la vez que se elimina el virus y decrece la sintomatología.
Como limitaciones del trabajo, cabe señalar que no se ha estudiado la muy probable asociación de coinfecciones virales, que en las series próximas a nuestro medio alcanzan el 30% de las BA34. Tampoco se ha tipificado el VRS en A o B. Además, el tamaño de la muestra es pequeño, con IC amplios, por lo que harían falta estudios prospectivos multicéntricos para afianzar la certeza de nuestros resultados.
En conclusión, nuestros datos ofrecen una relación entre la cifra de linfocitos circulantes inferior a 3.700 /ml en las primeras 48 h del distrés respiratorio y una peor evolución en lactantes menores de 12 meses previamente sanos y edad gestacional > 32 semanas con BA por el VRS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.