Introducción
La tuberculosis se ha convertido a finales de la década de 1980 y principios de 1990 en una enfermedad emergente en los países occidentales, debido principalmente a la epidemia del virus de la inmunodeficiencia humana (VIH) y a la creciente inmigración desde países con tuberculosis endémica. Por otra parte, el rebrote de casos graves de tuberculosis se ha querido relacionar con la supresión de la vacuna de bacilo de Calmette-Guérin (BCG), vacuna que dejó de administrarse en la Comunidad de Madrid en 1987.
La forma más grave de infección por Mycobacterium tuberculosis en la infancia es la meningitis tuberculosa, que se presenta en alrededor del 4 % de los niños con tuberculosis1.
En este artículo se presentan las características epidemiológicas, clínicas y evolutivas de 28 pacientes con meningitis tuberculosa ingresados en el Hospital Infantil La Paz a lo largo de 26 años, entre 1977 y 2003.
Pacientes y métodos
Se han revisado los 28 casos de meningitis tuberculosa diagnosticados en el Servicio de Enfermedades Infecciosas del Hospital Infantil La Paz desde enero de 1977 hasta diciembre de 2003. De ellos, 12 (42 %) venían remitidos de otros hospitales.
Se consideró diagnóstico de meningitis tuberculosa la alteración del líquido cefalorraquídeo (LCR) compatible, es decir, más de 10 linfocitos/μl, índice de glucosa en sangre/LCR < 0,6 mg/dl y proteinorraquia aumentada (> 40 mg/dl), asociado a uno o más de los siguientes hallazgos:
1.Aislamiento de M. tuberculosis en LCR, jugo gástrico o esputo.
2.Microscopia positiva para bacilos ácido-alcohol resistentes en LCR, aspirado gástrico, esputo o fluidos estériles del organismo.
3.Prueba de la tuberculina positiva (induración ≥ 5 mm) al inicio o durante el curso de la enfermedad.
4.Antecedente epidemiológico de contacto con una persona con tuberculosis activa comprobada.
En todos los casos se realizó tinción de Ziehl-Neelsen o auramina en busca del bacilo y cultivo de LCR y jugo gástrico en medio sólido de Löwenstein-Jensen y medios líquidos (Bactec 460 R de Becton-Dickinson y MB-Bact/ Alert 3D de Organon Teknica, Boxtel, Netherlands, desde 1998). La identificación de M. tuberculosis se realizó mediante sondas de ácidos nucleicos (Accuprobe, Gene probe BioMérieux) para M. tuberculosis o test bioquímicos como el test de niacina (Niacin reagent, strip remel, Lenerax, EE.UU.). Se realizaron asimismo cultivos de LCR y hemocultivos buscando otros posibles agentes etiológicos.
La intradermorreacción de Mantoux se llevó a cabo con 2 U de tuberculina PPD RT-23, con lectura a las 72 h. Se consideró positiva una induración mayor o igual de 5 mm, con independencia de la extensión del eritema. Según la sintomatología que presentaban en el momento del diagnóstico, los enfermos se clasificaron en uno de los tres estadios establecidos1:
1.Estadio I. Sintomatología infecciosa inespecífica con febrícula, anorexia, irritabilidad o cefalea.
2.Estadio II. Aparición de signos de hipertensión intracraneal y daño neurológico como somnolencia, alteración de pares craneales (III, VI y VIII fundamentalmente), anisocoria o convulsiones.
3.Estadio III. Afectación neurológica grave con coma, respiración y pulso irregular, estado convulsivo, etc.
Se analizaron los datos referentes a sexo, edad, contactos próximos con enfermos tuberculosos, vacunación con BCG, estadio clínico de la enfermedad y existencia de signos meníngeos en el momento del diagnóstico. Asimismo, se investigaron otras posibles localizaciones del bacilo, resultado de la prueba de tuberculina, estudio del fondo de ojo, analítica de sangre (hemograma y bioquímica), citoquímica del LCR, bacteriología, electroencefalograma (EEG), tomografía computarizada (TC), evolución clínica, seguimiento, complicaciones del tratamiento y secuelas de la enfermedad.
Los datos se analizaron con el programa estadístico SPSS®, y se compararon mediante los tests de la chi al cuadrado (x2) (con corrección exacta de Fischer en los casos oportunos).
Resultados
Características demográficas
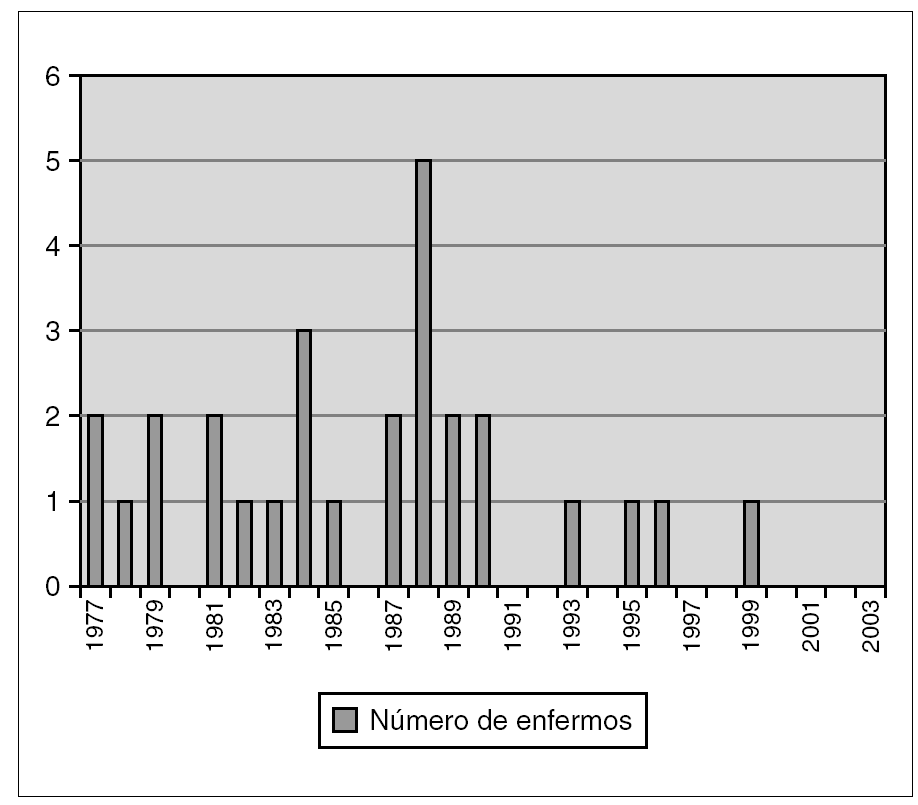
Se han analizado 28 casos entre 1977 y 2003 (27 años). Sólo se han diagnosticado cuatro casos (15 %) en los últimos 13 años, frente a 24 casos (85 %) en los 14 años anteriores (fig. 1). La tasa de incidencia de meningitis tuberculosa en nuestro hospital en el segundo período fue de 2,82/100.000 niños ingresados.
Figura 1. Frecuencia anual de ingresos por meningitis tuberculosa.
La edad media de nuestros pacientes fue de 3,6 años, y la mediana fue de 3,3 años, con un rango entre 5 meses y 11 años. El 32 % ocurrieron entre los 3 y los 6 años, y el 43 % por debajo de los 2 años. Hubo 15 varones y 13 mujeres, con una relación varón/mujer de 1,15/1. Tenían un contacto bacilífero comprobado (familiar o persona próxima al niño) 18 casos (64 %). En 13 casos (46 %) existía conocimiento de una tuberculosis previa en la familia. Existía constancia de inmunización con BCG en 2 pacientes (7 %) de 1 y 5 años, y de ausencia de vacunación en 21 casos (78 %); en cinco no pudo confirmarse con seguridad.
Datos clínicos y exploraciones complementarias
Ninguno de los niños tenía infección por el VIH como condición subyacente.
En el momento del diagnóstico, 8 niños (29 %) podían incluirse en estadio I, 9 casos (32 %) en estadio II y 11 (39 %) en estadio III de la enfermedad. Consultaron con algún signo de focalidad 13 niños (46 %), principalmente parálisis de los pares craneales y crisis convulsivas. Los signos meníngeos sólo fueron positivos en 16 casos (57 %), dudosos en tres (11 %) y negativos en nueve (32 %). Sólo 6 niños (21 %) mostraban edema de papila evidente. El fondo de ojo fue normal en el momento del ingreso en 16 pacientes (57 %), y el resto presentaban diferentes grados de borramiento y edema. El 54 % de los casos tenía una imagen pulmonar parenquimatosa o hiliar compatible con tuberculosis pulmonar. No se hallaron otras localizaciones de la enfermedad. En un caso, 2 meses antes del inicio del cuadro, había aparecido un eritema nudoso.
La intradermorreacción de Mantoux en el momento del diagnóstico fue mayor de 5 mm en 25 casos (89 %), entre 5 y 10 mm en 2 casos (7 %), y en 3 casos fue negativa (11 %).
Datos analíticos
La analítica sanguínea mostró un recuento leucocitario que osciló entre 3.900 y 32.200 leucocitos/μl, con una media de 11.600/μl. El 79 % de los casos tenían menos de 14.000 leucocitos, y fórmula normal. Existía predominio de neutrófilos en 10 casos (36 %). La velocidad de sedimentación globular (VSG) fue normal en 4 niños (14 %). En 22 (79 %) la elevación fue moderada, y sólo en dos fue mayor de 60 mm/h. El resto de los datos analíticos estuvieron dentro de valores normales, salvo 3 casos (11 %), que presentaron una elevación discreta o moderada de las transaminasas. No se detectó hiponatremia al inicio en ningún niño, aunque sí a lo largo de la evolución en seis (21 %).
El estudio de la primera muestra del LCR presentaba una media de 195 cél./μl, con un rango entre 20 y 580. El 54 % de los casos (15 niños) tenía entre 100 y 300 células. Se demostró predominio linfocitario en el 67 % de los casos. La glucorraquia alcanzó valores que oscilaron entre 8 y 62 mg/dl, con una media de 29 mg/dl. La proteinorraquia en LCR estaba elevada en todos los pacientes con un máximo de 1.290 mg/dl y una media de 226 mg/dl. Sólo en 7 casos (25 %), los valores fueron superiores a 200 mg/dl. En 3 niños (11 %) el estudio completo del LCR (glucosa, proteínas y células) fue compatible con una meningitis viral, con glucorraquia normal e hipercelularidad (70-400 células) de predominio linfocitario. En cuanto al estudio bacteriológico, sólo en un caso se obtuvo visión directa del bacilo en LCR con tinción de Ziehl-Neelsen. En 9 casos (32 %) el cultivo en medio de Löwenstein-Jensen fue positivo. En dos de éstos, se obtuvo también crecimiento de M. tuberculosis en jugo gástrico.
Se efectuó EEG al inicio del tratamiento en 25 (89 %) casos, apareciendo una lentificación más o menos intensa del trazado en 23 de ellos (92 %). Aparecieron trazados con alteraciones focales en 3 pacientes (11 %). En todos los niños diagnosticados después de 1978 (22 pacientes) se realizó TC, que mostró signos de hidrocefalia con dilatación uni o multiventricular en 20 casos (91 % de los pacientes con TC). En 10 de 23 casos la ventriculomegalia era grave y en 8 de 23 era discreta o moderada. La TC fue normal en 2 de 23 pacientes. En 2 pacientes se encontró imagen de tuberculoma intracraneal; en otros dos signos de aracnoiditis (opacidades y disminución de la densidad de las cisternas basales y acueducto de Silvio) y, en un caso, imagen de cerebritis focal.
Tratamiento
El número de días transcurridos entre el inicio de la sintomatología y el diagnóstico osciló entre 3 y 60 días, con una media de 14 días y una mediana de 10 días.
Inicialmente se utilizaron rifampicina e isoniazida durante 18-24 meses, a las que se asoció estreptomicina durante los primeros 2 meses. Desde 1984 se redujo la duración del tratamiento a un año, añadiéndose pirazinamida como cuarto fármaco. Nueve pacientes recibieron etambutol en lugar de estreptomicina durante los primeros 2 meses.
Únicamente 6 niños presentaron efectos secundarios al tratamiento, por lo general leves (intolerancia digestiva, elevación moderada de las transaminasas, ictericia, vómitos) que cedieron con disminución o suspensión temporal de rifampicina, sin que precisaran retirada definitiva en ningún caso. No se produjeron efectos adversos con el resto de los fármacos.
Fueron tratados con corticoides 25 niños (89 %), todos desde 1984, por un período de entre 6 y 12 semanas a dosis progresivamente decrecientes.
Fue precisa la colocación de válvula de derivación ventriculoperitoneal de LCR en 12 niños (43 %) con edades comprendidas entre 1 y 6 años (edad media de 3,5 años). En 11 niños (39 %) se utilizaron fármacos antiepilépticos por crisis convulsivas.
Datos de evolución y pronóstico
La mayoría de los niños estuvieron ingresados entre 1 y 2 meses, con un mínimo de 16 días y un máximo de 6 meses. Tres pacientes con deterioro neurológico grave perdieron el contacto con el hospital a los 40 y 50 y 180 días de evolución, y no se puede descartar su fallecimiento.
En cuanto a la mortalidad, en nuestra revisión tres de los niños fallecieron: uno en su domicilio tras pedir el alta voluntaria a los 15 días del ingreso, otro a los 5 meses del diagnóstico y tratamiento tras reingresar con estado convulsivo, hipertermia e insuficiencia hepatorrenal, y el tercero a los 45 días de tratamiento por una sepsis. Según estos datos, nuestra mortalidad se sitúa en el 10,7 %, considerando únicamente los casos de evolución conocida. Los tres fallecidos tenían 6, 4 y 2 años, respectivamente. Este último tuvo una prueba de tuberculina negativa. Ninguno de ellos tenía puesta la vacuna BCG. Los tiempos de evolución antes de iniciar el tratamiento específico en cada caso fueron 1 mes, 8 días y 10 días. Todos ellos presentaban un EEG con trazado lento y difuso, y el primero de ellos presentaba focalidad temporal izquierda. En la TC, uno de ellos presentó hidrocefalia comunicante con edema periventricular, otro hidrocefalia y aracnoiditis de la base y un tercero dilatación ventricular moderada. No se halló relación con el estadio clínico en el que llegaron (I, III y II, respectivamente).
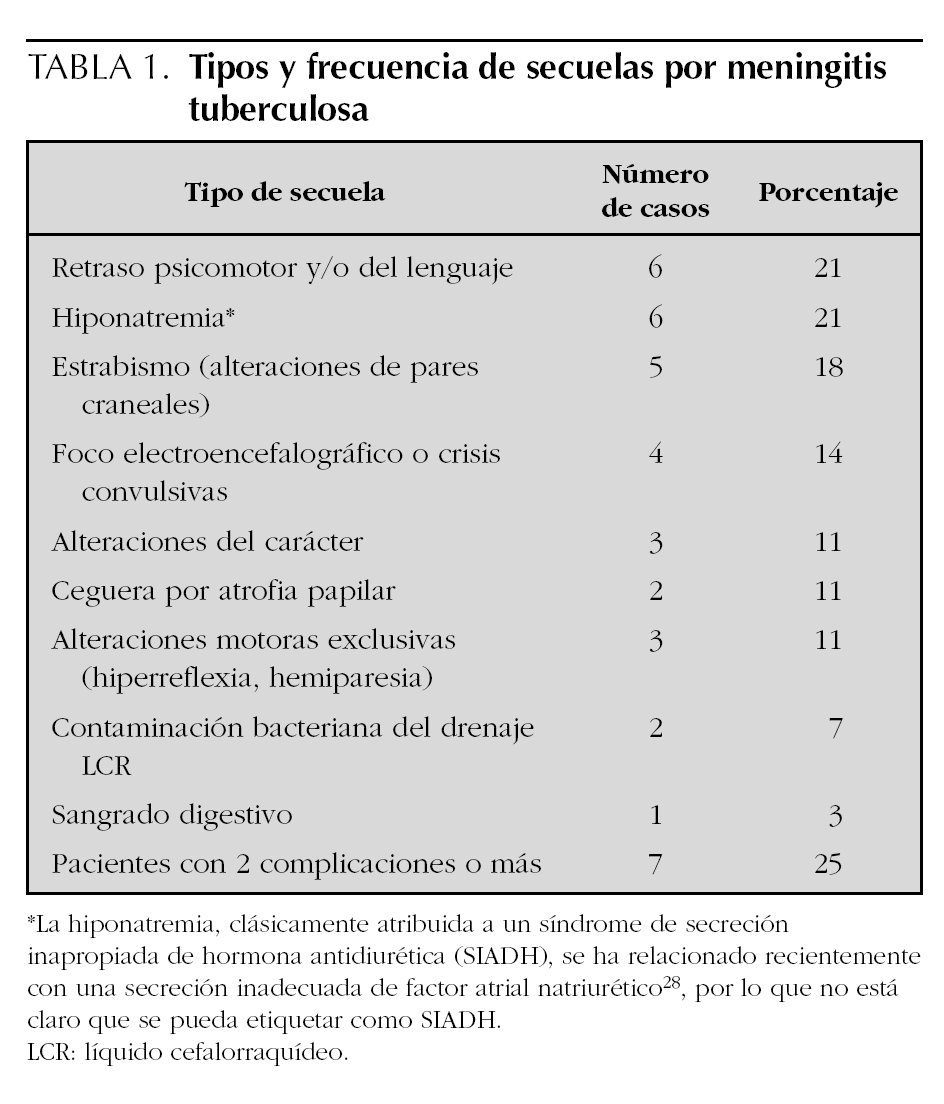
Se produjeron secuelas en 14 casos (50 %). Siete (25 %) pacientes presentaron más de una secuela. Los tipos de secuelas y su frecuencia en nuestra serie aparecen en la tabla 1. Las únicas complicaciones reversibles fueron las alteraciones de los pares craneales (5 casos de paresia [que remitieron en todos los casos] y un caso de ceguera) y la hiponatremia. Tres de los niños fueron trasladados a sus comunidades autónomas con afectación neurológica muy grave. Otras complicaciones fueron: un episodio de sangrado digestivo (probablemente secundario a corticoterapia) y dos episodios de contaminación bacteriana del LCR tras derivación ventriculoperitoneal.
Entre los supervivientes, ninguno de los 8 pacientes con estadio I presentó secuelas definitivas (sí hubo una oftalmoplejía reversible); frente al 33 % de los nueve que alcanzaron un estadio II (más otro 33 % de reversibles), y el 55 % de los 11 que llegaron a un estadio III (ninguna de ellas reversible). Entre los niños con secuelas irreversibles o fallecidos, el tiempo de evolución hasta el diagnóstico osciló entre 4 y 30 días, con una media de 14 días y una mediana de 10 días.
Discusión
La epidemiología de la meningitis tuberculosa en niños dentro de cada comunidad sigue un patrón paralelo a la incidencia de enfermedad tuberculosa en dicha comunidad1-6. En nuestro país, como en la mayoría de los países industrializados, las tasas de incidencia de la enfermedad están disminuyendo. La frecuencia de meningitis tuberculosa en nuestro estudio durante los años 1977-1990 permaneció alta como reflejo de tasas de incidencia elevadas en España, a diferencia de los trabajos publicados en la literatura anglosajona, ya que estos países presentaban durante ese período tasas mucho más bajas que las nuestras7-10. Sin embargo, en los últimos años la frecuencia de presentación de esta enfermedad ha disminuido llamativamente (fig. 1), aun siendo la tuberculosis una patología emergente en Europa11,12. En la primera mitad del período estudiado se registraron 5,7 veces más casos que en la segunda mitad. Esto puede explicarse porque la causa fundamental de la disminución de la endemia tuberculosa en España en los últimos 15 años, ha sido la mejora socioeconómica, seguida de la disminución de casos de sida con tuberculosis asociada. Por otro lado, la atención primaria, que cubre a todos los sectores de la población (incluyendo inmigrantes ilegales), ha mejorado en este período de tiempo. Ambos factores favorecen el diagnóstico precoz de la tuberculosis pulmonar, lo que lleva a una disminución de los casos graves. En este sentido, las mayores series publicadas proceden de países con capacidad asistencial limitada o que albergan una población con nivel socioeconómico bajo13-15.
Se ha descrito que la vacunación con BCG disminuye el riesgo de meningitis en un 75-86 %16-19, y que en caso de producirse afectación meníngea, estos niños presentan menos secuelas1. Sin embargo, en nuestra serie, la supresión de la vacunación BCG en la Comunidad de Madrid en 1987, como consecuencia de la disminución de las tasas de enfermedad tuberculosa, no ha tenido impacto en las tasas de meningitis tuberculosa, que siguen disminuyendo como corresponde a una situación de endemia de tuberculosis favorable en nuestro medio2. Esto parece confirmar que la disminución de la meningitis tuberculosa estaría más ligada al descenso de la incidencia de la tuberculosis infantil en general que a la eficacia preventiva de la vacuna.
Habitualmente la intradermorreacción de Mantoux es positiva en la mayoría de los niños al inicio de la enfermedad, pero hay amplias diferencias entre unas series y otras (16-70 %)1-4,18. Nuestros enfermos tuvieron intradermorreacción positiva en una alta proporción (89 %), lo que contrasta con el clásico concepto de prueba de tuberculina negativa que se positiviza durante el tratamiento. Este hecho sucedió en tan sólo un niño en nuestro estudio. Algunos estudios definen positividad como superior a 10 mm, pero la Sociedad Española de Neumología Pediátrica lo considera a partir de 5 mm20. Ya se ha publicado anteriormente en nuestro medio hasta el 70 % de pacientes con induración mayor de 10 mm6.
La radiografía de tórax en el momento del diagnóstico puede ser normal, pero existe algún dato indicativo de tuberculosis pulmonar en el 40-72 % de los casos. En nuestra serie la afectación pulmonar consistió principalmente en adenopatías hiliares o mediastínicas.
El diagnóstico precoz de la meningitis tuberculosa continúa siendo pieza clave en el pronóstico de la enfermedad. Al margen de la edad y el estadio clínico, el retraso en el diagnóstico e inicio del tratamiento es uno de los factores que más se han relacionado con una mayor tasa de mortalidad y secuelas irreversibles1,4,13,21. Entre los fallecidos en nuestra serie, uno llevaba más de un mes sintomático y otro había sido tratado 2 años antes con etambutol e isoniazida por tuberculosis pulmonar. El tercero llevaba tan sólo 10 días de evolución. Las dificultades diagnósticas de la meningitis tuberculosa radican en la variabilidad de su presentación clínica, la frecuente inespecificidad de los síntomas iniciales y la escasa rentabilidad de la bacteriología (elevada incidencia de hallazgos atípicos en LCR)4,22,23. En nuestro estudio, el 70 % de los casos fueron diagnosticados en estadios tardíos de la enfermedad tras un prolongado período de sintomatología clínica inespecífica, y el 43 % cursaron con signos meníngeos dudosos o negativos. Las técnicas de diagnóstico microbiológico rápido sólo fueron positivas en 2 pacientes y el diagnóstico de certeza se realizó únicamente en el 32 % de los pacientes. La prueba con mayor sensibilidad ha sido la TC, que mostró hidrocefalia en 91 % de los casos. Por lo tanto, pensamos que sería recomendable su realización precoz en los niños con meningitis linfocitaria con hipoglucorraquia o hiperproteinorraquia llamativa o ante cualquier meningitis supuestamente viral si existe mala evolución clínica, alteraciones en el EEG o signos de focalidad neurológica. La TC también permite detectar la presencia de complicaciones, controlar la necesidad de colocación de una válvula de derivación y valorar la respuesta al tratamiento24,25.
En nuestro estudio presentaron secuelas el 50 % de los niños, muchas de ellas persistentes. La secuela más frecuente fue el retraso psicomotor o del lenguaje, seguida de cerca por la oftalmoplejía con estrabismo.
Del total de pacientes de estadio I el 25 % presentaron secuelas irreversibles, el 33 % de los del estadio II y el 56 % de los del III. Analizamos estos datos mediante la prueba de la x2, concluyendo que hay más pacientes que llegan al estadio III que posteriormente presentan secuelas irreversibles que en los otros estadios, pero no hay casos suficientes para que esta diferencia sea estadísticamente significativa (p = 0,09). Asimismo, los pacientes con estadio I tuvieron menos secuelas que los otros estadios, pero la diferencia tampoco fue significativa (p = 0,056).
Desde 1984, coincidiendo con el momento en que se inició el tratamiento con corticoides asociado al régimen de cuatro tuberculostáticos recomendado por la American Academy of Pediatrics26 y el Joint Tuberculosis Committee27, no hubo ningún fallecimiento. El análisis estadístico no permite afirmar si esta disminución en la mortalidad se debe o no al uso de corticoides, pero un análisis con más pacientes podría definirlo. No se ha encontrado diferencia en cuanto a las secuelas frente a la época en que no se utilizaron corticoides, aunque algunos estudios han demostrado que su empleo disminuye significativamente la mortalidad y el retraso mental14.
El drenaje ventricular externo y la derivación ventriculoperitoneal se realizaron cuando se observó la presencia de hidrocefalia, deterioro neurológico a pesar del tratamiento médico adecuado, aumento de la presión intracraneal o detección por TC de aumento del tamaño de la cisterna basal. Esta técnica tiene pocas complicaciones, y muchos autores la consideran un complemento capaz de mejorar el pronóstico. Nosotros compartimos esta opinión cuando su aplicación es precoz, especialmente en lactantes.