Recién nacido de sexo femenino que ingresa en unidad de neonatología por haberse observado una masa retroperitoneal izquierda en la ecografía realizada en el segundo trimestre del embarazo.
Antecedentes personales: es el primer hijo de una pareja sana, con gestación a término (39 + 5 semanas) controlada y bien tolerada. Parto por ventosa con Apgar 9/10.
Exploración: peso: 3.160g, talla: 51cm, fenotipo normal. No tiene distrés respiratorio. Abdomen: se palpa masa redondeada firme en fosa renal izquierda. La auscultación cardiopulmonar y el resto de la exploración es normal.
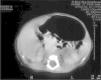
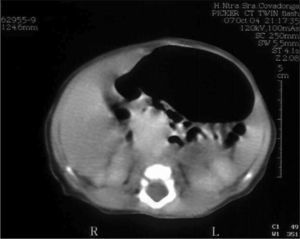
Pruebas complementarias: Hemograma: hemoglobina: 16,7g/dl, hematócritos: 50,1 %, 12.800 leucocitos/μl (2% C, 60 % S, 32 % linfocitos, 6 % monocitos). Plaquetas: 178.000/μl. Bioquímica: glucosa: 85mg/dl, urea: 19mg/dl, creatinina 0,9mg/dl, sodio: 139mmol/l, potasio: 3,9mmol/l. Proteína C reactiva, negativa. Las catecolaminas en orina y los marcadores tumorales (β-HCG y enolasa) están dentro de los límites fisiológicos. La radiografía de tórax es normal. La ecografía abdominal muestra una masa de 4 × 3cm de diámetro de ecogenicidad uniforme en la glándula suprarrenal izquierda. La tomografía computarizada (TC) abdominal con contraste realizada el primer día de vida confirma la existencia masa hipodensa de 4 × 3cm situada sobre el riñón izquierdo, independiente del mismo, que comprime la glándula suprarrenal ipsolateral y se extiende hasta el hiato (fig. 1).
Evolución: a los 15 días de vida se interviene quirúrgicamente y se halla una masa homogénea, de consistencia esponjosa con forma de reloj de arena, independiente del riñón y suprarrenal izquierdos que se extiende hacia la unión gastroesofágica. Es irrigado por arteria procedente de aorta y dos venas que drenan en cava inferior. Se realiza aspirado de médula ósea. El estudio histopatológico se muestra en la figura 2. El postoperatorio cursa sin incidencias y la paciente permanece asintomática. Es dada de alta 9 días después de la intervención.
PREGUNTA¿Cuál es su diagnóstico?
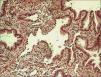
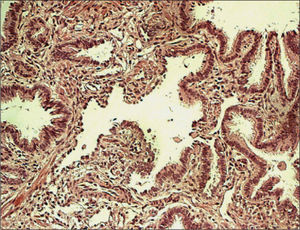
SECUESTRO PULMONAREl estudio anatomopatológico (fig. 2) muestra una organización compleja con múltiples espacios revestidos de epitelio cilíndrico ciliado con material mucinoso en su interior y macrófagos espumosos. Se describe una estroma fibrovascular con fascículos de músculo liso y acumulaciones de tejido cartilaginoso inmaduro, así como estructuras similares a bronquiolos respiratorios y alvéolos. En la periferia se observa una fina banda fibrovascular con revestimiento de células cuboidales sugerente de componente pleural. Se diagnostica de secuestro pulmonar extralobar intraabdominal.
El secuestro pulmonar, descrito por primera vez por Rokitansky y Rektorzik en 18611, se define como una masa de tejido pulmonar anormal no funcionante, comunicado o no con el árbol traqueobronquial, cuya vascularización arterial es de origen sistémico y el drenaje venoso llega a la vena cava o bien al sistema porta1–3. Representa el 0,15-6 % de las malformaciones pulmonares3,4. Su origen radica en defectos en el desarrollo del primitivo intestino anterior5 donde esbozos respiratorios adicionales originados en dicha estructura se desarrollan independientemente del aparato respiratorio principal1,6.
El secuestro pulmonar se diferencia en intralobar si se localiza dentro del pulmón sano estando rodeado de pleura pulmonar normal, y en extralobar, que tiene su propia pleura independiente de pleura visceral. El primero es la variedad más frecuente, y se localiza preferentemente en la base del pulmón izquierdo. El segundo se clasifica a su vez en torácico o abdominal2. Generalmente son asintomáticos, la mayoría se diagnostican en las ecografías prenatales o de forma casual en intervenciones quirúrgicas3. En caso de causar clínica, la más frecuente, en el secuestro intralobar, son las infecciones respiratorias repetidas en la misma localización3, así como distrés, taquipnea, incluso hemoptisis e insuficiencia cardíaca secundaria a importantes shunts arteriovenosos, aunque estos dos últimos son excepcionales7. El diagnóstico diferencial se debe realizar con otras malformaciones pulmonares como la malformación adenoide-quística congénita, quiste broncogénico o enfisema lobar congénito3,4, si bien las distintas malformaciones pueden coexistir2,3,7.
El secuestro pulmonar extralobar intraabdomiana (SPE) representa el 10-15 % de los secuestros pulmonares2. Se postula que su origen se debe al atrapamiento de un esbozo pulmonar independiente durante el cierre de membranas pleuroperitoneales5. Su localización más frecuente es en la proximidad de la glándula suprarrenal izquierda2. Su vascularización arterial proviene directamente de la aorta torácica, abdominal o del tronco celíaco5. En el 65 % se asocia a hernia diafragmática2 y se han descrito fístulas con el tracto gastrointestinal1,5. En las ecografías prenatales aparece como una masa de ecogenicidad uniforme con zonas hiperecogénicas (alvéolos o dilataciones bronquiales) sin calcificaciones2,8. Para demostrar su vascularización se puede recurrir a ecografía con Doppler, la angiografía5. Las catecolaminas en orina y marcadores tumorales están siempre dentro de los límites normales. El diagnóstico diferencial se realiza con masas o malformaciones abdominales como teratomas, tumores suprarrenales o renales o duplicaciones intestinales entre otros, y es fundamental el diagnóstico diferencial con el neuroblastoma ya que es la causa más frecuente de masa abdominal no renal diagnosticado en ecografías prenatales7. El neuroblastoma se observa generalmente en la ecografía del tercer trimestre de gestación, en la que aparece como una masa heterogénea, con quistes y calcificaciones5,8. El diagnóstico diferencial con SPE se realiza mediante ecografía, TC o resonancia magnética, y es esta última de elección, apareciendo el SPE como una lesión hipointensa en T18,9, y con la determinación de marcadores tumorales y catecolaminas en orina (elevadas hasta el 95 % de los casos de neuroblastoma9,10). Aunque se han descrito casos de regresión espontánea1,8, existe consenso en que el tratamiento quirúrgico es de elección debido a que la evolución natural de los secuestros pulmonares no es completamente conocida y que incluso la transformación maligna ha sido comunicada7,9.