La hipertensión en niños y adolescentes ha ido ganando terreno en la medicina cardiovascular, gracias a los avances producidos en distintas áreas de la investigación fisiopatológica y clínica. Estas guías nacen del consenso al que han llegado los especialistas en la detección y control de la hipertensión en niños y adolescentes. Por otra parte, dichas guías son un compendio de los datos científicos y la extensa experiencia clínica con la que se cuenta, y constituyen la información clínica más completa que los médicos, enfermeras y familiares deberían tener en cuenta a la hora de tomar decisiones. Estas guías, que hacen hincapié en la importancia de la hipertensión en niños y adolescentes, así como en el papel que desempeña en la actual epidemia de enfermedades cardiovasculares, deberían constituir un estímulo para que los gobiernos desarrollaran un esfuerzo global para una detección precoz y un tratamiento adecuado de la hipertensión arterial en niños y adolescentes. J Hypertens 27:1719-1742 Q 2009 Wolters Kluwer Health | Lippincott Williams & Wilkins.
Hypertension in children and adolescents has been gaining ground in cardiovascular medicine, mainly due to the advances made in several areas of pathophysiological and clinical research. These guidelines arose from the consensus reached by specialists in the detection and control of hypertension in children and adolescents. Furthermore, these guidelines are a compendium of scientific data and the extensive clinical experience it contains represents the most complete information that doctors, nurses and families should take into account when making decisions. These guidelines, which stress the importance of hypertension in children and adolescents, and its contribution to the current epidemic of cardiovascular disease, should act as a stimulus for governments to develop a global effort for the early detection and suitable treatment of high pressure in children and adolescents. J Hypertens 27:1719-1742 Q 2009 Wolters Kluwer Health | Lippincott Williams & Wilkins.
Las guías de la Sociedad Europea de Hipertensión (ESH) y de la Sociedad Europea de Cardiología (ESC) del tratamiento de la HTA, publicadas en 20031 y actualizadas en 20072, no incluyen, lamentablemente, ninguna sección dedicada a la HTA en niños y adolescentes. No obstante, ello no se debe al desconocimiento de la importancia de esta cuestión. Al contrario, un número creciente de datos indican que la prevalencia de HTA moderada en niños y adolescentes es mucho mayor de lo que se creía anteriormente. Distintos estudios longitudinales han demostrado que las alteraciones en la PA a esas edades con frecuencia se traducen en HTA en edades adultas, resaltando la importancia de dichos antecedentes, no solo desde un punto de vista epidemiológico, sino también desde un punto de vista clínico. Asimismo, la HTA en niños y adolescentes ha ido ganando terreno en la medicina cardiovascular, gracias a los avances producidos en distintas áreas de la investigación fisiopatológica y clínica. Por ejemplo, es posible determinar los valores de PA de niños y adolescentes, no solo en la consulta del médico (un entorno artificial), sino también durante las actividades diarias habituales, sin duda un ámbito mucho más representativo. Asimismo, se ha podido determinar el daño subclínico en distintos órganos, mediante aparatos y marcadores mucho más sensibles que de los que se disponía hace unos años. Por ello, ha sido posible detectar modificaciones precoces en la función y estructura orgánica, algo impensable hasta hace poco, lo que ha permitido evaluar de forma más precisa la significación clínica de las alteraciones en la PA. En última instancia, se ha podido establecer la correlación entre la HTA y el daño orgánico en la edad adulta, y las distintas alteraciones observadas en la edad juvenil, por ejemplo, sobrepeso y taquicardia. Ello no ha hecho sino enfatizar la importancia de implementar, también en individuos jóvenes, algunas de las estrategias de prevención cardiovascular originalmente destinadas a la población adulta.
Sin embargo, el hecho de que en guías previas no se haya tratado la HTA infantil puede deberse al menos a 2 motivos. En primer lugar, médicos de distintas especialidades se encargan, por un lado, de la asistencia de niños y adolescentes y, por otro, de personas adultas. Ello implica que cualquier grupo de trabajo responsable de realizar recomendaciones relativas a la HTA en niños debería haber contado con la opinión fundamentada de expertos en esta área. Esto es precisamente lo que se ha hecho a la hora de elaborar el presente documento, centrado específicamente en la HTA pediátrica.
En segundo lugar, y no por ello menos importante, las recomendaciones para tratar la HTA en adultos y niños se basan en datos y argumentos de ámbitos completamente diferentes. En adultos, la mayoría de las recomendaciones incluidas en las guías se basan en datos obtenidos en estudios observacionales y de intervención2,3. Por ejemplo, la definición de HTA en adultos se basa en datos observacionales de más de 1 millón de personas, que muestran que existe una relación continua entre valores crecientes de PAS y PAD ictus e infarto de miocardio4. Ello ha originado valores de corte aceptados convencionalmente que delimitan la presión normal de la HTA, así como sus diferentes grados. Por último los ensayos clínicos en los que se han incluido más de 250.000 pacientes, proporcionan información comparativa sobre los efectos de la disminución de la PA per se, y la reducción de la misma como resultado de la acción de distintos fármacos.
Por el contrario, no se dispone de estudios de este tipo en niños y adolescentes. Resulta prácticamente imposible establecer algún tipo de relación entre los valores de PA y los episodios cardiovasculares que se producen de forma aislada, muchos años después. No pueden realizarse recomendaciones basadas en la evidencia, en relación con los valores de corte que establezcan cuándo ha de iniciarse el tratamiento, cuáles son los objetivos, o qué clase de fármaco debería administrarse preferentemente en las distintas enfermedades. Muchas de las clasificaciones y recomendaciones dirigidas a niños se basan en consideraciones estadísticas y en extrapolaciones de los datos obtenidos en adultos. A pesar de que las guías relativas a la HTA pediátrica se basan fundamentalmente en la experiencia, no sería ético dejar de prestar la debida atención a esta importante cuestión, tanto desde un punto de vista médico como desde un punto de vista social. Las recomendaciones han de realizarse siendo conscientes de que aún no se dispone de información suficiente, lo que contribuirá a diseñar estudios observacionales y de intervención que permitan subsanar determinadas lagunas de conocimiento. Ello no constituye un objetivo menor de estas guías, y de hecho al final del presente documento se dedica una sección específicamente a la planificación de futuros estudios.
Definición y clasificación de hipertensiónEl hecho de que en la asistencia pediátrica se haya incluido la determinación de la PA, y de que se hayan publicado valores de referencia relativos a la PA en niños5–7 no solo ha permitido detectar casos graves de HTA asintomática, derivados de trastornos previos no detectados, sino que ha confirmado que durante la infancia los incrementos moderados de PA son más frecuentes de lo que se creía, especialmente en adolescentes.
La HTA del adulto tiene sus orígenes en la infancia. De hecho, se ha demostrado que los valores de PA en la infancia influyen los valores de PA en la edad adulta. Es decir, los niños que presentan una PA elevada tienen más probabilidades de presentar HTA en la edad adulta8–12, lo que marca la importancia de controlar la PA en niños y adolescentes. A la hora de identificar a niños con valores elevados de la PA, es importante realizar mediciones repetidas de la misma (cuyo objetivo es minimizar el error de medición)8, así como evaluar las comorbilidades (en particular, la obesidad) y los antecedentes familiares de enfermedades cardiovasculares12. Ello permitirá predecir con mucha más precisión los futuros casos de HTA13.
Según se ha comentado en la introducción, una de las limitaciones existentes a la hora de formular recomendaciones, es la ausencia de estudios prospectivos en los que se incluya un periodo de seguimiento suficientemente largo como para establecer correlaciones directas entre los valores de PA observados en la infancia y la aparición de enfermedades cardiovasculares o la mortalidad asociada. Es por ello que se han utilizado marcadores indirectos del daño orgánico derivado de la HTA (en corazón, vasos sanguíneos y riñones), aunque se disponga de una cantidad de datos sensiblemente menor que en adultos14,15. Entre los marcadores más significativos se encuentran la hipertrofia del ventrículo izquierdo (HVI)16,17, el engrosamiento y endurecimiento de las arterias de gran tamaño18–22, y la excreción urinaria de albúmina (EUA)23.
Los criterios diagnósticos de HTA en niños tienen en cuenta el hecho de que en los niños la PA se incrementa con la edad y el tamaño corporal, lo que hace que resulte imposible establecer un único valor de corte que defina la HTA, de la misma forma que en adultos.
Valores de referencia en niños y adolescentes, utilizando el método auscultatorio, se han obtenido en EE.UU., basados en más de 70.000 casos24. Se han calculado los correspondientes percentiles de PA en función del sexo, grupo de edad y de 7 categorías (percentiles) de talla (www.pediatrics.org/cgi/content/full/114/2/S2/555). Los percentiles de talla se basan en las tablas de crecimiento del Centro para el Control y la Prevención de Enfermedades (www.cdc.gov/growthcharts). En Europa, los valores de referencia se establecieron en 1991, agrupando los datos de 28.043 individuos (mediante el método auscultatorio25). Lamentablemente, en las tablas no se incluyen conjuntamente los datos relativos a la edad, el sexo y la talla. No obstante, en 1999 se obtuvieron valores de referencia para la población italiana, a partir de datos obtenidos mediante el método auscultatorio, en 11.519 niños en edad escolar (5–17 años), y se calcularon en función de la edad, el sexo y la talla26. Dos estudios más recientes27,28 proporcionan valores de referencia, basándose en el método oscilométrico, con un modelo Dinamap 8100, método con conocidas limitaciones. Por otra parte, recientemente se han obtenido datos oscilométricos con un equipo validado en el estudio llevado a cabo en Nord-Trondelag29. Sin embargo, en dicho estudio únicamente se incluyeron adolescentes (de edades comprendidas entre 13–18 años), y los valores del percentil 95 fueron muy altos, incluso tras excluir los individuos obesos o con sobrepeso. Asimismo, se han obtenido datos oscilométricos validados a partir de una cohorte de gran tamaño de niños chinos (en concreto, de Hong Kong) en edad escolar30, aunque dichos datos difícilmente puedan extrapolarse a la población europea.
Por lo tanto la Task Force for Blood Pressure in Children24 continúa siendo el estudio de elección para los valores de referencia. Debe tenerse en cuenta, sin embargo, que los valores de la Task Force en los distintos grupos de edad son unos mm Hg inferiores a los valores medidos mediante el mismo método ausculatorio en el estudio italiano26, y unos 10mm Hg inferiores a los datos oscilométricos obtenidos en el estudio Noruego29.
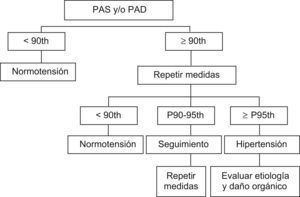
De acuerdo con los criterios Task Force for Blood Pressure in Children24 (los mismos criterios que se consideran en este informe), en niños la PA normal se define como una PAS y una PAD inferiores al percentil 90, por grupo de edad, sexo y talla. Por otra parte, la HTA se define como una PAS y/o una PAD que de forma reiterada se mantiene en el percentil 95 o por encima de este, debiéndose realizar al menos 3 mediciones, mediante el método ausculatorio. Se considera que los niños que presentan valores promedio de PAS o de PAD iguales o superiores al percentil 90, pero inferiores al percentil 95, tienen una PA normal-alta. Asimismo, se considera que los adolescentes con un valor de PA ≥120/80mm Hg, incluso aunque este esté por debajo del percentil 90, también presentan una PA normal alta (tabla 1). En las tablas 2 y 3 se muestran los percentiles de PA para chicos y chicas de edades comprendidas entre 1–18 años, de acuerdo con los datos de dicha Task Force24.
Definición y clasificación de la hipertensión en niños y adolescentes
| Clasificación | Percentil de PAS y/o PAD |
| Normal | < percentile 90 |
| Normal-alta | ≥percentil 90 y |
| ≥120/80, incluso aunque esté por debajo del percentil 90 en adolescentes | |
| Hipertensión de grado 1 | percentil 95 al percentil 99 mas 5mmHg |
| Hipertensión de grado 2 | >percentil 99 mas 5mmHg |
Presión arterial en niños (por edad y percentil de talla)
| Sistólica (mmHg) | Diastólica (mmHg) | ||||||||||||||
| Percentil de talla | Percentil de talla | ||||||||||||||
| Edad (años) | Percentil de PA | 5 | 10 | 25 | 50 | 75 | 90 | 95 | 5 | 10 | 25 | 50 | 75 | 90 | 95 |
| 1 | 90 | 94 | 95 | 97 | 99 | 100 | 102 | 103 | 49 | 50 | 51 | 52 | 53 | 53 | 54 |
| 95 | 98 | 99 | 101 | 103 | 104 | 106 | 106 | 54 | 54 | 55 | 56 | 57 | 58 | 58 | |
| 99 | 105 | 106 | 108 | 110 | 112 | 113 | 114 | 61 | 62 | 63 | 64 | 65 | 66 | 66 | |
| 2 | 90 | 97 | 99 | 100 | 102 | 104 | 105 | 106 | 54 | 55 | 56 | 57 | 58 | 58 | 59 |
| 95 | 101 | 102 | 104 | 106 | 108 | 109 | 110 | 59 | 59 | 60 | 61 | 62 | 63 | 63 | |
| 99 | 109 | 110 | 111 | 113 | 115 | 117 | 117 | 66 | 67 | 68 | 69 | 70 | 71 | 71 | |
| 3 | 90 | 100 | 101 | 103 | 105 | 107 | 108 | 109 | 59 | 59 | 60 | 61 | 62 | 63 | 63 |
| 95 | 104 | 105 | 107 | 109 | 110 | 112 | 113 | 63 | 63 | 64 | 65 | 66 | 67 | 67 | |
| 99 | 111 | 112 | 114 | 116 | 118 | 119 | 120 | 71 | 71 | 72 | 73 | 74 | 75 | 75 | |
| 4 | 90 | 102 | 103 | 105 | 107 | 109 | 110 | 111 | 62 | 63 | 64 | 65 | 66 | 66 | 67 |
| 95 | 106 | 107 | 109 | 111 | 112 | 114 | 115 | 66 | 67 | 68 | 69 | 70 | 71 | 71 | |
| 99 | 113 | 114 | 116 | 118 | 120 | 121 | 122 | 74 | 75 | 76 | 77 | 78 | 78 | 79 | |
| 5 | 90 | 104 | 105 | 106 | 108 | 110 | 111 | 112 | 65 | 66 | 67 | 68 | 69 | 69 | 70 |
| 95 | 108 | 109 | 110 | 112 | 114 | 115 | 116 | 69 | 70 | 71 | 72 | 73 | 74 | 74 | |
| 99 | 115 | 116 | 118 | 120 | 121 | 123 | 123 | 77 | 78 | 79 | 80 | 81 | 81 | 82 | |
| 6 | 90 | 105 | 106 | 108 | 110 | 111 | 113 | 113 | 68 | 68 | 69 | 70 | 71 | 72 | 72 |
| 95 | 109 | 110 | 112 | 114 | 115 | 117 | 117 | 72 | 72 | 73 | 74 | 75 | 76 | 76 | |
| 99 | 116 | 117 | 119 | 121 | 123 | 124 | 125 | 80 | 80 | 81 | 82 | 83 | 84 | 84 | |
| 7 | 90 | 106 | 107 | 109 | 111 | 113 | 114 | 115 | 70 | 70 | 71 | 72 | 73 | 74 | 74 |
| 95 | 110 | 111 | 113 | 115 | 117 | 118 | 119 | 74 | 74 | 75 | 76 | 77 | 78 | 78 | |
| 99 | 117 | 118 | 120 | 122 | 124 | 125 | 126 | 82 | 82 | 83 | 84 | 85 | 86 | 86 | |
| 8 | 90 | 107 | 109 | 110 | 112 | 114 | 115 | 116 | 71 | 72 | 72 | 73 | 74 | 75 | 76 |
| 95 | 111 | 112 | 114 | 116 | 118 | 119 | 120 | 75 | 76 | 77 | 78 | 79 | 79 | 80 | |
| 99 | 119 | 120 | 122 | 123 | 125 | 127 | 127 | 83 | 84 | 85 | 86 | 87 | 87 | 88 | |
| 9 | 90 | 109 | 110 | 112 | 114 | 115 | 117 | 118 | 72 | 73 | 74 | 75 | 76 | 76 | 77 |
| 95 | 113 | 114 | 116 | 118 | 119 | 121 | 121 | 76 | 77 | 78 | 79 | 80 | 81 | 81 | |
| 99 | 120 | 121 | 123 | 125 | 127 | 128 | 129 | 84 | 85 | 86 | 87 | 88 | 88 | 89 | |
| 10 | 90 | 111 | 112 | 114 | 115 | 117 | 119 | 119 | 73 | 73 | 74 | 75 | 76 | 77 | 78 |
| 95 | 115 | 116 | 117 | 119 | 121 | 122 | 123 | 77 | 78 | 79 | 80 | 81 | 81 | 82 | |
| 99 | 122 | 123 | 125 | 127 | 128 | 130 | 130 | 85 | 86 | 86 | 88 | 88 | 89 | 90 | |
| 11 | 90 | 113 | 114 | 115 | 117 | 119 | 120 | 121 | 74 | 74 | 75 | 76 | 77 | 78 | 78 |
| 95 | 117 | 118 | 119 | 121 | 123 | 124 | 125 | 78 | 78 | 79 | 80 | 81 | 82 | 82 | |
| 99 | 124 | 125 | 127 | 129 | 130 | 132 | 132 | 86 | 86 | 87 | 88 | 89 | 90 | 90 | |
| 12 | 90 | 115 | 116 | 118 | 120 | 121 | 123 | 123 | 74 | 75 | 75 | 76 | 77 | 78 | 79 |
| 95 | 119 | 120 | 122 | 123 | 125 | 127 | 127 | 78 | 79 | 80 | 81 | 82 | 82 | 83 | |
| 99 | 126 | 127 | 129 | 131 | 133 | 134 | 135 | 86 | 87 | 88 | 89 | 90 | 90 | 91 | |
| 13 | 90 | 117 | 118 | 120 | 122 | 124 | 125 | 126 | 75 | 75 | 76 | 77 | 78 | 79 | 79 |
| 95 | 121 | 122 | 124 | 126 | 128 | 129 | 130 | 79 | 79 | 80 | 81 | 82 | 83 | 83 | |
| 99 | 128 | 130 | 131 | 133 | 135 | 136 | 137 | 87 | 87 | 88 | 89 | 90 | 91 | 91 | |
| 14 | 90 | 120 | 121 | 123 | 125 | 126 | 128 | 128 | 75 | 76 | 77 | 78 | 79 | 79 | 80 |
| 95 | 124 | 125 | 127 | 128 | 130 | 132 | 132 | 80 | 80 | 81 | 82 | 83 | 84 | 84 | |
| 99 | 131 | 132 | 134 | 136 | 138 | 139 | 140 | 87 | 88 | 89 | 90 | 91 | 92 | 92 | |
| 15 | 90 | 122 | 124 | 125 | 127 | 129 | 130 | 131 | 76 | 77 | 78 | 79 | 80 | 80 | 81 |
| 95 | 126 | 127 | 129 | 131 | 133 | 134 | 135 | 81 | 81 | 82 | 83 | 84 | 85 | 85 | |
| 99 | 134 | 135 | 136 | 138 | 140 | 142 | 142 | 88 | 89 | 90 | 91 | 92 | 93 | 93 | |
| 16 | 90 | 125 | 126 | 128 | 130 | 131 | 133 | 134 | 78 | 78 | 79 | 80 | 81 | 82 | 82 |
| 95 | 129 | 130 | 132 | 134 | 135 | 137 | 137 | 82 | 83 | 83 | 84 | 85 | 86 | 87 | |
| 99 | 136 | 137 | 139 | 141 | 143 | 144 | 145 | 90 | 90 | 91 | 92 | 93 | 94 | 94 | |
| 17 | 90 | 127 | 128 | 130 | 132 | 134 | 135 | 136 | 80 | 80 | 81 | 82 | 83 | 84 | 84 |
| 95 | 131 | 132 | 134 | 136 | 138 | 139 | 140 | 84 | 85 | 86 | 87 | 87 | 88 | 89 | |
| 99 | 139 | 140 | 141 | 143 | 145 | 146 | 147 | 92 | 93 | 93 | 94 | 95 | 96 | 97 | |
Modificado a partir del estudio llevado a cabo por el Grupo de Trabajo de Hipertensión en Niños y Adolescentes24.
Presión arterial en niñas (por edad y percentil de talla)
| Sistólica (mmHg) | Diastólica (mmHg) | ||||||||||||||
| Percentil de talla | Percentil de talla | ||||||||||||||
| Edad (años) | Percentil de PA | 5 | 10 | 25 | 50 | 75 | 90 | 95 | 5 | 10 | 25 | 50 | 75 | 90 | 95 |
| 1 | 90 | 97 | 97 | 98 | 100 | 101 | 102 | 103 | 52 | 53 | 53 | 54 | 55 | 55 | 56 |
| 95 | 100 | 101 | 102 | 104 | 105 | 106 | 107 | 56 | 57 | 57 | 58 | 59 | 59 | 60 | |
| 99 | 108 | 108 | 109 | 111 | 112 | 113 | 114 | 64 | 64 | 65 | 65 | 66 | 67 | 67 | |
| 2 | 90 | 98 | 99 | 100 | 101 | 103 | 104 | 105 | 57 | 58 | 58 | 59 | 60 | 61 | 61 |
| 95 | 102 | 103 | 104 | 105 | 107 | 108 | 109 | 61 | 62 | 62 | 63 | 64 | 65 | 65 | |
| 99 | 109 | 110 | 111 | 112 | 114 | 115 | 116 | 69 | 69 | 70 | 70 | 71 | 72 | 72 | |
| 3 | 90 | 100 | 100 | 102 | 103 | 104 | 106 | 106 | 61 | 62 | 62 | 63 | 64 | 64 | 65 |
| 95 | 104 | 104 | 105 | 107 | 108 | 109 | 110 | 65 | 66 | 66 | 67 | 68 | 68 | 69 | |
| 99 | 111 | 111 | 113 | 114 | 115 | 116 | 117 | 73 | 73 | 74 | 74 | 75 | 76 | 76 | |
| 4 | 90 | 101 | 102 | 103 | 104 | 106 | 107 | 108 | 64 | 64 | 65 | 66 | 67 | 67 | 68 |
| 95 | 105 | 106 | 107 | 108 | 110 | 111 | 112 | 68 | 68 | 69 | 70 | 71 | 71 | 72 | |
| 99 | 112 | 113 | 114 | 115 | 117 | 118 | 119 | 76 | 76 | 76 | 77 | 78 | 79 | 79 | |
| 5 | 90 | 103 | 103 | 105 | 106 | 107 | 109 | 109 | 66 | 67 | 67 | 68 | 69 | 69 | 70 |
| 95 | 107 | 107 | 108 | 110 | 111 | 112 | 113 | 70 | 71 | 71 | 72 | 73 | 73 | 74 | |
| 99 | 114 | 114 | 116 | 117 | 118 | 120 | 120 | 78 | 78 | 79 | 79 | 80 | 81 | 81 | |
| 6 | 90 | 104 | 105 | 106 | 108 | 109 | 110 | 111 | 68 | 68 | 69 | 70 | 70 | 71 | 72 |
| 95 | 108 | 109 | 110 | 111 | 113 | 114 | 115 | 72 | 72 | 73 | 74 | 74 | 75 | 76 | |
| 99 | 115 | 116 | 117 | 119 | 120 | 121 | 122 | 80 | 80 | 80 | 81 | 82 | 83 | 83 | |
| 7 | 90 | 106 | 107 | 108 | 109 | 111 | 112 | 113 | 69 | 70 | 70 | 71 | 72 | 72 | 73 |
| 95 | 110 | 111 | 112 | 113 | 115 | 116 | 116 | 73 | 74 | 74 | 75 | 76 | 76 | 77 | |
| 99 | 117 | 118 | 119 | 120 | 122 | 123 | 124 | 81 | 81 | 82 | 82 | 83 | 84 | 84 | |
| 8 | 90 | 108 | 109 | 110 | 111 | 113 | 114 | 114 | 71 | 71 | 71 | 72 | 73 | 74 | 74 |
| 95 | 112 | 112 | 114 | 115 | 116 | 118 | 118 | 75 | 75 | 75 | 76 | 77 | 78 | 78 | |
| 99 | 119 | 120 | 121 | 122 | 123 | 125 | 125 | 82 | 82 | 83 | 83 | 84 | 85 | 86 | |
| 9 | 90 | 110 | 110 | 112 | 113 | 114 | 116 | 116 | 72 | 72 | 72 | 73 | 74 | 75 | 75 |
| 95 | 114 | 114 | 115 | 117 | 118 | 119 | 120 | 76 | 76 | 76 | 77 | 78 | 79 | 79 | |
| 99 | 121 | 121 | 123 | 124 | 125 | 127 | 127 | 83 | 83 | 84 | 84 | 85 | 86 | 87 | |
| 10 | 90 | 112 | 112 | 114 | 115 | 116 | 118 | 118 | 73 | 73 | 73 | 74 | 75 | 76 | 76 |
| 95 | 116 | 116 | 117 | 119 | 120 | 121 | 122 | 77 | 77 | 77 | 78 | 79 | 80 | 80 | |
| 99 | 123 | 123 | 125 | 126 | 127 | 129 | 129 | 84 | 84 | 85 | 86 | 86 | 87 | 88 | |
| 11 | 90 | 114 | 114 | 116 | 117 | 118 | 119 | 120 | 74 | 74 | 74 | 75 | 76 | 77 | 77 |
| 95 | 118 | 118 | 119 | 121 | 122 | 123 | 124 | 78 | 78 | 78 | 79 | 80 | 81 | 81 | |
| 99 | 125 | 125 | 126 | 128 | 129 | 130 | 131 | 85 | 85 | 86 | 87 | 87 | 88 | 89 | |
| 12 | 90 | 116 | 116 | 117 | 119 | 120 | 121 | 122 | 75 | 75 | 75 | 76 | 77 | 78 | 78 |
| 95 | 119 | 120 | 121 | 123 | 124 | 125 | 126 | 79 | 79 | 79 | 80 | 81 | 82 | 82 | |
| 99 | 127 | 127 | 128 | 130 | 131 | 132 | 133 | 86 | 86 | 87 | 88 | 88 | 89 | 90 | |
| 13 | 90 | 117 | 118 | 119 | 121 | 122 | 123 | 124 | 76 | 76 | 76 | 77 | 78 | 79 | 79 |
| 95 | 121 | 122 | 123 | 124 | 126 | 127 | 128 | 80 | 80 | 80 | 81 | 82 | 83 | 83 | |
| 99 | 128 | 129 | 130 | 132 | 133 | 134 | 135 | 87 | 87 | 88 | 89 | 89 | 90 | 91 | |
| 14 | 90 | 119 | 120 | 121 | 122 | 124 | 125 | 125 | 77 | 77 | 77 | 78 | 79 | 80 | 80 |
| 95 | 123 | 123 | 125 | 126 | 127 | 129 | 129 | 81 | 81 | 81 | 82 | 83 | 84 | 84 | |
| 99 | 130 | 131 | 132 | 133 | 135 | 136 | 136 | 88 | 88 | 89 | 90 | 90 | 91 | 92 | |
| 15 | 90 | 120 | 121 | 122 | 123 | 125 | 126 | 127 | 78 | 78 | 78 | 79 | 80 | 81 | 81 |
| 95 | 124 | 125 | 126 | 127 | 129 | 130 | 131 | 82 | 82 | 82 | 83 | 84 | 85 | 85 | |
| 99 | 131 | 132 | 133 | 134 | 136 | 137 | 138 | 89 | 89 | 90 | 91 | 91 | 92 | 93 | |
| 16 | 90 | 121 | 122 | 123 | 124 | 126 | 127 | 128 | 78 | 78 | 79 | 80 | 81 | 81 | 82 |
| 95 | 125 | 126 | 127 | 128 | 130 | 131 | 132 | 82 | 82 | 83 | 84 | 85 | 85 | 86 | |
| 99 | 132 | 133 | 134 | 135 | 137 | 138 | 139 | 90 | 90 | 90 | 91 | 92 | 93 | 93 | |
| 17 | 90 | 122 | 122 | 123 | 125 | 126 | 127 | 128 | 78 | 79 | 79 | 80 | 81 | 81 | 82 |
| 95 | 125 | 126 | 127 | 129 | 130 | 131 | 132 | 82 | 83 | 83 | 84 | 85 | 85 | 86 | |
| 99 | 133 | 133 | 134 | 136 | 137 | 138 | 139 | 90 | 90 | 91 | 91 | 92 | 93 | 93 | |
Modificado a partir del estudio llevado a cabo por el Grupo de Trabajo de Hipertensión en Niños y Adolescentes24.
Por otra parte, dicho informe proporciona los criterios para clasificar la gravedad de la HTA en niños y adolescentes, que puede resultar de utilidad en el ámbito clínico, a la hora de realizar las pertinentes evaluaciones e instaurar el tratamiento adecuado. La HTA de grado 1 se define como un valor de PA comprendido entre los percentiles 95–99 más 5mm Hg.
La HTA de grado 2 se define como cualquier valor de PA por encima del percentil 99 más 5mm Hg. Los niños o adolescentes con HTA de grado 2 deben evaluarse y tratarse de forma más rápida y/o intensa que aquellos que presenten un menor incremento de la PA.
Evaluación diagnósticaDeterminación de la PAEl diagnóstico de HTA debe basarse en varias mediciones de la PA, realizadas en la consulta en distintos momentos. Si bien deben tomarse como referencia las mediciones de la PA realizadas en la consulta, los valores de PA obtenidos fuera de la consulta pueden contribuir a realizar una evaluación más precisa de los individuos, tanto en los tratados como aquellos sin tratamiento.
Determinación de la PA realizada en la consultaLas mediciones de la PA realizadas en la consulta constituyen la base del conocimiento actual sobre el posible riesgo asociado con la HTA31. En este tipo de mediciones se ha fundamentado durante muchos años el tratamiento de los pacientes. En las guías de la ESH/ESC1 se comentan en profundidad cuestiones relativas a la determinación de la PA, que han de tenerse en cuenta tanto en niños como en adultos.
Uno de los aspectos que hay que considerar en niños y adolescentes es si han de utilizarse métodos auscultatorios u oscilométricos. La determinación basada en los ruidos de Korotkoff ha sido el método que se ha utilizado con más frecuencia para determinar la PAS (K1) y la PAD (K4 o K5). Si bien en un principio se aceptó oficialmente el ruido K4 como la medida de la PAD en niños de edad inferior a 13 años, en la actualidad se recomienda el ruido K524. Recientemente se han comenzado a utilizar los dispositivos oscilométricos que calculan la PA a partir de las oscilaciones de PA. Mediante este método se determina la PA directamente a partir del punto de máxima oscilación. Si bien ni la PAS ni la PAD se miden directamente, ambos valores se calculan mediante un algoritmo basado en una presunta relación entre las oscilaciones. Por ello, en los casos en los que la oscilación es menor de lo habitual (algo común en niños), aumenta la probabilidad de que se realicen mediciones erróneas32. Si se aplica un método oscilométrico, el monitor deberá haber sido validado mediante el procedimiento recomendado por la Sociedad Británica de Hipertensión33, la Asociación Americana para el Avance de la Instrumentación Médica34 o por el Protocolo Internacional de la Sociedad Europea de Hipertensión35. Hasta la fecha se han validado pocos monitores mediante los que se realizan determinaciones oscilométricas de la PA (bien en la consulta, el domicilio o de forma ambulatoria), de acuerdo con un protocolo establecido. En la página Web www.dableducational.org. puede encontrarse la información más actualizada sobre la validación de monitores oscilométricos para uso pediátrico. Sin embargo, ha de señalarse que los valores de referencia disponibles (como los recogidos en las tablas 2 y 3) se han obtenido aplicando el método auscultatorio, y que los valores obtenidos en equipos oscilométricos son considerablemente mayores29,36,37. Por lo tanto, si la HTA se diagnostica mediante métodos oscilométricos deberá confirmarse mediante el método auscultatorio. Si bien la reciente prohibición en la Comunidad Europea de los dispositivos que contengan mercurio sin duda favorecerá el desarrollo de los equipos oscilométricos, no es menos cierto que el método auscultatorio puede continuar utilizándose con manómetros que no contengan mercurio. No obstante, resultaría conveniente comenzar a desarrollar valores de referencia de la PA, obtenidos mediante dispositivos oscilométricos.
En el anexo 1 se recogen las recomendaciones específicas para la medida en la consulta de la PA en niños y adolescentes24,38,39.
Monitorización ambulatoria de PALa monitorización ambulatoria de la PA (MAPA) es una técnica que cada vez resulta más indispensable en el diagnóstico y tratamiento de la HTA40,41, y que ha contribuido significativamente a entender la HTA, al «desenmascarar» casos de HTA que no se identificaban al medir la PA en la consulta. Entre estos se incluyen los casos que presentan un descenso de la PA nocturna (dipping), aquellos que presentan HTA nocturna (non-dipping)42, así como los casos de HTA de bata blanca43 e HTA enmascarada44.
El uso clínico de la monitorización ambulatoria de PA durante 24h dependerá de que se disponga de valores de referencia de PA ambulatoria. En algunas poblaciones europeas se han obtenido valores de referencia preliminares45,46. Si bien el tamaño muestral relativamente pequeño limita en cierta medida la utilidad normativa de estos datos, estos constituyen un punto de partida importante para el futuro desarrollo de datos de referencia más sólidos (tablas 4 y 5).
Valores de presión arterial sistólica y diastólica ambulatorias (sistólica/diastólica)
| Niños | Niña | |||||||||||
| Día | Noche | Día | Noche | |||||||||
| Edad (años) | 75 | 90 | 95 | 75 | 90 | 95 | 75 | 90 | 95 | 75 | 90 | 95 |
| 5 | 116/76 | 120/79 | 123/81 | 99/59 | 103/62 | 106/65 | 114/77 | 118/80 | 121/82 | 100/61 | 105/66 | 108/69 |
| 6 | 116/76 | 121/79 | 124/81 | 100/59 | 105/63 | 108/66 | 115/77 | 120/80 | 122/82 | 101/61 | 106/65 | 110/68 |
| 7 | 117/76 | 122/80 | 125/82 | 101/60 | 106/64 | 110/67 | 116/77 | 121/80 | 123/82 | 102/60 | 107/65 | 111/67 |
| 8 | 117/76 | 122/80 | 125/82 | 102/60 | 108/64 | 111/67 | 117/76 | 122/80 | 124/82 | 103/60 | 108/64 | 112/67 |
| 9 | 118/76 | 123/80 | 126/82 | 103/60 | 109/64 | 112/67 | 118/76 | 122/80 | 125/82 | 103/59 | 109/64 | 112/67 |
| 10 | 119/76 | 124/80 | 127/82 | 104/60 | 110/64 | 113/67 | 119/76 | 123/79 | 126/81 | 104/59 | 110/64 | 113/67 |
| 11 | 121/76 | 126/80 | 129/82 | 105/60 | 111/64 | 115/67 | 120/76 | 124/79 | 127/81 | 105/59 | 110/63 | 114/66 |
| 12 | 123/76 | 128/80 | 132/82 | 107/60 | 113/64 | 116/67 | 121/76 | 125/80 | 128/82 | 105/59 | 110/63 | 114/66 |
| 13 | 126/76 | 131/80 | 135/82 | 109/60 | 115/64 | 119/67 | 122/77 | 126/80 | 129/82 | 106/59 | 111/63 | 114/66 |
| 14 | 129/77 | 134/80 | 138/82 | 112/61 | 118/64 | 121/67 | 123/77 | 127/80 | 130/82 | 106/59 | 111/63 | 114/65 |
| 15 | 132/77 | 137/81 | 141/83 | 114/61 | 120/64 | 123/66 | 124/77 | 128/80 | 130/82 | 107/59 | 111/63 | 114/65 |
| 16 | 135/78 | 140/81 | 144/84 | 117/61 | 123/64 | 126/66 | 124/77 | 129/80 | 131/82 | 107/59 | 111/63 | 114/65 |
Los valores se muestran en mmHg. Datos de46.
Valores de presión arterial sistólica y diastólica ambulatorias (sistólica/diastólica)
| Niños | Niñas | |||||||||||
| Día | Noche | Día | Noche | |||||||||
| Talla (cm) | 75 | 90 | 95 | 75 | 90 | 95 | 75 | 90 | 95 | 75 | 90 | 95 |
| 120 | 116/77 | 122/80 | 125/82 | 99/58 | 103/61 | 106/63 | 114/77 | 118/80 | 120/82 | 99/60 | 103/63 | 106/65 |
| 125 | 117/76 | 122/80 | 125/82 | 100/58 | 105/61 | 108/63 | 115/77 | 119/80 | 121/82 | 100/60 | 104/63 | 107/66 |
| 130 | 117/76 | 122/80 | 126/82 | 101/59 | 106/62 | 110/64 | 116/76 | 120/80 | 122/82 | 101/59 | 106/63 | 108/66 |
| 135 | 117/76 | 123/80 | 126/82 | 102/59 | 108/63 | 111/65 | 116/76 | 120/80 | 123/82 | 102/59 | 107/63 | 109/66 |
| 140 | 118/76 | 123/80 | 126/82 | 104/60 | 109/63 | 113/65 | 117/76 | 121/80 | 124/82 | 103/59 | 108/63 | 110/66 |
| 145 | 119/76 | 124/79 | 127/81 | 105/60 | 111/64 | 114/66 | 118/76 | 123/80 | 125/82 | 103/59 | 109/63 | 112/66 |
| 150 | 120/76 | 125/79 | 128/81 | 106/60 | 112/64 | 116/66 | 119/76 | 124/80 | 127/82 | 104/59 | 110/63 | 113/66 |
| 155 | 122/76 | 127/79 | 130/81 | 107/60 | 113/64 | 117/66 | 121/76 | 125/80 | 128/82 | 106/59 | 111/63 | 114/66 |
| 160 | 124/76 | 129/79 | 133/81 | 108/60 | 114/64 | 118/66 | 122/76 | 126/80 | 129/82 | 106/59 | 111/63 | 114/66 |
| 165 | 126/76 | 132/80 | 135/82 | 110/60 | 116/64 | 119/66 | 123/77 | 127/80 | 130/82 | 107/59 | 112/63 | 114/66 |
| 170 | 128/77 | 134/80 | 138/82 | 112/61 | 117/64 | 121/66 | 124/77 | 128/80 | 131/82 | 108/61 | 112/67 | 115/71 |
| 175 | 130/77 | 136/81 | 140/83 | 113/61 | 119/64 | 122/66 | 125/78 | 129/81 | 131/82 | 109/59 | 113/63 | 115/66 |
| 180 | 132/77 | 138/81 | 142/83 | 115/61 | 120/64 | 124/66 | N/D | N/D | N/D | N/D | N/D | N/D |
| 185 | 134/78 | 140/81 | 144/84 | 116/61 | 122/64 | 125/66 | N/D | N/D | N/D | N/D | N/D | N/D |
Los valores se muestran en mmHg. N/D, no disponible. Datos de46.
En el anexo 2 se incluyen algunas recomendaciones relativas al uso del MAPA durante 24h. El uso del MAPA en el ámbito de los ensayos clínicos puede desempeñar un papel de mayor relevancia en niños que en adultos47, dado que un número menor de niños presentan HTA.
PA domiciliariaSe cuenta con un número limitado de datos en relación con el registro domiciliario de la PA en niños y adolescentes. En niños, el registro domiciliario de la PA muestra una mayor reproducibilidad que las mediciones de la PA realizadas en la consulta, y es similar a la de las mediciones ambulatorias de la PA48. Un estudio realizado sugiere que la PA ha de medirse en el domicilio al menos durante 3 días, 2 veces al día (por la mañana y por la noche), aunque se recomienda que la monitorización se prolongue durante 6–7 días49. En niños, los valores de PA obtenidos en el domicilio son inferiores a los valores diurnos de PA ambulatoria, probablemente debido al grado de actividad física que mantienen durante el día50–52. En relación con los valores diurnos de PA, es posible que la PA domiciliaria muestre una correlación ligeramente superior con los valores obtenidos de forma ambulatoria, en comparación con las medidas aisladas de PA. Sin embargo, no es así en el caso de la PA nocturna53. Un estudio llevado a cabo en el ámbito escolar, en el que se evaluaron 778 niños y adolescentes, ha aportado valores de referencia preliminares, en relación con el registro domiciliario de la PA (tabla 6)51.
Valores de presión arterial sistólica y diastólica domiciliarias (sistólica/diastólica)
| Niños | Niñas | |||||
| Talla (cm) | N | 50 | 95a | N | 50 | 95a |
| 120–129 | 23 | 105/64 | 119/76 | 36 | 101/64 | 119/74 |
| 130–139 | 51 | 108/64 | 121/77 | 51 | 103/64 | 120/76 |
| 140–149 | 39 | 110/65 | 125/77 | 61 | 105/65 | 122/77 |
| 150–159 | 41 | 112/65 | 126/78 | 71 | 108/66 | 123/77 |
| 160–169 | 45 | 115/65 | 128/78 | 148 | 110/66 | 124/78 |
| 170–179 | 91 | 117/66 | 132/78 | 46 | 112/66 | 125/79 |
| 180–189 | 57 | 121/67 | 134/79 | 7 | 114/67 | 128/80 |
Datos de [51].
En adultos, la monitorización ambulatoria de la PA y, en menor medida, el registro domiciliario de la PA, se utilizan para definir los pacientes que presentan HTA en la consulta pero no fuera de ella (HTA de bata blanca) y viceversa (pacientes que presentan valores dentro de la normalidad en la consulta, pero no así fuera de ella [HTA enmascarada])54. Sin embargo, determinar estos tipos de HTA es más complicado en niños y adolescentes, dado que, como se ha descrito anteriormente, no se han establecido con claridad los valores de referencia para la PA medida en la consulta y, en particular, para la PA ambulatoria y domiciliaria. Es más, en adultos, tanto los valores de PA ambulatoria como de domiciliaria son inferiores a los valores medidos en la consulta. En niños y adolescentes, sin embargo, los valores de PA ambulatoria diurna y, con frecuencia, los valores de PA domiciliaria, no solo no son inferiores a las medidas realizadas en la consulta, sino que son incluso ligeramente superiores (véanse las tablas 2 y 3, en comparación a las tablas 4–6). Ello puede deberse al alto grado de actividad física que presentan los niños o a la escasez e imprecisión de los valores de referencia con los que se cuenta en la actualidad.
No resulta sorprendente, por tanto, que en distintos estudios llevados a cabo en niños y adolescentes, la prevalencia de la HTA de bata blanca oscile entre el 1–44%55–57. Por otra parte, únicamente 2 estudios han investigado la HTA enmascarada56,57, en los que se ha observado que esta se produce aproximadamente en el 10% de los casos. Tanto en niños como en adultos se ha observado que tanto la HTA de bata blanca55,56 como la HTA enmascarada57 se asocian con una mayor masa ventricular izquierda (MVI), en comparación con los individuos con valores de PA dentro de la normalidad.
Diagnóstico y evaluaciónLa detección y confirmación de la HTA debe llevarse a cabo siguiendo distintos pasos para descartar distintas causas secundarias de HTA, si ello está indicado. En la figura 1 se muestra el algoritmo diagnóstico propuesto. Una vez que se haya confirmado la HTA, deberá evaluarse el daño orgánico, que incluirá la evaluación del corazón, los vasos de mayor tamaño, los riñones, el sistema nervioso central y, si es posible, la retina, dada la importancia del daño orgánico subclínico, como una fase intermedia en el conjunto de la enfermedad vascular. Posteriormente, la evaluación del daño orgánico resulta de utilidad como criterio intermedio de valoración de la protección inducida por el tratamiento. En los anexos 3–5 se incluyen los aspectos más relevantes de los antecedentes familiares y clínicos, la exploración física, las pruebas analíticas y otras pruebas recomendadas a la hora de evaluar la HTA en niños y adolescentes58–62.
Evaluación del daño orgánicoCorazón. Hasta la actualidad, la hipertrofia ventricular izquierda (HVI) constituye la manifestación más extensamente documentada en niños y adolescentes del daño orgánico causado por la HTA. En adultos, la HVI constituye un factor independiente de riesgo cardiovascular. En niños, si bien no se cuenta con datos similares a partir de estudios prospectivos, parece aconsejable valorar la HVI de forma precoz, dado que ello puede facilitar la prevención primaria de enfermedades cardiovasculares.
La ecocardiografía es un instrumento lo suficientemente sensible como para valorar la masa ventricular izquierda (MVI) en niños. La MVI se calcula mediante la ecuación de Devereux63, y debe estandarizarse en función de la altura (m2,7), para minimizar el efecto derivado de los cambios en el tamaño corporal que se experimentan durante la infancia64. Se considera que existe HVI cuando la MVI (g/m2,7) es igual o mayor al percentil 95, es decir cuando la MVI presenta un valor de 38,6g/m2,765. No obstante, el valor de corte en adultos (51g/m2,7) se corresponde con el percentil 97,5. Por otro lado, los datos de referencia se han calculado a partir de cohortes relativamente pequeñas, no se cuenta con datos prospectivos y en los pocos estudios disponibles se han aplicado diferentes criterios. Por ello, no constituye ninguna sorpresa que la prevalencia de HVI oscile entre el 14–42%66–68.
Vasos sanguíneos Los primeros cambios morfológicos de la pared arterial, así como el grosor del complejo íntima media, pueden identificarse mediante una ecografía de alta resolución. Los investigadores evalúan el grosor de la íntima media (IM) en niños que presentan un alto riesgo de padecer aterosclerosis en un futuro. Los niños con antecedentes familiares de hipercolesterolemia presentan un mayor grosor de la IM que los niños sanos de similar edad69. En niños con o sin HTA esencial, el sobrepeso y la obesidad están relacionados con un mayor grosor de IM70,71. En un estudio transversal en el que se incluyeron 247 adolescentes sanos, Jourdan et al propusieron valores de referencia para el grosor de IM de las arterias carótida y femoral72 y la distensibilidad de los vasos de gran tamaño. En dicho estudio se observó que el 38,8% de los niños hipertensos presentaban un IM por encima de lo normal (más de 2 veces la desviación típica)66.
Asimismo, se observa que los niños hipertensos presentan más frecuentemente una mayor rigidez arterial, en comparación con los niños con PA normal15. No obstante, antes de establecer conclusiones más categóricas, debe contarse con un mayor número de datos que determinen el intervalo de la normalidad para la distensibilidad arterial (o la rigidez arterial) en niños.
Riñón El diagnóstico del daño renal derivado de la HTA se fundamenta en la menor función renal o la mayor excreción urinaria de albúmina (EUA). La insuficiencia renal se clasifica en función del filtrado glomerular (FG), calculado mediante la fórmula de Schwartz, que se basa en la edad, la talla y la concentración sérica de creatinina, en la que FG (ml/min por 1,73m2)=K×(talla en cm/concentración sérica de creatinina en mg/dl). K es un coeficiente dependiente de la edad (neonatos prematuros, 0,33; neonatos a término, 0,45; niños de 2–12 años, 0,55; niñas de 13–18 años, 0,55; niños de 13–18 años, 0,70). Un FG (estimado) permanentemente reducido indica daño renal. Si bien cuando se inicia o se intensifica el tratamiento antihipertensivo [principalmente con el uso de inhibidores de la enzima de conversión de la angiotensina (ACE) o antagonistas de los receptores de la angiotensina (ARA)] puede producirse un incremento temporal de la concentración sérica de creatinina (hasta un 20%), ello no indica un deterioro progresivo de la función renal.
En adultos, el incremento de la EUA constituye un marcador de daño renal inducido por la HTA. La proteinuria no solo constituye un marcador del daño glomerular en las glomerulopatías primaria y secundaria sino que puede aumentar como consecuencia de valores elevados de PA, siendo un indicador de las intervenciones terapéuticas destinadas a reducir la PA. Incluso pequeñas cantidades de albúmina en la orina se asocian con la progresión de la nefropatía y un mayor riesgo cardiovascular. Una mayor tasa de excreción urinaria de albúmina o proteínas indica alteraciones en la barrera de filtración glomerular. Se ha observado que la microalbuminuria (20–300μg/mg de creatinina, 2–30mg/mmol de creatinina, 30–300mg/d, 20–200μg/min) constituye un factor pronóstico del desarrollo de nefropatía diabética, mientras que la proteinuria (>300mg/d) indica la existencia de un daño establecido en el parénquima renal. No obstante, aún debe establecerse el papel que desempeña la evaluación de la microalbuminuria a la hora de valorar la HTA esencial en niños. La presencia en niños de HVI y/o microalbuminaria están a menudo asociadas con la presencia de HTA esencial73.
Cerebro. Convulsiones, ictus, alteraciones visuales y cambios vasculares retinianos, son complicaciones asociadas con la HTA grave en niños e incluso en lactantes aunque su frecuencia es escasa debido al diagnóstico precoz y a la instauración de un tratamiento antihipertensivo eficaz. Junto a la evaluación neurológica y oftalmológica, se utilizan como procedimientos diagnósticos la electroencefalografía y, en casos de emergencia, la TC. En las raras ocasiones en las que se sospecha de la presencia de pequeños infartos cerebrales silentes, microhemorragias y lesiones en la materia blanca, la resonancia nuclear magnética es el método de elección.
Oftalmoscopia. En fases tempranas del desarrollo de la HTA pueden darse lesiones vasculares en pequeñas arterias (estrechamiento de las arteriolas). Sin embargo, hasta la fecha se han realizado pocos estudios en los que se hayan evaluado las alteraciones retinianas en niños con HTA. En un estudio en el que se incluyeron 97 niños y adolescentes con HTA esencial, Daniels et al74 observaron que el 51% presentaba alteraciones retinianas, que se detectaron mediante oftalmoscopia directa. Recientemente Mitchell et al75, utilizando análisis cuantitativo de las imágenes retinianas digitales, observaron que incluso en niños de edades comprendidas entre 6–8 años, cada incremento de 10mm Hg en la PAS se asociaba con un estrechamiento de las arteriolas de 1,43–2,08μm. La aplicación rutinaria de la oftalmoscopia debe restringirse a la evaluación de la presencia de encefalopatía hipertensiva o de HTA maligna.
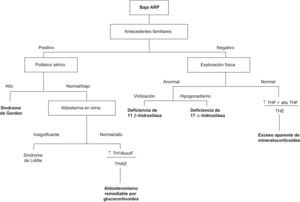
Análisis genéticoLos análisis genéticos merecen especial atención, incluso aunque no se haya demostrado el papel que desempeñan en la evaluación rutinaria de niños con HTA. Si bien en raras ocasiones la HTA tiene un origen monogénico, dichos casos deben detectarse durante la edad pediátrica, para instaurar el tratamiento adecuado y evitar la morbimortalidad asociada a la HTA76,77. Todas las causas monogénicas conocidas de HTA se caracterizan por alteraciones en el transporte de sodio en el riñón, expansión del volumen y baja actividad de renina plasmática.
Entre ellos, se han identificado el síndrome de Liddle78, el hiperaldosteronismo remediable por glucocorticoides79, el exceso aparente de mineralocorticoides77, el síndrome de Gordon80, el síndrome de hipersensibilidad del receptor mineralocorticoide81 y las formas hipertensivas de hiperplasia adrenal congénita82. La presencia de enfermedades monogénicas debe sospecharse en los casos que presenten HTA con baja actividad de renina plasmática e historia familiar de HTA severa, de aparición temprana, accidentes cerebrovasculares e insuficiencia cardiaca o HTA refractaria. La hipopotasemia constituye un rasgo característico en la mayoría de los casos descritos de HTA con baja actividad de renina plasmática, excepto en el síndrome de Gordon. En la figura 2 se muestra un algoritmo diagnóstico.
Algoritmo diagnóstico en los casos de hipertensión que cursan con baja actividad de renina plasmática y evaluación genética. Cociente normal de TH18oxoF/THAD urinario, entre 0–0,4; hiperaldosteronismo sensible a glucocorticoides, mayor de 1. Cociente normal de THF+ alloTHF/THE urinario, inferior a 1,3; exceso de mineralocorticoides, 5–10 veces mayor. AlloTHF: alotetrahidrocortisol; ARP: actividad de renina plasmática; TH18oxoF: 18-oxo-tetrahidrocortisol; THAD: tetrahidroaldosterona; THE: tetrahidrocortisona; THF: tetrahidrocortisol.
La mayoría de casos de PA normal alta e HTA en la edad pediátrica no corresponden a HTA secundaria, que deban detectarse y tratarse específicamente. Por ello, los esfuerzos deben centrarse en comprender los factores asociados, con el fin de normalizar los valores de PA y evitar que valores de PA normal alta en la juventud progresen a la HTA en la edad adulta.
En los últimos años se han realizado avances considerables en la identificación de factores que a menudo están asociados a elevaciones de la PA en niños y adolescentes. Sin embargo, se cuenta con un número limitado de datos en relación con los resultados de las distintas medidas de intervención.
Entre los factores que originan aumento de la PA en la infancia, el sobrepeso es posiblemente el más importante83, dado que aumenta en más del 50% el riesgo de que se desarrolle HTA84–87.
Se sabe que los niños con sobrepeso son más proclives a mantenerse obesos, y la adiposidad es el factor de riesgo más importante para presentar valores de PA elevados. Desafortunadamente, entre 1970–1990 la prevalencia del sobrepeso en niños y adolescentes estadounidenses se incrementó de 5% a 11%88, y se observó una tendencia similar en los niños británicos89. Un estudio realizado en Milán (Italia) a niños en edad escolar (6–11 años), la prevalencia de sobrepeso osciló entre 17,0–38,6%, en función de las diferentes definiciones utilizadas90. Aparte del índice de masa corporal, se ha observado que el perímetro de la cintura (obesidad abdominal) es otro factor que ha de tenerse en cuenta91. Recientemente se ha identificado que el peso al nacer y el crecimiento posnatal influyen en el desarrollo de HTA y enfermedades cardiovasculares en la edad adulta92–97. Por último, los hábitos dietéticos adoptados en las primeras fases de la vida, en particular una alta ingesta de sal, son factores que favorecen la elevación de la PA98,99.
Medidas relativas al estilo de vidaSe dispone de un número limitado de datos relativos a la reducción de la PA a partir de estudios aleatorizados en los que se hayan evaluado intervenciones para promover la pérdida de peso. En la actualidad hay distintos estudios en curso en los que se evalúa el estilo de vida en diferentes ámbitos100,101. No obstante, hasta que estos no hayan finalizado, no pueden formularse demasiadas recomendaciones basadas en la evidencia. La mayoría de las recomendaciones, sin embargo, son obvias y de sentido común. A partir de los datos de distintas revisiones, se recomienda realizar 40min de actividad física aeróbica (moderada o intensa), 3–5 días por semana, para mejorar la función vascular y reducir la PA en niños obesos83.
Por ello, cualquier intervención que no solo reduzca la ingesta de energía, sino que también incremente la actividad física de estos niños, posiblemente contribuya a mantener normal la PA. Por lo general, dichas intervenciones deberían aplicarse de forma generalizada en los colegios, e incluirse dentro de las recomendaciones que habría que transmitir no solo a los niños de forma individualizada sino también a los padres.
En los colegios deben fomentarse las actividades en grupo y al aire libre como parte del plan de estudios, con el objetivo de desarrollar un nuevo concepto de estilo de vida al aire libre. Asimismo, tanto los niños como las niñas deberán realizar ejercicio físico intenso con cierta regularidad. Todos ellos se consideran factores clave para mantener la PA normal durante la infancia y adolescencia. Si bien se dispone de guías dietéticas específicas, estas se basan parcialmente en la evidencia100–102. Entre dichas recomendaciones se propone reducir la ingesta de sal e incrementar la ingesta de potasio en edades tempranas103–105. Como se ha mencionado anteriormente, en la actualidad se están llevando a cabo distintos ensayos en los que se evalúan diversas modificaciones dietéticas100,101,104. En el anexo 6 se incluyen las recomendaciones relativas al estilo de vida.
Cada vez se cuenta con más datos que inciden en la importancia de la vida fetal en los factores que determinar el riesgo cardiovascular. Por ello, han de adoptarse medidas preventivas de forma muy precoz, como por ejemplo, desaconsejar el tabaquismo en la madre y promover la lactancia materna durante un período de 6–9 meses106. Asimismo, es importante restringir el contenido de sodio en la lactancia artificial, según se ha demostrado en un estudio, en el que se hizo seguimiento de los cambios de la PA, hasta la edad de 15 años98.
Evidencias para el tratamiento antihipertensivoDebido a la infrecuente incidencia de accidentes cardiovasculares en la infancia, tales como infarto de miocardio, ictus, insuficiencia renal o insuficiencia cardiaca no se han podido realizar hasta la fecha estudios para evaluar el efecto beneficioso de la reducción de los valores de PA. A pesar de ello, la experiencia clínica muestra que la reducción de la PA elevada en situaciones de riesgo vital como es la insuficiencia cardiaca aguda, encefalopatía hipertensiva e HTA maligna, mejora la supervivencia y reduce las secuelas en niños. Dado que estos accidentes cardiovasculares se producen en raras ocasiones, en la mayoría de los casos los pocos datos disponibles hasta el momento se basan en criterios de valoración del daño orgánico, incluidos la HVI y el mayor grado de EUA.
Ensayos basados en objetivos intermediosCorazónLa investigación pediátrica para evaluar los efectos que ejercen los tratamientos antihipertensivos sobre el daño cardiaco se limita a estudios de pequeño tamaño muestral sin grupo control, en poblaciones heterogéneas con HTA primaria y secundaria. Algunos datos, no obstante, indican que un tratamiento antihipertensivo eficaz puede mejorar la geometría cardiaca en niños. Se observó regresión de la HVI en 3 niños con HTA esencial que recibieron enalapril, en 19 niños con HTA primaria y secundaria a los que se trató con ramipril durante 6 meses, y en 65 niños con nefropatía crónica (NC) en estadio 2–4, que recibieron ramipril durante un periodo máximo de 2 años107–109. Todos los estudios pediátricos publicados hacen referencia a inhibidores de la ECA, y no se dispone de datos comparativos con otras clases de antihipertensivos.
Función renal y nefropatíaLos datos de estudios en adultos muestran que, entre los fármacos antihipertensivos, los bloqueantes del sistema renina-angiotensina son particularmente eficaces a la hora de reducir la proteinuria y retrasar la progresión de la nefropatía (véase la sección «Tratamiento farmacológico»). Estas evidencias han motivado la realización de un estudio de intervención en la edad pediátrica de amplio tamaño muestral: efecto de un Estricto Control de la Presión Arterial y de los Inhibidores de la ECA sobre la Progresión de la Insuficiencia Renal Crónica en Pacientes Pediátricos (ESCAPE, por sus siglas en inglés), que demostró, en 352 niños con NC, que ramipril (un inhibidor de la enzima conversora de angiotensina) reduce de forma eficaz la PA y la proteinuria110. No obstante, durante el tratamiento prolongado se observó un fenómeno de rebote gradual de la proteinuria, a pesar de que se mantuvo un buen control de los valores de PA. Ello cuestiona el supuesto beneficio que puede aportar en niños la inhibición de la ECA, en términos de nefroprotección a largo plazo111.
Cuándo ha de iniciarse el tratamiento antihipertensivoDe igual forma que en adultos, la decisión de iniciar el tratamiento antihipertensivo en niños no debe basarse únicamente en los valores de PA, sino que debe fundamentarse también en la presencia o ausencia de daño orgánico, y de otros factores de riesgo o enfermedades, tales como obesidad, enfermedades renales y diabetes. En niños con HTA secundaria documentada, el tratamiento específico de la enfermedad subyacente debe iniciarse inmediatamente después de la detección de la misma. En niños con HTA primaria, el tratamiento antihipertensivo debe centrarse, en primer lugar, en los factores de riesgo de HTA (por ejemplo, sobrepeso, ingesta excesiva de sal, poca actividad física), a similitud de lo descrito en la sección «Medidas preventivas».
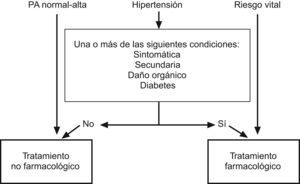
El tratamiento no farmacológico debe continuarse incluso una vez que haya comenzado el tratamiento farmacológico, dado que puede mejorar el perfil global de riesgo cardiovascular en niños hipertensos. El tratamiento farmacológico debe iniciarse de acuerdo con las recomendaciones contenidas en el anexo 7. Desafortunadamente, la decisión de cuándo ha de iniciarse el tratamiento farmacológico no está respaldada por ningún estudio clínico. Por lo tanto, las recomendaciones que se recogen en el árbol de toma de decisiones (fig. 3) se basan en analogías observadas en adultos. En particular, debe prestarse especial atención en niños pequeños a la relación riesgo/beneficio que presenta la administración prolongada de los fármacos.
Cuándo ha de iniciarse el tratamiento antihipertensivo. Deberá comenzar a administrarse un tratamiento antihipertensivo cuando se dé una o más de las condiciones listadas. Si se observa la existencia de hipertensión persistente (a pesar de haber adoptado medidas no farmacológicas), debe iniciarse el tratamiento farmacológico antihipertensivo.
En adultos, la recomendación de reducir la PA por debajo de 140/90mmHg está suficientemente basada en la evidencia2,3. Dado que no se han realizado estudios prospectivos a largo plazo que relacionen los valores de PA durante la infancia con los accidentes cardiovasculares, los objetivos de PA en la población pediátrica normalmente se establecen en relación con los percentiles de PA. El percentil 95 se toma habitualmente como valor de corte a la hora de definir la HTA en niños y adolescentes. Ello justifica el hecho de que en el caso de los niños y adolescentes con HTA esencial el objetivo sea mantener la PA por debajo del percentil 95 (en función de la edad, el sexo y la talla). No obstante, probablemente sea más prudente y seguro establecer un objetivo de PA inferior al percentil 90.
Objetivo de PA en nefropatías y diabetesLas guías actuales recomiendan que en adultos con HTA y enfermedades concomitantes, como diabetes, enfermedades cardiovasculares y nefropatías, se reduzcan los valores aislados de PA por debajo de 130/80mmHg, mientras que en adultos que presenten proteinuria la PA debe permanecer por debajo de 120/75mmHg1. Sin embargo, recientemente se ha considerado que estas recomendaciones necesitan nuevas evidencias3.
Los datos preliminares del estudio prospectivo y aleatorizado ESCAPE, en niños con nefropatía crónica, indican que un control estricto de la PA, mediante el que esta se mantenga durante 24h por debajo del percentil 50 la PA media, incrementa la supervivencia renal al cabo de 5 años, a pesar de que la proteinuria retorne a los valores previos al tratamiento112. Dicho control se consiguió mediante la adición de otros fármacos antihipertensivos al tratamiento con IECA. Los análisis llevados a cabo según los valores de PA alcanzados muestran resultados de supervivencia renal similares en pacientes que en el transcurso de 24h hayan presentado valores de PA por debajo del percentil 75. Por el contrario, los pacientes que presentaron valores por encima del percentil 90 mostraron una supervivencia renal significativamente menor al cabo de 5 años. Por otro lado, la proteinuria parece ser un factor que modifica en gran medida la eficacia renoprotectora derivada de un mayor control de la PA. A pesar de que los efectos renoprotector y antiproteinúrico no se produzcan simultáneamente, la mayor supervivencia renal se ha asociado con una mayor reducción de la PA, únicamente en niños con proteinuria basal moderada. En niños con enfermedad no proteinúrica, por el contrario, no se observa que los tratamientos intensivos destinados a reducir los valores de PA aporten ningún beneficio. Aparte del efecto renoprotector, los datos del estudio ESCAPE indican que un mayor control de los valores de PA (mediante la adición de ramipril a otros fármacos antihipertensivos), puede asociarse con la regresión de la HVI que estos niños presentaban en el momento basal113.
Si bien en niños con diabetes la nefropatía diabética franca es poco común, se considera que estos pacientes presentan un mayor riesgo a largo plazo de HTA y daño renal114,115. Ya en fases tempranas de la enfermedad se observan alteraciones moderadas en la PA (ligeros incrementos de la PAS y/o una menor variación circadiana de la PA) mediante la monitorización ambulatoria de PA115,116, pese a que los valores aislados de PA sean normales. En muchas ocasiones la alteración de la regulación de la PA nocturna precede al desarrollo de microalbuminuria, que constituye el primer marcador de la nefropatía diabética115. Si bien no se dispone de datos en pacientes pediátricos que demuestren la eficacia de las estrategias preventivas con tratamientos antihipertensivos y antiproteinúricos, los datos en adultos refuerzan la recomendación de mantener un estricto control en niños con diabetes.
Objetivos relativos a la PA domiciliaria y ambulatoriaLa monitorización ambulatoria de PA se considera el método de referencia para el diagnóstico y control de la HTA, así como para detectar tanto los casos de HTA de bata blanca como de HTA enmascarada. Los datos del estudio ESCAPE muestran que en niños la PA medida de forma ambulatoria presenta una menor variabilidad frente al tratamiento antihipertensivo que las mediciones de PA realizadas en la consulta117. Por lo tanto, parece prudente recomendar la monitorización ambulatoria de la PA para determinar si se alcanzan y se mantienen los objetivos de PA en niños con nefropatía. Dado que la monitorización ambulatoria de la PA no puede realizarse con frecuencia, las mediciones de PA realizadas en la consulta y el domicilio proporcionan información complementaria. El registro domiciliario de la PA guarda una correlación más estrecha con el promedio diurno de PA (derivado de la monitorización ambulatoria de la PA) que los valores de PA obtenidos en la consulta, por lo que el registro domiciliario de la PA debe considerarse una información más precisa.
Estrategias terapéuticasModificaciones del estilo de vidaSi bien dichas modificaciones ya se han comentado en la sección «Medidas Preventivas», es necesario reiterar que las modificaciones del estilo de vida no deben aplicarse únicamente antes del tratamiento farmacológico, sino que deben continuar llevándose a cabo de forma simultánea a dicho tratamiento.
Tratamiento farmacológicoHuérfanos terapéuticosHasta hace poco tiempo, no se había aprobado el uso de ningún fármaco antihipertensivo en niños y adolescentes. Las iniciativas llevadas a cabo en EE.UU. (Ley de Mejores Medicamentos para Niños, Ley de Equidad en Investigación Pediátrica) han contribuido a que las autoridades europeas comprendan que los niños deben ser tratados con fármacos que hayan sido estudiados y autorizados para ellos. El objetivo del Reglamento sobre medicamentos Pediátricos (Reglamento de la UE 1901/2006/CE)118 es incrementar la disponibilidad de medicinas autorizadas para uso pediátrico, así como obtener mayor cantidad de información sobre el uso de fármacos en la población pediátrica (que, de acuerdo con el reglamento mencionado, es aquella formada por niños y adolescentes de edades comprendidas entre 0–18 años). En particular, los fármacos cardiovasculares no están aprobados para su uso en niños, y en el inventario de necesidades pediátricas [Evaluación de las necesidades pediátricas (Productos cardiovasculares, EMEA 436949/2006)] se incluyen todos los agentes antihipertensivos que han de estudiarse en este grupo de edad. A las compañías farmacéuticas se les otorgará, como incentivo, 6 meses de extensión de la exclusividad de mercado, en caso de que hayan realizado adecuadamente los pertinentes estudios pediátricos. Es más, si se llevan a cabo estudios en población pediátrica con fármacos que hayan perdido la patente, estos recibirán un periodo adicional de exclusividad, de acuerdo con la Autorización de Comercialización para Uso Pediátrico (Artículo 40, regulación de la UE). De acuerdo con este proceso, los IECA, beta bloqueantes, bloqueantes de los canales de calcio, la dihidralazina, prazosina y los diuréticos podrán ser aprobados para su uso en lactantes, niños y adolescentes.
Los cambios legislativos que se han producido en EE.UU. (Ley para la Modernización de la Administración de Fármacos y Alimentos, 1997; Ley de Mejores Medicamentos para Niños, 2002)119 han favorecido el estudio y aprobación de nuevos fármacos antihipertensivos para su uso en niños y adolescentes. El reciente reglamento sobre Medicamentos Pediátricos [Reglamento (CE) de la UE 1901/2006] motivará que en Europa se aprueben otros fármacos antihipertensivos para su uso en niños e incluso en lactantes. Algunos fármacos antihipertensivos ya están disponibles comercialmente en forma de suspensión oral (líquido), o pueden prepararse extemporáneamente, de tal forma que se facilite su administración. Las fichas técnicas de distintos fármacos han incluido recientemente información relativa a su administración pediátrica, basándose en los resultados de los ensayos clínicos de búsqueda de dosis. En un futuro a corto plazo se espera contar con más información relativa a nuevos fármacos y a edades de administración más tempranas. Uno de los aspectos negativos de los nuevos reglamentos es el hecho de que para los compuestos más antiguos, cuya patente ha expirado, no se dispone de datos pediátricos fiables, obtenidos a partir de estudios controlados (de búsqueda de dosis y eficacia). Posiblemente la Autorización de Comercialización para Uso Pediátrico (PUMA) contribuirá a resolver esta cuestión, al menos parcialmente. Por el momento, las recomendaciones actuales se basan en un pequeño número de estudios patrocinados por la industria, y principalmente, en series de casos de un único centro, así como en la experiencia clínica colectiva, la opinión de los expertos y la extrapolación de los datos obtenidos en adultos.
MonoterapiaParece razonable que en niños el tratamiento se inicie con monoterápia a dosis bajas, para evitar que la PA descienda bruscamente de forma significativa. Si la PA no se reduce de forma significativa después de unas pocas semanas (entre 4–8 semanas), se debe comenzar a administrar la dosis completa del fármaco. Si persiste la falta de control o si aparecen efectos secundarios, se recomienda comenzar a administrar un fármaco antihipertensivo de una clase distinta. Este procedimiento posibilita determinar la mejor respuesta para cada paciente, en términos de eficacia y tolerabilidad. Dado que las tasas de respuesta alcanzadas con los tratamientos de dosis única no son suficientes, en particular en los casos de HTA moderada o grave, en muchos casos es necesario administrar un tratamiento combinado.
De igual forma que en adultos, entre los fármacos antihipertensivos que pueden administrarse se incluyen los IECA, los antagonistas de los receptores de la angiotensina (ARA), los antagonistas del calcio, los betabloqueantes y los diuréticos. Si bien se han realizado algunos estudios controlados con placebo, apenas se han realizado estudios en los que se compare directamente la eficacia y seguridad de distintos fármacos antihipertensivos en niños y adolescentes. En una revisión reciente120 de 27 estudios pediátricos se han observado reducciones comparables de la PA cuando se administran IECA (10,7/8,1mmHg), ARA (10,5/6,9mmHg) y antagonistas del calcio (9,3/7,2mmHg).
Bloqueantes beta adrenérgicosSi bien el propranolol se ha incluido durante muchos años en las recomendaciones terapéuticas para la HTA pediátrica, se ha estudiado como fármaco antihipertensivo en un número limitado de ensayos, en los que se incluyó un número reducido de niños121,122. Gran parte de la información relativa a la seguridad y eficacia de este fármaco proviene de estudios en niños sin HTA, con enfermedad cardiaca o HTA portal123. La situación es similar en el caso de atenolol y metoprolol124. El único estudio en el que se ha investigado específicamente la HTA es un ensayo realizado recientemente, de 52 semanas de duración125 en el que se incluyeron 140 niños (de edades comprendidas entre 6–11 años). En dicho estudio se observó que una formulación de metoprolol de liberación prolongada producía reducciones significativas de la PAS y la PAD, en comparación con placebo, cuando se administraron 1,0mg/kg y 2,0mg/kg. El fármaco fue bien tolerado, y únicamente el 5% de los pacientes abandonó el estudio debido a acontecimientos adversos.
Antagonistas del calcioSe cuenta con un número limitado de datos de eficacia y seguridad para diltiazem, verapamil, nifedipina, felodipino e isradipina126. No obstante, se han realizado distintos ensayos en los que se ha investigado amlodipino120, un fármaco que se utiliza ampliamente como tratamiento de la HTA en niños127. En un ensayo multicéntrico de amplio tamaño muestral, en el que se incluyeron 268 niños de edades comprendidas entre 6–16 años, amlodipino redujo la PAS, en comparación con placebo128. Se estableció una relación dosis respuesta significativa cuando se administraron dosis de entre 0,06–0,34mg/kg al día. Por otra parte, en un estudio farmacocinético129 se observó que los parámetros farmacocinéticos de amlodipino difieren significativamente en niños menores de 6 años, con menor peso corporal, en comparación con los niños de mayor edad o peso. Ello indica que deben administrarse dosis mayores de amlodipino (mg por kg de peso corporal) cuando se trata a niños de mayor edad.
Inhibidores de la enzima de conversión de la angiotensinaEl inhibidor de la enzima de conversión de la angiotensina (iECA) que se desarrolló en primer lugar, captopril, ha sido ampliamente estudiado en niños. Si bien el perfil de eficacia y seguridad de este fármaco está bien establecido, este presenta una acción de corta duración. Debido a ello, debe administrarse 2 o 3 veces al día, por lo que ha sido sustituido por inhibidores de la ECA de acción prolongada130, algunos de los cuales se han estudiado recientemente en niños120. Por ejemplo, se dispone de resultados de eficacia controlados con placebo para enalapril131, fosinopril132 y lisinopril133, y se han llevado a cabo estudios farmacocinéticos para enalapril134, lisinopril135 y quinapril136. Si bien los estudios con enalapril131 y lisinopril133 han establecido una dosis efectiva mínima de 0,08mg/kg/d, dosis de 0,6mg/kg/d fueron bien toleradas. Se estudió la formulación de suspensión extemporánea de estos fármacos. En el estudio de fosinopril132 no se logró establecer una relación dosis respuesta con la reducción de los valores de PA. Los autores de dicho estudio sugirieron que probablemente todas las dosis administradas fueran demasiado altas (0,1; 0,3 y 0,6mg/kg/d; la máxima dosis permitida fue de 40mg/d). Fosinopril132, sin embargo, produjo una mayor reducción de la PAS, en comparación con placebo, y fue bien tolerado. En el estudio se incluyó una extensión de 52 semanas de duración, en la que el tratamiento se administró de forma abierta, y en la que se recogió más información relativa a la seguridad y tolerabilidad del fármaco, en comparación con otros estudios realizados. Ramipril se ha estudiado principalmente en niños con nefropatía crónica. Cuando se administra una dosis de 6mg/m2 al día, el fármaco reduce la PA media en 24h, en particular en niños con HTA o proteinuria graves110. Asimismo, al administrar una dosis inferior de ramipril (2,5mg/m2 al día), se observó una reducción de la PA y la proteinuria en niños con HTA esencial e HTA renal, con insuficiencia renal crónica137.
Antagonistas del receptor de la angiotensinaRecientemente se han obtenido un mayor número de datos sobre el efecto de los antagonistas del receptor de la angiotensina (ARAII) en niños hipertensos120. El tratamiento a corto plazo con losartan, en niños con un FG estimado de ≥30ml/min por 1,73m2 conllevó reducciones significativas de la PAD dosis-depndiente138. Si bien la dosis inicial eficaz fue 0,75mg/kg al día, se toleraron bien dosis de hasta 1,44mg/kg al día. Un pequeño estudio farmacocinético de irbesartan indicó que dosis de 75–150mg/d son eficaces en niños con HTA139. Otro ensayo clínico con un pequeño tamaño muestral140, en el que se incluyeron niños hipertensos con proteinuria, mostró que dosis de 3,8–5,9mg/kg/d de irbesartan redujeron significativamente la PA y la proteinuria. Asimismo, se cuenta con datos para candesartan, a partir de un pequeño estudio realizado en 17 niños, de edades comprendidas entre 1–6 años. En dicho estudio se administró una dosis al día de candesartan141 (0,16–0,47mg/kg de peso corporal). Se observó una reducción significativa de la PA, y el efecto sobre la PA fue similar en pacientes con o sin proteinuria manifiesta. Recientemente se ha observado que valsartan reduce eficazmente la PAS y la PAD en niños de edades comprendidas entre 1–5 años, en comparación con placebo142.
Otros fármacos antihipertensivosNo se han llevado a cabo estudios pediátricos en los que se investiguen diuréticos (excepto un antiguo estudio de pequeño tamaño muestral de clortalidona122), vasodilatadores directos, fármacos que actúan sobre el sistema nervioso central o antagonistas de los receptores alfa-1 a pesar de que estos fármacos se han utilizado desde hace tiempo en el ámbito clínico como tratamientos farmacológicos en niños con HTA143. Sin embargo, se cuenta con experiencia pediátrica con hidroclorotiazida y clortalidona. Este último presenta una vida media más prolongada, y el intervalo de administración de dosis varía entre 24–48h. Las tiazidas en dosis altas ejercen un efecto marginal sobre la PA y se asocian con una mayor incidencia y gravedad de los efectos secundarios.
Por ello, a la hora de seleccionar el fármaco con el que ha de iniciarse el tratamiento antihipertensivo, debe considerarse la experiencia clínica y los diversos aspectos fisiopatológicos. Dado que muchos de los niños y adolescentes que requieren tratamiento con fármacos antihipertensivos presentan algún grado de nefropatía, los fármacos más ampliamente utilizados son aquellos que inhiben el sistema renina angiotensina, fundamentalmente IECA o ARAII en caso de que el paciente presente intolerancia frente a los IECA. Los diuréticos de asa (por ejemplo, la furosemida), constituyen un tratamiento esencial en niños con insuficiencia renal crónica avanzada o con insuficiencia cardiaca. En la tabla 7 se muestran las dosis de los fármacos antihipertensivos recomendadas en la población pediátrica, mientras que en la tabla 8 se presentan recomendaciones y contraindicaciones específicas.
Dosis iniciales recomendadas para distintos fármacos antihipertensivos seleccionados para el tratamiento de la hipertensión en niños y adolescentes
| Clase | Fármaco | Dosis | Intervalo |
| Diuréticos | |||
| Amiloride | 0,4–0,6mg/kg al día | q.d. | |
| Clortalidona | 0,3mg/kg al día | q.d. | |
| Furosemida | 0,5–2,0mg/kg por dosis | q.d.–b.i.d. | |
| Hidroclorotiazida | 0,5–1mg/kg al día | q.d. | |
| Espironolactona | 1mg/kg al día | q.d.–b.i.d. | |
| Bloqueantes beta adrenérgicos | |||
| Atenolol | 0,5–1mg/kg al día | q.d.–b.i.d. | |
| Metoprolol | 0,5–1,0mg/kg al día | q.d. (LP) | |
| Propanolol | 1mg/kg al día | b.i.d.–t.i.d. | |
| Bloqueantes del canal de calcio | |||
| Amlodipino | 0,06–0,3mg/kg al día | q.d. | |
| Felodipinoa | 2,5mg al día | q.d. | |
| Nifedipina | 0,25–0,5mg/kg al día | q.d.–b.i.d. (LP) | |
| Inhibidores de la enzima de conversión de angiotensina | |||
| Captopril | 0,3–0,5mg/kg por dosis | b.i.d.–t.i.d. | |
| Enalapril | 0,08–0,6mg/kg al día | q.d. | |
| Fosinopril | 0,1–0,6mg/kg al día | q.d. | |
| Lisinopril | 0,08–0,6mg/kg al día | q.d. | |
| Ramiprila | 2,5–6mg al día | q.d. | |
| Bloqueantes de los receptores de angiotensina | |||
| Candesartan | 0,16–0,5mg/kg al día | q.d. | |
| Irbesartana | 75–150mg al día | q.d. | |
| Losartan | 0,75–1,44mg/kg al día | q.d. | |
| Valsartan | 2mg/kg al día | q.d. | |
b.i.d.: dos veces al día; LP: liberación prolongada; q.d.: una vez al día; t.i.d.: tres veces al día. No debe excederse en ningún caso la dosis máxima recomendada en adultos.
Enfermedades en las que se recomienda el uso de clases específicas de antihipertensivos, o en las que está contraindicado
| Clase de antihipertensivo | Recomendado | Contraindicado |
| Diuréticos ahorradores de potasio diuréticos | Hiperaldosteronismo | Insuficiencia renal crónica |
| Diuréticos de asa | Insuficiencia renal crónica | |
| Insuficiencia cardiaca congestiva | ||
| Bloqueantes beta-adrenérgicos | Coartación de la aorta | Asma bronquial |
| Insuficiencia cardiaca congestiva | ||
| Bloqueantes de los canales de calcio | Postransplante | Insuficiencia cardiaca congestiva |
| Inhibidores de la enzima de conversión de angiotensina | Enfermedad renal crónica | Estenosis bilateral de la arteria renal |
| Diabetes mellitus | Estenosis de las arterias renales (en uno de los riñones) | |
| Insuficiencia cardiaca congestiva | Hiperpotasemia | |
| Embarazo | ||
| Las mujeres en edad fértil deben utilizar un método de contraceptivo fiable | ||
| Antagonistas del receptor de la angiotensina | Enfermedad renal crónica | Estenosis bilateral de la arteria renal |
| Diabetes mellitus | Estenosis de las arterias renales (en uno de los riñones) | |
| Insuficiencia cardiaca congestiva | Hiperpotasemia | |
| Embarazo | ||
| Las mujeres en edad fértil deben utilizar un método de contraceptivo fiable | ||
| Vasodilatadores intravenosos | Enfermedades potencialmente mortales |
En niños con nefropatía, a menudo la monoterapia no es suficiente para alcanzar un control adecuado de la PA. Por ello, se requiere la administración temprana de un tratamiento combinado. La administración temprana de combinaciones de fármacos antihipertensivos es más eficaz y presenta una menor tasa de reacciones adversas, en comparación con la administración de altas dosis en monoterapia. En las guías de la ESH/ESC (2007) se recogen las combinaciones de fármacos antihipertensivos recomendadas2. Si bien en niños no es frecuente administrar combinaciones de 2 fármacos en dosis fijas, dado que se prefiere individualizar el tratamiento, las combinaciones fijas pueden resultar adecuadas para incrementar el cumplimiento terapéutico en adolescentes144.
Estrategias terapéuticas en situaciones especialesEnfermedades asociadasEn ciertos casos la HTA ha de abordarse mediante un enfoque terapéutico específico, no solo porque deban alcanzarse valores de PA inferiores a los habitualmente recomendados, sino por la presencia de determinadas enfermedades sobre las que puedan actuar fármacos antihipertensivos específicos. Entre ellas se incluyen la nefropatía crónica, la diabetes mellitus, el síndrome metabólico, la insuficiencia cardiaca y la apnea del sueño.
Enfermedad renal crónicaEn la sección «Objetivos Terapéuticos» se han resumido los datos preliminares, obtenidos recientemente, del estudio ESCAPE, que indican que en niños con nefropatía crónica, en particular si esta se acompaña de proteinuria, la HTA ha de tratarse de forma más intensa, para reducir la proteinuria y prevenir el deterioro progresivo de la función renal. Si bien han de tenerse en cuenta las opciones no farmacológicas, el tratamiento farmacológico constituye el tratamiento antihipertensivo de referencia en todos los estadios de la nefropatía crónica. Las diferentes clases de fármacos antihipertensivos muestran una eficacia similar, en términos de reducción de los valores de PA en niños con nefropatía crónica120,145. No obstante, la mayor parte de los datos clínicos disponibles hacen referencia a los bloqueantes del sistema renina angiotensina110,120,146. Dichos fármacos muestran un potente efecto antiproteinúrico en nefropatías, y presentan un perfil de seguridad favorable. Por otra parte, en el único estudio aleatorizado en el que se han comparado los efectos de un ARAII (irbesartan) con un antagonista del calcio (amlodipino), en niños con nefropatía crónica proteinúrica no diabética, se ha demostrado que se da una reducción significativa de la proteinuria únicamente cuando se administra un ARAII, pese a que ambos tratamientos ejercen efectos similares sobre la PA140.
En la actualidad, por lo tanto, parece razonable recomendar la administración de bloqueantes del sistema renina angiotensina, como tratamiento de primera opción en pacientes con NC, tanto si presentan proteinuria como si no la presentan. En 3 cuartas partes de los niños hipertensos con nefropatía crónica en estadios 2–4, los valores de PA pueden controlarse mediante la administración de antihipertensivos en monoterapia. No obstante, al menos el 50% de los niños requieren más de un fármaco para alcanzar unos valores de PA suficientemente bajos. En caso de que sea necesario administrar un tratamiento combinado, los diuréticos y los bloqueantes de los canales de calcio constituyen las opciones más adecuadas para combinar con los bloqueantes del sistema reninavangiotensina. Se ha sugerido que los ARAII, en combinación con los IECA, ejercen un efecto antiproteinúrico y renoprotector adicional147, e incluso se ha llevado a cabo un pequeño estudio a corto plazo en niños148. Sin embargo, recientemente se han publicado los resultados negativos del estudio ONTARGET, en una población de pacientes adultos de alto riesgo149, en relación con la combinación de distintos bloqueantes del sistema reninavangiotensina. A la vista de dichos resultados, se ha de ser cauteloso a la hora de administrar esta combinación a cualquier grupo de edad, dado que parece claro que ha de contarse con un mayor número de datos.
Nefropatía diabéticaSi bien es cierto que la nefropatía diabética no es frecuente en este grupo de edad, esta enfermedad debe abordarse de forma similar a otras nefropatías crónicas. Extrapolando los resultados obtenidos en adultos, parece adecuado considerar la microalbuminuria como una señal para comenzar a reducir la PA, y de esa forma reducir el riesgo de que el paciente presente proteinuria. En este caso, el control nocturno de la PA puede ser un factor decisivo. Por ello la monitorización ambulatoria de la PA es útil para evaluar si se alcanzan los objetivos de PA. Si el paciente no presenta HTA o microalbuminuria, se puede considerar el tratamiento con IECA o ARAII si se observa de forma permanente una menor variabilidad circadiana de la PA115.
Diabetes mellitus y síndrome metabólicoSi el paciente presenta diabetes tipo 2 o resistencia a la insulina (enfermedades que constituyen las causas subyacentes del síndrome metabólico150), el tratamiento de la HTA debe basarse en modificaciones del estilo de vida, en la dieta y el ejercicio físico, que permiten perder peso y aumentar la perfusión muscular. Si se decide comenzar a administrar un tratamiento farmacológico, serán preferibles aquellos fármacos que induzcan una menor resistencia a la insulina, y que modifiquen el perfil lipídico y la concentración de glucosa. Por lo tanto, los IECA, ARAII o antagonistas de los canales de calcio han de administrarse preferentemente, antes que los diuréticos y beta bloqueantes, siempre que no exista algún tipo de contraindicación que lo desaconseje. En caso de que sea necesario administrar un tratamiento combinado, este puede incluir bajas dosis de diuréticos. No obstante, deberá evitarse administrar una combinación de tiazidas (diuréticos) y beta bloqueantes151.
Insuficiencia cardiacaLa HTA constituye uno de los principales factores de riesgo para que se desarrolle insuficiencia cardiaca. De igual forma que en adultos, el tratamiento de la insuficiencia cardiaca en niños incluye la administración de diuréticos, beta bloqueantes y bloqueantes del sistema reninavangiotensina152. Si bien no se han realizado estudios en niños, los datos de insuficiencia cardiaca en adultos sugieren que los IECA (o los ARAII), junto con los beta bloqueantes, no solo pueden reducir los síntomas, sino que también prolongan la supervivencia153. Los diuréticos (tanto los diuréticos de asa como los antagonistas de la aldosterona) están indicados en niños con insuficiencia cardiaca e hipervolemia. Los diuréticos no deben administrarse en monoterapia, sino combinados con bloqueantes del sistema renina angiotensina y del sistema simpático. En cualquier caso, las dosis de todos los fármacos deberán incrementarse gradualmente. En caso de que se produzca una insuficiencia cardiaca aguda derivada de un emergencia hipertensiva, deben administrarse preferentemente diuréticos de asa y vasodilatadores.
Síndrome de apnea del sueñoEl síndrome de apnea del sueño a menudo se asocia con HTA, en especial en niños con sobrepeso. Durante los últimos años se ha hecho hincapié en la posible relación entre las alteraciones respiratorias durante el sueño (ARS)/la apnea obstructiva del sueño (AOS) en la infancia y las enfermedades cardiovasculares. Algunos datos indican que existe una relación entre las alteraciones respiratorias durante el sueño (de carácter moderado o grave), experimentadas durante la infancia, y el mayor riesgo de presentar HTA. Dichos datos son, no obstante, polémicos. En un metaanálisis de distintos estudios, en el que se evaluó la relación entre el alto índice de apnea/hipoapnea y la HTA en la población pediátrica, se observó un mayor riesgo de HTA (OR, 2,93; IC al 95% 1,18–7,29)154. Sin embargo, en otro metaanálisis realizado más recientemente, no se observó una relación estadísticamente significativa (OR 1,87; IC 95%, 0,73–4,80)155. Tanto el sobrepeso como la obesidad pueden interferir en la interpretación de los datos relativos a la HTA y a las alteraciones respiratorias durante el sueño. Por el momento, parece aconsejable instaurar un tratamiento para reducir el sobrepeso. En los casos extremos que presenten apnea obstructiva del sueño de carácter grave, quizás sea necesario intervenir quirúrgicamente o hacer uso de equipos de respiración de presión positiva156.
Emergencias hipertensivasUna crisis hipertensiva (emergencia o urgencia) se produce cuando existe una enfermedad que pone en riesgo la vida, asociada con HTA de carácter grave. Se define una emergencia hipertensiva como una HTA de carácter severo, agravada por una disfunción orgánica aguda (principalmente de tipo neurológico, renal o cardiaco). La urgencia hipertensiva, por otra parte, se define como una HTA severa sin presencia de disfunción orgánica aguda. Los niños que presenten emergencias hipertensivas deberán ingresarse en una unidad de cuidados intensivos, para garantizar la monitorización y el mantenimiento de la función de los órganos vitales.
La estrategia terapéutica debe centrarse en la reducción inmediata de la PA, de tal forma que se minimice el daño orgánico. Dicha reducción de la PA no debe producirse de forma excesivamente rápida, para evitar que se produzca una hipoperfusión de los órganos vitales (principalmente la hipoperfusión cerebral con secuelas neurológicas). Por lo tanto, en las primeras fases del tratamiento ha de realizarse una evaluación neurológica y cardiovascular exhaustiva del paciente. No se cuenta con datos experimentales que respalden la velocidad óptima con la que ha de reducirse la PA en los casos de emergencia hipertensiva. Basándose en la experiencia clínica, la PA no debe reducirse más de un 25–30% en el transcurso de las 6–8 primeras horas, y debe continuar reduciéndose de forma gradual durante las siguientes 24–48h157,158. En ningún caso la HTA severa debe normalizarse de forma más rápida, dado que ello podría provocar un daño mayor que la propia HTA. Los niños que presenten emergencias hipertensivas deben recibir siempre un tratamiento intravenoso. La infusión continua es más segura que las inyecciones en bolo, en relación con las posibles complicaciones (hipotensión inesperada con hipoperfusión de los órganos vitales). El nitroprusiato sódico y el labetalol son los fármacos más ampliamente utilizados para el tratamiento de las emergencias hipertensivas en niños. Las urgencias hipertensivas pueden tratarse con fármacos administrados por vía oral. En la tabla 9 se indican los fármacos utilizados (con las correspondientes dosis), para tratar las crisis hipertensivas en la infancia.
Fármacos antihipertensivos para las emergencias y urgencias hipertensivas
| Fármaco | Clase | Ruta | Dosis | Inicio de la acción | Comentario |
| Nitroprusiato sódico | Vasodilatador directo | Infusión intravenosa | 0,5–8μg/kg/min | En segundos | Puede provocar toxicidad por tiocianato, se inactiva con la luz |
| Labetalol | Alfa y beta bloqueantes | Infusión intravenosa | 0,25–3mg/kg/h | 5–10min | Contraindicado en asma, insuficiencia cardiaca; puede provocar bradicardia |
| Nicardipina | Antagonistas del calcio | Infusión intravenosa | 1–3μg/kg/min | En minutos | Taquicardia refleja |
| Clonidina | Alfa agonista de acción central | Bolo intravenoso | 2–6μg/kg/dosis | 10min | Sequedad de boca, sedación, hipertensión rebote |
| Esmolol | Beta bloqueante | Infusión intravenosa | 100–500μg/kg/min | En segundos | Contraindicado en asma; puede provocar bradicardia |
| Enalaprilato | IECA | Bolo intravenoso | 0,05–0,1mg/kg/dosis | 15min | Contraindicado si se sospecha la existencia de estenosis bilateral de la arteria renal |
| Furosemida | Diurético de asa | Bolo intravenoso | 0,5–5mg/kg/dosis | En minutos | Hipopotasemia |
| Nifedipina | Antagonista del calcio | Vía oral | 0,25mg/kg/dosis | 20–30min | Puede provocar hipotensión impredecible, taquicardia refleja |
| Captopril | IECA | Vía oral | 0,1–0,2mg/kg/dosis | 10–20min | Contraindicado si se sospecha la existencia de estenosis bilateral de la arteria renal |
| Minoxidil | Vasodilatador directo | Vía oral | 0,1–0,2mg/kg/dosis | 5–10min | Retención de líquidos |
ICEA: inhibidor de la enzima de conversión de angiotensina.
La HTA resistente se define como aquella HTA en la que no se han podido reducir los valores de PAS y de PAD al objetivo terapéutico, cuando se ha instaurado un plan terapéutico basado en modificaciones del estilo de vida y la administración de al menos 3 fármacos [entre los que se incluye un diurético (en dosis adecuadas)]. En niños y adolescentes, la HTA resistente casi siempre indica la presencia de HTA secundaria (una vez que se ha verificado mediante la monitorización ambulatoria de la PA, y que se hayan excluido las enfermedades descritas en el anexo 8). Por consiguiente, debe realizarse un estudio diagnóstico completo, según se describe en la sección «detección de los diferentes tipos de HTA secundaria».
Tratamiento de los factores de riesgo asociadosFármacos hipolipemiantesLas nuevas guías de la Academia Americana de Pediatría (AAP) recomiendan determinar la concentración de lipoproteínas a partir de los 2 años de edad, en niños con sobrepeso, hipertensos o diabéticos, o en aquellos con antecedentes familiares de dislipidemia o formas tempranas de arteriopatía coronaria159. Si los valores lipídicos se encuentran dentro del límite de la normalidad correspondiente a la edad y el sexo, la concentración de lípidos deberá volver a evaluarse en 3–5 años. En relación con los niños que presenten valores fuera del intervalo de normalidad, el tratamiento inicial debe centrarse en una dieta baja en colesterol (<200mg/d) y grasas saturadas (<7% de calorías), complementada con esteroles de origen vegetal y fibra dietética (la edad del niño+5g/d–hasta 20g, para un adolescente de 15 años de edad)160. El aumento de la actividad física puede contribuir a modificar la concentración de C-HDL y triglicéridos. De acuerdo con las recomendaciones de la AAP, deberá considerarse la administración de estatinas en niños de edad ≥8 años, en cualquiera de las siguientes situaciones: la concentración de C-LDL se mantiene ≥190mg/dl (4,94mmol/l); la concentración de C-LDL se mantiene ≥160mg/dl (4,16mmol/l) y el niño presenta antecedentes familiares de formas tempranas de arteriopatía coronaria, o presenta otros factores de riesgo (obesidad, HTA o tabaquismo); la concentración de C-LDL se mantiene ≥130mg/dl (3,38mmol/l) en niños con diabetes mellitus. La FDA y la Agencia Europea del Medicamento (EMEA) han aprobado el uso de pravastina en niños de edad ≥8 años, con hipercolesterolemia familiar. Debe indicarse, no obstante, que las recomendaciones de la AAP son controvertidas, dado que no se basan en la evidencia y se desconocen los efectos a largo plazo del tratamiento con estatinas en niños.
El uso de ezetimiba está aprobado en EE.UU. (no así en Europa), únicamente en los casos, poco frecuentes, de niños con hipercolesterolemia familiar homocigótica o con sitosterolemia. Los tratamientos a largo plazo con secuestradores de ácidos biliares no son bien tolerados. Los fibratos pueden administrarse a adolescentes con concentraciones de triglicéridos ≥500mg/dl, y que presenten un mayor riesgo de pancreatitis159,160.
Control glucémicoLa mayor prevalencia de diabetes tipo 2 en niños se corresponde con la creciente prevalencia de la obesidad en la población pediátrica. Los niños obesos presentan resistencia a insulina (60%), alteración de la tolerancia a glucosa (5%), alteraciones de las concentraciones de glucosa en ayunas (1%) y diabetes tipo 2 (0,2%)161. Si se reduce el sobrepeso y se corrige la tolerancia a la glucosa puede contribuir a prevenir o retrasar el desarrollo de diabetes tipo 2 en los niños de riesgo elevado. Los cambios conductuales (modificaciones dietéticas y actividad física durante 60min al día o más), constituyen medidas eficaces para reducir la concentración de insulina y revertir la alteración de la tolerancia a glucosa a la normalidad. Dichos cambios deben realizarse aplicando técnicas que motiven a los niños y a sus familias162. Metformina es la única medicación oral que ha sido convenientemente estudiada en niños, habiéndose aprobado por la FDA y algunas agencias europeas para su uso en niños mayores de 10 años con diabetes tipo 2. En niños con obesidad mórbida resistentes a insulina, metformina ha mostrado efectos favorables sobre la composición corporal, la concentración de insulina y glucosa en ayunas163. Se está llevando a cabo un ensayo clínico en adolescentes, en el que se investiga si la reducción agresiva de la resistencia a insulina en fases tempranas de la diabetes tipo 2, mediante tratamientos farmacológicos, es más eficaz que las modificaciones del estilo de vida164.
Detección de hipertensión secundariaEn niños y adolescentes la hipertensión se clasifica habitualmente como HTA secundaria cuando puede identificarse una causa que a menudo puede corregirse con intervenciones específicas. Las causas más frecuentes pueden diferir según el grupo de edad. Si bien los lactantes y niños en raras ocasiones presentan HTA esencial, su prevalencia se incrementa significativamente durante la adolescencia4. En líneas generales, la probabilidad de identificar una causa secundaria de HTA es inversamente proporcional a la edad del niño y directamente proporcional al grado de HTA165. Por lo tanto, la evaluación de las causas de HTA en niños, especialmente en aquellos de menor edad o con HTA severa, debe realizarse de forma sistemática y considerando la edad de presentación.
La distribución de las distintas causas varía claramente con la edad. Los trastornos del parénquima renal166, con enfermedad renovascular y coartación de la aorta, suponen entre el 70–90%167,168 de todos los casos. En ciertos casos, la HTA está relacionada con la administración de fármacos con potencial hipertensivo. Una vez que se hayan descartado las causas más comunes de HTA, deberán considerarse otras posibles causas menos frecuentes (tumores, trastornos endocrinos y del sistema nervioso central). Otra de las causas de HTA secundaria son las monogénicas en las que la mutación de un gen provoca aumentos significativos en la PA169.
Hasta el 2% de todos los recién nacidos a término y los niños prematuros ingresados en unidades de cuidados intensivos neonatales presentan HTA. Si bien en este grupo de edad no se ha estandarizado completamente la definición de HTA, se han publicado datos170 que pueden resultar de utilidad a la hora de realizar el diagnóstico en los recién nacidos. De igual forma que en niños de mayor edad, la HTA en neonatos puede deberse a numerosas causas. Entre las más frecuentes se encuentran las enfermedades renales (enfermedades vasculares y que afecten al parénquima). En concreto, el tromboembolismo derivado de la implantación de un catéter en la arteria umbilical, que afecte bien a la aorta y/o a las arterias renales, posiblemente sea la causa subyacente en la mayoría de casos de HTA observados en cualquier unidad de cuidados intensivos neonatales171. En la mayoría de los casos, una anamnesis detallada y una exploración física exhaustiva permiten identificar la causa subyacente, sin necesidad de que se realice un gran número de pruebas analíticas o radiológicas.
En niños menores de 6 años, la HTA con frecuencia es resultado de enfermedades del parénquima renal (glomerulonefritis, nefroesclerosis, riñón poliquístico, estenosis de las arterias renales y displasia renal). En este grupo de edad, otras causas menos frecuentes de HTA son los trastornos cardiovasculares (por ejemplo, la coartación de la aorta). La HTA esencial es la causa más común de HTA al final de la primera década y durante la segunda década de vida, en especial en aquellos niños con HTA moderada y asintomática172.
Si se presenta un caso de HTA crónica de causa desconocida, en la evaluación diagnóstica deberán considerarse los valores de PA, la edad, el sexo, los hallazgos clínicos y los antecedentes familiares. Una cuidadosa selección de las pruebas que han de realizarse acorta el proceso diagnóstico (anexo 9). No obstante, entre los objetivos de estas guías no se incluye una descripción detallada de dicho proceso de selección173,174.
Seguimiento a largo plazoDependiendo de la causa subyacente que origine la HTA deberán realizarse distintos procedimientos de investigación: monitorización de la concentración plasmática de electrolitos y creatinina, medición del FG en distintos intervalos, estudios de imagen renal y renovascular (ecografías y estudios isotópicos), y posiblemente repetición de los estudios angiográficos (angiografía por sustracción digital [ASD], angiografía por inyección de CO2 [CO2], angiografía por RM [ARM] o angiografía por tomografía computarizada [ATC]). En caso de que se constate la presencia de feocromocitoma o paraganglioma, puede estar indicado repetir la concentración de catecolaminas o realizar una gammagrafía con metayodobenzilguanidina-I123. Tras realizar seguimiento a largo plazo de la PA quizás esté indicado reducir el tratamiento gradualmente, incluso suspenderlo en algunos pacientes. No obstante, en la mayoría de los pacientes debe realizarse seguimiento a largo plazo, para lo cual el registro domiciliario de la PA puede resultar de gran utilidad. En niños con HTA de causa renal, la monitorización ambulatoria de la PA, realizada de forma regular (cada 6–12 meses), es indispensable para descartar la HTA nocturna selectiva.
Investigaciones futurasDesafortunadamente, las recomendaciones relativas al diagnóstico y tratamiento de la HTA pediátrica no se fundamentan en datos sólidos de ensayos clínicos. En el anexo 10 se incluyen algunas áreas en las que es necesario adquirir un mayor conocimiento. En el ámbito europeo, debería alcanzarse un compromiso para encontrar respuestas a las cuestiones pendientes, en un esfuerzo común que guíe las líneas de actuación concertadas en el transcurso de los próximos años.
Implementación de las guíasLas presentes guías deben implementarse satisfactoriamente para limitar, e incluso reducir, la carga que supone la HTA y sus complicaciones en niños y adolescentes. Para ello deben tomarse medidas sinérgicas a distintos niveles: sociedades científicas y comités de expertos internacionales, médicos de familia, pediatras, enfermeras y otros profesionales sanitarios, escuelas, padres y gobiernos. Únicamente mediante la adopción de medidas conjuntas puede salvarse la distancia entre las recomendaciones de los expertos y el bajo control de la PA, la falta de diagnóstico de la HTA en niños y adolescentes y la dificultad para detectar el daño orgánico. El papel de las sociedades científicas es crucial, en particular el de la ESH, no solo para difundir las guías en los distintos países europeos, sino también para su aceptación por parte de las sociedades y ligas nacionales de HTA.
En paralelo, deben tomarse medidas públicas concertadas, para incrementar la identificación e instaurar el tratamiento adecuado para la HTA en niños y adolescentes, así como para impulsar cambios en el estilo de vida (mantener una dieta saludable, ingerir poca sal, no fumar, no beber alcohol y realizar actividad física) como medidas preventivas y curativas. Únicamente mediante iniciativas concertadas se logrará implicar a los profesionales sanitarios, las compañías aseguradoras y otros agentes de salud, para conseguir una mejora del tratamiento a largo plazo de la HTA en niños y adolescentes.
En los países europeos deben establecerse programas integrales de prevención, en los que participen todas las partes mencionadas, junto con las familias y el personal docente, para poner en práctica la implantación de todas estas medidas terapéuticas y mejorar la salud de niños y adolescentes.
El comité de redacción es consciente de que la elaboración de estas guías no implica su implementación automática. No obstante, estas guías son el resultado del consenso al que han llegado los especialistas en la detección y control de la HTA en niños y adolescentes. Si bien algunos aspectos no están respaldados por datos científicos de estudios realizados en niños, y es probable que las mismas se modifiquen a lo largo de los próximos años, las recomendaciones aquí recogidas son un compendio de una gran cantidad de datos científicos y experiencia clínica, y constituyen la información más completa que los médicos, enfermeras y familiares deberían tener en cuenta a la hora de tomar decisiones. Estas guías, que hacen hincapié en la carga que supone la HTA en niños y adolescentes, así como en el papel que desempeña en la actual epidemia de enfermedades cardiovasculares, deberían constituir un estímulo para que los gobiernos realizaran un esfuerzo global para una detección precoz y un tratamiento efectivo de la HTA en niños y adolescentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- •
Se recomienda utilizar el método auscultatorio.
- •
La PAS ha de determinarse mediante la auscultación del primer ruido de Korotkoff, mientras que la PAD se determina por el quinto ruido (K5).
- •
Si se emplea el método oscilométrico, debe validarse el monitor.
- •
Si se determina que existe hipertensión mediante el método oscilométrico, deberá confirmarse mediante el método auscultatorio.
- •
Debe utilizarse un manguito de esfigmomanómetro de la anchura (un 40% del perímetro del brazo) y la longitud adecuadas (4×8cm, 6×12cm, 9×18cm, 10×24cm), de tal forma que comprenda el 80–100% del perímetro del brazo.
- •
Deberá medirse la PA a todos aquellos niños mayores de 3 años que acudan a consulta.
- •
En niños de menor edad, la PA deberá medirse en circunstancias especiales en las que pueda existir un mayor riesgo de hipertensión: en enfermedades neonatales que requieran asistencia intensiva o cuando el niño presente cardiopatía o nefropatía congénitas, indicios de una mayor presión intracraneal, o haya recibido tratamiento con fármacos que eleven la presión arterial.
Durante el proceso diagnóstico
Confirmar la hipertensión previamente al comienzo de la administración de un tratamiento farmacológico antihipertensivo
Diabetes tipo 1
Nefropatía crónica
Trasplante de riñón, hígado o corazón
Durante el tratamiento farmacológico antihipertensivo
Evaluación de la hipertensión refractaria
Evaluación del control de la PA en niños con daño orgánico
Síntomas de hipotensión
Ensayos clínicos
Otras enfermedades clínicas
Disfunción autonómica
Sospecha de tumores secretores de catecolaminas
ANTECEDENTES FAMILIARES
Hipertensión
Enfermedades cardiovasculares y cerebrovasculares
Diabetes mellitus
Dislipidemia
Obesidad
Nefropatía hereditaria (nefropatía poliquística)
Enfermedad endocrina hereditaria (feocromocitoma, hiperaldosteronismo sensible a glucocorticoides, neoplasia endocrina múltiple tipo 2, enfermedad de von Hippel–Lindau)
Síndromes asociados con hipertensión (neurofibromatosis)
ANTECEDENTES CLÍNICOS
Antecedentes perinatales
Peso al nacer, edad gestacional, oligohidramnios, anoxia, cateterismo de la arteria umbilical
Antecedentes
Hipertensión
Infección del tracto urinario, nefropatía u enfermedad urológica
Enfermedad cardiaca, endocrina (incluida la diabetes) o neurológica
Retraso del crecimiento
Síntomas sugestivos de hipertensión secundaria
Disuria, sed/poliuria, nicturia, hematuria
Edema, pérdida de peso, fallo de medro
Palpitaciones, sudoración, fiebre, palidez, rubor
Extremidades frías, claudicación intermitente
Virilización, amenorrea primaria y pseudohermafroditismo masculino
Síntomas sugestivos de daño orgánico
Cefaleas, epistaxis, vértigo, alteraciones visuales
Parálisis facial idiopática, convulsiones, ictus
Disnea
Anamnesis del sueño
Ronquidos, apnea, somnolencia diurna
Antecedentes de factores de riesgo
Ejercicio físico, hábitos dietéticos
Tabaquismo, alcohol
Ingesta de fármacos
Antihipertensivos
Esteroides, ciclosporina, tacrolimus u otro
Antidepresivos tricíclicos, antipsicóticos atípicos, descongestivos
Anticonceptivos orales, drogas ilegales
Embarazo
Talla, peso, índice de masa corporal
Rasgos externos de síndromes/enfermedades asociados con la hipertensión
Neurofibromatosis, Klippel–Trenaunay–Weber, síndrome de Feuerstein–Mims, síndrome de von Hippel–Lindau, neoplasia endocrina múltiple, pseudoxantoma elástico, síndrome de Turner, síndrome de Williams, síndrome de Marfan, síndrome de Cushing, hipertiroidismo, lupus, vasculitis, hiperplasia adrenal congénita
Examen cardiovascular
Determinación del pulso y la PA en ambos brazos y piernas
Ruidos/soplos–corazón, abdomen, flancos, espalda, cuello, cabeza
Signos de hipertrofia del ventrículo izquierdo o insuficiencia cardiaca
Abdomen
Masas–tumor de Wilms, neuroblastoma, feocromocitoma, poliquistosis autosómica dominante y autosómica recesiva, displasia renal multiquística, uropatía obstructiva
Hepatoesplenomegalia
Exploración neurológica
Oftalmoscopia para detectar cambios hipertensivos y hamartoma retiniano (síndrome de von Hippel–Lindau)
Indicios de parálisis del nervio VIII
Otros defectos neurológicos, incluido el ictus
Pruebas rutinarias a las que deben someterse todos los niños hipertensos
Hemograma
Concentración plasmática de sodio, potasio, calcio, urea y creatinina
Concentración plasmática de glucosa en ayunas
Concentración sérica de lípidos (colesterol, colesterol LDL, colesterol HDL)
Concentración sérica de triglicéridos (en ayunas)
Análisis de orina y determinación cuantitativa de microalbuminuria y proteinuria
Ecografía renal
Radiografía de torax, electrocardiograma y ecocardiografía bidimensional
Pruebas adicionales de cribado recomendadas
Actividad de la renina plasmática, concentración plasmática de aldosterona
Concentración urinaria y plasmática de catecolaminas y metanefrinas
Gammagrafía con ácido dimercaptosuccínico marcado con Tc99
Concentración de cortisol libre en orina
Pruebas más complejas que deberán realizarse tras conocer los resultados de las anteriores pruebas de cribado
Ecografía Doppler-color
Test del captopril
Medición de la concentración de renina en las venas renales
Angiografía renal
Gammagrafía con metayodobenzilguanidina-I123
Tomografía computarizada/Resonancia magnética
Determinación de esteroides en orina, y pruebas endocrinas más complejas
Estudios de genética molecular (exceso aparente de mineralocorticoides, síndrome de Liddle, etc.)
En elAnexo 9se muestran otras pruebas específicas para determinadas enfermedades
OBJETIVOS
IMC mantener el IMC para prevenir el sobrepeso
IMC en el percentil 85–95: mantenimiento del peso (niños de menor edad) o pérdida gradual de peso (adolescentes), para reducir el IMC a un percentil<85
IMC >percentil 95: pérdida gradual de peso (1–2kg/mes) hasta alcanzar un valor
RECOMENDACIONES GENERALES
Realizar 40min de actividad física aeróbica (moderada o intensa), 3–5 días a la semana, y evitar realizar más de 2h diarias de actividades sedentarias
Evitar consumir azúcar, refrescos, grasas saturadas y sal en exceso. Se recomienda tomar frutas, vegetales y cereales
Aplicar cambios conductuales (actividad física o dieta), adaptados a las características del niño y su familia
Involucrar a los padres/a la familia en los cambios conductuales
Proporcionar apoyo y materiales educativos
Establecer objetivos realistas
Desarrollar un sistema de recompensa que fomente un estado saludable
La participación en deportes competitivos debe limitarse únicamente si el niño presenta hipertensión de grado 2 no controlada
DATOS QUE APOYAN EL TRATAMIENTO
Reducción de la mortalidad y las secuelas de enfermedades potencialmente mortales
Reducción de la hipertrofia del ventrículo izquierdo
Reducción de la excreción urinaria de albúmina
Reducción de la velocidad de progresión a la insuficiencia renal
CUÁNDO HA DE INICIARSE EL TRATAMIENTO
El tratamiento no farmacológico debe iniciarse en todos aquellos niños con PA normal alta o hipertensión
El tratamiento no farmacológico debe continuarse incluso una vez haya comenzado el tratamiento farmacológico
El tratamiento farmacológico debe iniciarse cuando el paciente presente hipertensión sintomática, daño orgánico, hipertensión secundaria o diabetes mellitus tipo 1 o 2
OBJETIVOS DE PRESIÓN ARTERIAL
En general
PA por debajo del percentil 90 (en función de la edad, sexo y talla)
Nefropatía crónica
PA por debajo del percentil 75 en niños que no presenten proteinuria, y por debajo del percentil 50 en niños con proteinuria
Hipertensión secundaria
Baja adherencia al tratamiento
Incremento de peso
Ingesta continuada de fármacos que aumenten la presión arterial
Síndrome de apnea obstructiva grave
Persistencia de hipervolemia:
Tratamiento diurético inadecuado
Insuficiencia renal progresiva
Alta ingesta de sodio
| Nefropatía crónica | Proteínas, eritrocitos y cilindros eritrocitarios en orina |
| Concentración sérica de creatinina y potasio | |
| Ecografía abdominal | |
| Estudios de imágenes estáticas con ácido dimercaptosuccínico [99Tcm] | |
| Hipertensión renovascular | Actividad de renina plasmática |
| Ecografía abdominal | |
| Ecografía Doppler | |
| Gamagrafía renal | |
| Angiografía por RM | |
| Angiografía | |
| Feocromocitoma y paraganglioma | Concentración urinaria y plasmática de catecolaminas y metanefrinas (durante 24h) |
| Resonancia magnética | |
| Metayodobenzilguanidina-I123 | |
| Hiperaldosteronismo primario | Actividad de renina plasmática |
| Aldosterona plasmática | |
| Síndrome de Cushing | Cortisol plasmático, ACTH plasmática |
| Concentración de cortisol libre en orina durante 24h | |
| Coartación de la aorta | Radiografía torácica |
| Ecocardiografía | |
| Angiografía por resonancia magnética | |
| Aortografía | |
| Herencia mendeliana | Evaluación genética |
| Inducida por fármacos | Regaliz, anticonceptivos orales, glucocorticoides, fármacos antiinflamatorios no esteroideos, simpatomiméticos, eritropoyetina, ciclosporina, tacrolimus, cocaína, esteroides |
| Hipertiroidismo | TSH, FT3, FT4 |
| Hiperplasia adrenal congénita | Desoxicorticosterona y corticosterona plasmáticas |
| 18-hidroxicorticosterona, 18-hidroxidesoxicorticosterona, | |
| 11 desoxicortisol |
- •
Desarrollar un esfigmomanómetro que no contenga mercurio y sea preciso, para la determinación auscultatoria de la PA, así como de dispositivos precisos para la determinación oscilométrica de la PA. Comparación de los resultados obtenidos mediante ambos métodos en lactantes, niños y adolescentes.
- •
Establecer valores de referencia en relación con las mediciones de PA realizadas en la consulta, el domicilio o de forma ambulatoria, basados en la población pediátrica europea.
- •
Profundizar en el conocimiento sobre el uso de las mediciones ambulatorias de la PA.
- •
Recoger información relativa al daño orgánico precoz, para la estratificación en función de los factores de riesgo, y utilizar dicha información para establecer objetivos intermedios durante el tratamiento.
- •
Realizar ensayos clínicos, de amplio tamaño muestral, aleatorizados, a largo plazo, para evaluar el daño orgánico (por ejemplo, la aparición de microalbuminuria y/o hipertrofia del ventrículo izquierdo), y determinar cuándo ha de iniciarse el tratamiento con fármacos antihipertensivos, y los objetivos de PA que han de alcanzarse.
- •
Realizar estudios controlados con fármacos antihipertensivos, para incrementar el conocimiento sobre los beneficios y desventajas específicos de los fármacos hipotensores, y establecer las dosis adecuadas.
Publicado previamente en Journal of Hypertension 2009;27(9):1719–42