La morbi-mortalidad en menores de 5 años por gastroenteritis aguda (GEA) en países en desarrollo sigue siendo elevada. Los autores han elaborado un documento que ayude a tomar decisiones en el tratamiento del menor de 5 años con GEA en el contexto Ibero-latinoamericano. Se realizó una revisión sistemática de la literatura (mayo 2008). La gradación de la evidencia se realizó siguiendo las guías Oxford y expertos latinoamericanos opinaron respecto a las recomendaciones.
La rehidratación oral representa la piedra angular del tratamiento de la GEA en niños, asociándose a menos efectos adversos que la rehidratación intravenosa. La GEA no es contraindicación para la alimentación normal. Racecadotrilo, zinc y esmectita pueden coadyuvar al tratamiento, así como Lactobacillus GG y Saccharomyces boulardii. No se recomiendan otros fármacos. En el tratamiento de niños con GEA se recomienda la rehidratación oral junto con racecadotrilo, zinc o esmectita, y algunos probióticos.
Acute gastroenteritis (AG) morbidity and mortality rates in infants and prescholars continue to be high in developing countries. Authors want to develop an evidence-based document that supports decision making regarding AG therapy in infants and children younger than 5 y/o. A systematic review of the literature was performed (May, 2008). Evidence grading was established according to Oxford guidelines and Latin American experts submitted their opinions on the recommendations generated.
Oral rehydration solutions are the threatment's keystone for children with AG, showing lesser complications due to therapy than IV fluids. AG is no contraindication of a normal diet. Racecadotril, zinc and smectite can contribute to AG treatment, as well as Lactobacillus GG and Saccharomycces boulardii. No other drugs are recommended. It is recommended to treat children presenting AG with oral rehydration solutions among racecadotril, zinc or smectite as well as some probiotics.
A pesar del gran avance que significa la hidratación oral como herramienta para el tratamiento o prevención de la deshidratación en la Gastroenteritis Aguda (GEA), existen otros aspectos del manejo clínico de esta enfermedad que necesitan ser igualmente atendidos. El enfoque diagnóstico etiológico inicial, las decisiones sobre si el manejo puede ser ambulatorio o debe ser hospitalario, el manejo dietético y el rol de los fármacos, son esos otros aspectos sobre los que el médico necesita guía y orientación. Esta Guía de Práctica Clínica Ibero-Latinoamericana (GPC-ILA) se divide básicamente en dos partes: la primera se ha elaborado en base en la Guía Europea y la segunda se ha elaborado tras realizar un análisis de la evidencia científica del arsenal terapéutico existente en GEA, y se ha matizado considerando las diferencias en cuanto a eficiencia preventiva y terapéutica de los sistemas de salud, tradiciones, cultura, uso y aceptación de diferentes opciones de tratamiento existentes en cada uno de los países Ibero-latinoamericanos y se ofrece como herramienta para estandarizar el manejo de la GEA en niños en esta región.
Desarrollo de la GPC-ILAEste documento consta de dos partes: En la sección I, únicamente se ha pretendido situar el problema de la Gastroenteritis Aguda en niños menores de 5 años en contexto, por lo que se realizó una revisión de la literatura adoptándose, en general, las definiciones y recomendaciones publicadas por ESPGHAN/ESPID en el 2008 las cuales consideramos un «gold standard» para países desarrollados1,2. La segunda sección (Sección II), que se centra en el abordaje terapéutico, se fundamentó en el análisis detallado, riguroso y sistematizado de la evidencia científica publicada. Para su desarrollo se contó con expertos en las áreas de gastroenterología pediátrica, urgencias pediátricas, metodología de la investigación, análisis de la evidencia, pediatría general y economía de la salud. Para el ensamblado de las estrategias de búsqueda, identificación de la evidencia, evaluación de la calidad y gradación de la misma se contó con instituciones profesionales dedicadas específicamente a la implementación de esta metodología. Una vez establecidas las recomendaciones basadas en la evidencia se enviaron para su análisis a cada uno de los expertos regionales de Latino América (LA), España y Portugal para recoger los comentarios basados en su experiencia. Por último se recogieron las observaciones y se armonizaron para constituir el documento final.
Alcances de la GPC-ILAEl objetivo final del desarrollo de esta GPC-ILA fue elaborar un documento capaz de apoyar en la toma eficiente de decisiones en salud a médicos generales, pediatras, médicos familiares, urgenciólogos pediatras, gastroenterólogos pediatras, residentes de las especialidades referidas, internos de pre-grado, pasantes en servicio social, enfermeras y promotores de salud comunitaria. De igual forma, esta GPC-ILA pretende orientar a las autoridades administrativas y gerenciales de los diferentes niveles de atención hospitalaria y ambulatoria para enfocar de forma más eficiente la asignación de recursos para el tratamiento eficaz de los menores de 5 años con GEA. La GPC-ILA se encuentra orientada específicamente a brindar soporte en la toma de decisiones para el tratamiento integral del menor de 5 años con GEA.
Esta Guía NO analiza la utilidad de estudios de laboratorio y gabinete para el establecimiento de la etiología del cuadro diarreico, los factores de riesgo relacionados con la gravedad del cuadro de gastroenteritis ni incluye análisis de la evidencia relacionada con el tratamiento de la GEA en recién nacidos, manejo de la deshidratación grave, de las recomendaciones actuales sobre rehidratación intravenosa (RIV) ni sobre la utilización de antibióticos en el niño con GEA.
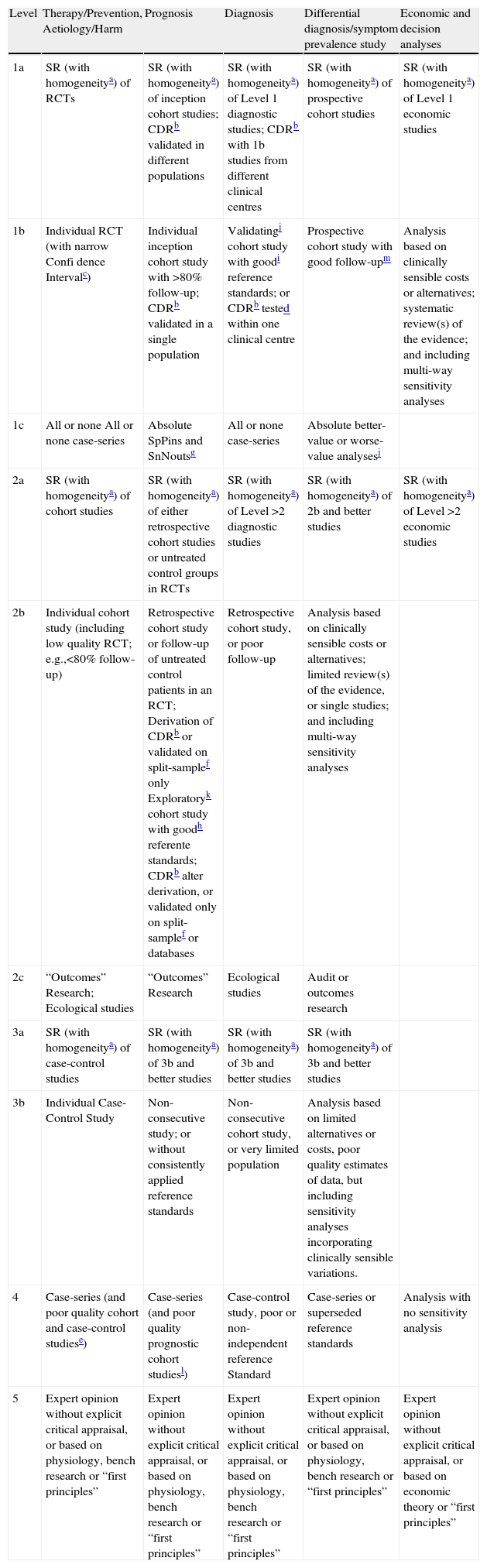
Métodos para el Ensamblado y Análisis de la EvidenciaPara la elaboración de la sección II, una vez discutidos los tópicos de mayor relevancia, por los investigadores responsables del desarrollo de la GPC-ILA, se establecieron preguntas clínicas basadas en las características de los pacientes, el análisis de las intervenciones de interés, las diferentes intervenciones comparativas así como los desenlaces de mayor relevancia (Estructura Problema, Intervención, Comparación, y Outcome [PICO]). Teniendo como fundamento las preguntas relevantes, se establecieron protocolos de búsqueda de evidencia a través de estrategias validadas y publicadas3–14, utilizando los términos MesH: soluciones; terapia de fluidos; rehidratación oral; fórmula infantil; alimentación infantil; alimentación especializada; nutrición especial; tratamientos dietéticos; prebióticos; probióticos. Se incluyeron también los términos específicos para cada una de las medicaciones a revisar (racecadotrilo, kaolín pectina, loperamida y bismuto). Se utilizaron los términos en castellano o inglés según las bases de datos correspondientes. Las búsquedas se limitaron de igual manera para todas las bases de datos, cuando éstas lo permitían, a los siguientes términos: estudios en humanos, niños (de 0 a 5 años), guías de práctica clínica, meta-análisis, ensayos aleatorizados controlados con grupos placebo, conferencias para el desarrollo de consenso y ensayos controlados del National Institute of Health (NIH, U.S). Se realizaron las búsquedas en Medline (Pubmed 1966-Mayo 2008), EMBASE (1980-Mayo 2008), The Cochrane library, Cochrane Iberoamericana, Centro para revisiones y diseminación (CRD-DARE) y las bases de datos latinoamericanas: Latin American and Caribbean Health Sciences Literature (LILACS 1982-Mayo 2008), Scientific Electronic Library Online (Scielo 1997-Mayo 2008) y la base de datos Mexicana Artemisa (1993–2006). La calidad de las guías identificadas fue evaluada mediante el instrumento AGREE® y sólo aquellas que obtuvieron puntuaciones satisfactorias de acuerdo al rigor de su elaboración por dicho instrumento fueron incluidas15. Los meta-análisis fueron evaluados mediante el instrumento QUOROM® y sólo se consideraron para esta GPC-ILA aquellos con criterios de elaboración satisfactorios de acuerdo con el mismo16. Los ensayos clínicos controlados y aleatorizados (ECCA) fueron evaluados mediante el instrumento CONSORT® y, de igual manera, sólo aquellos con criterios de elaboración satisfactorios fueron considerados para la elaboración de esta GPC17. La calificación se realizó por dos evaluadores independientes y las discrepancias mayores en puntuación fueron discutidas y resueltas. Un tercer evaluador experto en metodología validó las puntuaciones obtenidas. Una vez evaluada la calidad, se efectuó gradación de la evidencia para el ensamblado de las recomendaciones, siguiendo las guías de Oxford (ver tabla 1)18.
Oxford Centre for Evidence-based Medicine Levels of Evidence (May 2001)
| Level | Therapy/Prevention, Aetiology/Harm | Prognosis | Diagnosis | Differential diagnosis/symptom prevalence study | Economic and decision analyses |
| 1a | SR (with homogeneitya) of RCTs | SR (with homogeneitya) of inception cohort studies; CDRb validated in different populations | SR (with homogeneitya) of Level 1 diagnostic studies; CDRb with 1b studies from different clinical centres | SR (with homogeneitya) of prospective cohort studies | SR (with homogeneitya) of Level 1 economic studies |
| 1b | Individual RCT (with narrow Confi dence Intervalc) | Individual inception cohort study with >80% follow-up; CDRb validated in a single population | Validatingj cohort study with goodi reference standards; or CDRb tested within one clinical centre | Prospective cohort study with good follow-upm | Analysis based on clinically sensible costs or alternatives; systematic review(s) of the evidence; and including multi-way sensitivity analyses |
| 1c | All or none All or none case-series | Absolute SpPins and SnNoutsg | All or none case-series | Absolute better-value or worse-value analysesj | |
| 2a | SR (with homogeneitya) of cohort studies | SR (with homogeneitya) of either retrospective cohort studies or untreated control groups in RCTs | SR (with homogeneitya) of Level >2 diagnostic studies | SR (with homogeneitya) of 2b and better studies | SR (with homogeneitya) of Level >2 economic studies |
| 2b | Individual cohort study (including low quality RCT; e.g.,<80% follow-up) | Retrospective cohort study or follow-up of untreated control patients in an RCT; Derivation of CDRb or validated on split-samplef only Exploratoryk cohort study with goodh referente standards; CDRb alter derivation, or validated only on split-samplef or databases | Retrospective cohort study, or poor follow-up | Analysis based on clinically sensible costs or alternatives; limited review(s) of the evidence, or single studies; and including multi-way sensitivity analyses | |
| 2c | “Outcomes” Research; Ecological studies | “Outcomes” Research | Ecological studies | Audit or outcomes research | |
| 3a | SR (with homogeneitya) of case-control studies | SR (with homogeneitya) of 3b and better studies | SR (with homogeneitya) of 3b and better studies | SR (with homogeneitya) of 3b and better studies | |
| 3b | Individual Case-Control Study | Non-consecutive study; or without consistently applied reference standards | Non-consecutive cohort study, or very limited population | Analysis based on limited alternatives or costs, poor quality estimates of data, but including sensitivity analyses incorporating clinically sensible variations. | |
| 4 | Case-series (and poor quality cohort and case-control studiese) | Case-series (and poor quality prognostic cohort studiesl) | Case-control study, poor or non-independent reference Standard | Case-series or superseded reference standards | Analysis with no sensitivity analysis |
| 5 | Expert opinion without explicit critical appraisal, or based on physiology, bench research or “first principles” | Expert opinion without explicit critical appraisal, or based on physiology, bench research or “first principles” | Expert opinion without explicit critical appraisal, or based on physiology, bench research or “first principles” | Expert opinion without explicit critical appraisal, or based on physiology, bench research or “first principles” | Expert opinion without explicit critical appraisal, or based on economic theory or “first principles” |
Produced by Bob Phillips, Chris Ball, Dave Sackett, Doug Badenoch, Sharon Straus, Brian Haynes, Martin Dawes since November 1998.NotesUsers can add a minus-sign “−“to denote the level of that fails to provide a conclusive answer because of:
- •
EITHER a single result with a wide Confidence Interval (such that, for example, an ARR in an RCT is not statistically significant but whose confidence intervals fail to exclude clinically important benefit or harm)
- •
OR a Systematic Review with troublesome (and statistically significant) heterogeneity.
- •
Such evidence is inconclusive, and therefore can only generate Grade D recommendations.
By homogeneity we mean a systematic review that is free of worrisome variations (heterogeneity) in the directions and negrees of results between individual studies. Not all systematic reviews with statistically significant heterogeneity need be worrisome, and not all worrisome heterogeneity need be statistically significant. As noted above, studies displaying worrisome heterogeneity should be tagged with a “-” at the end of their designated level.
Clinical Decision Rule. (These are algorithms or scoring systems which lead to a prognostic estimation or a diagnostic category.)
See note #2 for advice on how to understand, rate and use trials or other studies with wide confi dence intervals.
Met when all patients died before the Rx became available, but some now survive on it; or when some patients died before the Rx became available, but none now die on it.
By poor quality cohort study we mean one that failed to clearly defi ne comparison groups and/or failed to measure exposures and outcomes in the same (preferably blinded), objective way in both exposed and non-exposed individuals and/or failed to identify or appropriately control known confounders and/or failed to carry out a suffi ciently long and complete follow-up of patients. By poor quality case-control study we mean one that failed to clearly defi ne comparison groups and/or failed to measure exposures and outcomes in the same (preferably blinded), objective way in both cases and controls and/or failed to identify or appropriately control known confounders.
Split-sample validation is achieved by collecting all the information in a single tranche, then artifi cially dividing this into “derivation” and “validation” samples.
An “Absolute SpPin” is a diagnostic fi nding whose Specifi city is so high that a Positive result rules-in the diagnosis. An “Absolute SnNout” is a diagnostic fi nding whose Sensitivity is so high that a Negative result rules-out the diagnosis.
Good, better, bad and worse refer to the comparisons between treatments in terms of their clinical risks and benefi ts.
Good reference standards are independent of the test, and applied blindly or objectively to applied to all patients. Poor reference standards are haphazardly applied, but still independent of the test. Use of a non-independent reference Standard (where the “test” is included in the “referente”, or where the “testing” affects the “referente”) implies a level 4 study.
Better-value treatments are clearly as good but cheaper, or better at the same or reduced cost. Worse-value treatments are as good and more expensive, or worse and the equally or more expensive.
Validating studies test the quality of a specifi c diagnostic test, based on prior evidence. An exploratory study collects information and trawls the data (e.g. using a regression analysis) to fi nd which factors are “signifi cant”.
By poor quality prognostic cohort study we mean one in which sampling was biased in favour of patients who already had the target outcome, or the measurement of outcomes was accomplished in<80% of study patients, or outcomes were determined in an unblinded, non-objective way, or there was no correction for confounding factors.
Finalmente, se diseñó una encuesta para conocer las opiniones de los expertos participantes con respecto a situaciones regionales o particulares relacionadas con los tópicos que aquí se analizan que hubiesen mostrado una evidencia de grados II a IV y que pudieran afectar la aplicabilidad de estas guías. Se trata pues de opiniones individuales no vinculadas a metodología de análisis de evidencia científica. Sus aportaciones se incluyen tras cada una de las recomendaciones de forma claramente diferenciada y son comentadas en la sección de discusión.
SECCIÓN I
Definición de GEALa consistencia y frecuencia de las evacuaciones varía de acuerdo a la dieta y edad del niño, por lo que en función de las distintas guías y trabajos publicados, la definición de diarrea puede variar. Existen definiciones generales como: Cambio en el hábito de evacuaciones en un niño que resulta en un incremento sustancial de la frecuencia y/o evacuaciones semilíquidas19. Otros autores han definido y utilizado el volumen de evacuaciones por encima de 10ml/kg/día para definir diarrea20. Nosotros adoptaremos la definición incluida en la ESPGHAN/ESPID recientemente publicada, que define la GEA como una reducción en la consistencia de las evacuaciones (líquidas o semilíquidas) y/o un incremento en la frecuencia de las mismas (por lo general ≥3 en 24h), pudiendo acompañarse de fiebre o vómito. Su duración es por lo general<7 días y, por definición, nunca mas de 14 días2. Se debe considerar que, si bien esta definición es la más completa que se ha publicado hasta estos momentos, no considera diferencias por grupos etarios, situaciones dietéticas o culturales que pueden producir cambios en los hábitos intestinales21.
Comentarios de expertos:Las definiciones de diarrea anteriormente expuestas son generalmente aceptadas entre los profesionales de la salud, quienes, adicionalmente, señalan que pueden ser no válidas en neonatos y niños únicamente alimentados con leche, donde el patrón normal de evacuaciones puede ser > a 3 veces al día (hasta 8) y las características de las evacuaciones pueden variar desde líquidas, semi-líquidas a pastosas o semi-pastosas.
Indicaciones para visita al médicoEl tratamiento de la GEA se debe iniciar en casa tan pronto como se detecte el cuadro. En general, es aconsejable disponer en casa de SRO, recomendación aun más relevante para padres de niños en riesgo de GEA e iniciar la administración de SRO (60 a 120ml cada vez que el niño evacue, en pequeños ofrecimientos y a ser posible, con técnica de vaso y cuchara y no con biberón, ya que se ha demostrado que estimula la náusea y la predisposición a presentar mayor número de vómitos). Existe evidencia que señala que la administración temprana de SRO puede reducir el número de complicaciones asociadas a GEA, el número de visitas al consultorio del médico, al servicio de urgencias y de hospitalizaciones22. Además, se deben identificar y considerar las condiciones socioeconómicas de la comunidad y de los pacientes debido a su impacto en la GEA23.
| Grades of Recommendation |
|
«Extrapolations» are where data is used in a situation which has potentially clinically important differences than the original study situation
La ESPGHAN/ESPID22 recomiendan solicitar atención médica para lactantes y niños pequeños con GEA en caso de:
- •
Número considerable de evacuaciones (>8 episodios en 24h) Vómito persistente (>2 vómitos)
- •
Enfermedad de base relevante (malnutrición, enfermedad renal, diabetes, estados de inmunosupresión)
- •
Edad menor de 2 meses
Si bien la mayoría de los líderes de opinión concuerdan con los criterios arriba señalados, existe preocupación en considerar el criterio de >8 evacuaciones diarreicas para solicitar atención médica, debido a que la presencia de niveles limitados de educación en salud, o la dificultad de acceso a sitios de atención médica podría llevar a la solicitud tardía de atención, cuando el niño pueda ya estar cursando con deshidratación significativa o con un cuadro complicado. Se sugiere recomendar la búsqueda de atención médica cuando los padres sospechen deshidratación o cuando la frecuencia o cantidad de evacuaciones o vómito sea superior a la cantidad de solución de rehidratación que el niño tolera.
Indicaciones para ingreso hospitalarioLas recomendaciones para iniciar tratamiento hospitalario son derivadas de consenso del ESPGHAN/ESPID22 y comprenden cualquiera de las situaciones siguientes:
- •
Choque
- •
Deshidratación grave (> 9% del peso corporal)
- •
Alteraciones neurológicas (letargo, crisis convulsivas etc.)
- •
Vómito persistentes o biliares
- •
Fracaso del tratamiento con SRO
- •
Los cuidadores no pueden prestar unos cuidados adecuados en el domicilio o hay problemas sociales o logísticos.
- •
Sospecha de proceso quirúrgico
Si bien se ha considerado y está bien establecido que la mejor forma de evaluar la presencia de deshidratación es calculando el porcentaje de pérdida de peso en relación al peso del niño previo al cuadro de GEA, para efectos prácticos, en la mayoría de los casos se desconoce el peso antes del inicio de la enfermedad. De acuerdo con lo señalado por la Organización Mundial de la Salud (OMS) y el Centro para Control de Enfermedades (CDC) es importante diferenciar a los niños con GEA que no presentan deshidratación, de aquellos niños con GEA y deshidratación leve o moderada y de aquellos niños con GEA y deshidratación grave con estado de choque24–30.
Los autores y ESPGHAN/ESPID22 recomiendan que cuando se evalúe un niño con GEA en quien se sospecha deshidratación, siempre hay que recordar que:
- •
Los informes de los padres de los síntomas de deshidratación son tan poco específicos que posiblemente carecen de utilidad clínica. Una diuresis normal según los padres disminuye las probabilidades de deshidratación.
- •
Las pruebas clínicas para la deshidratación son imprecisas y generalmente muestran un grado de coincidencia regular a moderado entre los examinadores
- •
Los tres mejores signos individuales de la exploración para la valoración de la deshidratación son la prolongación del tiempo de llenado capilar, la turgencia anormal de la piel y la respiración anormal
- •
No hay pruebas que respalden el uso de un sistema de puntuación para el control del niño individual-mente
En 2004 Friedman, J. y cols., considerando los limitantes anteriormente señalados, efectúa un estudio de cohortes en el cual seleccionan 9 parámetros clínicos para evaluar la presencia de deshidratación y establecen que el agregado de apariencia general alterada, ojos hundidos, membranas mucosas secas y ausencia de lágrimas, es válido, reproducible, discriminatorio y tiene sensibilidad al cambio significativa29. En una reciente publicación (2008), estos autores validan dicha escala desarrollada en 2004, con los mismos parámetros pero con diferentes variables de desenlace (tiempo de estancia y rehidratación intravenosa), encontrando que las tres categorías de deshidratación (no deshidratación, deshidratación leve y deshidratación moderada/ severa) se relacionan positivamente con tiempo de estancia hospitalaria (no deshidratación 245±181min, leve 397±302min y moderada/severa 501±389min p<0,001). De igual manera se encontró una asociación positiva con respecto al uso de rehidratación intravenosa (no deshidratación 15%, leve 49% y moderada/severa 80% p=0,001)31. De esta manera validan la escala y tres categorías de deshidratación en pacientes de un mes a cinco años con GEA.
Comentarios de expertos:En su mayoría, los líderes de opinión latinoamericanos concuerdan que el llenado capilar prolongado y el patrón respiratorio anormal son datos clínicos muy tardíos para establecerlos como parámetro de utilidad para el diagnóstico temprano de deshidratación. Se deben corroborar los hallazgos del grupo canadiense en centros de atención de LA, antes de poder ser recomendada ampliamente.
SECCIÓN II
Abordaje Terapéutico de la GEA1. Rehidratación Oral| RECOMENDACIÓN: |
|
A partir del descubrimiento del transporte acoplado de sodio a la glucosa en los sesenta, se evidenció la utilidad de este mecanismo fisiológico en el tratamiento de la deshidratación causada por diarreas. La OMS generó hace más de 30 años una SRO que ha sido utilizada con éxito disminuyendo la morbi-mortalidad infantil en todo el mundo. Esta solución se ha tratado de mejorar desde su introducción, con el objeto de producir un efecto sobre la carga osmolar, el volumen y duración de la diarrea, así como en la frecuencia de vómitos.
1.1 Rehidratación enteral (oral o nasogástrica) vs. intravenosaEn una revisión sistemática con metaanálisis que incluyó datos de 1.545 menores de 15 años con GEA participantes en 16 ensayos clínicos controlados aleatorizados (ECCA) o casi aleatorizados (ECCQA) se demostró que los niños tratados con SRO presentaron menor riesgo de muerte o convulsiones (RR 0,36; IC95% 0,14 a 0,89) así como una reducción significativa de la estancia hospitalaria (media 21h, IC95% 8 a 35h) al compararse con los niños tratados con RIV32. Una revisión más reciente, que incluyó 17 ECCA o ECCQA con 1,811 menores de 18 años, igualmente identificó menor estancia hospitalaria en el grupo tratado con SRO (media —1,2 días, IC95% —2,38 a —0,02 días)33. (Nivel de evidencia I, A)
1.2 SRO de osmolaridad reducida (SRO-OR) y de baja osmolaridad (SRO-BO)Existen hasta el momento dos revisiones sistemáticas con meta-análisis publicadas sobre la eficacia y seguridad de las SRO-OR (75mEq/L de sodio) y de las SRO-BO (60mEq/L de sodio) en niños con GEA34,35. La revisión sistemática de Hahn, publicada en 2001, incluyó 15 ECCA efectuados en 2.397 niños menores de 5 años, con diarrea aguda de me-nos de 5 días de evolución tratados con SRO-OR o SRO-BO vs. SRO estándar (90mEq/L de sodio). Esta revisión sistemática demostró en los niños tratados con SRO-OR o SRO-BO, una reducción de la necesidad de hidratación intravenosa (OR 0,61; IC95% 0,47 – 0,81), de la tasa de gasto fecal (SMD −0,214; IC95% −0,305 – −0,123) y del riesgo de vómitos (OR 0,71; IC95% 0,55 – −0,92) cuando fueron comparados con niños tratados con SRO estándar y además sin riesgo significativo para el desarrollo de hiponatremia. Una segunda revisión sistemática efectuada en 2004 por Murphy et al35, incluyó 7 ECCA en 718 pacientes (adultos y niños) con diarrea por cólera, e identificó mayor riesgo de hiponatremia bioquímica (sin repercusión clínica) en el grupo tratado con SRO-OR o SRO-BO (RR 1,67, IC95% 1,07 – 2,57), sin mayor riesgo de presentar hiponatremia grave (NaS<125mEq/L) (RR 1,58; IC95% 0,62 – 4,04). Además, no se observaron diferencias entre los grupos en relación con la necesidad de RIV. (Nivel de evidencia I, A)
Fundamentados en esta evidencia en 2001, la OMS y el Fondo para la Infancia de las Naciones Unidas (UNICEF), recomendaron la utilización de las SRO-OR y las SRO-BO basándose en que poseen una superioridad clínica y significativa sobre las SRO con 90mEq/L de sodio para el tratamiento integral de la GEA, considerando su equivalencia terapéutica para prevenir o tratar la deshidratación y su superioridad, pues se asocia significativamente con una reducción de la tasa de gasto fecal, de la necesidad de RIV y de la frecuencia de vómitos.
Esto permite recomendar las SRO-BO sobre las SRO-OR y las SRO-estándar como piedra angular en el tratamiento de la GEA en menores de 5 años, lo que concuerda con las recomendaciones establecidas por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)22.
1.3 SRO basadas en Cereales (arroz o trigo)Las SRO basadas en carbohidratos complejos (como la harina de arroz o de trigo), pueden reducir la tasa de gasto fecal pues incrementan la cantidad de sólidos en la luz intestinal sin producir aumentos de la osmolaridad, al mismo tiempo que proporcionan una mayor cantidad de glucosa para la unión con sodio y en teoría, producen mayor absorción de agua. Al respecto, se identificaron dos revisiones sistemáticas con meta-análisis publicadas por el mismo autor en diferentes fechas y fuentes36,37. En la revisión sistemática más reciente de 1995 (actualmente en actualización por Cochrane Library) se incluyeron 22 ECCA y se identificó que estas soluciones pueden ser efectivas al reducir la tasa de gasto fecal en las primeras 24h de seguimiento de niños con GEA secundaria a cólera, pero sin beneficio en niños con diarrea no colérica. (Nivel de evidencia I, A)
1.4 SRO basadas o con adición de otros sustratos (almidón amilasa-resistente, goma de algarrobo, carbohidratos no digeribles, glutamina, prebióticos, zinc)Adicionales a la glucosa, el arroz o el trigo, se han utilizado otros sustratos como fuente de acoplamiento al sodio en las SRO, con la finalidad de reducir la osmolaridad e incrementar el aporte calórico.
En 2006, se publicó un ECCA en niños de 6 a 36 meses de edad con GEA38 sobre la eficacia y seguridad de las SRO basadas en almidón resistente a la amilasa, el cual al entrar en contacto con el lumen colónico se fermenta en ácidos grasos de cadena corta, incrementando la absorción de sodio y agua. Se observó una reducción en la duración de la diarrea a favor del grupo tratado con SRO basadas en almidón resistente (6,75h, IC95% 4,3 – 9,2h). (Nivel de evidencia II, B)
En 2000, otro ECCA39 con 150 niños en los que se utilizó SRO-estándar con adición de goma de algarrobo vs. SRO estándar, se observó reducción en la duración de la diarrea (74±37h vs. 90±50h, p=0,03), sin diferencias significativas en relación con la tasa de gasto fecal u otras variables de interés clínico. (Nivel de evidencia II, B)
En 2004 se publicó un ECCA40 que analizó la eficacia de una mezcla de carbohidratos no digeribles (25% polisacáridos, 9% de a-celulosa, 19% de goma arábiga, 18,5% de fructo-oligosacáridos, 21,5% de inulina y 7% de almidón resistente) como adyuvante en las SRO-BO. Si bien la duración de la diarrea en el grupo suplementado fue menor con 82±39h y en grupo control de 97±76h, esta diferencia no fue estadísticamente significativa y tampoco se observaron diferencias en las otras variables de desenlace. (Nivel de evidencia I, A)
Aunque existe abundancia de evidencia y revisiones sistemáticas sobre la eficacia y seguridad de los probióticos para el tratamiento de la GEA, existe mínima evidencia sobre su eficacia cuando se combinan con SRO. En 2000 se efectuó un ECCA41, en 287 niños de 1 a 3 años con GEA en quienes se identificó que la adición de Lactobacillus GG a la SRO, redujo significativamente la duración de la diarrea (58,3±27,6h vs. 71,9±35,8h, p=0,03), especialmente en casos de diarrea por rotavirus (56,2±16,9h vs. 76,6±41,6h, p=0,008), así como el riesgo de diarrea de más de siete días de evolución (2,7% vs. 10,7%, p=0,01). (Nivel de evidencia II, B)
En relación al zinc, en 2002 se efectuó en India un ECCA en niños de 6 a 35 meses con GEA42, que identificó una reducción significativa en el número total de evacuaciones, en la proporción de niños con evacuaciones líquidas o semilíquidas y en la duración de la diarrea. (Nivel de evidencia II, B)
Por último, con glutamina se efectuó un ECCA en 199443 en 120 niños de 1 a 12 meses en quienes no se observaron diferencias estadísticamente significativas en ninguna variable de desenlace del estudio. Un segundo ECCA en 200744 (llevado a cabo en 147 niños mexicanos deshidratados de 1 a 60 meses) se administro SRO-estándar+L-Glutamina vs. SRO-estándar, sin observarse de igual manera diferencias en las variables de desenlace analizadas. (Nivel de evidencia I, A)
2. Dieta y Fórmulas especiales| RECOMENDACIÓN: |
|
El interés por el manejo nutricional del paciente con diarrea siempre ha sido una preocupación fundamental para padres y médicos. Es conocido que en cada episodio diarreico (ED) se evidencia pérdida de peso, debido a pérdida de fluidos y absorción disminuida de nutrientes a nivel intestinal, así como por la reducción del apetito que se observa, no sólo en las diarreas, sino también en otras infecciones durante la infancia. Se estima que un niño puede perder entre 100 y 200 gramos por cada día de duración de la enfermedad, lo que incrementa el riesgo de malnutrición, sobre todo en diarreas prolongadas o recurrentes45. También es notorio que la diarrea se presenta de forma más frecuente y más grave en niños malnutridos, por lo que el manejo dietético de estos pacientes con GEA es fundamental. (Nivel de evidencia II, B)
Cuatro estudios realizados entre 1985 y 199046–49, demostraron que la alimentación temprana reduce significativamente la duración de la diarrea (0,43 días, IC95% —0,74 a —0,12 días), y cuatro estudios posteriores efectuados entre 1988 y 199750–53 demostraron adicionalmente mejoría en la ganancia ponderal, sin efectos negativos sobre la duración de la diarrea o la tasa de gasto fecal. (Nivel de evidencia I, A)
De esta forma, la Academia Americana de Pediatría (AAP) y la ESPGHAN, recomiendan, en niños con GEA no deshidratados, continuar con su alimentación habitual y en niños deshidratados, reiniciar la alimentación tan pronto como se termine el esquema de RO54,55.
2.1 Alimentación con leche maternaLa lactancia materna debe mantenerse a libre demanda durante el episodio de GEA22. Bhandari y cols., reportan una reducción significativa en la prevalencia de diarrea cuando la lactancia materna es exclusiva hasta los 6 meses de edad (0,64; IC95% 0,44 a 0,95 a los 3 meses, p=0,028 y 0,85, IC95% 0,72 a 0,99 a los 6 meses, p=0,04)56. Khin en 1985 y Haffejee en 1990 demostraron reducción del volumen, del número de evacuaciones y de la duración de la diarrea en niños alimentados con leche materna57,58. (Nivel de evidencia II, B)
2.2 Alimentación con fórmulas infantilesEn 1994 Keneth Brown y cols. efectuaron un meta-análisis con la finalidad de evaluar el impacto de utilizar fórmulas infantiles diluidas sobre la evolución de la GEA59. Esta revisión sistemática incluyó un total de 29 estudios (2.215 pacientes), y consideró como variables de desenlace la tasa de fracaso terapéutico, la frecuencia y cantidad de evacuaciones, la duración de la diarrea y la ganancia ponderal. Los resultados ponderados de catorce estudios incluidos en el meta-análisis, identificaron un 16% de fracaso terapéutico (IC95% de 11% a 18%) en el grupo que recibió leche no diluida frente al 12% (IC95% de 7% a 13%) en quienes recibieron leche diluida, con diferencias clínica y estadísticamente significativas. Al analizar sólo el grupo de pacientes con diarrea grave, el fracaso terapéutico fue del 20% (IC95% de 15% al 25%) para el grupo con leche no diluida y del 12% en el grupo de leche diluida (IC95% de 10% a 17%, p=0,003). Al analizarse el grupo de los pacientes sin deshidratación grave, no se observaron diferencias significativas entre el uso de formulas diluidas vs. no diluidas; por lo que se recomienda no extrapolar estos resultados para la totalidad de pacientes con GEA. En relación con la frecuencia y cantidad de evacuaciones, los datos ponderados de seis estudios incluidos en el meta-análisis sugieren que la frecuencia y volumen de las evacuaciones es marginalmente superior con la utilización de leche no diluida (p=0,046). En relación con la duración de la diarrea no se observaron diferencias significativas entre los grupos. Finalmente en cuanto a ganancia ponderal, los datos ponderados de siete de los estudios incluidos en el meta-análisis revelan que el grupo alimentado con leche no diluida presentó mejor ganancia ponderal (p=0,002). Por lo anterior se concluye que no existen beneficios en la dilución de fórmulas en niños con diarrea y sin deshidratación o deshidratación leve, pero sí existe un riesgo de causar una ingesta calórica baja durante el periodo de la diarrea, si se sigue esta práctica. (Nivel de evidencia I, A)
En relación con el tipo de fórmulas indicadas, se han analizado diversidad de fórmulas entre las que se encuentran aquellas derivadas de leche de vaca, libres de lactosa, a base de soja o combinaciones de cereales con leche, sin que se haya identificado un franco impacto de la utilización de algún tipo especial de fórmula sobre la evolución de la GEA. En relación con las leches libres de lactosa, el meta-análisis publicado por Brown59 (mencionado previamente), observó que la tasa de fracaso terapéutico en el grupo alimentado con leche libre de lactosa fue de 12% (IC95% de 9% a 15%), comparado con una tasa de fracaso terapéutico del 22% (IC95% de 18% a 27%) en el grupo alimentado con lactosa, p=0,0001, sin embargo, se observó heterogeneidad significativa en los resultados. Cuando se analizaron por separado los pacientes con diarrea grave, la tasa de fracaso terapéutico fue del 38% (IC95% 31% a 44%) en el grupo con fórmulas con lactosa vs. 16% (IC95% 12% a 20%), en el grupo alimentado sin lactosa (p=0.0001). Por el contrario, no se encontraron diferencias significativas cuando se analizaron los casos de diarrea no grave o sin deshidratación grave. En cuanto a frecuencia y volumen de las evacuaciones, se identificó que las fórmulas con lactosa se asociaron de forma marginal a mayor tasa de gasto fecal. En cuanto a duración de la diarrea los resultados ponderados e identificados en el meta-análisis ya referido, indican que la administración de fórmulas con lactosa se asocian a discretos incrementos en la duración de la diarrea (85h a 67h, p=0,001), aunque nuevamente los estudios fueron significativamente heterogéneos (p=0,003). Análisis adicionales, excluyendo algunos estudios por la utilización de comidas complementarias, encontró que la media de duración de la diarrea fue superior en los grupos con lactosa vs. no lactosa (95±69h vs. 82±53h), sin embargo estos análisis carecen de homogeneidad. (Nivel de evidencia I, A)
En relación con las fórmulas derivadas de soja, no se ha identificado evidencia suficiente que avale la utilización rutinaria de este tipo de alimentación en niños con GEA. Así, dos estudios conducidos en 198960,61 no mostraron diferencias en cuanto a la duración de la diarrea, duración de la hospitalización o fracasos terapéuticos. De manera similar, no existen evidencias de suficiente calidad que apoyen la recomendación de uso rutinario de otras fórmulas especializadas como los hidrolizados de proteínas en este tipo de pacientes.
2.3 Alimentación con productos no lácteosLa dieta a utilizar en los casos de GEA, dependerá de la edad del niño, de sus preferencias alimentarías, de los sus patrones dietéticos previos a la enfermedad y de los sus patrones culturales. En general, los alimentos apropiados para niños con diarrea, son los mismos que para niños sa-nos22. En casos de suspensión de la dieta, la realimentación debe iniciarse de manera inmediata al término de los esquemas de rehidratación. Los alimentos recomendados deben ser aquellos culturalmente aceptados, disponibles fácilmente, con alto contenido energético y proveer cantidades adecuadas de micronutrientes esenciales. En relación a su preparación, deben estar bien cocidos y triturados o cortados para facilitar su digestión22. No existe evidencia concluyente que soporte el uso rutinario de alimentación con derivados de soja, yogur de cereales especiales (resistentes a la digestión), o dietas excesivamente restringidas (dieta BRAT a base de pan, arroz, manzana) en el tratamiento integral de niños con GEA. Diversos estudios realizados en países en desarrollo han demostrado que la combinación de alimentos culturalmente aceptables y de fácil accesibilidad local (vegetales, pollo, cereales) son seguros, nutricionalmente adecuados y de bajo coste, sin que se hayan publicado ECCA al respecto, pero que cuentan con el respaldo de guías de manejo de la diarrea19,54. (Nivel de evidencia V, D)
Finalmente en relación con la incorporación al tratamiento de algunas bebidas especiales, como los jugos de frutas, Valois y cols. (2005) publicaron un ECCA, para evaluar el consumo de dos tipos de jugo de frutas en niños con diarrea aguda, en 90 niños de entre 4 y 18 meses con diarrea aguda, deshidratación moderada y menos de 3 días de duración. Los niños fueron asignados aleatoriamente a 3 grupos para recibir jugo de manzana (JM), jugo de uva blanca (JUB) o agua (Ag). Las tres bebidas presentaron el mismo color y apariencia. La administración de estos jugos fue posterior a la fase inicial de rehidratación de los pacientes, según protocolo de la OMS y como hidratación complementaria. El consumo de JUB fue superior al de JM y Ag, por lo tanto, la ingesta calórica fue también superior en este grupo. Asimismo, quienes consumieron JUB ganaron significativamente más peso, que aquellos con JM y Ag (p=0,08). No obstante, es importante señalar que la duración de la diarrea fue significativamente superior entre los grupos que ingirieron jugos (JM 111,7±48,2, JUB 105,4±44,9 y Ag 80,0±39,6h; p<0,05) respecto al grupo que ingirió Ag. De igual manera el volumen de las evacuaciones fue 40% menor en el grupo Ag, que en aquellos con jugos62. Por lo anterior, independientemente de las ganancias nutricionales referidas, debido a su impacto negativo sobre la duración y volumen de las evacuaciones durante el cuadro diarreico, no se recomienda el uso de este tipo de bebidas durante los episodios de GEA. (Nivel de evidencia II, B)
Comentarios de expertos:El consenso médico no recomienda el uso de bebidas herbales (como canela, menta o anís) o de soluciones de rehidratación utilizadas en deportes que tienen un alto contenido de glucosa lo que las hace inapropiadas para su utilización en la población pediátrica con GEA.
3. Tratamiento Farmacológico| RECOMENDACIÓN: |
|
Racecadotrilo (acetorfan) es un inhibidor específico de la encefalinasa, una peptidasa de membrana celular localizada en diversos tejidos del organismo, principalmente en el epitelio del yeyuno e íleon. Esta enzima contribuye tanto a la digestión de péptidos exógenos como endógenos, tales como las encefalinas, la neurokinina y la sustancia P. Diversos estudios en modelos animales y en humanos han demostrado que la administración oral de racecadotrilo reduce de forma significativa la duración de la enfermedad diarreica, así como la tasa de gasto fecal, sin incrementar el tiempo de tránsito intestinal ni reducir la actividad de la encefalinasa en líquido cefalorraquídeo, por lo tanto tiene un efecto anti-secretor intestinal selectivo, mediado a través de la activación de los receptores d opioides, y que, a su vez, disminuye la secreción de agua y electrolitos a través del bloqueo en la conversión acelerada de ATP hacia AMPc63–65. Si bien previamente a 1999 se habían realizado diversos estudios sobre el efecto antisecretor de racecadotrilo en modelos experimentales y di-versos ECCA sobre la eficacia y seguridad de este medicamento en adultos con GEA, Turck y cols. realizaron en ese año, el primer ensayo en 102 niños de 2 a 10 años con GEA, recibiendo racecadotrilo (1,5mg/Kg/dosis) o loperamida (0,03mg/Kg/dosis). Encontraron una frecuencia de evacuaciones de 2,7±0,4 en el grupo de racecadotrilo y de 2,1±0,4 en el grupo de loperamida, con duración similar del ED entre los grupos, pero con menor frecuencia de eventos adversos en el grupo de niños tratados con racecadotrilo (11,5% vs. 22%) presentando significativamente más constipación (58% vs. 36,5%; p=0,03) los pacientes tratados con loperamida66. En el 2000 Salazar-Lindo y cols. realizaron un segundo ECCA en 135 niños de 3 a 35 meses con GEA, administrando racecadotrilo (1,5mg/Kg/dosis) vs. placebo, en el que se observó menor producción de heces a las 48h (92±12g/Kg) en el grupo de racecadotrilo frente a placebo (170±15g/Kg) y gasto fecal total de 157±27g/Kg. y 331±39g/Kg respectivamente, siendo las diferencias estadísticamente significativas a favor de racecadotrilo (p<0,001) para las dos variables evaluadas. Además, se encontró una duración media de la diarrea de 28h para racecadotrilo independientemente del estatus para rotavirus, comparado con 72 y 52h para los pacientes rotavirus positivos y negativos respectivamente del grupo placebo (p<0,001)67. En 2001, Cézard et al68. efectuaron un ECCA, en 168 niños de 3 meses a 4 años de edad con GEA. 86 niños recibieron racecadotrilo (1,5mg/Kg/dosis) y 82 niños, placebo. A las 48h de tratamiento, la tasa de producción de heces fue significativamente menor (disminución de un 60%; CI 95% 43–88%, p<0,009) en el grupo de racecadotrilo respecto al grupo placebo. Racecadotrilo mostró ser igualmente eficaz en pacientes rotavirus positivos que rotavirus negativos. El tiempo de recuperación fue similar en ambos grupos, pero en el análsis de las curvas de super vivencia se pudo observar que, en los pacientes rotavirus positivos, el tiempo hasta la recuperación era significativamente menor en los pacientes tratados con racecadotrilo que en los tratados con placebo (6,9h vs. 36 h; p<0,02). La incidencia de eventos adversos fue similar en ambos grupos (10 en el grupo racecadotrilo y 11 en el grupo placebo). La mayor parte de los eventos fueron clasificados como leves o moderados y únicamente dos fueron clasificados por el investigador como potencialmente relacionados con el medicamento. En 2002, Cojocaru y cols. realizaron el cuarto ECCA abierto69 en 164 niños con GEA (81 aleatorizados a racecadotrilo y 83 a placebo). Se observó una reducción de uso de recursos sanitarios en el grupo tratado con racecadotrilo (p<0,05) así como en el número de evacuaciones en las primeras 48 horas y en la duración total de la diarrea.
En 2007, Szajewska et al70 publicaron una revisión sistemática en la que incluyeron tres de los estudios referidos previamente67–69, con un total de 471 niños de 3 a 48 meses de edad, identificando en el grupo tratado con racecadotrilo al compararlo con el grupo placebo, una reducción significativa en el gasto fecal (Diferencia Media Estandarizada (DME) —0,67; IC95% —0,9 a —0,44; p = 0,01), aunque se debe mencionar la heterogeneidad de los estudios (x2=1,8; p=0,02). El promedio de gasto fecal total a los 5 días fue menor en el grupo de racecadotrilo (Diferencia Media (DM) —174g/kg, IC95% —185 a —163, Reducción del Riesgo Relativo del 53%, p=0,001). En relación con la duración de la diarrea, si bien todos los estudios evaluaron esta variable, la forma de reportarla fue distinta y no permitió la agregación de datos. Salazar-Lindo reportó la duración de la diarrea a través de la duración media para pacientes rotavirus positivos (28h vs. 72h, p<0,001) y rotavirus negativos (28h vs. 52h, p<0,001), mientras que Cézard reportó una reducción significativa de tiempo necesario para el fin de la diarrea a favor de racecadotrilo vs placebo en pacientes rotavirus positivos (p=0,02) y Cojocaru reportó la duración de la diarrea en promedio±desviación estándar a favor de racecadotrilo (97,2±36h vs. 138±42h, p<0,05). (Nivel de evidencia I, B-)
3.2 ZincEl Zinc esta relacionado con funciones tales como el mantenimiento de la barrera epitelial, la reparación de tejidos y la función inmune71. En enfermedades como la diarrea aguda se puede producir una deficiencia de zinc en adición a deficiencias nutricionales de base que pueden tener los pacientes. Varios estudios y meta-análisis han demostrado que la administración de zinc puede reducir la incidencia de infecciones respiratorias agudas y diarrea72–76. En la actualidad la suplementación con zinc en niños en países subdesarrollados es avalada por una recomendación con-junta de la UNICEF y la OMS77. El meta-análisis de Lukacik y cols. recientemente publicado identificó 16 estudios con 15.231 niños de 1 a 60 meses y GEA78. Encontró una reducción promedio de la frecuencia de heces del 18,8%, una reducción de la duración de la diarrea del 15% y un 17,9% de probabilidad de reducir la diarrea sobre placebo. El efecto adverso más frecuente en pacientes que recibían zinc al compararlo con placebo es el vómito con un RR: 1,55 (IC95% 1,30 a 1,84). El análisis de subgrupos entre sulfato y gluconato de zinc, demostró que los pacientes con sulfato de zinc vomitaron menos que los pacientes que recibían gluconato de zinc. La dosis recomendada de zinc es de 10mg/día durante 10–14 días para niños<6 meses o 20mg/día para niños > de 6 meses77. Publicaciones de tratamiento con zinc en niños79,80. Además, una revisión Cochrane del 2007 ha estratificado por edad sus resultados, sin encontrar beneficios en la administración de zinc en niños menores de 6 meses. Por lo demás, sus resultados corroboran los beneficios de la utilización del zinc (niños > de 6 meses) y la recomendación de uso de zinc por la OMS81. (Nivel de evidencia I, A)
La evidencia a favor de la utilización del zinc es abundante y proviene en su mayoría de estudios realizados en países en desarrollo; sin embargo, el rol y beneficio de administración de zinc en niños de países desarrollados requieren estudios adicionales. En cuanto a su dosis óptima por edad, beneficio según la edad y nivel socioeconómico, requiere de estudios adicionales.
3.3 EsmectitaEsmectita es un silicato natural hidratado de aluminio y magnesio (esmectita dioctaédrica o esmectita aluminosa) con acción absortiva sobre toxinas, bacterias y rotavirus. En 2006 se efectuó un meta-análisis que incluyó 9 ECCA con 1.238 niños menores de 5 años (622 con esmectita y 616 en grupo control) con similares dosis de esmectita y duración del tratamiento entre 2 y 6 días en todos los estudios82. La duración de la diarrea fue menor en los pacientes que recibieron esmectita frente a placebo: —22,7h (IC95% —24,8 a 20,6). La frecuencia de las evacuaciones fue similar en ambos grupos hasta las 48 horas de tratamiento y se observaron diferencias significativas a las 72h (2 RCT n=125 —0,58 IC95% 0,9 a 0,3) y a las 96h (1 RCT n=44 —1,87 IC95% —3 a 0,3). Por último, en cuanto a la curación de la diarrea, al tercer día se observó diferencia en la cura entre esmectita y placebo (1,64, IC95% 1,36 – 1,98), la cual fue mayor al quinto día (1,24, IC95% 1,08 – 1,42)82. (Nivel de evidencia I, B-)
3.4 AntieméticosA pesar de que el vómito es un síntoma común en niños con GEA, su tratamiento continúa siendo controvertido. Mientras diversas sociedades científicas recomiendan evitar el tratamiento antiemético debido a potenciales eventos ad-versos y riesgo-beneficio cuestionable, el personal de salud y los padres o cuidadores del niño tratan de identificar intervenciones que reduzcan el riesgo de fracaso de la administración de esquemas de RO. En 2006, Alhashimi efectuó una revisión sistemática83 que incluyó 3 ECCA con 396 participantes, con la finalidad de identificar la eficacia del uso de antieméticos para el tratamiento del vómito secundario a GEA. Se encontró que existe evidencia, aunque no necesariamente reproducible y con ciertas debilidades, de que ondansetrón (inhibidor de la 5-HT) y metoclopramida, comparados con placebo redujeron los episodios de vómito en niños. El incremento en la duración y el número de episodios adversos observados en este análisis se consideró una consecuencia de la retención de líquidos y toxinas que se eliminan a través del vómito. Un segundo meta-análisis84 que incluyó 4 ECCA con 490 pacientes evaluó el efecto del ondansetrón vs. placebo. Datos de 3 de los 4 ECC demostraron que ondansetrón incrementó la probabilidad de cese del vómito (RR 1,3; IC95% 1,2 a 1,5; NNT 5,9; IC95% 4 a 8), al inicio del ED, aun cuando este efecto no se mantuvo a las 24h. Adicionalmente, se observó que ondansetrón redujo el riesgo de hidratación intravenosa (RR 0,4; IC95% 0,3 a 0,7; NNT 7,0; IC95% 5 a 14). En cuanto a la metoclo-pramida, sus posibles efectos extrapiramidales y la relación coste-beneficio (análisis del número necesario a tratar o NNT), hacen que no se recomiende su uso de forma rutinaria. (Nivel de evidencia I, B-)
Recientemente, DeCamp y cols. (2008) realizaron un meta-análisis sobre el uso de antieméticos en niños con GEA, con la inclusión de dos ECCA adicionales (no disponibles para el meta análisis de Szajewska), encontrando un efecto beneficioso en la reducción de vómito (RR 0,45; IC95% 0,33 a 0,62; NNT 5) disminución en el uso de rehidratación IV (RR 0,41; IC95% 0,28 a 0,62; NNT 5) y una disminución en la necesidad inmediata de hospitalización (RR 0,52; IC95% 0,27 a 0,95; NNT 14) con el uso de ondansetrón85. Se debe clarificar que estos resultados se han obtenido en ámbitos hospitalarios y concretamente, en salas de emergencia, por lo que no se deben extrapolar a consultas externas, salas de rehidratación o, en general, a atención médica extrahospitalaria y se requiere de estudios adicionales antes de recomendar su uso más ampliamente. (Nivel de evidencia I, A)
3.5 LoperamidaLoperamida (sintetizada en 1969 y comercializada en 1973), es un derivado sintético de la meperidina. Es un compuesto agonista de los receptores opioides con disminución de las secreciones gastrointestinales y enlentecimiento del tránsito intestinal por reducción de la motilidad intestinal, lo que genera mayor reabsorción de agua y electrolitos. En 2007, Li y cols. publicaron una revisión sistemática sobre la eficacia de loperamida en niños menores de 12 años en el tratamiento de la diarrea aguda86. En esta revisión se incluyeron ECCA realizados en 1.788 menores de 12 años con EDA (975 recibieron loperamida y 813 placebo). Se observó menor prevalencia de diarrea a las 24h (0,66; IC95% 0,57 a 0,78) y 48h (0,59; IC95% 0,45 a 0,78) con loperamida, menor duración media de la diarrea (0,8 días; IC95% 0,7 a 0,9 días) así como en la frecuencia de las evacuaciones (0,84; IC95% 0,77 a 0,92). Sin embargo, los eventos adversos fueron significativamente superiores en el grupo tratado con loperamida (94 de 927 pacientes) respecto a placebo (16 de 764 pacientes). Ocho de 927 pacientes menores de 3 años, que habían recibido loperamida presentaron efectos adversos graves (EAG) (en este caso, letargia y muerte). En el grupo de loperamida también se produjeron otros efectos adversos (EA) como distensión abdominal y somnolencia (21 de 927) comparado con el grupo placebo (4 de 764). De este meta-análisis se desprende que, aun cuando está demostrado el efecto antidiarreico de la loperamida, los EAG descritos recomiendan no utilizar de forma rutinaria este medicamento en niños con GEA en menores de 3 años86. (Nivel de evidencia I, B)
3.6 Kaolín PectinaLos estudios disponibles que evalúan la actividad de la Kaolín pectina en GEA en niños son en general de baja calidad y con problemas de diseño (en algunos casos por antiguedad)87–90. Además, se identificaron dos estudios en diarreas prolongadas que no entran dentro de los objetivos de esta revisión91,92. La escasa disponibilidad de ensayos con adecuada calidad hace que no exista suficiente evidencia para recomendar el uso de este medicamento en el tratamiento de la GEA en niños. Sin embargo es de interés clínico el investigar la pectina y su actividad ya que ésta se encuentra presente en alimentos que se encuentran disponibles para niños con GEA. (Nivel de evidencia II, D)
3.7 Subsalicilato de bismutoSubsalicilato de bismuto (SSB) es un salicilato utilizado para el control de la diarrea y otros síntomas gastrointestinales desde principios de siglo XX. Su mecanismo de acción exacto se desconoce, aun cuando estudios in vitro sugieren su acción en dos sentidos: una acción antibacteriana, dirigida contra microorganismos patógenos y una acción antisecretora a nivel intestinal, que estimula la absorción de fluidos y electrolitos93. Los datos experimentales sobre su mecanismo de acción y su eficacia en el tratamiento de la diarrea aguda son consistentes. Esto motivó la realización de varios ensayos clínicos con resultados modestos94–97. Sin embargo, continúa siendo un fármaco de libre comercialización en algunos países. Hasta el año 2003 incorporaba en sus etiquetas la indicación de diarrea y la dosifi cación para niños. La última regulación de la U.S Food and Drug Administration (FDA) para este fármaco, obligó a los fabricantes a modificar las etiquetas y sugerir su utilización en casos de diarrea del viajero98. Los fabricantes añadieron como recomendación consultar con el médico antes de la administración de SSB a menores de 12 años. La precaución en el uso de SSB se asocia a dos hechos: entre 1973 y 1980 se reportaron aproximadamente 1.000 casos de encefalopatía asociada a bismuto (la mayoría ocurrió en tratamientos a largo plazo y con dosis elevadas de bismuto) y segundo, a la posibilidad de presentación de Síndrome de Reye en diarreas de etiología viral ante la administración de SSB, dado que la aspirina, otro salicilato de uso común, incrementa el riesgo de presentación de esta patología99. Debido a esto, en 2001, Guarino y Bruzzese plantearon la prioridad del valorar más profundamente las diferentes versiones de las SRO, antes de proponer la utilización extendida de SSB en diarreas agudas infantiles, vistos sus modestos resultados, incremento en los costes a gran escala y riesgos implícitos a todo fármaco100. Soriano-Brücher describe resultados favorables al tratamiento con SSB en 123 niños con GEA entre 4 y 28 meses de edad en Chile. En este ECCA los niños recibieron 100mg/Kg/día de SSB en el grupo en tratamiento y una suspensión de características similares en el grupo control y se observó una reducción significativa de la duración de las evacuaciones anormales (SSB 2,9 días comparado con placebo: 4,0 días p=0,05). Asimismo se redujo significativamente el tiempo de presentación de la primera evacuación normal posterior al ED, comparado con placebo (SSB 5,4 días frente a placebo 7,1 días; p<0,01)97. Figueroa-Quintanilla en 1993 realizó un ECCA doble ciego para evaluar el efecto de SSB en la duración y el volumen de la diarrea aguda en niños de 3 a 59 meses de edad. Los niños se asignaron aleatoriamente a tres grupos; placebo (n=84), SSB 100mg/Kg/día (n=85) y SSB 150mg/Kg/día (n=83), cada 4h por 5 días de tratamiento. Se encontraron diferencias estadísticamente significativas a favor de los grupos tratados con SSB frente a placebo, pero no entre las dos dosis de SSB evaluadas (SSB-100 p=0,09 y SSB-150 p=0,019, frente a placebo). La reducción en la duración de la diarrea se hizo evidente a los 3 días de haber iniciado el tratamiento y persistió por el resto de los días. Los días de hospitalización se redujeron significativamente en ambos grupos (p=0,005). Así mismo, el volumen de las evacuaciones fue significativamente menor en los grupos SSB-100 y SSB-150 así como la ingesta total de SRO (p=0,013)96. Chowdhury, en 2001, en un ensayo clínico que pretendía demostrar el efecto de SSB en la prevención de la diarrea persistente, no encontró diferencias significativas en ambos grupos en esta variable, y sí diferencias más modestas pero significativas en duración de la diarrea, ingesta de SRO y aumento de peso durante la hospitalización a favor del grupo SSB94. Teniendo en consideración los resultados de los estudios disponibles que presentan importantes deficiencias en los análisis estadísticos realizados y los discretos resultados en la reducción de la diarrea, no se recomienda la utilización del subsalicilato de bismuto en niños. (Nivel de evidencia II, C)
Comentarios de expertos:Diversos lideres de opinión han expresado la práctica común, no soportada por evidencia científica, de administrar SSB como coadyuvante en el tratamiento de la gastroenteritis aguda, reflexionando ellos mismos en la necesidad de establecer ensayos clínicos controlados, aleatorizados, doblemente cegados, multicentricos y multinacionales en LA con la finalidad de establecer evidencia sólida y reproducible sobre la eficacia y seguridad de este medicamento.
3.8 Vitamina ALos ECCA realizados para observar la incidencia de diarrea en pacientes con suplementación de vitamina A han arrojado resultados contradictorios101–104. En este sentido, los resultados del meta-análisis de Grotto y cols. (8 ECCA en niños con diarrea) encontraron un riesgo relativo de 1,00 (IC95%: 0,94–1,07) lo cual significa que no hay efecto de la suplementación de vitamina A en la morbilidad por diarrea105. Los autores de este meta-análisis concluyen que la administración de altas dosis de vitamina A en niños de edad preescolar tiene poco valor en la prevención primaria de la EDA e infecciones respiratorias agudas. Una revisión posterior de meta-análisis publicados y uno de Machado de Oliveira y cols. publicado en 2006, encuentran una disminución de la mortalidad general de niños de 6 meses a 5 años entre el 23%–30%106. Los trabajos recientes de Long y cols. en la ciudad de México en niños de 6 a 15 meses, encontró que vitamina A incrementaba la enfermedad diarreica y las infecciones respiratorias en niños del área peri-urbana de la ciudad de México107. Se realizaron análisis de subgrupos considerando aspectos económico-sanitarios como presencia o no de agua corriente doméstica, refrigeradores y piso de baldosa, encontrando respuestas diferentes en niños de diferentes grupos económico-sanitarios107–109. De esta forma concluye, que la suplementación con vitamina A debido a sus propiedades inmunoregulatorias puede tener diferentes efectos en niños según las condiciones socio-económicas y sanitarias donde los patógenos causantes de la diarrea son diferentes. Debido a la disparidad de la información disponible creemos que, la recomendación del uso de suplemento de vitamina A debe ser considerado en función de las condiciones socio-económicas mencionadas y específicamente se debe considerar en niños con deficiencia de vitamina A105. (Nivel de evidencia I, B)
4. Probióticos y Prebióticos| RECOMENDACIÓN: |
|
El uso de leche fermentada para el tratamiento de patologías gastrointestinales se describió a inicios del siglo XX, y desde entonces, diversas especies de probióticos, formulaciones y sus mecanismos de acción se han estudiado, in vitro e in vivo como terapia de patologías gastrointestinales entre otras. Los probióticos orales son microorganismos vivos que, al ser ingeridos en cantidades específi cas, ejercen efectos beneficiosos en cuanto a promoción de la salud, más allá de la nutrición inherente110. El probiótico ideal debe probar sus beneficios clínicos en ECCA, carecer de EA (especialmente en niños, pacientes debilitados e inmunocomprometidos), y evidenciar ausencia de riesgo a desarrollar resistencia a los antibióticos111. Su utilidad clínica depende, entre otros aspectos, a su resistencia a la degradación por ácido gástrico, bilis, secreciones intestinales y del sistema inmune intestinal. Durante el tiempo que permanezca en la luz intestinal, debe sobrevivir y ser metabólicamente activo, sin embargo, no debe permanecer a largo plazo. Final-mente, las propiedades benéficas del microorganismo han de mantenerse con posterioridad a su procesamiento farmacológico y almacenamiento112.
Las propiedades antidiarreicas de algunas cepas de lactobacilos se han investigado desde principios de los años sesenta113, además del estudio de sus beneficios en la prevención y manejo de diarreas agudas que se estudian desde los años setenta del siglo pasado. En la última década destacan los ECCA sobre la efi cacia de Lactobacillus rhamnosus, Lactobacillus GG (una cepa de L. rhamnosus), Lactobacillus reuteri, Lactobacillus acidophilus, entre otros bacterianos y la levadura Sacharomyces boulardii. El que cuenta con más y mejores estudios es, sin duda, Lactobacillus GG. La disponibilidad de estos compuestos varía entre países, lo que dificulta su utilización o estandarización terapéutica.
Se presume que los probióticos modifican la composición de la flora intestinal y actúan contra los enteropatógenos. No obstante, el mecanismo a través del cuál ejercen su función permanece desconocido. Los posibles mecanismos incluyen la síntesis de sustancias antimicrobianas, mecanismos competitivos por nutrientes necesarios para el crecimiento de patógenos, modificación de toxinas o sus receptores, y estimulación de respuestas inmunes específicas y no específicas a patógenos114.
Los probióticos han sido estudiados en diferentes formas de administración: SRO-Probióticos (Lactobacillus GG vivos (1.010 UFC/250ml) para ser reconstituidos en SRO41, preparación de L. acidophilus muertos LB, medio de cultivo y SRO115, Saccharomyces boulardii en SRO116), probióticos se-cos en viales congelados para ser reconstituidos en solución glucosada117, fórmula láctea con prebióticos para ser reconstituida en agua118, leche pasteurizada fermentada con cepas de bacterias vivas: L. acidophilus y L. caseii cepa CERELA119, cepas de probióticos tindalizados (L. acidophilus) en mezcla con polvo de arroz inflado, disponibles en la India120 y Saccharomyces boulardii en jugos o alimentos semisólidos121.
En este documento de consenso se han incluido cinco me-ta-análisis posteriores al año 2000. Szajewska, H y cols. estudiaron la eficacia de los probióticos en el tratamiento de EDA en niños entre 1 y 48 meses de edad, en 10 ECCA doble ciego. Todos, excepto uno, en pacientes hospitalizados y en países desarrollados. De éstos, 8 ECCA estudiaron lactobacilos (4 L. GG, 2 L. reuteri, 2 L. acidophilus LB); 1 Saccharomy ces boulardii y 1 la combinación de cepas de Streptococcus thermophilus, L. acidophilus y L. bulgaricus. El uso de probióticos se asoció a reducción del riesgo de presentar diarrea de más de 3 días de duración. El riesgo estimado en los datos combinados fue de 0,43 (IC95% 0,34 a 0,53; p<0,0001). Esta reducción sólo fue consistente en el análisis de subgrupos de LGG. En relación a la duración de la diarrea, el grupo de pacientes tratados con LGG y L. reuteri redujo significativamente la duración del ED, cuando se comparó con placebo (—20,1 horas; IC95% —26,1 a —14,2 vs. —24,8 horas; IC95% —31,8 a —17,9; p<0,0001)114. (Nivel de evidencia I, A)
Huang y cols., reportaron una reducción de 0,8 días de diarrea en el grupo de pacientes tratados con probióticos respecto al grupo control (IC95% —1,1 a —0,6 días; p<0,001). Este resultado inicial incorporó 18 ECCA para diferentes tipos de probióticos, solos o en combinación de cepas, aun cuando todos utilizaban al menos una cepa de lactobacilos. Todos los estudios, excepto dos, fueron realizados en niños hospitalizados de entre 1 y 60 meses de edad. Dada la heterogeneidad encontrada en el meta-análisis inicial, se realizó análisis de subgrupos en pacientes hospitalizados, en ECCA doble ciego contra placebo, en aquellos que evaluaban lactobacilos y aquellos que evaluaron cepas distintas a lactobacilos. En todos los subgrupos la reducción de la duración del ED fue significativa cuando se comparó con placebo y esta reducción fue mayor cuando se restringió a lactobacilos122. (Nivel de evidencia I, A)
Van Niel y cols. realizaron un meta-análisis de 8 ECCA para evaluar la eficacia de Lactobacilos en el tratamiento de EDA en niños entre 1 y 36 meses de edad. Se observó una reducción de 0,7 días en la duración de la diarrea en los pacientes tratados con Lactobacilos comparados con el grupo control (IC95% 0,3 a 1,2 días). Esta diferencia se mantuvo significativa, aunque menor, al analizar pacientes con diarrea de todas las etiologías y no sólo rotavirus. El meta-análisis de 3 estudios reportó, además, una reducción en la frecuencia de las evacuaciones en el grupo tratado con lactobacilos. Se evidenció una relación dosis-respuesta positiva y lineal entre la dosis en unidades formadoras de colonias de lactobacilos y los días de duración de la diarrea (p<0,01). Así mismo las diferencias se mantuvieron signifi cativas cuando el preparado de lactobacilos suministrados era de cepas vi-vas o muertas123. (Nivel de evidencia I, A)
En 2007 Swajeska y cols., realizó dos meta-análisis para evaluar respectivamente la efi cacia de Lactobacillus GG y Saccharomyces boulardii en el tratamiento de GEA en niños. 8 ECCA contemplaron 988 niños entre 1 y 36 meses. De estos, 4 ECCA fueron realizados en países europeos y los restantes en países no europeos (Brasil, Pakistán, Perú y Uruguay). Dada la heterogeneidad de las variables analizadas en los distintos ensayos incluidos, los análisis de subgrupos son considerados de más valor. Se encontró reducción de la duración de la diarrea en el grupo tratado con LGG contra el grupo control (—1,1 días; IC95% —1,9 a —0,3). Posterior al análisis de sensibilidad esta reducción perdió su significación estadística. El análisis de subgrupos reveló que esta reducción sólo era estadísticamente significativa en los estudios realizados en Europa. LGG redujo significativamente la duración de la diarrea por rotavirus (—2,1 días; IC95% —3,6 a —0,6). No se encontraron diferencias en el volumen de las evacuaciones, los días de hospitalización, vómitos y fallos de tratamiento entre el grupo tratado con LGG y el grupo control. Tampoco encontraron diferencias significativas en el riesgo de presentar diarreas de más de 3 días, 7 días o 10 días de duración, ni respecto a la duración de la diarrea en pacientes con diarreas invasivas o por causas inespecíficas124. (Nivel de evidencia I, A)
El meta-análisis de Szajewska y cols., para Saccharomyces boulardii, incluyó 5 ECA, con 619 niños entre 2 meses y 12 años de edad (310 en el grupo probiótico y 309 en el grupo control). Dos de estos fueron realizados en países con alto índice de desarrollo humano (IDH), mientras que los otros tres, en países con IDH medio (2 en Pakistán y 1 en Turquía). Los estudios incluidos eran homogéneos y cuatro de estos estudios reportaron como variable principal la duración de la diarrea. Se observó reducción de la duración en el grupo tratado con S. boulardii, respecto al grupo control (—1,1 día; IC95% —1,3 a —0,83). Así mismo mostraron reducción en la frecuencia de las evacuaciones. El resto de variables se analizaron para un estudio en cada caso, por lo que no se considera la generalización de sus hallazgos125. Los meta-análisis de Szajewska y cols. no reportan EA en los grupos tratados con ambos probióticos. (Nivel de evidencia I, A)
Todos los meta-análisis mostraron heterogeneidad o diferencias importantes en las variables estudiadas. Por tanto, es necesario valorar la etiología del GEA, el estado nutricional y de hidratación del paciente para poder generar recomendaciones con respecto a su utilidad.
4.2 PrebióticosSe definen como componentes nutricionales no digeribles con efecto benéfico en la salud al estimular el crecimiento o la actividad de un número limitado de microorganismos benéficos en el colon. Desde el punto de vista terapéutico existe evidencia limitada sobre la eficacia y seguridad de los prebióticos como coadyuvantes en el tratamiento de la GEA en niños. Así por ejemplo Duggan y cols. efectuaron un ECCA en 282 niños de 6 a 12 meses, con GEA en quienes emplearon un cereal adicionado con oligrofrutosa (0,55g/15g de cereal) vs. cereal control, sin identificarse diferencias significativas en cuanto a la duración del evento diarreico, tasa de gasto fecal o número de eventos graves126. (Nivel de evidencia II, C)
Comentarios de expertos:El porcentaje de uso de prebióticos y probióticos en Ibero-Latinoamérica se estima se encuentra entre un 20% al 80% en los diferentes países. Su popularidad se ha extendido entre pediatras, farmacias y padres, que le dan valor por su origen natural. Los probióticos más utilizados en Iberolatinoamerica contienen: Saccharomyces boulardii, Lactobacillus acidophilus y Bacillus clausii.
DiscusiónA pesar de los avances en el tratamiento de la GEA, su mor-bi-mortalidad continua siendo importante en países en desarrollo. Nuestra revisión sistemática de la literatura y consenso de opinión entre médicos ibero latinoamericanos ha generado el presente documento en el cual, una vez establecidas las recomendaciones basadas en la evidencia, se enviaron para su análisis a cada uno de los expertos regionales de Latino América (LA), España y Portugal para recoger los comentarios basados en su experiencia. Por último se recogieron las observaciones de estos mediante una encuesta y se armonizaron dichas opiniones para constituir el documento final.
Nuestra revisión de la literatura y recomendaciones tienen un ámbito más limitado que la revisión del ESPGHAN/ ESPID 2008, al centrarse la nuestra exclusivamente en el área terapéutica de la GEA en niños menores de 5 años. Debemos señalar que a pesar de las similitudes en las recomendaciones, hemos utilizado la calificación de OXFORD para la evaluación de las publicaciones y generar el grado de recomendación, por lo cual estos grados de recomendación no coinciden en algunos casos con los obtenidos en la revisión de la ESPGHAN/ESPID cuyos expertos utilizaron el método del grupo de trabajo «GRADE» (Grading of Recommendations Assessment, Development and Evaluation).
La ESPGHAN/ESPID reconoce diferencias en el manejo de la diarrea aguda entre Europa y países no desarrollados. Realizamos búsquedas en bases de datos latinoamericanas para, identificar los artículos originales y locales que puediesen arrojar luz sobre las posibles diferencias entre países desarrollados y no desarrollados. Desafortunadamente, existen escasos estudios generados en Latinoamérica. Además, al analizar las publicaciones por su calidad encontramos deficiencias que no nos permitieron incluirlos en nuestra revisión. Por lo cual nos hemos visto en la necesidad de utilizar los estudios generados en América del Norte, Europa y particularmente en Asia donde se concentra la mayoría de investigación en el área (por ejemplo: de 18 estudios en uso de zinc, sólo dos se llevaron a cabo en LA). Nuestra visión de la medicina basada en la evidencia no varía, pero sí su adaptación a condiciones especificas de aplicabilidad, en las cuales debemos reconocer diferencias en las posibilidades reales de aplicabilidad de las medidas que han probado su eficacia.
Otro punto en el cual encontramos difi cultades logísticas es la obtención de opiniones de personal sanitario diferente de los médicos participantes, debido a la logística envuelta en este tipo de encuesta de opinión entre un número elevado de participantes. A pesar de la carencias de estudios LA, debemos reconocer que los trabajos locales llevados a cabo en países asiáticos son los que pueden representar la aproximación más cercana a las condiciones de países LA.
Los siguientes puntos merecen consideración especial ya que han sido identificados en común (por los médicos de LA y expertos consultados) como obstáculos mayores para implementar estas recomendaciones en LA e incluyen:
- •
La reducida disponibilidad de recursos educativos y/o campañas de salud pública constante y continua, en el ámbito geográfico donde se identifican las poblaciones que presentan un mayor riesgo de GEA como lo son las áreas rurales o distantes, donde no se encuentran centros de atención primaria cercanos a los pacientes o en áreas urbanas de bajos recursos.
- •
La escasez de campañas educativas entre el personal de salud, ciudadanos (tanto padres como niños) y por supuesto, de infraestructuras físicas (acueducto-alcantarillado y centros asistenciales) para la atención a los pacientes.
- •
La falta de producción de materiales educativos acordes con el nivel educativo al cual van dirigidos (dibujos, caricaturas, videos, etc.).
- •
La carencia de educación médica continúa, lo que deriva en que el personal sanitario puede continuar prácticas no recomendadas. El cambio cultural debe empezar en el consultorio y de esta manera, extenderse a escuelas y hogares.
- •
La libre prescripción (sin receta) por parte de las farmacias. En muchas instancias el primer contacto entre el paciente y el servicio sanitario se realiza en la farmacia, recomendando la utilización de medicaciones sin beneficios y, en algunos casos, contraindicadas para el manejo de la GEA de orígenes virales (antibióticos y antiparasitarios).
Deseamos destacar algunos estudios que consideramos importantes y pueden causar un impacto significativo en la generación de guías y consensos de práctica clínica en el futuro, a pesar de no estar dentro del ámbito de nuestra revisión (debido al tiempo de publicación): los trabajos publicados por Friedman et al (2004 y 2008) apuntan y dan parámetros válidos para la evaluación de la deshidratación y establecer un grado de deshidratación (leve, moderado y severa) utilizando unos parámetros clínicos limitados y comunes (agregado de apariencia general alterada, ojos hundidos, membranas mucosas secas y ausencia de lágrimas). El confirmar la utilidad de estos parámetros puede ayudar a estandarizar y mejorar el proceso diagnóstico y de tratamiento en niños con GEA, por lo que esperamos se realicen trabajos encaminados a validar estas observaciones en otros ámbitos de atención y condiciones socioculturales. Las principales diferencias con respecto a las recomendaciones del ESPGHAN/ESPID las encontramos con respecto a la utilización de antieméticos, a pesar de contar con tres revisiones recientes en el uso de antieméticos con diferentes conclusiones y partiéndose de la base que el uso regular de antieméticos no está recomendado, al parecer la evidencia se decanta a favor del uso de ondansetron en el trabajo de DeCamp's (2008) en salas de urgencias en niños deshidratados con gastroenteritis y vómito. El estudio encontró una disminución en el uso de rehidratación intravenosa y las hospitalizaciones en niños con vómitos y GEA atendidos en salas de urgencias. Debemos señalar no existe evidencia del uso de ondasentrón en ámbitos ambulatorios y oficinas privadas, por lo cual se insiste en un uso exclusivo del ondansentrón en pacientes hospitalarios y en salas de emergencia. Otra diferencia adicional la encontramos con respecto al uso del zinc; respaldamos y seguimos la recomendación del uso de zinc en niños con GEA formuladas por la OMS, sin embargo por lo menos una revisión Cochrane 2007, apuntan a diferencias en respuesta según la edad, ya que no encontró beneficios en el uso del zinc en niños menores de 6 meses de edad. Por lo cual estudios adicionales en ámbitos socio-económicos específicos y en edades específicas son requeridos para corroborar estos hallazgos y poder recomendar o no su uso definitivamente en menores de 6 meses.
Finalmente, deseamos destacar los siguientes puntos en común: el reconocer que la piedra angular del tratamiento de la GEA es la RO. Los beneficios obtenidos con los SRO-BO y el SRO-OR hacen que sean considerados de elección en las GEA. El manejo nutricional de los niños con GEA debe luchar contra una de las costumbres más arraigadas en nuestras comunidades, el ayuno, el cual es totalmente inadecuado al privar a los niños de ingestas calóricas habituales (las cuales ya pueden ser pobres en algunos casos) durante la GEA y el período de recuperación del niño. En cuanto al uso de zinc, es recomendado como adyuvante en la GEA en particular en niños >6 meses en zonas donde puedan existir deficiencias nutricionales del mismo (en general países en desarrollo). En relación a la utilización de terapias farmacológicas, el uso indiscriminado de antieméticos, antibióticos y antiparasitarios está claramente contraindicado. Sin embargo, existe evidencia que el ondasentrón puede ser de uso en niños deshidratados que fracasan con la RO dentro de un ámbito intrahospitalario (salas de emergencias). Tanto Lactobacillus GG como Saccharomyces boulardii han demostrado beneficios como adyuvantes en el tratamiento de la GEA en niños. Además, racecadotrilo y esmectita pueden ser considerados en el tratamiento de la GEA en niños menores de 5 años.
ConclusionesEsta revisión sistemática ha permitido generar unas recomendaciones sobre el tratamiento de la GEA en niños menores de 5 años focalizada en los países de LA, pero por otra parte, ha evidenciado la necesidad de realizar estudios sobre GEA en niños en LA no sólo en relación al tratamiento, sino también estudios epidemiológicos y de coste-beneficio que permitan seleccionar las medidas más adecuadas en situaciones donde se requieran los máximos impactos sanitarios con recursos limitados. Además, deseamos realizar un llamado especial al personal sanitario e instituciones de salud con respecto al uso de campañas y material educativo constante entre la población (en especial en edad reproductiva) para incrementar los niveles de reconocimiento y cuidados básicos de los niños con GEA con el objeto de limitar la atención tardía de estos niños y las complicaciones potenciales que se puedan producir.
Expertos participantesDr. Acosta Bastidas, Mario A. (México); Dr. Amil Dias, Jorge (Portugal); Dr. Batista de Morais, Mauro (Brasil); Dr. Bejarano, Roderick (Panamá); Dr. Ceresa O’Brien, Sergio (Chile), Dra. Cruchet, Silvia (Chile); Dra. Chea, Elsa (Perú); Dr. Fernandez, Marlon (Honduras); Dra. Furnes, Raquel (Argentina); Dra. Guzman, Celina (Costa Rica); Dr. Jaén, Domingo (Venezuela); Dra. Jasinski, Clara (Uruguay); Dr. Maruy, Aldo (Perú); Dra. Materán, Mercedes de (Venezuela); Dra. Matos Imbert, Angela M. (R. Dominicana); Dra. Montijo Barrios, Erika (México); Dr. Naranjo, Alfredo (Ecuador); Dr. Palacios, Jorge (Guatemala); Dr. Ramírez Mayans, Jaime A (México).; Dr. Ribeiro, Hugo (Brasil); Dra. Román, Enriqueta (España); Dra. Salvador de Avila, Alexandra (Ecuador); Dra. Consuelo Sánchez, Alejandra (México); Dr. Velasco, Carlos. A (Colombia); Dra. Sdepanian, Vera (Brasil), Dr. Vieira, Mario C.(Brasil) y Dr. Zablah, Roberto (El Salvador); Dra. Zacur de Jimenez, Mabel (Paraguay).