Se presentan las recomendaciones de la Conferencia de Consenso «Manejo diagnóstico y terapéutico de la bronquiolitis aguda». Se resume la evidencia sobre frecuencia de bronquiolitis en población general y grupos de riesgo, factores y marcadores de riesgo de formas graves, escalas de gravedad y perfil clínico-etiológico. Las pruebas diagnósticas habitualmente empleadas apenas resultan útiles en el manejo de la enfermedad; solo se considera necesaria la medición de la saturación de oxígeno en la valoración inicial o en el control de cambios en los pacientes con compromiso respiratorio. Otras pruebas como la radiografía de tórax, las pruebas de diagnóstico rápido de infección por virus respiratorios y las pruebas de cribado de infección bacteriana solo deben emplearse de forma muy selectiva. Existe evidencia suficiente sobre la falta de eficacia de la mayoría de las intervenciones ensayadas en la bronquiolitis. Al margen de la oxigenoterapia, la fluidoterapia, la aspiración de secreciones y la asistencia respiratoria, pocas opciones terapéuticas resultarán beneficiosas. Solo en los casos moderado-graves estaría justificado el ensayo con broncodilatadores inhalados (salbutamol o adrenalina) con o sin suero salino hipertónico. En casos con fracaso respiratorio podría emplearse heliox y técnicas de ventilación no invasiva, en pacientes con apneas valorar el uso de metilxantinas y en pacientes graves intubados el uso de surfactante. Ningún tratamiento se ha mostrado eficaz para evitar la persistencia o recurrencia de síntomas postbronquiolitis. En cuanto a la prevención de bronquiolitis, solo palivizumab reduce discretamente el riesgo de ingreso por infecciones respiratorias bajas por virus respiratorio sincitial, aunque por su elevado coste solo se justifica su uso en un reducido grupo de pacientes de alto riesgo.
The recommendations of the Consensus Conference “Diagnostic and Therapeutic Management of Acute Bronchiolitis” are presented. Evidence on the frequency of bronchiolitis in the general population and risk groups, risk factors and markers of severe forms, severity scores and the clinical-etiological profile is summarized. The commonly used diagnostic tests are ineffective in the management of the disease; oxygen saturation measurement is considered necessary only in the initial assessment or to monitor changes in patients with respiratory distress. Other tests such as chest radiograph, rapid diagnostic tests for respiratory virus infection and screening tests for bacterial infection should be used only very selectively. There is sufficient evidence on the lack of effectiveness of most interventions tested in bronchiolitis. Apart from oxygen therapy, fluid therapy, aspiration of secretions and ventilation support, few treatment options will be beneficial. Only in moderate-severe bronchiolitis would it be justified to test a treatment with inhaled bronchodilators (salbutamol or epinephrine) with or without hypertonic saline solution. Heliox and non-invasive ventilation techniques could be used in cases with respiratory failure, methylxanthine in patients with apnea and surfactant in intubated critically ill patients. No treatment has proved effective in preventing persistence or recurrence of post-bronchiolitis symptoms. As for prevention of bronchiolitis, only palivizumab slightly reduces the risk of admissions for lower respiratory infections by respiratory syncytial virus, although its high cost justifies its use only in a small group of high-risk patients.
La bronquiolitis aguda (BA) es una enfermedad muy frecuente en la infancia que origina una gran demanda asistencial en atención primaria y en los servicios de urgencias, siendo la principal causa de ingreso por infección respiratoria aguda (IRA) de vías bajas en el niño menor de 2 años. El virus respiratorio sincitial (VRS) es el agente causal dominante, aunque otros virus están también implicados. En nuestro medio, la mayoría de las infecciones por VRS tienen lugar en las épocas epidémicas (final de otoño e invierno), quedando expuestos a este virus la mayoría de los lactantes en al menos una ocasión.
La definición más aceptada de BA es la de McConnochie1, que considera bronquiolitis el primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con/sin fiebre), que afecta a niños menores de 2 años, aunque preferentemente se da en el primer año de vida. Pero no todos los autores están de acuerdo con esta definición y aún no se ha llegado a un consenso acerca de los criterios necesarios para hacer el diagnóstico, especialmente los de edad o número de episodios. Algunos definen la bronquiolitis como un cuadro agudo de sibilancias que afecta a un niño previamente sano y que acompaña a una enfermedad viral respiratoria aguda, sin precisar si es un primer episodio o son episodios de repetición. Otras definiciones consideran más importante la aparición de taquipnea, hiperinsuflación y crepitantes en el curso de la enfermedad.
Desde el punto de vista práctico, el principal problema que plantea la BA es la falta de consenso y homogeneidad en su manejo diagnóstico-terapéutico. Aunque existen algunos protocolos o guías de práctica clínica (GPC), estos presentan diferencias en la evaluación de la evidencia disponible y en sus recomendaciones. Salvo las medidas generales como la aspiración de secreciones y el mantenimiento de la hidratación, ninguna otra intervención es aceptada de forma generalizada; de hecho, tratamientos ampliamente utilizados, como los broncodilatadores inhalados, solo se recomiendan de forma tentativa, valorando individualmente la respuesta y tolerancia a los mismos. Por otro lado, se ha podido comprobar que incluso las recomendaciones que mayor grado de evidencia tienen son escasamente seguidas en la práctica clínica.
Considerando lo anteriormente expuesto, parece importante estudiar cómo se diagnostican y tratan las BA en nuestro medio, evaluando su variabilidad e idoneidad. Para ello llevamos a cabo el proyecto titulado «Variabilidad e idoneidad del manejo diagnóstico y terapéutico de la bronquiolitis aguda». El estudio adquiere el acrónimo «aBREVIADo»: BRonquiolitis —Estudio de Variabilidad, Idoneidad y ADecuación. El proyecto tiene dos objetivos:
- 1.
Describir la variabilidad en el manejo diagnóstico y terapéutico de la BA, en cuanto: criterios diagnósticos, exploraciones complementarias indicadas en fase aguda y diferidas, elección de tratamientos (en fase aguda, de rescate y mantenimiento), elección de modalidades de tratamiento preventivo y criterios de derivación e ingreso hospitalario
- 2.
Evaluar la idoneidad en el manejo diagnóstico-terapéutico de dichos pacientes con bronquiolitis, tras elaborar específicamente unos patrones de referencia de uso apropiado de los mismos.
En este documento se presentan los resultados de la Conferencia de Consenso que forma parte del estudio de idoneidad, en la que se establecieron recomendaciones sobre el manejo diagnóstico y terapéutico de la BA.
Para describir la variabilidad en el manejo de la BA se han recogido una muestra de casos pediátricos menores de 2 años diagnosticados de bronquiolitis, atendidos en las consultas, servicios de urgencias y hospitalización de una muestra de centros de salud y hospitales españoles durante el periodo epidémico octubre de 2007–marzo de 2008 y con representatividad de 91 centros sanitarios de 25 provincias de España distribuidas en 12 comunidades autónomas. Las principales características se han publicado recientemente en Anales de Pediatría.2.
Para evaluar la idoneidad debíamos definir el «patrón oro» de manejo diagnóstico y terapéutico de la BA. Para establecer este «patrón oro», se han llevado a cabo los siguientes pasos:
- 1.
Creación de un grupo de trabajo para la realización de una revisión bibliográfica profunda, sistemática y crítica sobre BA procedentes de fuentes bibliográficas primarias, secundarias y terciarias de carácter internacional (Medline, Embase, Cochrane Library) y nacional (Índice Médico Español). En la tabla 1 se detallan las estrategias de búsqueda empleadas. No se emplearon restricciones de idioma. No se realizaron restricciones de tiempo para los ensayos clínicos, revisiones sistemáticas (RS) y GPC. La búsqueda primaria de estudios observacionales se limitó a la última década en las bases de datos de Medline y Embase, pero no en Cochrane Library ni Índice Médico Español. Las búsquedas bibliográfica iniciales se realizaron entre marzo de 2008 y junio de 2008. Posteriormente se mantuvo una alerta bibliográfica con incorporación de citas de interés hasta mayo de 2009.
Tabla 1.Estrategia de búsqueda bibliográfica sobre bronquiolitis aguda
Click Here To View StripinFuente de información Citas Nuevas Medline (PubMed). Marzo 2008 Términos genéricos ([«Bronchiolitis, Viral»{Mesh} OR bronchiolitis {tw}] NOT Animal) OR ([«Respiratory Tract Infections»{Mesh}AND «Respiratory Syncytial Viruses»{Mesh}]) OR ([«Pneumovirus Infections»{Mesh} OR «Adenoviridae Infections» {Mesh} OR «Paramyxoviridae»{Mesh}OR «Virus Diseases» {Mesh}] AND [Bronchopneumonia {tw}OR acute bronchitis {tw}OR lower respiratory tract* {tw}]) 1.762 1.762 Limits: All Infant: birth-23 months, All Child: 0–18 years Publication Date from 2000/01/01 to 2008/02/29 («Respiratory Syncytial Virus Infections/epidemiology» [Mesh] OR «Respiratory Syncytial Virus Infections/prevention and control» [Mesh] OR palivizumab[tw]) 676+359 Limits: Publication Date from 2000/01/01 to 2008/02/29, Humans, All Infant: birth-23 months, All Child: 0–18 years Revisión manual de citas recientes no indexadas (bronchiolitis [tw]) 35+35 Filtros de etiología ([relative {Title/Abstract} AND risk* {Title/Abstract}] OR [relative risk {Text Word}] OR risks [Text Word] OR cohort studies [MeSH:noexp] OR [cohort {Title/Abstract} AND stud* {Title/Abstract}]) 189 Filtros de diagnóstico (sensitivity and specificity [MeSH] OR diagnosis [MeSH] OR diagnosis [Subheading:noexp] OR «Radiography, Thoracic» [Mesh] OR «Laboratory Techniques and Procedures» [Mesh]) 923 Filtros de tratamiento ([clinical {Title/Abstract} AND trial {Title/Abstract}] OR clinical trials [MeSH Terms] OR clinical trial [Publication Type] OR random* [Title/Abstract] OR random allocation [MeSH Terms] OR therapeutic use [MeSH Subheading] OR «Steroids» [Mesh] OR «Bronchodilator Agents» [Mesh] OR «Anti-Infective Agents»[Mesh] OR «Antiviral Agents» [Mesh] OR «Anti-Bacterial Agents» [Mesh]) 709 Filtros de metanálisis (systematic [sb] OR «Meta-Analysis» [Publication Type]) 74 Filtros de guías de práctica clínica («Guideline» [Publication Type]) 3 Filtros de pronóstico (incidence [MeSH:noexp] OR mortality [MeSH Terms] OR follow up studies [MeSH:noexp] OR cohort [Title/Abstract] OR prognos* [Text Word] OR predict* [Text Word]) 509 Filtros de profilaxis: («Primary Prevention» [Mesh] OR «Immunoglobulins» [Mesh] OR “Infection Control» [Mesh]) 211 Filtro de costes («Costs and Cost Analysis» [Mesh]) 42 Citas de las guías de práctica clínica AAP y SIGN Revisión manual de citas 197+124 Índice Médico Español; fecha 16-3-08 (Bronquiolitis OR Palivizumab) 244+49 Cochrane Library plus; Fecha 2-6-08 (Bronquiolitis OR Palivizumab OR respiratory sincitial virus) 284+134 Revisiones completas (11/39) Registro de Ensayos Clínicos Íberoamericanos (1/1) CENTRAL (256/336) Health Technology Assessment Database (HTA) (6/6) NHS EED abstracts (7/7) NHS EED bibliographic details only (14/15) Systematic reviews published elsewhere (8/8) EMBASE; fecha 10-6-08 ♯1 ‘bronchiolitis’/exp/mj AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 526 ♯3 ‘viral bronchiolitis’/exp/mj AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 46 ♯4 ‘palivizumab’/exp/mj AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 143 ♯5 ‘respiratory syncytial pneumovirus’/exp/mj AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 522 ♯6 ‘prevention and control’/exp AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 21.019 ♯7 ♯5 AND ♯6 125 ♯8 ‘respiratory tract infection’/exp/mj AND [humans]/lim AND ([newborn]/lim OR [infant]/lim OR [preschool]/lim OR [school]/lim OR [child]/lim) AND [embase]/lim AND [2000–2008]/py 4.128 ♯9 ♯5 AND ♯8 209 ♯10 ‘bronchiolitis obliterans’/exp 729 ♯11 ♯1 NOT ♯10 504 ♯12 ♯3 OR ♯9 OR ♯11 680+161 ♯13 ♯4 OR ♯7 214+35 Trabajos identificados a partir de las referencias bibliográficas de artículos +135 Totales Citas bibliográficas identificadas 2.794 Artículos seleccionados y revisados 953 Las búsquedas previas se completaron con las citas de las principales guías de GPC existentes (guías de la Academia Americana de Pediatría y de la Scottish Intercollegiate Guidelines Network, publicadas en el año 2006). Se llevó a cabo una revisión manual de resúmenes por parte de dos miembros del grupo revisor, para la selección de trabajos relevantes, que debían ser recuperados e incorporados a tablas de evidencia. Las discordancias de criterio se resolvieron por consenso. Finalmente, se revisaron las referencias bibliográficas de todos los artículos seleccionados para recuperar otros trabajos previamente no identificados. El total de citas bibliográficas identificadas fue de 2.794, de las que 953 se recuperaron y revisaron para el análisis de la evidencia.
- 2.
Síntesis de la evidencia: todos los trabajos revisados se valoraron críticamente y se resumieron en tablas de evidencia, siguiendo una metodología explícita. En cada tabla de evidencia se detallaron los siguientes apartados: objetivo del estudio, autor y año de publicación, país de estudio, diseño y calidad del estudio (se han confeccionado ad-hoc cinco criterios de calidad para cada tipo de estudio; tabla 2), muestra de estudio e intervención, medidas de efecto y variables evaluadas, resultados (medidas de frecuencia, de efecto, de validez y de impacto), limitaciones, importancia clínica y conflictos de interés. En el supuesto específico de las tablas de evidencia sobre evaluación económica, los epígrafes de las tablas de evidencia eran algo diferentes: autor, año, país, diseño, calidad, pacientes diana, perspectiva, horizonte temporal, tasa de descuento, año de referencia, datos de efectividad, análisis de sensibilidad, resultados, limitaciones, origen de los datos, importancia clínica y conflictos de intereses.
Tabla 2.Criterios de calidad valorados en cada tipo de estudio
Ensayos clínicos - a)
Definición clara de la población de estudio, intervención y resultado de interés
- b)
Aleatorización adecuada
- c)
Control de sesgos (enmascaramiento)
- d)
Seguimiento completo (menos del 20% de pérdidas)
- e)
Análisis correcto (análisis por intención de tratar y control de covariables no equilibradas con la aleatorización)
Estudios de valoración de pruebas diagnósticas - a)
Comparación con un patrón de referencia válido
- b)
Muestra representativa
- c)
Descripción completa de los métodos de realización de la prueba diagnóstica
- d)
Control de sesgos (comparación ciega e independiente; control de sesgos de incorporación, verificación diagnóstica y revisión)
- e)
Análisis correcto (datos que permitan calcular indicadores de validez)
Estudios de cohortes - a)
Cohortes representativas de la población con y sin exposición, libres del efecto o enfermedad de interés
- b)
Medición independiente, ciega y válida de exposición y efecto
- c)
Seguimiento suficiente (igual o superior al 80%), completo y no diferencial
- d)
Control de la relación temporal de los acontecimientos (exposición-efecto) y de la relación entre nivel de exposición y grado de efecto (dosis-respuesta)
- e)
Análisis correcto (control de factores de confusión y modificadores de efecto)
Estudios de casos y controles - a)
Grupo de casos representativo de la población de casos (criterios de inclusión)
- b)
Grupo control representativo del nivel de exposición en la población de la que proceden los casos, sin la enfermedad/efecto de interés, pero en riesgo de tenerlo
- c)
Medición independiente y ciega de la exposición (enmascarada u objetiva)
- d)
Control de la relación temporal de los acontecimientos (exposición-efecto) y de la relación entre nivel de exposición y grado de efecto (dosis-respuesta)
- e)
Análisis correcto (control de factores de confusión y modificadores de efecto)
Estudios de evaluación económica - a)
Pregunta bien definida: intervenciones o programas evaluados (uno o varios), medidas de resultados consideradas en términos de costes y efectos (coste-efectividad, coste-utilidad, coste-beneficio o minimización de costes) y perspectiva (paciente, hospital, proveedor sanitario o sociedad)
- b)
Análisis basado en estimaciones de efectividad válidas
- c)
Análisis basado en estimaciones de costes válidas
- d)
Consideración de todas las alternativas, resultados y costes importantes
- e)
Análisis correcto: ajustes temporales de los costes (tasa de descuento), análisis incremental y de sensibilidad (asunciones del modelo)
Revisiones sistemáticas - a)
Objetivos de la revisión bien definidos (población, intervención o factor de estudio, factor de comparación, medida de resultado)
- b)
Búsqueda bibliográfica exhaustiva (estrategias y fuentes de datos)
- c)
Adecuados criterios de inclusión y exclusión de estudios
- d)
Correcta evaluación de la validez de los estudios incluidos
- e)
Análisis correcto de los resultados (evaluación de la heterogeneidad, correcta combinación de resultados)
Estudios transversales y series de casos (sin valoración de pruebas diagnósticas): - a)
Población de estudio (población diana, población de estudio) y factor de exposición o efecto (enfermedad) objeto de estudio bien definidos
- b)
Muestra de estudio representativa de la población de estudio (procedimientos de selección, criterios de inclusión y exclusión, tamaño muestral). Validez externa
- c)
Medición independiente y ciega del factor de exposición o efecto en estudio (instrumentos válidos, homogéneos y objetivos). Validez interna
- d)
Presentación completa de los resultados (control de valores perdidos o fuera de rango)
- e)
Análisis correcto de los resultados (estimaciones adaptadas al tipo de muestreo; control de sesgos)
Para cada tipo de estudio se han establecido cinco criterios, confeccionados ad-hoc para esta Conferencia de Consenso. En función del cumplimiento de dichos criterios se ha asignado a cada rabajo una puntuación relativa, indicando junto a la puntuación las claves de los criterios que cumple. Ejemplo: puntuación 3/5 (a, b, d): cumple tres de los cinco criterios, en concreto los criterios a, b y d.
A partir de la información contenida en cada tabla de evidencia se elaboraron tablas simplificadas con una presentación agrupada y comparativa de los principales resultados de todos los estudios relacionados.
Asimismo se realizó un resumen textual de la evidencia disponible, considerando los aspectos a valorar en la jerarquización de los niveles de evidencia y los grados de recomendación (tablas resumen):
- ○
Volumen de la evidencia (número de estudios, calidad de los estudios, tamaños muestrales, sesgos de publicación).
- ○
Análisis PECOT: pacientes, exposición, comparación, outcome (resultado) o medidas principales y tiempo.
- ○
Intensidad del efecto o fuerza de la asociación. Interés o importancia clínica.
- ○
Consistencia entre estudios.
- ○
Precisión de las estimaciones.
- ○
Estimación de sesgos, factores de confusión o modificadores de efecto.
- ○
Grado de relación con la pregunta clínica: relación directa o indirecta.
- ○
Validez externa y aplicabilidad de la evidencia.
- ○
Balance riesgo-beneficio-coste.
- ○
Valoración de la utilidad y de las preferencias de los pacientes.
- ○
Estimación del impacto de futuros nuevos estudios sobre la evidencia actual.
Las tablas de evidencia, tablas simplificadas y tablas resumen se agruparon por áreas de interés. Para cada área se elaboró un documento de revisión, con una breve introducción y justificación, un apartado con las «bases para la toma de decisiones» y un conjunto de preguntas clínicas relacionadas que debían contestarse en la Conferencia de Consenso.
Se realizaron los siguientes documentos:
- ○
Epidemiología de la BA. Riesgo de bronquiolitis. Factores de riesgo.
- ○
Perfil etiológico y patrones clínicos asociados en la BA.
- ○
Validez de las pruebas de diagnóstico rápido de infección por el VRS.
- ○
Pruebas diagnósticas en la BA: radiografía de tórax, pulsioximetría y pruebas de cribado de infección bacteriana.
- ○
Factores pronósticos de gravedad en la BA.
- ○
Escalas de valoración de síntomas o gravedad en la BA.
- ○
Riesgo de asma postbronquiolitis.
- ○
Tratamiento de la BA.
- ○
Prevención primaria y secundaria en la BA.
- ○
Evaluación económica en la BA.
(Estos documentos se publicarán de forma explícita en posteriores números de Anales de Pediatría, en una serie de artículos sobre cada apartado de la Conferencia de Consenso).
- a)
- 3.
Realización de una Conferencia de Consenso, siguiendo las directrices los National Institutes of Health americanos3: revisión en profundidad de la literatura con metodología explícita por un grupo de trabajo, formación de un panel de expertos no gubernamental, planteamiento al panel de una serie de preguntas clínicas y elaboración de un documento de consenso con recomendaciones para la buena práctica clínica y jerarquización del grado de evidencia que sustenta cada recomendación.
- 4.
La constitución del panel de expertos ha seguido los siguientes criterios:
- ○
Ser profesionales con amplia experiencia en clínica e investigación sobre bronquiolitis y prestigio en el ámbito de su especialidad.
- ○
Proporcionar un carácter multidisciplinar al panel.
- ○
Procurar una representación regional equilibrada.
Se ha incorporado al panel los siguientes expertos de cada una de las siguientes áreas:
- ○
Atención primaria (2)
- ○
Urgencias pediátricas (2)
- ○
Infectología pediátrica (1)
- ○
Inmunología clínica y alergia pediátrica (1)
- ○
Neumología pediátrica (1)
- ○
Neonatología (1)
- ○
Cardiología pediátrica (1)
- ○
Cuidados intensivos pediátricos (1)
(La elección de dos panelistas en el área de atención primaria y urgencias pediátricas se fundamenta al considerar que son los ámbitos de trabajo más frecuentemente vinculados a la atención sanitaria del lactante con BA).
- ○
Consideramos que nuestras recomendaciones debían basarse en una evaluación rigurosa de los resultados y por ello ser explícitas acerca de cada argumentación que conduzcan a una determinada recomendación. Para ponderar la relevancia y aplicabilidad se considerarán medidas de efecto, impacto y validez con traducción clínica. Se propone un sistema de jerarquización de los niveles de evidencia basado en cuatro niveles con criterios relacionados con el volumen, tipo de diseño y calidad de los estudios disponibles. Estos criterios se han adaptado de otros sistemas de jerarquización propuestos4–8. Se ha elaborado una clasificación para cada objeto de estudio, tal como se indica en la tabla 3.
Niveles de evidencia científica para los diferentes tipos de estudios
| Eficacia de una intervención |
|
| Validez de una prueba diagnóstica |
|
| Validez de un factor pronóstico o de riesgo: |
|
| Validez de estimaciones de evaluación económica |
|
Partiendo del nivel asignado en el sistema de clasificación previo se propone un ajuste del nivel inicial siguiendo las recomendaciones de la propuesta GRADE9–12:
Disminuir el nivel de evidencia si:
- •
Existen limitaciones importantes en la calidad de los estudios.
- •
Existen inconsistencias importantes entre estudios.
- •
Existen dudas sobre si la evidencia es directa o indirecta.
- •
La información disponible es imprecisa o escasa.
- •
Es muy probable que los resultados tengan sesgos importantes.
Aumentar el nivel de evidencia si:
- •
Existen pruebas de una asociación muy fuerte (riesgo relativo >5 o<0,2) basadas en evidencia directa, sin amenazas importantes para la validez.
- •
Existen pruebas válidas de un gradiente dosis-respuesta.
- •
Se ha realizado un ajuste correcto de todos los factores de confusión posibles.
Se propone un sistema simplificado de graduación de las recomendaciones, adaptado de propuestas previas2–6 (tabla 4). Además del volumen y calidad de la evidencia, a la hora de asignar el grado de recomendación se deben tener en cuenta otros criterios9–12:
- •
La coherencia entre estudios.
- •
La posible influencia de factores de confusión o modificadores de efecto.
- •
La precisión de las estimaciones.
- •
La intensidad del efecto o fuerza de la asociación.
- •
El grado de relación con la pregunta clínica: relación directa o indirecta.
- •
La aplicabilidad de la evidencia (efectividad y riesgo basal en la práctica clínica).
- •
El balance entre beneficios y riesgos o costes.
- •
La utilidad sobre los pacientes y sus preferencias.
- •
El potencial impacto de futuros estudios sobre la evidencia actual.
Graduación de las recomendaciones
| Recomendación basada en una evidencia científica bien demostrada (Nivel de evidencia I; recomendación grado A) |
| Recomendación sugerida por una evidencia científica (Nivel de evidencia II; recomendación grado B) |
| Recomendación basada en experiencia clínica (Niveles de evidencia III; recomendación grado C) |
| Recomendación basada en opinión de expertos (Niveles de evidencia IV; recomendación grado D) |
Para los procedimientos diagnósticos y terapéuticos en los que se consideró necesario se establecieron las siguientes categorías (tabla 5):
- 1.
Opciones de primera elección (indicación rutinaria).
- 2.
Opciones de uso alternativo (indicación selectiva u opcional).
- 3.
Opciones inapropiadas o no recomendadas (innecesarias).
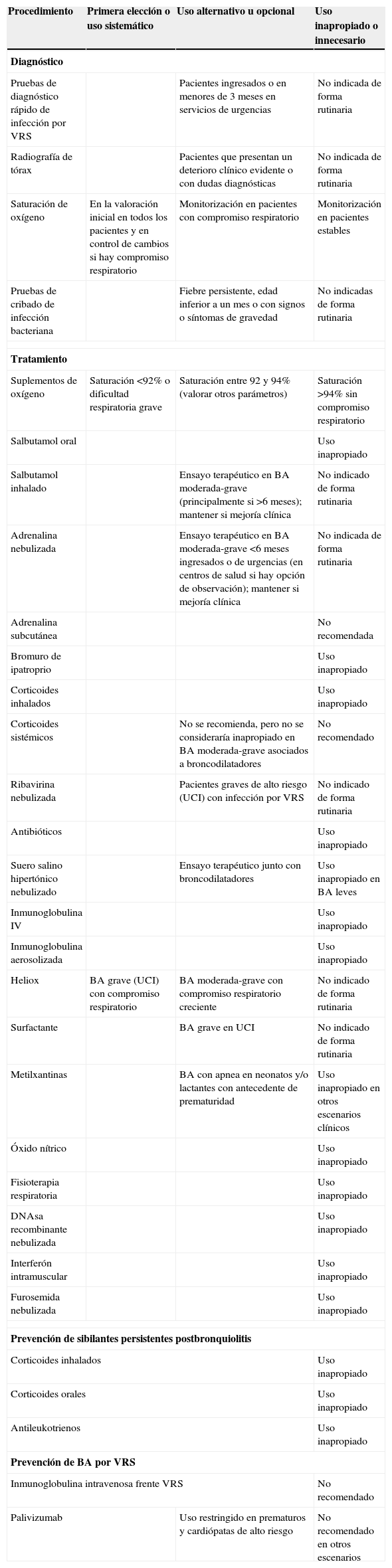
Clasificación de la idoneidad de procedimientos diagnósticos y terapéuticos en BA
| Procedimiento | Primera elección o uso sistemático | Uso alternativo u opcional | Uso inapropiado o innecesario |
| Diagnóstico | |||
| Pruebas de diagnóstico rápido de infección por VRS | Pacientes ingresados o en menores de 3 meses en servicios de urgencias | No indicada de forma rutinaria | |
| Radiografía de tórax | Pacientes que presentan un deterioro clínico evidente o con dudas diagnósticas | No indicada de forma rutinaria | |
| Saturación de oxígeno | En la valoración inicial en todos los pacientes y en control de cambios si hay compromiso respiratorio | Monitorización en pacientes con compromiso respiratorio | Monitorización en pacientes estables |
| Pruebas de cribado de infección bacteriana | Fiebre persistente, edad inferior a un mes o con signos o síntomas de gravedad | No indicadas de forma rutinaria | |
| Tratamiento | |||
| Suplementos de oxígeno | Saturación <92% o dificultad respiratoria grave | Saturación entre 92 y 94% (valorar otros parámetros) | Saturación >94% sin compromiso respiratorio |
| Salbutamol oral | Uso inapropiado | ||
| Salbutamol inhalado | Ensayo terapéutico en BA moderada-grave (principalmente si >6 meses); mantener si mejoría clínica | No indicado de forma rutinaria | |
| Adrenalina nebulizada | Ensayo terapéutico en BA moderada-grave <6 meses ingresados o de urgencias (en centros de salud si hay opción de observación); mantener si mejoría clínica | No indicada de forma rutinaria | |
| Adrenalina subcutánea | No recomendada | ||
| Bromuro de ipatroprio | Uso inapropiado | ||
| Corticoides inhalados | Uso inapropiado | ||
| Corticoides sistémicos | No se recomienda, pero no se consideraría inapropiado en BA moderada-grave asociados a broncodilatadores | No recomendado | |
| Ribavirina nebulizada | Pacientes graves de alto riesgo (UCI) con infección por VRS | No indicado de forma rutinaria | |
| Antibióticos | Uso inapropiado | ||
| Suero salino hipertónico nebulizado | Ensayo terapéutico junto con broncodilatadores | Uso inapropiado en BA leves | |
| Inmunoglobulina IV | Uso inapropiado | ||
| Inmunoglobulina aerosolizada | Uso inapropiado | ||
| Heliox | BA grave (UCI) con compromiso respiratorio | BA moderada-grave con compromiso respiratorio creciente | No indicado de forma rutinaria |
| Surfactante | BA grave en UCI | No indicado de forma rutinaria | |
| Metilxantinas | BA con apnea en neonatos y/o lactantes con antecedente de prematuridad | Uso inapropiado en otros escenarios clínicos | |
| Óxido nítrico | Uso inapropiado | ||
| Fisioterapia respiratoria | Uso inapropiado | ||
| DNAsa recombinante nebulizada | Uso inapropiado | ||
| Interferón intramuscular | Uso inapropiado | ||
| Furosemida nebulizada | Uso inapropiado | ||
| Prevención de sibilantes persistentes postbronquiolitis | |||
| Corticoides inhalados | Uso inapropiado | ||
| Corticoides orales | Uso inapropiado | ||
| Antileukotrienos | Uso inapropiado | ||
| Prevención de BA por VRS | |||
| Inmunoglobulina intravenosa frente VRS | No recomendado | ||
| Palivizumab | Uso restringido en prematuros y cardiópatas de alto riesgo | No recomendado en otros escenarios | |
A continuación se exponen las respuestas planteadas en la Conferencia de Consenso, con la argumentación del nivel de evidencia y del grado de recomendación y que concretamos de forma resumida en el anexo 3.
Marco conceptualEl ámbito clínico de las recomendaciones que se realizarán en esta Conferencia de Consenso se adapta a los criterios diagnósticos de BA de McConnochie1 (los más aceptados) y a los criterios de inclusión y exclusión del proyecto aBREVIADo. En ausencia de estudios que hayan validado los criterios diagnósticos aquí expresados, la definición de BA se basará en la opinión de expertos (nivel IV).
No obstante, las recomendaciones podrían ser aplicables a otros pacientes diagnosticados de BA que no cumplan dichos criterios, aunque el grado de confianza sobre la validez y aplicabilidad de las recomendaciones a dichos pacientes sería bajo.
Criterios diagnósticos de bronquiolitis de McConnochie: primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con/sin fiebre), que afecta a niños menores de 2 años.
Criterios de inclusión y exclusión del estudio aBREVIADo:
- •
Criterios de inclusión: pacientes menores de 2 años (<24 meses) diagnosticados de bronquiolitis, atendidos en las consultas, servicios de urgencias y hospitalización (plantas de pediatría y UCIP) de centros de salud y hospitales españoles.
- •
Criterios de exclusión: pacientes con antecedente de episodios previos de sibilantes (solo se aceptará el primer episodio de sibilantes). A efectos operativos se considerará episodio previo de sibilantes aquel cuya sintomatología haya desaparecido al menos 15 días antes del episodio actual.
Epidemiología. Riesgo de bronquiolitis. Factores de riesgo.
E.1.1. ¿Cuál es el riesgo de BA en nuestro medio?
Para población menor de 2 años la frecuencia (incidencia acumulada) de ingreso por BA se sitúa en un intervalo entre 1–3,5% y para las IRA de vías bajas por VRS entre 0,8%–2,5%. La frecuencia de ingreso publicada en nuestro país oscila para la BA entre 1,1–3,5% y para las IRA por VRS entre 1,4–2,5%. El nivel de evidencia de estas estimaciones se sustenta en estudios de cohortes prospectivos y retrospectivos con limitaciones (nivel II).
Las estimaciones de frecuencia de consultas y urgencias se basan en la revisión de bases de datos de sistemas sanitarios de Estados Unidos, situándose en un intervalo entre 4–20% para consultas y en el 2,6% (un solo estudio13) para urgencias. En España, los datos aportados por el panel indican una frecuencia de entre 1–2% de las consultas a urgencias. Al considerar estos estudios, menos del 10% de los casos de BA requerirían ingreso. Datos no publicados aportados por el panel de expertos, basados en encuestas validadas, estiman que la frecuencia de primeros episodios de sibilantes podría situarse entre 25–30% en nuestro medio. La estimación de frecuencia general de episodios de BA (sin ingreso) se sustenta en estudios descriptivos con limitaciones o dudas sobre su aplicabilidad a nuestro medio (nivel III).
Para población de riesgo, la frecuencia recogida en la mayoría de los estudios se refiere a ingresos por IRA por VRS, situándose para prematuros de 32 semanas de gestación (SG) entre 4,4–18%; en estos estudios las IRA por VRS suponían aproximadamente la mitad de los ingresos por problemas respiratorios. Los prematuros entre 33–35SG tienen una frecuencia de ingreso por IRA por VRS entre 5,7 y 7,9%. Los estudios referidos a población española sitúan la frecuencia de ingreso por BA en 10,6% para ≤32SG y 7,9% entre 33–35SG14. La estimación del grupo IRIS de frecuencia de ingreso por IRA por VRS para prematuros de ≤32SG es del 13,1% (20,7% para ingresos por problema respiratorio)15. Otro estudio nacional sobre muestras más pequeñas sitúan la frecuencia de ingreso por IRA por VRS en 4,4% para ≤32SG y 7,8% entre 33–35SG16. El nivel de evidencia de estas estimaciones se sustenta en estudios de cohortes prospectivos y retrospectivos con limitaciones (nivel II).
Para niños con displasia broncopulmonar, el intervalo de frecuencias es muy amplio, entre 7,3–42%, y para niños con enfermedad pulmonar crónica (EPC), entre 6–12%. A nivel nacional, contamos con una estimación de frecuencia de ingreso sobre una muestra pequeña de niños con displasia broncopulmonar del 42%14. Datos no publicados aportados por el panel de expertos sitúan este riesgo en el 25%. Para niños con cardiopatías congénitas, la frecuencia de ingreso por BA o IRA por VRS se sitúa entre 1,6–9,8% (entre 2–9,8% para cardiopatías hemodinámicamente significativas, complejas o con hiperaflujo); la única estimación publicada en España en niños sin inmunoprofilaxis se refiere a frecuencia de ingreso por BA en cardiópatas con hiperaflujo pulmonar, que se sitúa en el 9,8%14. Las estimaciones para otros grupos de riesgo son poco precisas. El nivel de evidencia se basa en estudios de muestras pequeñas con limitaciones e importante heterogeneidad (nivel III).
E.1.2. ¿Qué factores deben ser tenidos en cuenta para la estimación del riesgo de BA en nuestro medio?
Solo contamos con información suficiente sobre los factores de riesgo de ingreso por BA o IRA por VRS, por lo que no podemos diferenciar los factores asociados a formas graves de la enfermedad de los que influyen directamente en la decisión de ingreso (asociados o no a gravedad).
Los principales factores de riesgo de ingreso por BA o IRA por VRS son la displasia broncopulmonar, la enfermedad pulmonar crónica, las cardiopatías congénitas (fundamentalmente las complejas, hemodinámicamente inestables o con hiperaflujo pulmonar), la prematuridad (con una discreta tendencia inversa a la edad gestacional) y la edad inferior a 3–6 meses.
Otros factores de riesgo documentados son la presencia de hermanos mayores o asistencia a guardería, el sexo masculino, la exposición a tabaco (fundamentalmente durante la gestación), la lactancia materna durante menos de 1–2 meses y variables asociadas a bajo nivel socioeconómico. Asimismo, los antecedentes personales de eccema o sibilantes se han encontrado en algún estudio asociados a mayor riesgo de ingreso por IRA de vías bajas, aunque esta asociación ofrece dudas de su aplicabilidad al conjunto de BA; de hecho, los antecedentes familiares de atopia (eccema o asma) han mostrado resultados contradictorios a favor y en contra del riesgo de ingreso.
Otros factores mencionados por miembros del panel de expertos son las malformaciones congénitas, la inmunodeficiencia, el síndrome de Down, la fibrosis quística de páncreas y la humedad en domicilio.
La evidencia que sustenta los factores de riesgo se basa en estudios de cohortes con alguna limitación para los principales factores de riesgo (nivel II) y estudios de cohortes con varias limitaciones o de casos y controles para otros factores de riesgo (nivel III).
Grado de recomendación: B
Perfil etiológico de la bronquiolitis aguda y patrones clínicos asociados
E.2.1. ¿Cuál es el perfil etiológico habitual en la BA?
El VRS es el agente dominante de las BA, constituyendo algo más de la mitad de los casos ingresados por debajo de los 2 años (mediana 56%; intervalo entre 27–73%). El porcentaje de BA con virus identificado en los trabajos en que se ha recurrido a técnicas de PCR no supera el 75–80%. Otros virus implicados por orden descendente de frecuencia son los rinovirus, adenovirus, metapneumovirus, virus de la gripe, parainfluenza, enterovirus y bocavirus. Entre el 9–27% de los casos presentan coinfección viral.
La evidencia en que se sustenta el perfil etiológico de la BA procede de estudios de cohortes con alguna limitación (nivel II).
E.2.2. ¿Existe algún patrón clínico característico de las BA por VRS?
La clínica no resulta útil para diferenciar la etiología de la BA. Aunque las BA por VRS tienen un perfil clínico, fundamentalmente asociado a la menor edad de los pacientes que las presentan, las variables identificadas no han mostrado suficiente capacidad predictiva. Las BA por VRS tienen menor edad, más sibilantes y trabajo respiratorio, mayor duración de síntomas y oxigenoterapia y se asocian a menor uso de antibióticos.
La información sobre el perfil clínico de las BA se basa en estudios de cohortes con importantes limitaciones y estudios de casos y controles (nivel III)
Grado de recomendación: C
E.2.3. ¿La identificación etiológica es útil de cara al manejo terapéutico o el pronóstico de los pacientes con BA?
La identificación etiológica no permite diferenciar formas clínicas de BA que requieran un manejo diagnóstico y terapéutico diferente. No obstante, en lactantes pequeños (menores de 3 meses) con BA febriles en el medio hospitalario, la identificación de un VRS u otros virus respiratorios puede facilitar el manejo conservador de dichos pacientes y ahorrar intervenciones diagnósticas y/o terapéuticas.
Estas recomendaciones se basan en estudios observacionales con limitaciones y en la opinión de expertos (niveles III y IV).
Grado de recomendación: C
Validez de las pruebas de diagnóstico rápido de infección por VRS
D.1.1. ¿Cuál es la muestra respiratoria más apropiada para la identificación del VRS en pacientes con BA?
Las muestras respiratorias obtenidas mediante aspirado nasofaríngeo son las más válidas para la identificación del VRS.
Esta información se sustenta en estudios de pruebas diagnósticas con alguna limitación (nivel II)
Grado de recomendación: B
D.1.2. ¿Son válidas las pruebas de diagnóstico rápido de infección VRS (enzimoinmunoanálisis, inmunocromatografía, inmunoensayo óptico e inmunofluorescencia directa) en pacientes con BA?
Las pruebas de diagnóstico rápido de infección por VRS son aceptablemente válidas, presentando una sensibilidad moderada-alta y una alta especificidad en relación a otras pruebas de referencia (cultivo y/o PCR). Las pruebas más empleadas, por su escasa complejidad y rapidez (técnicas de enzimoinmunoanálisis, inmunocromatografía e inmunoensayo óptico), presentan una menor sensibilidad que la inmunofluorescencia directa. Con ellas, un resultado positivo es válido, pero un resultado negativo no permite descartar con suficiente seguridad la presencia de infección.
Esta información se sustenta en estudios de pruebas diagnósticas con alguna limitación (Nivel II).
Grado de recomendación: B
D.1.3. ¿Se recomienda el empleo rutinario de las pruebas de diagnóstico rápido de infección VRS en los pacientes con BA?
No se recomienda el empleo rutinario de las pruebas de diagnóstico rápido de infección por VRS en los pacientes con BA.
Esta información se sustenta es estudios observacionales con limitaciones (nivel III), no habiéndose demostrado la eficacia del empleo rutinario de estas pruebas.
Grado de recomendación: C
D.1.4. ¿Debe considerarse en el empleo de las técnicas de diagnóstico rápido algún criterio relacionado con la edad, ámbito de asistencia del paciente (cuidados intensivos, hospitalización, urgencias, primaria), antecedentes o gravedad?
Podría considerarse el uso de pruebas de diagnóstico rápido de VRS en el medio hospitalario con pacientes menores de 3 meses. En aquellos lactantes con una situación clínica en la que la realización de procedimientos, el ingreso hospitalario o la prescripción de antibióticos es altamente probable, el uso de pruebas de diagnóstico rápido podría resultar útil; esto podría corresponder a lactantes, atendidos en urgencias hospitalarias en periodo epidémico con cierta afectación general. Aunque los resultados negativos de estas pruebas no permiten descartar la presencia de infección por VRS (y, por lo tanto, evitar el aislamiento de los pacientes en el curso de epidemias) un resultado positivo facilitaría la agrupación de enfermos.
Estas recomendaciones se basan en la opinión de expertos (nivel IV).
Grado de recomendación: D
Pruebas diagnósticas en el manejo de la BA: radiografía de tórax, pulsioximetría y pruebas de cribado de infección bacteriana
D.2.1. ¿Resulta útil la realización de una radiografía de tórax para el manejo de la BA?
No se recomienda el uso rutinario de la radiografía de tórax en la BA. No se ha demostrado su utilidad y existe una relación riesgo-beneficio desfavorable, por la exposición a radiación ionizante que implica su realización.
Esta recomendación se basa en los resultados de estudios observacionales con limitaciones en los que se han analizado la prevalencia de alteraciones en la radiografía de tórax, la validez de modelos predictivos clínicos de dichas alteraciones, la concordancia de su interpretación o su asociación con resultados clínicos (nivel II).
Grado de recomendación: B
D.2.2. ¿Existe algún criterio que permita identificar a los pacientes en los que la radiografía de tórax sea útil?
No existen signos o síntomas concretos que permitan identificar a los pacientes que se beneficiarán de la realización de una radiografía de tórax. No obstante podría considerarse la realización de una radiografía de tórax en pacientes con BA que presentan un deterioro clínico evidente o en los que existen dudas diagnósticas.
Esta recomendación se sustenta en la opinión de expertos (nivel IV).
Grado de recomendación: D
D.2.3. ¿Resulta útil la medición de la saturación de oxígeno (SatO2) en los pacientes con BA?
La medición de la SatO2 resulta útil en la valoración inicial o en el control de los cambios clínicos de los pacientes con BA, pues es el mejor método disponible para la estimación no invasiva de la oxigenación del paciente. Sin embargo, no parece justificada la monitorización rutinaria mantenida de los niveles de SatO2.
Esta recomendación se sustenta en estudios observacionales con limitaciones y en una relación riesgo-beneficio favorable (nivel III).
Grado de recomendación: C
D.2.4. ¿Existe algún criterio que permita identificar a los pacientes que precisan la medición de la SatO2?
No existen criterios clínicos específicos que permitan seleccionar los pacientes con BA que requieren la medición de la SatO2. Se recomienda su medición en la valoración inicial de todos los pacientes y en el control de cambios clínicos en los pacientes con compromiso respiratorio.
Esta recomendación se sustenta en estudios observacionales con limitaciones y en la opinión de expertos (niveles III y IV).
Grado de recomendación: C
D.2.5. ¿Qué puntos de corte de la SatO2 orientan en el manejo del paciente con BA?
Un paciente con BA con una SatO2 superior a 94% y sin otros signos o síntomas de compromiso respiratorio o afectación general puede ser manejado habitualmente a nivel ambulatorio (recomendación basada en la opinión de expertos; nivel IV). Un paciente con una SatO2 por debajo del 92% requiere oxigenoterapia (recomendación basada en estudios observacionales con limitaciones y en los fundamentos de la curva de disociación de la oxihemoglobina; nivel III). Con SatO2 entre 92–94% (ambos inclusive) se valorará individualmente la administración de oxígeno y el manejo ambulatorio, valorando conjuntamente otros parámetros: trabajo respiratorio, alimentación, ambiente familiar, posibilidad de control, etc. (recomendación basada en la opinión de expertos; nivel IV).
Grado de recomendación: C
D.2.6. ¿Existe algún criterio que permita identificar a los pacientes con BA que requieren la realización de cribado de infección bacteriana?
Los pacientes con BA tienen un riesgo muy bajo de infección bacteriana coincidente (fundamentalmente infección urinaria). Para el conjunto de infecciones bacterianas se sitúa en una mediana del 2,4% (intervalo 1,1–6,5%), para las bacteriemias del 0% (intervalo 0–0,7%) y para las infecciones del tracto urinario 2% (intervalo 0,6–6,5%). Por ello, no está indicada la realización rutinaria de pruebas de cribado de infección bacteriana. Aunque no existen criterios clínicos con suficiente capacidad predictiva como para seleccionar los casos que se beneficiarían de dichas pruebas, podría considerarse su realización en pacientes con fiebre persistente, edad inferior a un mes o con signos o síntomas de gravedad (recomendación basada en estudios observacionales con limitaciones y en la opinión de expertos; niveles III y IV).
Grado de recomendación: C
Factores pronósticos de gravedad en BA
PN.1.1. ¿Qué factores de riesgo se asocian con mayor gravedad?
En pacientes ingresados con BA son factores de riesgo documentados de estancias prolongadas o ingreso en UCIP: la displasia broncopulmonar y/o enfermedad pulmonar crónica, la prematuridad, las cardiopatías congénitas y la edad menor de 3 meses. Otros factores de riesgo menos documentados son la exposición a tabaco, el antecedente de ventilación mecánica neonatal, la lactancia materna de menos de 4 meses, la coinfección vírica y otras enfermedades crónicas (neuromusculares, cromosomopatías, inmunodeficiencias, anomalías congénitas).
Son marcadores de gravedad asociados a la indicación de ingreso en pacientes atendidos en urgencias y/o a la duración de la estancia hospitalaria en pacientes ingresados: el aspecto tóxico, la taquipnea, la hipoxia (SatO2 inferior a 92%), la presencia de atelectasia o infiltrado en la radiografía de tórax, el trabajo respiratorio aumentado, los signos de deshidratación, la taquicardia y la fiebre. Aunque algunos de estos marcadores influyen en la decisión de ingreso hospitalario, no se ha establecido el impacto clínico sobre el paciente de su consideración.
Esta información se sustenta en estudios observacionales con limitaciones: nivel II para los principales factores de riesgo; nivel III para otros factores y marcadores de riesgo. Algunos miembros del panel proponen que el tiempo de evolución de la BA inferior a 24–48h, especialmente en lactantes menores de 3 meses, podría ser un marcador de riesgo (recomendación basada en opinión de expertos; nivel IV).
Grado de recomendación: B
PN.1.2. ¿Existe algún modelo predictivo válido de gravedad?
Aunque existen diversos modelos predictivos de gravedad que incorporan combinaciones de los factores de riesgo y marcadores de gravedad previamente expuestos, ninguno ha mostrado suficiente validez predictiva como para recomendar su uso en la práctica clínica (información basada en estudios de validación de modelos predictivos con limitaciones; nivel II).
Grado de recomendación: B
PN.1.3. ¿Qué factores de riesgo o marcadores clínicos de gravedad deben ser considerados en la decisión de ingreso hospitalario?
En la decisión de ingreso hospitalario deben considerarse los siguientes factores de riesgo: displasia broncopulmonar y/o enfermedad pulmonar crónica, prematuridad, cardiopatías congénitas hemodinámicamente significativas y edad menor de 3 meses. Así mismo deben tenerse en cuenta los siguientes marcadores de gravedad: presencia de apneas, aspecto tóxico, hipoxia (cianosis, SatO2 inferior a 92%), taquipnea (según edad), rechazo de tomas o problemas de hidratación. Además, debe valorarse la capacidad del entorno familiar para realizar los cuidados que requiere el paciente con BA.
Estas recomendaciones se basan en estudios observacionales con limitaciones y en la opinión de expertos (niveles III y IV).
Grado de recomendación: C
PN.1.4. ¿Qué factores de riesgo o marcadores clínicos de gravedad deben ser considerados en la decisión de ingreso en UCI?
No existen criterios específicos de ingreso en UCIP aplicables a pacientes con BA, por lo que les serían aplicables los criterios generales (recomendación basada en la opinión de expertos; nivel IV).
Grado de recomendación: D
Escalas de valoración de síntomas o gravedad
PN.2.1. ¿Existe alguna escala más válida y precisa para la valoración de síntomas o gravedad de BA?
Aunque existen diversas escalas, que incorporan diferentes signos y síntomas de gravedad, ninguna ha demostrado ser más válida o precisa como para recomendar su aplicación preferente en la práctica clínica (información sustentada en estudios observacionales con limitaciones; nivel III).
Grado de recomendación: C
PN.2.2. ¿Qué síntomas o signos deben incluirse en la valoración de la gravedad de la BA?
Los principales síntomas o signos que deben considerarse en la valoración de la gravedad de la BA son la hipoxia (cianosis o baja SatO2), la intensidad y extensión de sibilantes y retracciones torácicas y la frecuencia respiratoria. Otros signos o síntomas a considerar son la frecuencia cardiaca, el nivel de conciencia, el grado de hidratación, la presencia de apneas y otros signos directos o indirectos de compromiso respiratorio (rechazo de tomas, tos, capacidad de vocalización y grado de ventilación).
Esta información se basa en estudios observacionales con limitaciones y en estudios sobre concordancia de signos, síntomas y escalas con alguna limitación (niveles II y III).
Toda valoración de síntomas o signos de gravedad debe realizar tras una adecuada aspiración de secreciones nasofaríngeas, para mejorar la precisión de las mediciones (recomendación basada en la opinión de expertos; nivel IV).
Grado de recomendación: B y D
Riesgo de asma posbronquiolitis
P.3.1. ¿Es la BA un factor de riesgo independiente de asma?
Parece existir una consistente y fuerte asociación entre ingreso por BA o IRA baja antes de los 2 años y episodios de sibilantes recurrentes en los primeros 5 años de vida. Sin embargo no está claro si en años posteriores dicha asociación se prolonga, existiendo información discordante sobre la asociación entre ingreso por BA o IRA baja y asma.
La información disponible se refiere a pacientes hospitalizados, por lo que no podemos extenderla a pacientes ambulatorios con BA. Además, el factor de exposición considerado (ingreso por BA o IRA baja), no permite diferenciar el riesgo preexistente (que puede favorecer el ingreso) del atribuible al episodio infeccioso (formas graves de la enfermedad que dañen las vías áreas).
La evidencia sobre el riesgo de sibilantes recurrentes o asma se sustenta en estudios de cohortes con limitaciones (nivel II).
Grado de recomendación: B
Tratamiento de la BALa literatura publicada en relación con el tratamiento de la BA es muy abundante, con múltiples ensayos clínicos aleatorizados (ECA) en las distintas intervenciones analizadas. La síntesis de la información de estos ECA es también sólida, fundamentada en las GPC y RS con o sin metanálisis (MA).
Destacamos 3 GPC sobre BA, actuales y con rigurosa metodología: la de American Academy of Pediatrics (AAP)17, la de Scottish Intercollegiate Guideline Network (SIGN)18 y la del Cincinnati Children′s Hospital Medical Center (CCHMC)19. El repertorio de GPC National Guideline Clearinghouse acaba de publicar la síntesis comparativa de estas 3 GPC que abordan un mismo problema de salud20. Las GPC clasifican como alta la fuerza de las recomendaciones de muchas intervenciones, dado que están basadas en RS de la Colaboración Cochrane. Se reconocen al menos las siguientes revisiones de la Cochrane sobre intervenciones en BA: adrenalina21, antibióticos22, beta-2-adrenérgicos23,24 bromuro de ipratropio25,26, corticoides27–30, fisioterapia31,32, inmunoglobulinas33–35, ribavirina36,37, suero salino hipertónico38 y surfactante39. Las GPC se deben actualizar y contextualizar, pues no siempre reflejan la práctica clínica habitual para todos los países. También merece una mención especial la profundidad del informe de la Agency of Healthcare Research and Quality40.
La cuestión está en definir el medicamento correcto para el paciente adecuado en la dosis apropiada y en el tiempo oportuno41. La existencia de múltiples ECA en los últimos 25 años sobre las potenciales intervenciones farmacológicas en la BA (principalmente broncodilatadores, antiinflamatorios y antivíricos) y el escaso avance en el manejo de los infrecuentes casos de BA moderada-grave llegan a plantear incluso la duda de si es necesario continuar algunas líneas de investigación42. El mayor avance en el desarrollo farmacológico de la BA en los últimos años se debe al campo de la prevención (desarrollo de anticuerpos monoclonales como inmunoprofilaxis), mientras que en el tratamiento son menos las novedades (heliox, suero salino hipertónico, etc). Los objetivos del tratamiento de la BA son43: disminuir la morbi-mortalidad, disminuir los costes sociales y económicos (reducir los ingresos hospitalarios y días de hospitalización) y disminuir las secuelas a largo plazo (patología respiratoria recurrente y, quizás, asma).
1) Medidas de soporte
T.1.1. ¿Debe hacerse alguna recomendación específica sobre el uso de tratamiento de soporte (fluidoterapia, suplementos de oxígeno, desobstrucción nasal, posición) en el manejo de la BA?
No existe un tratamiento de soporte específico en el manejo de la BA; es decir, no es posible concretar una fluidoterapia u oxigenoterapia diferencial respecto a otros lactantes con dificultad respiratoria.
Estas medidas, junto con una monitorización adecuada, constituyen el tratamiento de soporte de uso generalizado y uniformemente aceptado. Las pruebas científicas sobre las que se apoya esta terapia son escasas, y la mayoría constituyen extrapolaciones derivadas de la práctica clínica habitual y datos obtenidos en otros procesos respiratorios (no exclusivamente BA), perpetuadas en sucesivas revisiones y consensos de expertos. Es evidente que la imposibilidad ética de realizar ECA sobre estas medidas terapéuticas (no ofrecer oxigenoterapia a un grupo control, por ejemplo), mantiene en el rango de consenso la adopción de estas medidas.
Se consideran recomendaciones basadas en la opinión de expertos y en la buena práctica clínica las siguientes:
- •
La decisión de administrar oxígeno se debe basar en la valoración conjunta de los signos de dificultad respiratoria y la pulsioximetría. Los niños con dificultad respiratoria grave y/o cianosis (de origen no cardiológico) y/o SatO2<92% deben recibir oxígeno suplementario. En los niños con cardiopatías congénitas cianógenas existe una dificultad particular para interpretar la SatO2 y es preciso conocer su SatO2 basal.
- •
Se recomienda aspirar las secreciones respiratorias antes de las tomas, antes de valorar la gravedad, antes de cada tratamiento inhalado y cuando se objetiven signos de obstrucción de vías altas. Se pueden usar lavados nasales con suero fisiológico antes de la aspiración de secreciones.
- •
Se recomienda aplicar medidas posturales: elevación de la cabecera de la cuna.
- •
Se debe valorar el estado de hidratación y la capacidad de tomar líquidos.
- •
Se recomienda fraccionar y/o espesar las tomas si se objetiva dificultad para la ingesta.
- •
La alimentación por SNG puede ser una opción en los niños con riesgo de deshidratación y desnutrición.
- •
En los niños más graves o en los que no toleren la vía oral se recomienda obtener acceso vascular e hidratar parenteralmente.
- •
Evitar exposición al tabaco.
El nivel de evidencia se fundamenta en la opinión de expertos (nivel IV) y en la experiencia clínica (nivel III); solo en el caso de la fluidoterapia y oxigenoterapia la información procede de dos estudios de cohortes (nivel II-2).
Grado de recomendación: C.
2) Broncodilatadores
T.2.a.1. ¿Es eficaz el salbutamol inhalado en el tratamiento de la BA?
Se ha postulado que el efecto broncodilatador de los beta-2-agonistas podría ser beneficioso en el tratamiento sintomático de la BA y, de hecho, se utilizan de forma muy habitual en esta entidad. Es probable que su uso generalizado en la BA se deba a la semejanza de los síntomas y signos entre BA y asma. Sin embargo, la fisiopatología de la BA consiste principalmente en la inflamación de los bronquiolos terminales y alvéolos con edema de las vías respiratorias y mucosidad, lo que conlleva obstrucción de las vías respiratorias.
No se considera eficaz el salbutamol inhalado de forma rutinaria, con una relación beneficio-riesgo desfavorable. Existe un predominio de riesgos (efectos adversos, coste medicación y administración) sobre beneficios (mejoría clínica a corto plazo como mínimos cambios en puntuación clínica, sin diferencias en hospitalización).
El nivel de evidencia se fundamenta en 16 ECA de calidad media-baja y pequeño tamaño muestral, con escasa consistencia entre ellos y alto riesgo de sesgos (nivel II-1), así como 2 RS, una con 8 ECA sobre salbutamol y otra con 22 ECA sobre el conjunto de broncodilatadores (nivel I).
Grado de recomendación: A
T.2.a.2. ¿Es eficaz el salbutamol oral en el tratamiento de la BA?
No se considera eficaz el salbutamol oral, con una relación beneficio-riesgo muy desfavorable, ante la presencia de más efectos adversos que la vía inhalada y ningún beneficio demostrado. El uso de salbutamol oral se considera un uso inapropiado en la BA.
El nivel de evidencia se fundamenta en 3 ECA de calidad media-baja y pequeño tamaño muestral, si bien consistentes entre ellos respecto a la ausencia de efecto (nivel II-1). Aunque el volumen de la evidencia es escaso (los 3 ECA referidos que, además, eran ramas de tratamiento diferentes en ECA sobre salbutamol inhalado), el panel considera que no se deberían realizar más estudios al respecto con esta vía de aplicación del broncodilatador.
Grado de recomendación: B.
T.2.a.3. ¿Es útil la realización de una prueba terapéutica con salbutamol inhalado de forma sistemática en la BA?
Ante la ausencia de pruebas científicas, el panel de expertos consensúa que no se debe considerar la prueba terapéutica sistemática con salbutamol inhalado, con el objetivo de mitigar el excesivo uso de este broncodilatador en la BA. Además, con la información clínica disponible, no podemos predecir los casos que se pueden beneficiar del tratamiento, por lo que cualquier intento terapéutico tendrá que ser individualizado y monitorizado con criterios objetivos. El panel considera el ensayo terapéutico con salbutamol como un uso alternativo en BA de intensidad moderada-grave (especialmente en los mayores de 6 meses y/o con historia personal/familiar de atopia). En cualquier caso, si se decide realizar un ensayo terapéutico, este debería ser suspendido si tras su aplicación no se objetiva mejoría clínica.
Las 3 GPC17–19 concluyen que no se aconseja el uso rutinario de broncodilatadores en el tratamiento de la BA. Dos de estas GPC17,19 consideran razonable realizar un ensayo terapéutico con salbutamol y evaluar la respuesta clínica, pero de forma objetiva y continuar con este tratamiento solo si se documenta una respuesta clínica positiva.
El nivel de evidencia se fundamenta en la opinión de expertos (nivel IV) y en la experiencia clínica (nivel III).
Grado de recomendación: D.
T.2.b.1. ¿Es eficaz la adrenalina nebulizada en el tratamiento de la BA?
La adrenalina tiene un potencial beneficio teórico en el tratamiento de la BA por su propiedad alfa-adrenérgica (con efectos vasoconstrictores y la reducción del edema), además del efecto beta-adrenérgico (broncodilatador), en el alivio de la obstrucción al flujo aéreo.
Aunque el panel de expertos considera que no se debe utilizar adrenalina nebulizada de forma rutinaria en la BA, con una relación beneficio-riesgo parcialmente desfavorable, no existe consenso al respecto. La controversia en el panel surge del reciente ECA de calidad de Plint et al44 realizado en lactantes de 6–12 meses que acuden a urgencias con primer episodio de BA y en los que se aplica adrenalina nebulizada (2 nebulizaciones 3ml cada 30min) y dexametasona 6 dosis (1mg/kg en urgencias y 0,6mg/kg/día y durante 5 días), encontrando una mejoría significativa en reducción de hospitalización a los 7 días. No obstante, los resultados de este estudio son fruto de comparaciones múltiples (4 grupos de intervención) y el grupo con la combinación adrenalina + dexametasona tiene un mayor porcentaje de atopia familiar y personal (no significativo pero equivalente a la diferencia de efecto observado), por lo que la eficacia de la combinación debería comprobarse en un estudio específico.
Existe un predominio de riesgos (efectos adversos, coste medicación y administración) sobre beneficios (mejoría clínica pequeña y transitoria) en el uso rutinario de adrenalina nebulizada. La guía de la AAP17 especifica que la adrenalina es el broncodilatador preferido en urgencias y en pacientes hospitalizados, no así en el domicilio (en donde sería más apropiado el uso de salbutamol, según la opinión de expertos). El panel de expertos considera que la adrenalina nebulizada es poco eficaz, por lo que no se debería emplear de forma rutinaria; se puede considerar como prueba terapéutica en pacientes menores de 6 meses, como una opción de uso alternativo en el tratamiento de la BA.
El nivel de evidencia se fundamenta en 17 ECA de calidad media-alta y, generalmente, pequeño tamaño muestral con baja consistencia entre ellos y riesgo de sesgos (nivel II-1), así como una RS con 14 ECA sobre adrenalina (nivel I); la recomendación de uso preferido en urgencias se basa en la opinión de expertos (nivel IV).
Grado de recomendación: A y D
T.2.b.2. ¿Es eficaz la adrenalina subcutánea en el tratamiento de la BA?
El panel considera de forma unánime que la adrenalina subcutánea no es eficaz en la BA, más como extrapolación de la falta de eficacia de la adrenalina nebulizada que por los estudios sobre adrenalina subcutánea.
El nivel de evidencia se fundamenta en un solo ECA de calidad media-baja45 y muy pequeño tamaño muestral (nivel II-1) y en el que se constata mejoría clínicamente significativa en el grupo de intervención respecto a la puntuación clínica (RDAI y RACS) a los 15min tras el tratamiento, de escaso impacto clínico y sin consistencia, por la ausencia de otros ECA sobre esta vía de administración.
Grado de recomendación: B
T.2.b.3. ¿Es útil la realización de una prueba terapéutica con adrenalina nebulizada de forma sistemática en la BA?
El panel considera que sí se puede considerar el ensayo terapéutico con adrenalina como opción de uso alternativo. Pero sirven los mismos comentarios respecto al ensayo terapéutico con salbutamol: no podemos predecir los casos que se pueden beneficiar del tratamiento, por lo que cualquier intento terapéutico tendrá que ser individualizado y monitorizado con criterios objetivos. El panel considera el ensayo terapéutico con adrenalina como una opción de uso alternativo en BA de intensidad moderada-grave (especialmente en los menores de 6 meses) y en pacientes hospitalizados o atendidos en urgencias o en centros de salud, si hay posibilidad de observación. En cualquier caso, si se decide realizar un ensayo terapéutico, este debería ser suspendido si tras su aplicación no se objetiva mejoría clínica.
Dos GPC17,19 consideran razonable realizar un ensayo terapéutico con adrenalina nebulizada, evaluar la respuesta clínica de forma objetiva y continuar con este tratamiento solo si se documenta una respuesta clínica positiva.
El nivel de evidencia se fundamenta en ensayos clínicos con limitaciones (nivel II-1), la opinión de expertos (nivel IV) y en la experiencia clínica (nivel III).
Grado de recomendación: B
T.2.b.4. ¿Es más eficaz la adrenalina que el salbutamol?
En el global de estudios publicados se considera que adrenalina es algo superior a salbutamol (mejoría en puntuación clínica, oxigenación, función respiratoria). Aunque es posible que sean necesarios estudios con mayor número de pacientes y que evalúen más claramente su papel a medio y largo plazo, en el momento actual, la adrenalina constituye el agente broncodilatador de elección en el tratamiento de la BA por su relación entre riesgos-beneficios-costes. En una RS21 la sensación de mejoría es mayor en los ECA de adrenalina vs salbutamol (OR=4,51; IC95% 1,93–10,53), pero solo en los pacientes no ingresados.
El nivel de evidencia se fundamenta en distintos ECA comparativos entre ambos fármacos, no exentos de algunas limitaciones (nivel II-1).
Grado de recomendación: B.
T.2.c.1. ¿Es eficaz el bromuro de ipratropio nebulizado en el tratamiento de la BA?
El panel considera de forma unánime que no es eficaz. El nivel de evidencia se fundamente en 6 ECA con calidad media-baja y pequeño tamaño muestral (la mayoría de ECA corresponden a ramas de tratamiento diferentes de ECA sobre salbutamol) (nivel II-1). Ningún estudio encuentra beneficios, salvo uno, de interés clínico marginal. Existe una RS sobre bromuro de ipratropio25 que incorpora los resultados de ECA en lactantes <2 años con sibilancias; aunque los autores no definen claramente qué enfermedad se pretende tratar, sus características concuerdan con BA y/o episodios recurrentes de sibilancias secundarias a un primer episodio de BA, si bien también pacientes con asma (nivel II-1).
Grado de recomendación: B.
3) Corticoides
T.3.1. ¿Son eficaces los corticoides inhalados en el tratamiento de la BA?, ¿existe alguna pauta que sea más eficaz o segura?
El panel considera de forma unánime que los corticoides inhalados no son útiles en la BA, con una relación beneficio-riesgo desfavorable. Existe un predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (posibilidad de mejoría en el seguimiento de algunos pacientes, pero datos contradictorios y no consistentes).
A pesar del papel predominante de la inflamación en la patogénesis de la obstrucción de la vía aérea en la BA, existen numerosos ECA y RS que demuestran que los corticoides no proporcionan beneficios clínicos (ni durante la fase aguda, ni en la evolución posterior de los lactantes previamente sanos con un primer episodio de BA) y presenta, además, efectos adversos bien reconocidos.
El nivel de evidencia se fundamenta en 11 ECA de calidad media-baja y pequeño tamaño muestral con baja consistencia entre ellos y riesgo de sesgos (nivel I).
Grado de recomendación: A
T.3.2. ¿Son eficaces los corticoides sistémicos en el tratamiento de la BA?
El panel considera de forma unánime que los corticoides sistémicos no son útiles en la BA. Se establece un equilibrio entre riesgos (potenciales, aunque poco constatados por el escaso tiempo de aplicación) y beneficios (diferencias significativas en niños atendidos en urgencias con corticoides orales durante 3–5 días, principalmente). La controversia en el panel, tal como se ha comentado con la adrenalina, surge del ECA de Plint et al44 (combinación de adrenalina nebulizada y dexametasona oral).
En los corticoides orales el nivel de evidencia procede de 13 ECA de calidad media-alta y consistencia escasa (nivel II-1), si bien en los 4 ECA de mayor calidad se obtiene algún resultado significativo, en tres casos con dexametasona46,44,47 y en uno con prednisolona48. Los dos recientes ECA publicados en N Engl J Med con dexametasona oral (sola47 o combinada con adrenalina nebulizada44) ofrecen conclusiones diferentes, probablemente en base al efecto sinérgico del broncodilatador.
En los corticoides parenterales el nivel de evidencia procede de 10 ECA de calidad media-baja, pequeño tamaño muestral y consistencia principal hacia la falta de efecto (nivel II-1). La ausencia de diferencias en la RS27 a nivel global también se confirma en cualquiera de los subgrupos analizados (edad, antecedentes de sibilancias, etiología viral, dosis diaria de corticoides y dosis total), lo que apoya la ausencia de efecto de los corticoides sistémicos para disminuir la duración del ingreso, la puntuación clínica y el porcentaje de niños que requieren ingreso hospitalario por BA. Además, la magnitud de cualquier potencial beneficio es pequeña y de relevancia clínica dudosa. Esta RS ha sido recientemente descatalogada de la Cochrane (nivel II).
Grado de recomendación: B
4) Ribavirina
T.4.1. ¿Es eficaz la ribavirina nebulizada en el tratamiento sistemático de la BA por VRS?
La ribavirina es el único tratamiento específico en la BA, dado que es un agente antivírico para la infección por VRS. Las recomendaciones iniciales de la AAP Committee on Infectious Diseases49 en el año 1996 consideraban el uso de la ribavirina entre 3–7 días en aquellos niños con infección por VRS (confirmada o sospechosa) grave y/o que precisaran ventilación mecánica, así como en aquellos niños con enfermedades de base que pudieran tener mayor riesgo de complicaciones asociadas por el VRS. Si bien es a partir de 2003 cuando ya no se recomienda debido a su alto coste, eficacia dudosa y potencial efecto teratogénico en embarazadas.
El panel de expertos considera que no se debe considerar su uso sistemático, dado el predominio de los riesgos (problemas de administración, efectos secundarios y teratogenicidad) sobre los beneficios (cierta mejoría en algunas variables, no consistente entre los estudios y marginal en la mayoría de los casos), sin perder en cuenta los costes económicos de su administración (es un medicamento caro).
El nivel de evidencia procede de 13 ECA con calidad media-alta y pequeño tamaño muestral, así como de 4 estudios de cohortes (anidados en ECA en algún caso), con baja consistencia ente estudios (nivel II-1): globalmente, los estudios se dividen casi numéricamente entre no favorables y favorables a la intervención, si bien con medidas de resultado diferentes y con poca relevancia clínica. Riesgo de sesgos alto derivado de la consideración general de infecciones por VRS (en la mayoría de los estudios se trata de infecciones de vías respiratorias inferiores por VRS de distinta gravedad, no exclusivamente BA), así como del uso de agua como placebo (con desventajas en el grupo control, pues se aplica una solución aerosolizada más hipotónica que el suero fisiológico y con más riesgo de broncoespasmo, lo que puede favorecer el efecto potencialmente beneficioso de ribavirina en dichos ECA).
Existen 2 RS: una con 8 ECA50 y en el que no se pudo demostrar diferencias significativas en ninguna de las medidas analizadas, bien primarias (mortalidad e insuficiencia respiratoria) o secundarias (tiempo de hospitalización, necesidad de ventilación mecánica y/o oxigenoterapia, mejoría clínica o función pulmonar), y otra con 11 ECA36, en el que la única diferencia significativa encontrada es un menor tiempo de ventilación mecánica (DME=−1,79 días, IC95% −3,37 a −0,21) (nivel I).
Grado de recomendación: A.
T.4.2. ¿Es más útil la ribavirina en algún grupo de pacientes? (Relación riesgo-beneficio)
Los pacientes en los ECA sobre ribavirina son representativos de los atendidos en cuidados intensivos, por afectación grave de la infección VRS. El efecto observado tiene un escaso impacto clínico, por lo que no podemos predecir la magnitud de la respuesta al tratamiento si se considera quizás su potencial utilización en pacientes con infecciones respiratorias graves por VRS y/o en pacientes de alto riesgo (prematuros, enfermedad pulmonar crónica, cardiopatía hemodinámicamente significativa, inmunodeprimidos).
El panel considera que, basado en estudios no controlados y en la opinión de expertos, se puede considerar su utilización en pacientes de riesgo muy seleccionados, principalmente en inmunodeprimidos (nivel IV).
Grado de recomendación: D
5) Antibióticos
T.5.1. ¿Son eficaces los antibióticos en el tratamiento de la BA?
Las GPC y estudios de revisión no recomiendan el uso de antibióticos a menos que haya sospecha de una complicación como la neumonía bacteriana secundaria u otra sobreinfección51,52. Aunque existen evidencias de que la infección por VRS no predispone a la sobreinfección bacteriana53 se ha estimado que entre el 57–81% de los lactantes diagnosticados de BA reciben antibióticos54. Sin embargo, el uso rutinario de antibióticos carece de efectos beneficiosos, no solo en la BA sino también en la neumonía por VRS55,56. Por todas estas circunstancias, el panel ratifica la no necesidad de antibióticos en la BA y lo considera un uso inapropiado, por el claro predominio de riesgos (favoreciendo la exposición innecesaria y sus consecuencias sobre resistencias bacterianas, efectos adversos y costes) sobre beneficios (posibilidad de tratar pacientes con infección bacteriana, pero son infrecuentes y no graves en su mayoría: principalmente infección de orina).
El nivel de evidencia procede de 4 ECA de calidad media-baja, pequeño tamaño muestral, estudios heterogéneos con alto riesgo de sesgos (nivel II-1). Solo un ECA57 encuentra diferencias significativas en menor tiempo de hospitalización y oxigenoterapia y menor número de readmisiones, pero es un estudio con grandes limitaciones (dudoso método de aleatorización, pérdidas de un 30% y sin análisis por intención de tratar) y escasa potencia debido al pequeño tamaño muestral. Aunque hay publicada una RS22 solo considera uno de los anteriores ECA, por lo que es una RS con limitaciones metodológicas importantes.
Grado de recomendación: B
6) Suero salino hipertónico
T.6.1. ¿Es eficaz el suero salino hipertónico nebulizado en el tratamiento de la BA?
El panel de expertos considera que el suero salino hipertónico es eficaz y útil en el manejo de la BA del niño hospitalizado, dado que la relación entre riesgos (no constatados), beneficios (en días de hospitalización, mejoría clínica en los 3 primeros días y potencial disminución de la hospitalización) y costes (prácticamente nulo, salvo la adquisición del nebulizador) es francamente favorable. Se plantea la duda de que la pauta utilizada (2–4ml con dosis repetidas cada 8h —o más frecuentemente— y durante 5 días) sea factible aplicarla en el medio ambulatorio (urgencias o domicilio) con el objetivo de disminuir la gravedad de la BA y necesidad de ingreso.
El nivel de evidencia procede de 4 ECA con calidad alta, de pequeño tamaño muestral, pero consistentes en el diseño y dirección de los resultados (nivel I). La RS de estos 4 ECA38 demuestra que el suero salino hipertónico (usado junto a broncodilatadores) ofrece los siguientes resultados: disminución de la duración de la hospitalización en casi un día (25,9% de reducción respecto al grupo control) y mejoría del estado clínico en los tres primeros días (20% de reducción en la puntuación clínica respecto al grupo control), y cierta tendencia (no estadísticamente significativa) de reducción en la tasa de hospitalización (pues datos procedentes de un solo ECA con pacientes ambulatorios58).
Grado de recomendación: A
T.6.2. ¿Debe usarse el suero salino hipertónico asociado a broncodilatadores?
En los ECA realizados el suero salino hipertónico se administra con broncodilatadores, bien 1,5mg de adrenalina59,60 o 5mg de terbutalina58, salvo el estudio de Kuzik et al61 (si bien en el 37% de las nebulizaciones se aplicó conjuntamente con salbutamol y en el 23% con adrenalina). Se considera que esto puede influir tanto en la eficacia como en los efectos adversos: el efecto secundario teórico y conocido de la nebulización de solución salina hipertónica es el broncoespasmo agudo, que no se constata en estos ECA posiblemente porque la administración conjunta con broncodilatadores evita cualquier posible efecto broncoconstrictor.
De momento los estudios publicados abogan por el uso simultáneo de las nebulizaciones de suero salino hipertónico con broncodilatadores (beta-2-adrenérgicos o adrenalina), si bien será interesante disponer de información añadida futura sobre ensayos clínicos que comparen la nebulización de suero salino hipertónico solo frente a la actual pauta combinada con broncodilatadores. De momento no hay datos que sugieran sinergia y si en respuestas anteriores el panel ha considerado que no se deben utilizar sistemáticamente los broncodilatadores (salbutamol y/o adrenalina) en la BA, caben dos consideraciones simultáneas: la aplicación actual de suero salino hipertónico con broncodilatadores tendría el potencial beneficio de evitar el potencial broncoespasmo de una solución hipertónica en el árbol bronquial; si se considera la utilización de broncodilatadores en el manejo de la BA, considerar vehiculizarlo mejor con salino hipertónico que con salino fisiológico. El nivel de evidencia se basa en la opinión de expertos extrapolado de los datos publicados en los ECA (nivel IV).
Grado de recomendación: D
7) Inmunoglobulinas
T.7.1. ¿Es eficaz la inmunoglobulina IV en el tratamiento de la BA?
La inmunoglobulina frente a VRS se han estudiado preferentemente en la prevención de la infección aguda en lactantes de alto riesgo, pero su papel en la infección ya establecida ha sido menos explorado. El panel considera por unanimidad que no es eficaz la inmunoglobulina IV en el tratamiento de la BA, con un balance desfavorable entre riesgos (potenciales), beneficios (no constados) y costes (elevados).
El nivel de evidencia procede de 3 ECA de calidad media-alta, pequeño tamaño muestral, pero adecuada consistencia entre estudios al no encontrar diferencias significativas. En la RS publicada35 no se pudo realizar metanálisis por la escasez de los estudios, la falta de mediciones comparativas y gran heterogeneidad de los resultados evaluados; pero no se apoya el uso en BA (nivel I).
Grado de recomendación: A
T.7.2. ¿Es eficaz la inmunoglobulina aerosolizada en el tratamiento?
El panel también considera por unanimidad la no utilidad de la inmunoglobulina aerosolizada en el tratamiento de la BA.
El nivel de evidencia procede de un único ECA (publicado en 1996) de pequeño tamaño muestral en niños (⇐2 años con infección grave por VRS ingresados en cuidados intensivos y que encuentra diferencias con mínimo valor clínico [menos apneas en el tercer día —pero no el día 1, 2, 6 o 7— y menos necesidad de presión positiva] y como efectos adversos se observa marcado aumento de la salivación en la primera hora de la administración62 (nivel II-1). Existe falta de consistencia en los datos al no publicarse nuevos estudios al respecto.
Grado de recomendación: B
8) Medidas de soporte respiratorio
T.8.1. ¿Debe hacerse alguna recomendación específica sobre el tipo de soporte respiratorio en la BA?
No se puede realizar ninguna recomendación específica sobre el soporte respiratorio de la BA respecto a otras entidades con dificultad respiratoria, salvo quizás el predominio en esta entidad del fracaso respiratorio hipercápnico y la utilidad de la ventilación no invasiva.
En el manejo de la BA puede ser necesario soporte respiratorio, bien para el manejo de las apneas recurrentes o para el fracaso respiratorio. Se han utilizado distintas modalidades de soporte respiratorio en la BA (ventilación con presión positiva intermitente63–65, continuous positive airways pressure [CPAP]66,67, presión extratorácica negativa68, ventilación de alta frecuencia69 y oxigenación con membrana extracorporea70,71), pero no se han estudiado con el diseño de ECA que permita comparar su eficacia y/o seguridad, salvo en el caso de la CPAP.
En la CPAP, el balance entre riesgos (método de ventilación no invasiva, sin efectos adversos constatados) y beneficios (mejoría clínica y gasométrica a corto plazo, pero sin correlato con otras medidas de impacto clínico, como ingreso) puede ser favorable en las BA que presentan dificultad respiratoria moderada-grave o apnea recurrente, especialmente por la posibilidad de evitar intubación y ventilación mecánica de estos pacientes.
En el soporte respiratorio de las cardiopatías congénitas conviene tener en cuenta la hemodinámica que subyazca; por ejemplo la CPAP en una fisiología univentricular es perjudicial, al igual que en lactante postoperado de tetralogía de Fallot con ventrículo derecho restrictivo.
El nivel de evidencia se fundamenta en la opinión de expertos (nivel IV) y en la experiencia clínica (nivel III). Solo en el caso de la CPAP, que procede de 4 estudios: un ECA aleatorizado con diseño cruzado72 (nivel II-2) y tres estudios observacionales (nivel III).
Grado de recomendación: B para la CPAP y D para el resto de modalidades de soporte respiratorio
T.8.2. ¿Existen criterios clínicos que delimiten los pacientes que requieren un aumento del soporte respiratorio (CPAP, ventilación con presión positiva intermitente, ventilación de alta frecuencia y oxigenación con membrana extracorpórea)?
Sí existen criterios, pero no específicos para la BA, sino genéricos para los pacientes con dificultad respiratoria. Se consideran recomendaciones basadas en la opinión de expertos y en la buena práctica clínica las siguientes:
- •
Las técnicas de ventilación no invasiva se han descrito como técnicas ventilatorias con un alto porcentaje de éxito en la BA, habiéndose estudiado distintos parámetros que pueden predecir el éxito o el fracaso de la técnica. Se ha propuesto la ventilación no invasiva (CPAP o BiPAP) como una alternativa o paso intermedio, antes de la ventilación invasiva, de forma particular en aquellos pacientes con crisis de apnea frecuentes. La CPAP contribuye a disminuir el trabajo respiratorio, prevenir atelectasias y mejorar la distribución de gases en vías aéreas con obstrucción.
- •
Se debe considerar la ventilación mecánica en aquellos pacientes con BA con insuficiencia respiratoria (hipoxia y/o hipercapnia refractarias y secundarias a una BA moderada-grave), en aquellos que presenten apneas, en los que hayan fracasado otras medidas como la ventilación no invasiva, o en los que presenten riesgo de parada cardiorespiratoria inminente. Sin embargo no existen evidencias claras sobre cuál es la modalidad ventilatoria de elección.
- •
Cuando se requiere ventilación mecánica, la mayoría de los autores prefieren modos ventilatorios controlados por presión, con frecuencias bajas, tiempos inspiratorios cortos, espiración prolongada y picos de presión los más bajos posibles, para tratar de minimizar el riesgo de atrapamiento y prevenir el barotrauma, aun a expensas de provocar una hipercapnia (hipercapnia permisiva).
- •
La ventilación de alta frecuencia oscilatoria (VAFO) parece ser útil en aquellos pacientes con insuficiencia respiratoria hipercápnica a pesar de la ventilación convencional, principalmente en el caso de neumonías por VRS que desarrollan un síndrome de distrés respiratorio agudo.
- •
Finalmente, en los casos refractarios a todas las modalidades anteriores, se ha comprobado que la ECMO puede ser beneficiosa, con altas tasas de supervivencia, aunque con una morbilidad significativa.
El nivel de evidencia se fundamenta en la opinión de expertos (nivel IV) y en la experiencia clínica (nivel III), salvo en el caso de la CPAP (nivel II-2 y nivel III).
Grado de recomendación: B para la CPAP y D para el resto
T.8.3. ¿Es eficaz el heliox en el tratamiento de la BA?
El balance del heliox entre los riesgos (medicación muy segura) y beneficios (mejoría clínica a corto plazo de dudosa relevancia clínica) es parcialmente favorable, pero muy dependiente de los costes de su aplicación (no existen estudios). Algún miembro del panel remarca que no existe ningún estudio negativo en el heliox, ni en BA ni en otros cuadros respiratorios en los que se ha utilizado. Ante estos datos el panel de expertos considera que se debe considerar el uso selectivo del heliox en BA moderada-grave utilizado con mascarilla con reservorio y de forma continua con un concentración 70/30; en los casos de BA grave y/o refractarios al tratamiento con heliox a través de mascarilla con reservorio se recomienda utilizar el heliox combinado con CPAP.
El nivel de evidencia se fundamenta en 3 ECA de calidad media y pequeño tamaño muestral (2 con diseño paralelo y 1 con diseño cruzado) (nivel II-1) y 3 estudios observacionales (2 estudio prospectivos no aleatorizados y una serie de casos) (nivel III). Los datos discordantes de los estudios son muy dependientes de los aspectos técnicos de la administración del heliox (tipo de interfase, concentración de helio, aplicación con o sin presión positiva, modo continuo o discontinuo); en general los beneficios se obtienen cuando el heliox se administra de forma continua73, pero no cuando se utiliza de forma discontinua o puntual como fuente de nebulización74, dado que el heliox es un gas inerte cuyo efecto solo persiste mientras se administra.
La potencial utilidad del heliox en la BA se plantea ante el impacto de futuros estudios mejor diseñados: ECA con mejor definición de pacientes (<12 meses con primer episodio de BA grave que requiera cuidados intensivos y excluir posible asma del lactante y otras infecciones por VRS), mejor definición de la intervención (concentración de la mezcla de helio-oxígeno, dosis, intervalo, tiempo y modo de aplicación), variables clínicas de interés homogéneas (tiempo de ingreso y ventilación mecánica, mortalidad) y mayor tamaño muestral.
Grado de recomendación: B
T.8.4. ¿Es eficaz el surfactante en el tratamiento de la BA?
El panel de expertos considera el uso selectivo del surfactante en los casos de BA grave que precisen ventilación mecánica, dada la favorable relación entre beneficios (menor días de ingreso en cuidados intensivos y necesidad de ventilación mecánica) y riesgos (nulo). Aunque no hay estudios de costes al respecto, es preciso tener en cuenta que las preparaciones de surfactante (porcino, bovino, sintético) son caras.
El nivel de evidencia procede de 3 ECA de calidad media y pequeño tamaño muestral, con importante consistencia, tanto el diseño de los estudios como en la favorable dirección de los resultados, bien datos de mejoría clínica (menos días de ingreso en cuidados intensivos y menos días de ventilación mecánica)75–77, gasométricos (mejoría en paO2 y paCO2 a las 24 y 48hs)75,76 y/o de función pulmonar (mejoría índice ventilatorio, índice de oxigenación)77. Los datos son consistentes con los resultados de una revisión sistemática que incluye estos 3 ECA39 (nivel II-1). No existe información suficiente como para considerar una determinada pauta más eficaz o segura.
Grado de recomendación: B
T.8.5. ¿Son eficaces las metilxantinas en el tratamiento de la BA?
Aproximadamente el 20% de los niños ingresados con BA padecen alguna forma de apnea. En ese caso el uso de metilxantinas (teofilina y cafeína) podría estar justificado, aunque no hay ECA al respecto.
El panel de expertos considera que los datos actuales disponibles no permiten aconsejar su utilización sistemática en la BA. Se podría considerar como de uso alternativo en la BA con apnea en neonatos y/o en lactantes con antecedentes de prematuridad (nivel IV).
Solo se encuentra limitada evidencia de un estudio retrospectivo78 y dos casos clínicos79,80 (en un total de 10 pacientes) y en el que se percibe una favorable respuesta en la disminución de las pausas de apnea y prevención de la ventilación mecánica por apneas (nivel III).
Grado de recomendación: C y D
T.8.6. ¿Es eficaz el óxido nítrico en el tratamiento de la BA?
No existen evidencias de que el óxido nítrico pueda ser beneficioso, ni como vasodilatador pulmonar (por la baja incidencia de hipertensión pulmonar en estos pacientes), ni tampoco por sus efectos broncodilatadores. Basado en la opinión de expertos, este tratamiento se reserva para BA graves refractarias a las modalidades convencionales de ventilación mecánica (nivel IV).
Grado de recomendación: D
9) Fisioterapia
T.9.1. ¿Es eficaz la fisioterapia en el tratamiento de la BA?, ¿existe alguna pauta que sea más eficaz o segura?
La fisioterapia, teóricamente, puede actuar ayudando a los lactantes con BA a expulsar las secreciones y disminuir el esfuerzo respiratorio. Sin embargo, el panel de expertos no la considera eficaz, pues aunque se emplea de forma habitual en algunos países (como en Francia, en donde se utiliza una técnica que se denomina kinesiterapia, que no es exactamente igual a nuestra fisioterapia), no existen evidencias directas que demuestren que la fisioterapia respiratoria sea beneficiosa en estos pacientes, con predominio de los riesgos (estrés de su administración a un paciente con disnea, tiempo y personal para su administración) sobre los beneficios (no diferencias en movilidad y limpieza de secreciones, ni en prevención de atelectasias).
El nivel de evidencia se fundamenta en 3 ECA de calidad media-baja y pequeño tamaño muestral, consistentes en cuanto a la ausencia de efectos favorables a la intervención. La RS31, que incluye los 3 ECA previos, no permite ofrecer un resultado cuantitativo procedente del metanálisis, pues los estudios originales no aportan valores combinables. Existe un alto riesgo de sesgos, por la escasa definición de los grupos de inclusión-exclusión, así como de las diferentes intervenciones analizadas (que se describe como percusión, drenaje y aspiración nasofaríngea, pero no se estudian técnicas de aceleración pasiva del flujo espiratorio). Cabe considerar la ausencia de un placebo válido en los estudios y la selección de una variable de interés (duración del ingreso) con poca probabilidad de disminuir con la fisioterapia (nivel II-1).
Grado de recomendación: B
10) Otras intervenciones
T.10.1. ¿Es eficaz la DNAsa recombinante humana nebulizada en el tratamiento de la BA?
La DNAsa es un agente mucolítico que, al aplicarse nebulizado, actúa mejorando la eliminación de las secreciones de vías respiratorias. Ha sido demostrado que la DNAsa reduce la viscosidad del esputo, mejora la función pulmonar y reduce el número de exacerbaciones pulmonares en pacientes con enfermedad pulmonar moderada y ha sido especialmente utilizado en pacientes con fibrosis quística.
Se asume un papel similar en la BA, si bien el panel de expertos considera que no es eficaz, pues el balance entre riesgos (probables), beneficios (sin interés clínico) y costes (elevados) es desfavorable a la intervención.
El nivel de evidencia se fundamenta en 2 ECA de alta calidad: la única diferencia significativa encontrada en uno de los ECA (mejoría en la evolución radiológica)81 es clínicamente irrelevante (nivel I).
Grado de recomendación: A
T.10.2. ¿Es eficaz el interferón IM en el tratamiento de la BA?
No se considera eficaz, con un balance entre riesgos (potenciales), beneficios (escasos y poco relevantes) y costes (elevados) desfavorable a la intervención.
El nivel de evidencia se fundamenta en 2 ECA de baja calidad y pequeño tamaño muestral, en los que la única diferencia significativa encontrada (cambios de puntuación a partir segundo día)82 es clínicamente irrelevantes (y sin relación con una menor diseminación viral) como para considerar un fármaco IM de estas características en el tratamiento de la BA (nivel II-1).
Grado de recomendación: B
T.10.3. ¿Es eficaz la furosemida nebulizada en el tratamiento de la BA?
No se considera eficaz. El nivel de evidencia se fundamenta en 2 ECA de pequeño tamaño muestral y desigual calidad, si bien ninguno encuentra diferencias significativas a favor de la intervención (nivel II-1). Aunque no se constatan efectos adversos, tampoco hay beneficios en su aplicación.
Grado de recomendación: B
Prevención de la bronquiolitis aguda1) Corticoides
PV.1.1. ¿Son eficaces los corticoides inhalados en la prevención de las sibilancias postbronquiolitis? ¿Existe algún criterio clínico que permita predecir la eficacia de los corticoides inhalados?
Existe cierto debate sobre la eficacia de los corticoides inhalados en los primeros años de vida, en los que el diagnóstico de asma resulta problemático, siendo difícil distinguir los niños realmente asmáticos de los que presentan sibilantes recurrentes secundarios a procesos infecciosos (enfermedad reactiva de las vías aéreas postbronquiolitis).
El panel de expertos considera que los corticoides inhalados no son eficaces como tratamiento preventivo tras un primer episodio de BA, dado el predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (posibilidad de mejoría en el seguimiento de algunos pacientes, pero datos contradictorios, de forma que las diferencias encontradas son clínica y estadísticamente poco importantes y no consistentes).
El nivel de evidencia se fundamenta en 10 ECA de calidad media-baja y pequeño tamaño muestral con baja consistencia entre ellos y riesgo de sesgos. Una primera RS30 revisa 5 ECA y apoya la ausencia de efecto de los corticoides inhalados para prevenir las sibilancias postbronquiolitis, si bien el número de participantes incluidos y la incapacidad para agrupar los resultados clínicos impedía el poder hacer recomendaciones sólidas. El posterior estudio de Ermers et al83, de mayor tamaño muestral y calidad, apoya los datos de su falta de eficacia como tratamiento preventivo de las sibilancias recurrentes (nivel I).
Castro Rodríguez et al4 han publicado recientemente una RS con MA sobre el papel de los corticoides inhalados en los niños<5 años con sibilancias recurrentes y/o asma, en el que se analizan 29 ECA (3.592 pacientes). Según este estudio, los corticoides inhalados son útiles en lactantes y preescolares con sibilantes recurrentes/asma para reducir las reagudizaciones al comparar con placebo, independientemente de la edad, diagnóstico, presencia de atopia, modo de dispensación y tipo de corticoide utilizado.
El panel responde de forma casi unánime sobre la no utilidad de los corticoides inhalados en el primer episodio de BA; pero se plantean dudas en los pacientes que presentan BA y posteriores sibilantes recurrentes, especialmente tras la publicación de la reciente RS de Castro Rodríguez et al4, aunque no se puede definir una pauta que sea más eficaz o segura, ni criterios clínicos que permitan predecir la respuesta.
Grado de recomendación: A
PV.1.2. ¿Son eficaces los corticoides orales en la prevención de las sibilancias postbronquiolitis?
Los corticoides orales no son eficaces en la prevención de las sibilancias postbronquiolitis, con un predominio de riesgos (exposición a medicación innecesaria, con potenciales efectos adversos) frente a beneficios (ausente).
El nivel de evidencia se fundamenta en 4 ECA de calidad media y pequeño tamaño muestral, recuperados de estudios sobre tratamiento con corticoides orales y que incluyen variables resultado a medio-largo plazo (entre 1–5 años) (nivel II-1). Los resultados de los ECA son consistentes, pues ninguno encuentra diferencias significativas en las variables analizadas.
Grado de recomendación: B
PV.1.3. ¿Es útil la realización de una prueba terapéutica con corticoides inhalados en los pacientes con BA con sibilancias mantenidas?
Esta pregunta ha sido de difícil resolución por el panel de expertos, en concordancia con lo expuesto en la pregunta P.V.1.1, en la que subyace la opinión de que existen evidencias suficientes para limitar el uso indiscriminado de los corticoides inhalados en este grupo. Existe, no obstante, acuerdo en que en los pacientes con BA con síntomas persistentes (15–30 días) pero no recurrencias, no debería realizarse la prueba terapéutica con corticoides inhalados.
El nivel de evidencia se fundamenta en 10 ECA de calidad media-baja y pequeño tamaño muestral con baja consistencia entre ellos y riesgo de sesgos (nivel II-1).
Grado de recomendación: B
2) Inhibidores de leucotrienos
PV.2.1. ¿Es eficaz el montelukast en la prevención de las sibilancias recurrentes postbronquiolitis? ¿Existe algún criterio clínico que permita predecir la eficacia de montelukast?
Aunque la eficacia de los antagonistas de los receptores de los leucotrienos es contradictoria, había razones para pensar que podían ser útiles en esta edad, en donde la mayoría de las sibilancias están asociadas a infecciones víricas de las vías respiratorias, en las que se libera gran cantidad de leucotrienos que, además de actuar como potentes broncoconstrictores, favorecen la inflamación neutrofílica en al vía aérea y la hiperreactividad bronquial.
Tal contradicción es patente en los resultados de los dos ECA realizados por el mismo grupo investigador, uno con calidad media-baja y pequeño tamaño muestral publicado en 200384 (que detecta una diferencia estadísticamente significativa en la ausencia de síntomas durante 24h en los cincos ítems en la fase de intervención) y otro con calidad media-alta y mayor tamaño muestral publicado en 200885 (que no encuentra ninguna diferencia significativa respecto al grupo control). Solo en el análisis post-hoc de 523 pacientes con síntomas persistentes (30% días libres de síntomas en semanas 1–2) sí se apreciaron diferencias en las semanas 3–24 en el porcentaje de días libres de síntomas: 5,7 (0,0–11,3) entre el grupo de montelukast a 4mg/día y grupo control y 5,9 (0,1–11,7) entre el grupo montelukast a 8mg/día y control; pero dadas las elevadas pérdidas postaleatorización del estudio (24%), las diferencias significativas encontradas en el análisis post-hoc deben ser confirmadas en futuros estudios85 (nivel II-1).
El panel responde de forma casi unánime sobre la no utilidad del montelukast en el primer episodio de BA. Dado el balance entre ausencia de beneficios (confirmado en el segundo ECA, de mayor calidad) y ausencia de riesgos, la decisión viene condicionada por la ausencia de eficacia y los costes asociados en la prevención de la enfermedad reactiva vías aéreas postbronquiolitis. Tampoco es posible definir una pauta que sea más eficaz o segura, ni criterios clínicos que permitan predecir la respuesta.
Grado de recomendación: B
PV.2.3. ¿Es útil la realización de una prueba terapéutica con montelukast en los pacientes con sibilancias mantenidas?
No se recomienda el ensayo terapéutico con montelukast en pacientes con síntomas persistentes (15–30 días). El panel comparte muchas de las reflexiones expuesta en el apartado PV.1.3., prevaleciendo la idea de evitar el sobretratamiento con montelukast en la BA.
Téngase presente que la pregunta se refiere a sibilancias mantenidas tras BA (15–30 días) no sibilancias recurrentes. En los lactantes que han presentado BA y presentan posteriores sibilancias recurrentes nos enfrentamos a la incertidumbre de cómo actuar (a nivel del tratamiento agudo y del tratamiento de mantenimiento), pues no se dispone de marcadores biológicos que permitan predecir con certeza a cuál de los grupos fenotípicos de Tucson86,87 descritos pertenece (sibilancias precoces transitorias, sibilancias persistentes no atópicas y sibilancias persistentes atópicas) y distinguir a los lactantes con sibilancias recurrentes que van a ser futuros asmáticos atópicos y que son, además, los que habiendo nacido con una función pulmonar normal presentarán un deterioro irreversible de ésta en los primeros años de la vida. Para identificar a este grupo de lactantes se describió el índice predictivo de asma (IPA)88 o modificaciones de éste89, con dudoso valor en la aplicación individual.
La decisión de cuándo iniciar un tratamiento de mantenimiento preventivo los niños menores de 3 años con sibilancias recurrentes resulta difícil y no es motivo de la presente Conferencia de Consenso.
El nivel de evidencia se fundamenta en los dos ECA referidos en el apartado previo (nivel II-1).
Grado de recomendación: B
3) Inmunoglobulinas
PV.3.1. ¿Es eficaz y útil la inmunoglobulina intravenosa hiperinmune frente a VRS (IgIV-VRS) como tratamiento preventivo para disminuir la frecuencia y gravedad de la BA por VRS en población de riesgo?
El panel de expertos considera que la IgIV-VRS no es recomendable como tratamiento preventivo en la BA, dado que el balance entre beneficios (disminución hospitalización) y riesgos (acceso IV, sobrecarga de volumen, crisis de cianosis en cardiópatas, etc) es desfavorable, máxime con la disponibilidad de anticuerpos monoclonales (palivizumab). Aunque en los estudios de evaluación económica se constata que palivizumab es una medicación más cara que la IgIV-VRS, se prefiere por su perfil de eficacia y seguridad. El panel de expertos pone especial énfasis en indicar que RespiGamR nunca ha sido comercializada en Europa, de ahí la no utilidad de la IgIV-VRS en nuestro medio.
El nivel de evidencia se fundamenta en 3 ECA de diferente calidad en lactantes hospitalizados con diferentes factores de riesgo, dos de los cuales encuentran diferencias significativas en la menor hospitalización por enfermedad respiratoria por VRS, con reducción del riesgo entre 5,590–12,8%91. La RS de Wang et al34 del año 2000 (actualmente retirada de la Colaboración Cochrane) recogía estos tres ECA con IgIV-VRS policlonal y también el Impact Study92, con anticuerpos monoclonales IM (palivizumab), lo que dado el gran tamaño muestral y potencia del ECA con palivizumab, distorsionaba los propios datos de la IgIV-VRS exclusivamente (nivel II-1).
Grado de recomendación: B
4) Palivizumab
PV.4.1. ¿Es eficaz el palivizumab como tratamiento preventivo para disminuir la frecuencia y gravedad de la BA por VRS en población de riesgo?
La literatura sobre palivizumab es amplia e incluye el debate sobre sus indicaciones, pues plantea siempre retos al médico (en términos de eficacia, seguridad y efectividad), al paciente (en términos de satisfacción y aceptabilidad) y al gestor (en términos de eficiencia, accesibilidad y equidad). Se debería indicar de forma muy selectiva a población de alto riesgo, que es donde se detecta una tasa de ingreso más alta y la gravedad de la enfermedad (estimada por el porcentaje de ingresos en cuidados intensivos, la necesidad de ventilación mecánica, duración de la oxigenoterapia y tiempo de estancia) es mayor que para el resto de ingresados. Un problema asociado es que no existe consenso respecto a los criterios de ingreso de los lactantes con BA y se detecta importante variabilidad en la práctica clínica (más a nivel interhospitalario que intrahospitalario)93.
Existen dos ensayos clínicos, uno en cada grupo de riesgo (prematuros 35SG92 y cardiopatías congénitas hemodinámicamente inestables94), que muestran, respectivamente, una reducción del riesgo de ingreso por infección respiratoria por VRS del 55% y 44% en una escala relativa y del 5,8% y 4,4% en términos absolutos (número necesario a tratar [NNT] de 17 y 23). Los resultados de ambos estudios, realizados con el mismo diseño y patrocinio, son consistentes en sus resultados. Sin embargo, en Impact Study92 los dos únicos pacientes ingresados que fallecen están en el grupo de intervención y se constata que el palivizumab resulta menos efectivo entre los grupos de mayor riesgo (<32SG y con DBP). De forma similar, en el ECA de Feltes et al94 entre los grupos de mayor riesgo (cardiopatías cianógenas) resulta menos efectivo.
Aunque ambos estudios son metodológicamente correctos y de calidad, podrían existir algunas limitaciones que tienen que ver con los criterios de selección (definición de cardiopatía hemodinámicamente significativa) y fundamentalmente con las medidas de efecto (ingreso hospitalario). Estas limitaciones afectarían al grado de evidencia con el que estos ensayos permiten contestar a la pregunta clínica de eficacia. En los dos ECA se ha empleado como medida de efecto principal el ingreso hospitalario por infección respiratoria por VRS. Considerando la ausencia de unos criterios clínicos especificados de hospitalización y la habitual heterogeneidad de esta decisión, existen dudas sobre la relevancia clínica de la medida de efecto. Estas dudas se atenuarían si la reducción de ingreso se acompañara de efecto en otras medidas con interés clínico como ingreso en UCI, necesidad de ventilación mecánica o mortalidad. En este sentido, contrasta el discreto pero significativo descenso de ingresos en UCI solo entre prematuros (no entre cardiópatas), con la ausencia de efecto para mortalidad o ventilación mecánica. De hecho, los pacientes tratados que ingresan no son más leves que los no tratados que ingresan.
El panel de expertos considera de forma unánime que palivizumab es eficaz como tratamiento preventivo, si bien el debate se plantea sobre el nivel de evidencia y grado de recomendación asignado: nivel I o nivel II-1 (descenso de nivel por las dudas sobre la importancia clínica de la medida de efecto). Los beneficios del palivizumab parecen merecer la pena frente a los perjuicios (no diferencias significativas en los efectos adversos), pero no sabemos si frente a los costes (no se aborda en los ECA). El balance riesgo-beneficios estará muy condicionado por los costes elevados de este anticuerpo monoclonal (existen numerosos estudios de evaluación económica con resultados contradictorios) y la potencial necesidad de redefinir las indicaciones de uso en aquellas poblaciones de mayor riesgo.
No existe consenso en cuanto al nivel de evidencia, habiéndose propuesto los niveles de evidencia I y II-1.
Grado de recomendación: en consonancia con la falta de consenso sobre el nivel de evidencia, el grado de recomendación podría ser A o B.
PV.4.2. ¿Es efectivo (en estudios observacionales) el palivizumab como tratamiento preventivo para disminuir la frecuencia y gravedad?
Existen múltiples estudios de cohortes que han evaluado la efectividad de palivizumab; en algunos de ellos se han comparado las cohortes tratadas con cohortes históricas o contemporáneas no tratadas. Se han publicado dos estudios realizados en España con cohortes de prematuros de 32SG (uno con control histórico, el estudio IRIS95, y otro sin control5) y uno con niños con cardiopatías hemodinámicamente significativas (el 85% con profilaxis completa con palivizumab; estudio CIVIC)96.
En los estudios que evalúan la reducción del riesgo tras la introducción del programa de profilaxis con palivizumab, con respecto controles históricos, se ha observado una reducción de ingresos por infección por VRS en niños prematuros de un 40–60%, con reducciones absolutas del riesgo muy variadas en función del nivel de riesgo de las cohortes. La disminución relativa del riesgo es similar a la observada en los ECA; aunque en términos absolutos la magnitud del efecto es discreta, especialmente en ciertos países. Cuando se ha medido la reducción de ingresos por IRA bajas o BA de cualquier etiología, se ha observado un descenso equivalente al esperado para los casos por VRS95, aunque en algún estudio se ha observado un mantenimiento o incluso aumento del riesgo97,98. En los trabajos que comparan cohortes tratadas con cohortes contemporáneas de menor riesgo no tratadas, dos estudios muestran un riesgo similar o incluso mayor en los tratados, debido al mayor riesgo basal de las cohortes tratadas99,100. Una comparación entre áreas de población similares con o sin programa de profilaxis solo encuentra una disminución del riesgo en un análisis del subgrupo de prematuros de alto riesgo (<33SG; 33–35SG con enfermedad pulmonar crónica)101. No existe información suficiente sobre efectividad en cuanto a mortalidad.
En nuestro país, el estudio IRIS ha encontrado en la cohorte de prematuros de 32SG tratada con palivizumab una reducción de riesgo de ingreso por infección por VRS, con respecto a la cohorte histórica, superior a la del ensayo clínico original (riesgo de ingreso en la cohorte tratada: 3,9%; en la cohorte control histórica: 13,2%). No obstante, podría haber diferencias epidemiológicas o en las características de los ingresos con el estudio Impact Study, ya que en el ensayo clínico el riesgo de ingreso por enfermedad respiratoria no relacionada con el VRS era en el grupo control del 14% (en comparación con el 10% por VRS), mientras que en el estudio IRIS los ingresos no relacionados con el VRS solo alcanzaban en el grupo control el 5,2% (en comparación con el 13,2% por VRS).
En Andalucía, el estudio del Grupo de Hospitales Benazuza5, encuentra en una cohorte de recién nacidos tratados con palivizumab un riesgo de ingreso por BA por VRS del 3,9% (para los ingresos por BA no relacionadas con el VRS el riesgo fue del 6,5%). En un estudio retrospectivo realizado años antes en la misma área geográfica14, se había encontrado un riesgo para el conjunto de BA de 10,6% en prematuros de <32SG y de 9,8% en cardiopatías con hiperaflujo pulmonar.
El estudio CIVIC96 ha encontrado en niños españoles con cardiopatías congénitas hemodinámicamente significativas, mayoritariamente tratados con palivizumab, un riesgo de ingreso por infección por VRS del 3,2% (2,32% entre los casos con profilaxis completa y 7,08% entre los que tuvieron profilaxis incompleta; no obstante, no detallan si el ingreso se produjo en periodo de cobertura de la profilaxis), inferior al observado en el ensayo clínico original (5,3%).
La información procedente de estudios observacionales con controles históricos (alguno de ellos realizado en nuestro país) sugiere que palivizumab tiene una efectividad similar a la observada en los ensayos clínicos, en cuanto a reducción del riesgo de hospitalización, pero no existe información en cuanto a frecuencia y gravedad de la BA (ingresos en UCI, necesidad de VM y mortalidad).
No existe consenso en cuanto al nivel de evidencia, habiéndose propuesto los niveles II-2 (estudios de cohortes) y III (reducción de nivel por limitaciones en cuanto a tipo de medida de efecto y control histórico).
Grado de recomendación: en consonancia con la falta de consenso sobre el nivel de evidencia, el grado de recomendación podría ser B o C.
Evaluación económica de la bronquiolitis agudaSiempre y cuando los resultados de una intervención médica en términos de eficacia, efectividad y seguridad sean positivos, la evaluación económica (eficiencia) es un pilar fundamental de apoyo en la posterior toma de decisiones.
En la práctica no existe, ni puede éticamente existir, un baremo a priori sobre los tratamientos que son soportables por el sistema de salud en términos de coste-efectividad. Sin embargo, sí se puede comparar el impacto farmacoeconómico de diversos fármacos en diferentes situaciones clínicas, y así tener una idea global del coste-efectividad de cada uno de ellos. Aunque la caracterización genérica del impacto farmacoeconómico no es tarea fácil, ya existen aproximaciones a esta materia y se pueden establecer umbrales que varían sensiblemente por países. Como consenso de lo publicado, en nuestro estudio consideramos el umbral de 30.000€/ años de vida ajustados por calidad (AVAC) como un coste-efectividad incremental asumible por el sistema sanitario.
Los estudios de costes habituales en la BA se concentran en las estrategias preventivas frente al VRS, fundamentalmente enfocadas en la inmunoprofilaxis con palivizumab. Es llamativo el alto número de evaluaciones económicas en relación con palivizumab (en donde solo se han realizado dos ECA) y el anecdótico número de evaluaciones económicas en el conjunto de otras intervenciones terapéuticas (en el que detectamos cientos de ECA).
La evidencia en inmunoprofilaxis con palivizumab se fundamenta en 24 estudios de evaluación económica con criterios de calidad muy variables y 5 RS (3 realizados en Reino Unido102–104, uno en Estados Unidos105 y uno en Canadá106). Los 3 datos de efectividad valorados con mayor frecuencia son: episodios de hospitalización evitados (EHE, generalmente indicando el coste y el NNT) en 11 estudios, años de vida ganados (AVG) en 10 estudios y AVAC en 7 estudios.
Existe una gran variación en los resultados de los distintos estudios de evaluación económica, tal como se especifica en la RS de Wang et al publicada en 2008104: los EHE varían entre 5.307–69.240£ (media 33.1900£/EHE, DE: 17.807£), los AVG entre 5.288–1.104.351£ (media 202.104£/AVG, DE: 78.066£) y los AVAC entre 3.164–1.489.668£ (media 547.817£/AVAC, DE: 169.082£). Se realiza análisis de sensibilidad en 13 estudios. Las modificaciones introducidas respecto al caso basal para tratar la incertidumbre han sido muy variadas, pero principalmente: eficacia de la profilaxis, costes de palivizumab, probabilidad de hospitalización, coste medio de hospitalización, peso del niño y secuelas (asma/sibilancias).
No existe consistencia entre estudios, lo que es opinión común de las 5 RS102–106 que analizan los estudios de evaluación económica de palivizumab:
- •
La RS de Kamal-Bahl et al105 concluye que el coste potencial de la profilaxis farmacológica frente a VRS excede mucho el actual coste de hospitalización. Los resultados divergentes pueden ser explicados por las diferencias metodológicas de los estudios, las diferentes asunciones del modelo y por la pobre calidad de algunas evaluaciones económicas. También cabe considerar el marcado sesgo del financiador: en el análisis de subgrupos se encontraron marcadas diferencias entre los estudios financiados (4 estudios, todos efectivos en cuanto al coste) y los no financiados por la industria farmacéutica (8 estudios, ninguno efectivo en cuanto al coste). Opinan que el coste-efectividad incremental (CEI) mejoraría si se demostrara que la profilaxis disminuye la mortalidad por VRS y disminuye las sibilancias recurrentes; además, recomiendan comparar palivizumab con medidas preventivas no farmacológicas.
- •
Las dos revisiones de Embleton et al102,103 también determinan que los estudios de evaluación económica ofrecen datos discrepantes en relación con el diferente método de evaluación económica, asunciones, país, tipo de población y calidad del estudio. Abogan por limitar las indicaciones a prematuros con enfermedad pulmonar crónica que requieran oxígeno domiciliario y con cardiopatías congénitas hemodinámicamente significativas; y no justifican su uso en prematuros sin factores de riesgo asociados.
- •
La RS de Dunfield et al106 comenta que la marcada variabilidad de los estudios incluidos puede ser debida a diferente origen de los datos de costes. La profilaxis con palivizumab no es efectiva en cuanto al coste cuando se utiliza en todos los niños en los que está recomendada, por lo que, dado el alto coste de esta medicación, solo justifican el uso en niños de muy alto riesgo.
- •
La RS de Wang et al104 comenta que la gran variabilidad en los resultados de los estudios incluidos se debe, principalmente, a las diferencias en la asunción de la mortalidad prevenida por palivizumab (no demostrada en ECA). En los estudios de evaluación económica en prematuros (con o sin enfermedad pulmonar crónica) el CEI de los estudios varía hasta 17 veces en AVG y hasta 465 veces en AVAC; en los estudios realizados en niños con cardiopatías congénitas estas diferencias son menos marcadas (1,5 y 9 veces, respectivamente).
C.1. ¿En qué grupo de niños prematuros, por edad gestacional, patología asociada y edad posconcepcional, podemos considerar efectiva en cuanto al coste la inmunoprofilaxis con palivizumab en nuestro medio?
Las estimaciones disponibles de coste-efectividad de la inmunoprofilaxis con palivizumab presentan una gran heterogeneidad, dependiente principalmente de las asunciones consideradas en los distintos modelos económicos. Solo aceptando la asunción de que palivizumab reduce la mortalidad y el riesgo de asma, este tratamiento resultaría efectivo en cuanto al coste en los grupos de mayor riesgo.
El CEI umbral varía en cada país (aunque mayoritariamente se considera una intervención como efectiva en cuanto al coste por debajo de 30.000€/AVAC, también se ha referido umbrales superiores e inferiores en los estudios) y, aunque algunos estudios confirman un resultado favorable a la profilaxis con palivizumab107–114, el resto de estudios individuales y las diferentes RS analizadas plantean que la profilaxis con palivizumab es coste-efectiva en los grupo de mayor riesgo, habiéndose recomendado un uso más restrictivo que las recomendaciones de la AAP: prematuros 23–32SG con EPC activa y prematuros 23–32SG sin EPC que presenten múltiples factores de riesgo de hospitalización115, prematuros con EPC grave116, prematuros 32SG dados de alta con oxígeno117, prematuros con EPC con 2 o más factores de riesgo104 y cardiopatías congénitas hemodinámicamente significativas118.
El panel de expertos no ha alcanzado un consenso sobre los grupos de riesgo en los que palivizumab podría ser efectivo en cuanto al coste. Las opciones propuestas serían una más restrictiva limitada a prematuros de 23–32SG con EPC, o sin EPC con múltiples factores de riesgo o con EPC grave; y otra más amplia (vinculada a la aceptación de todas las asunciones) que contemplaría: prematuros (32SG con 6 meses de edad o 28SG con 12 meses de edad) o con EPC activa (con 2 años de edad) y prematuros de 32–35SG (con 6 meses de edad) con 2 factores de riesgo: edad
No existe consenso sobre el nivel de evidencia, habiéndose propuesto niveles I y II.
Grado de recomendación: en consonancia con los niveles de evidencia propuestos, el grado de recomendación podría ser A o B
C.2. ¿En qué grupo de niños con cardiopatías congénitas, por tipo de cardiopatía y edad postconcepcional, podemos considerar efectiva en cuanto al coste la inmunoprofilaxis con palivizumab en nuestro medio?
No se ha alcanzado un consenso sobre el grupo de niños con cardiopatía congénita en los que la inmunoprofilaxis con palivizumab podría ser efectiva en cuanto al coste. No obstante se ha considerado que su uso podría ser eficiente en<2 años con cardiopatía congénita (no corregida o con intervención paliativa) con alteración hemodinámica significativa, en tratamiento con insuficiencia cardiaca, hipertensión pulmonar moderada o cardiopatías cianógenas.
No existe consenso sobre el nivel de evidencia, habiéndose propuesto nivel II.
Grado de recomendación: en consonancia con el nivel de evidencia propuesto, el grado de recomendación podría ser B
C.3. ¿Son aceptables las asunciones que se han empleado en los modelos económicos de efectividad en cuanto al coste de palivizumab?
Existen dudas sobre la validez de las asunciones de que la inmunoprofilaxis con palivizumab reduce la mortalidad o el riesgo de asma, ya que no se sustentan en los resultados de ensayos clínicos, sino que son extrapolaciones a partir de estudios observacionales sobre riesgos asociados a ingreso por infección por VRS.
La no consideración de la mortalidad de muchos modelos se ha basado en los resultados de los ECA, en los que no se observó reducción significativa de la mortalidad. No obstante, había diferencias entre los 2 ensayos clínicos, ya que mientras en el estudio sobre cardiópatas los tratados tenían menor mortalidad (aunque no fuera significativa la diferencia) con los prematuros ocurrió lo contrario (aunque ninguna de las muertes fuera achacable a la infección por VRS o al tratamiento). Utilizar los resultados de estudios de cohortes de pacientes que ingresaron por una IRA por VRS, comparando la mortalidad posterior con la de controles que no habían ingresado, resulta arriesgado, ya que es asumir que la mortalidad es achacable al ingreso (y no a otros riesgos previos) y que es evitable con palivizumab. Algo parecido pasaría con el riesgo de asma; en este caso tendríamos además la limitación de que el propio ingreso podría ser una manifestación inicial de predisposición asmática.
No existe consenso sobre el nivel de evidencia.
FinanciaciónFinanciado con una beca de la Fundación-Hospital Torrevieja (código de protocolo: BECA0001).
Conflictos de interesesTodos los autores implicados en la elaboración de este documento han realizado una declaración explícita de los conflictos de intereses por escrito. No constan conflictos de intereses que puedan influir en el contenido de este documento. No obstante, varios autores (FMT, JFS, LGMA, MMEB, MPC, RRF, SLLA y XCE) han declarado su participación en ponencias, congresos y proyectos patrocinados por distintas empresas de la industria farmacéutica relacionadas con el tema tratado (Abbott, ALK-Abello, GSK y MSD fundamentalmente).
Jesús M. Andrés de Llano. Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
María Aparicio Rodrigo. Centro de Salud Entrevías, Área 1 de Atención Primaria, SERMAS, Madrid.
Ana Fe Bajo Delgado. Servicio de Pediatría, Hospital Virgen Concha Zamora.
Albert Balaguer. Servicio de Pediatría, Hospital General de Catalunya, Universitat Internacional de Catalunya, Barcelona.
Antonio Bonillo Perales. Servicio de Pediatría, Hospital de Torrecárdenas, Almería.
José Cristóbal Buñuel Álvarez. Centro de Salud, ABS Girona-4, ICS, Gerona.
Andrés Canut Blasco. Sección Microbiología, Hospital Santiago Apóstol, Osakidetza-Servicio Vasco de Salud, Vitoria.
José María Eiros Bouza. Servicio de Microbiología, Hospital Clínico Universitario de Valladolid, Facultad de Medicina de Valladolid, Valladolid.
Jordi Fàbrega Sabaté. Servicio de Pediatría, Hospital Universitari Germans Trias i Pujol, Badalona.
José Elviro Fernández Alonso. Servicio de Pediatría, Complejo Asistencial de Palencia, Palencia.
Mercedes Fernández Rodríguez. Centro de Salud EAP Potes, SERMAS, Madrid.
Santiago Lapeña López de Armentia. Servicio de Pediatría, Complejo Asistencial de León, León.
Javier López Ávila. Centro de Salud San Bernardo Oeste, Salamanca.
Cristina Molinos Norniella. Servicio de Pediatría, Hospital de Cabueñes, Gijón.
Gloria Orejón de Luna. Centro de Salud General Ricardos, Área 11 de Atención Primaria, SERMAS, Madrid.
Svetlana Todorcevic. Servicio de Pediatría, Hospital Materno Infantil de Gran Canaria, Las Palmas de Gran Canaria.
Documentalistas:
María García-Puente Sánchez. Hospital de Torrevieja, Alicante.
Beatriz Muñoz Martín. Complejo Asistencial de Zamora, Zamora.
M. Teresa Callén Blecua. Asociación Española de Pediatría de Atención Primaria (AEPap), San Sebastián.
Xavier Carbonell Estrany. Sociedad Española de Neonatología (SEN), Barcelona.
Servando García de la Rubia. Sociedad Española de Pediatría Extrahospitalaria y de Atención Primaria (SEPEAP), Murcia.
Luís García Marcos. Sociedad Española de Inmunología Clínica y Alergia Pediátrica (SEICAP), Murcia.
Federico Gutiérrez Larraya. Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas (SECPCC), Madrid.
Javier Korta Murua. Sociedad Española de Neumología Pediátrica (SENP), San Sebastián.
Carles Luaces Cubells. Sociedad Española de Urgencias Pediátricas (SEUP), Barcelona.
Federico Martinón Torres. Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), Santiago de Compostela, La Coruña.
Manuel Praena Crespo. Asociación Española de Pediatría de Atención Primaria (AEPap), Sevilla.
Rosa Rodríguez Fernández. Sociedad Española de Infectología Pediátrica (SEIP), Madrid.
Jesús Sánchez-Etxaniz. Sociedad Española de Urgencias Pediátricas (SEUP), Baracaldo, Vizcaya.
Véase tabla A1.
Resumen de las respuestas planteadas en la Conferencia de Consenso (con niveles de evidencia y grados de recomendación)
| Respuestas a las preguntas planteadas en la conferencia de consenso | NE | GR |
| Epidemiología. Riesgo de bronquiolitis. Factores de riesgo | ||
| E.1.1. ¿Cuál es el riesgo de BA en nuestro medio? | ||
| Para población menor de dos años la frecuencia de ingreso por BA se sitúa entre 1–3,5% y para IRA de vías bajas por VRS entre el 0,8–2,5% | II | |
| Las estimaciones de frecuencia de consultas en atención primaria se sitúa entre 4–20% y en urgencias entre 1–2% | III | |
| Para población de riesgo la frecuencia recogida en la mayoría de los estudios se refiere a ingresos por IRA por VRS: ≤32 SG entre 4,4–18%; niños con DBP entre 7,3–42%, niños con CC entre 1,6–9,8% | II y III | |
| E.1.2. ¿Qué factores deben ser tenidos en cuenta para la estimación del riesgo de BA en nuestro medio? | ||
| Los principales factores a considerar en la estimación del riesgo de BA son: prematuridad, DBP, EPC, CC (fundamentalmente las complejas, hemodinámicamente inestables o con hiperaflujo pulmonar), edad al inicio de la epidemia inferior a 3–6 meses: Otros factores son: hermanos mayores o asistencia a guardería, sexo masculino, exposición a tabaco (fundamentalmente durante la gestación), lactancia materna durante menos de 1–2 meses y variables asociadas a bajo nivel socioeconómico | II y III | B |
| Perfil etiológico de la bronquiolitis aguda y patrones clínicos asociados | ||
| E.2.1. ¿Cuál es el perfil etiológico habitual en la BA? | II | |
| El VRS es el agente dominante de las BA, constituyendo el 56% de los casos ingresados por debajo de los dos años (intervalo 27–73%). Otros virus implicados por orden descendente de frecuencia son los rinovirus, adenovirus, metapneumovirus, virus de la gripe, parainfluenza, enterovirus y bocavirus | ||
| El porcentaje de BA con virus identificado en los trabajos en que se ha recurrido a técnicas de reacción en cadena de polimerasa no supera el 75–80%. Entre el 9% y el 27% de los casos presentan coinfección viral | ||
| E.2.2. ¿Existe algún patrón clínico característico de las BA por VRS? | III | C |
| La clínica no resulta útil para diferenciar la etiología de la BA. Aunque las BA por VRS tienen más sibilantes y trabajo respiratorio, mayor duración de síntomas y oxigenoterapia y se asocian a menor uso de antibióticos, estos datos están asociados a la menor edad de los pacientes que las presentan y no permiten predecir la etiología | ||
| E.2.3. ¿La identificación etiológica es útil de cara al manejo terapéutico o el pronóstico de los pacientes con BA? | III y IV | C |
| En general, la identificación etiológico no resulta útil de cara al manejo de los pacientes con BA. No obstante, en lactantes pequeños (< 3 meses) con BA febriles en el medio hospitalario, la identificación de un VRS u otros virus respiratorios puede facilitar el manejo conservador de dichos pacientes y ahorrar intervenciones diagnósticas y/o terapéuticas | ||
| Validez de las pruebas de diagnóstico rápido de infección por VRS | ||
| D.1.1. ¿Cuál es la muestra respiratoria más apropiada para la identificación del VRS en pacientes con BA? | II | B |
| Se recomienda la recogida de aspirados nasofaríngeos para la identificación del VRS | ||
| D.1.2. ¿Son válidas las pruebas de diagnóstico rápido de infección VRS (enzimoinmunoanálisis, inmunocromatografía, inmunoensayo óptico e inmunofluorescencia directa) en pacientes con BA? | II | B |
| Las pruebas de diagnóstico rápido de infección por VRS son aceptablemente válidas, presentando una moderada-alta sensibilidad y una alta especificidad en relación a otras pruebas de referencia (cultivo y/o reacción en cadena de polimerasa). Las pruebas más empleadas, por su escasa complejidad y rapidez (técnicas de enzimoinmunoanálisis, inmunocromatografía e inmunoensayo óptico), presentan una menor sensibilidad que la inmunofluorescencia directa. Con ellas, un resultado positivo es válido, pero un resultado negativo no permite descartar con suficiente seguridad la presencia de infección | ||
| D.1.3. ¿Se recomienda el empleo rutinario de las pruebas de diagnóstico rápido de infección VRS en los pacientes con BA? | III | C |
| No se recomienda el empleo rutinario de pruebas de diagnóstico rápido de infección por VRS en los pacientes con BA | ||
| D.1.4. ¿Debe considerarse en el empleo de las técnicas de diagnóstico rápido algún criterio relacionado con la edad, ámbito de asistencia del paciente (Cuidados Intensivos, hospitalización, Urgencias, Primaria), antecedentes o gravedad? | IV | D |
| Podría considerarse el uso de pruebas de diagnóstico rápido de VRS en el medio hospitalario con pacientes menores de 3 meses. Aunque los resultados negativos de estas pruebas no permiten descartar la presencia de infección por VRS y por lo tanto evitar el aislamiento de los pacientes, en el curso de epidemias, un resultado positivo facilitaría la agrupación de enfermos hospitalizados | ||
| Pruebas diagnósticas en el manejo de la bronquiolitis aguda: radiografía de tórax, pulsioximetría y pruebas de cribado de infección bacteriana | ||
| D.2.1. ¿Resulta útil la realización de una radiografía de tórax para el manejo de la BA? | II | B |
| No se recomienda el uso rutinario de la radiografía de tórax en la BA. | ||
| D.2.2. ¿Existe algún criterio que permita identificar a los pacientes en los que la radiografía de tórax sea útil? | IV | D |
| No existen signos o síntomas concretos que permitan identificar a los pacientes que se beneficiarán de la realización de una radiografía de tórax. No obstante podría considerarse en pacientes con BA que presentan un deterioro clínico evidente o en los que existen dudas diagnósticas | ||
| D.2.3. ¿Resulta útil la medición de la saturación de oxígeno en los pacientes con BA? | III | C |
| La medición de la saturación de oxígeno resulta útil en la valoración inicial o en el control de los cambios clínicos de los pacientes con BA. Sin embargo, no parece justificada la monitorización rutinaria mantenida | ||
| D.2.4. ¿Existe algún criterio que permita identificar a los pacientes que precisan la medición de la saturación de oxígeno? | III y IV | C |
| Se recomienda la medición de la SatO2 en la valoración inicial de todos los pacientes y en el control de cambios clínicos en los pacientes con compromiso respiratorio. | ||
| D.2.5. ¿Qué puntos de corte de la saturación de oxígeno orientan en el manejo del paciente con BA? | C | |
| Los pacientes con SatO2>94% y sin otros signos o síntomas de compromiso respiratorio o afectación general pueden ser manejados habitualmente a nivel ambulatorio | IV | |
| Los pacientes con SatO2<92% requieren oxigenoterapia | III | |
| En pacientes con SatO2 entre 92–94% se valorará individualmente la administración de oxígeno y el manejo ambulatorio, considerando conjuntamente otros parámetros: trabajo respiratorio, alimentación, ambiente familiar, posibilidad de control, etc | IV | |
| D.2.6. ¿Existe algún criterio que permita identificar a los pacientes con BA que requieren la realización de cribado de infección bacteriana? | III y IV | C |
| No existen criterios clínicos con suficiente capacidad predictiva como para seleccionar los casos que se beneficiarían de dichas pruebas; podría considerarse su realización en pacientes con fiebre persistente, edad inferior a un mes o con signos o síntomas de gravedad | ||
| Factores pronósticos de gravedad en bronquiolitis agudas | ||
| PN.1.1. ¿Qué factores de riesgo se asocian con mayor gravedad? | B | |
| En pacientes ingresados con BA son factores de riesgo documentados de estancias prolongadas o ingreso en UCIP: la displasia broncopulmonar y/o enfermedad pulmonar crónica, la prematuridad, las cardiopatías congénitas y la edad menor de 3 meses | II y IV | |
| Son marcadores de gravedad asociados a la indicación de ingreso en pacientes atendidos en urgencias y/o a la duración de la estancia hospitalaria en pacientes ingresados: el aspecto tóxico, la taquipnea, la hipoxia (SatO2<92%), la presencia de atelectasia o infiltrado en la radiografía de tórax, el trabajo respiratorio aumentado, los signos de deshidratación, la taquicardia y la fiebre | III | |
| PN.1.2. ¿Existe algún modelo predictivo válido de gravedad? | II | B |
| Aunque existen diversos modelos predictivos, ninguno ha mostrado suficiente validez como para recomendar su uso en la práctica clínica | ||
| PN.1.3. ¿Qué factores de riesgo o marcadores clínicos de gravedad deben ser considerados en la decisión de ingreso hospitalario? | III y IV | C |
| En la decisión de ingreso hospitalario deben considerarse los siguientes factores de riesgo: prematuridad, DBP y/o EPC, CC y edad menor de 3 meses. Así mismo se deben tener en cuenta los marcadores de gravedad: presencia de apneas, aspecto tóxico, hipoxia (cianosis, SatO2 inferior a 92%), taquipnea (según edad), rechazo de tomas o problemas de hidratación. Además, debe valorarse la capacidad del entorno familiar para realizar los cuidados que requiere el paciente con BA | ||
| PN.1.4. ¿Qué factores de riesgo o marcadores clínicos de gravedad deben ser considerados en la decisión de ingreso en UCI? | IV | D |
| No existen criterios específicos de ingreso en UCIP aplicables a pacientes con BA, por lo que les serían aplicables los criterios generales | ||
| Escalas de valoración de síntomas o gravedad | ||
| PN.2.1. ¿Existe alguna escala más válida y precisa para la valoración de síntomas o gravedad de BA? | III | C |
| Ninguna escala de valoración de síntomas o gravedad de BA ha demostrado ser más válida o precisa como para recomendar su aplicación preferente en la práctica clínica | ||
| PN.2.2. ¿Qué síntomas o signos deben incluirse en la valoración de la gravedad de la BA? | ||
| Los principales síntomas o signos que deben considerarse en la valoración de la gravedad de la BA son la hipoxia, la intensidad y extensión de sibilantes y retracciones torácicas y la FR. Otros signos o síntomas a considerar son la FC, el nivel de conciencia, el grado de hidratación, la presencia de apneas y otros signos directos o indirectos de compromiso respiratorio (rechazo de tomas, tos, capacidad de vocalización, grado de ventilación) | II y III | B |
| Toda valoración de síntomas o signos de gravedad debe realizarse tras una adecuada aspiración secreciones nasofaríngeas, para mejorar la precisión de las mediciones | IV | D |
| Riesgo de asma postbronquiolitis | ||
| P.3.1. ¿Es la BA un factor de riesgo independiente de asma? | II | B |
| Parece existir una consistente y fuerte asociación entre ingreso por BA o IRA baja antes de los dos años y episodios de sibilantes recurrentes en los primeros cinco años de vida. Sin embargo no está claro si en años posteriores dicha asociación se prolonga, existiendo información discordante sobre la asociación entre ingreso por BA o IRA baja y asma | ||
| Tratamiento de la bronquiolitis aguda | ||
| Medidas de soporte | ||
| T.1.1. ¿Debe hacerse alguna recomendación específica sobre el uso de tratamiento de soporte (fluidoterapia, suplementos de oxígeno, desobstrucción nasal, posición) en el manejo de la BA? | C | |
| No existe un tratamiento de soporte específico en el manejo de la BA. Se consideran recomendaciones basadas en la opinión de expertos y en la buena práctica clínica las siguientes: | ||
| Los niños con dificultad respiratoria grave y/o cianosis y/o SatO2<92% deben recibir O2 suplementario | II-2 | |
| Se recomienda aspirar las secreciones respiratorias antes de las tomas, antes de valorar la gravedad, antes de cada tratamiento inhalado y cuando se objetiven signos de obstrucción de vías altas | III y IV | |
| Se recomienda aplicar medidas posturales: elevación de la cabecera de la cuna | III y IV | |
| Se debe valorar el estado de hidratación y la capacidad de tomar líquidos | III y IV | |
| Se recomienda fraccionar y/o espesar las tomas si se objetiva dificultad para la ingesta | III y IV | |
| La alimentación por SNG puede ser una opción en los niños con riesgo de deshidratación y desnutrición | III y IV | |
| En los niños más graves o en los que no toleren la vía oral se recomienda canalizar una vía e hidratar vía i.v. | II-2 | |
| Evitar exposición al tabaco | III y IV | |
| Broncodilatadores | ||
| T.2.a.1. ¿Es eficaz el salbutamol inhalado en el tratamiento de la BA? | I y II-1 | A |
| No se recomienda el uso rutinario de salbutamol en el tratamiento de la BA, por tener una relación beneficio-riesgo desfavorable | ||
| T.2.a.2. ¿Es eficaz el salbutamol oral en el tratamiento de la BA? | II-1 | B |
| No debe emplearse el salbutamol oral en el tratamiento de la BA, por tener con una relación beneficio-riesgo muy desfavorable | ||
| T.2.a.3. ¿Es útil la realización de una prueba terapéutica con salbutamol inhalado de forma sistemática en la BA? | III y IV | D |
| El ensayo terapéutico con salbutamol inhalado es una opción alternativa en BA de intensidad moderada-grave (especialmente en los mayores de 6 meses y/o con historia personal/familiar de atopia). En cualquier caso, si se decide realizar un ensayo terapéutico, este debería ser suspendido si tras su aplicación no se objetiva mejoría clínica | ||
| T.2.b.1. ¿Es eficaz la adrenalina nebulizada en el tratamiento de la BA? | ||
| No se recomienda el uso rutinario de adrenalina nebulizada en el tratamiento de la BA, por tener una relación beneficio-riesgo parcialmente desfavorable | I y II-1 | A |
| Por su perfil terapéutico y de seguridad sería el broncodilatador preferido en urgencias y en pacientes hospitalizados | IV | D |
| T.2.b.2. ¿Es eficaz la adrenalina subcutánea en el tratamiento de la BA? | II-1 | B |
| La adrenalina subcutánea no es eficaz en la BA | ||
| T.2.b.3. ¿Es útil la realización de una prueba terapéutica con adrenalina nebulizada de forma sistemática en la BA? | II-1, III y IV | B |
| El ensayo terapéutico con adrenalina nebulizada es una opción alternativa en BA de intensidad moderada-grave (especialmente en los menores de 6 meses) y en pacientes hospitalizados o atendidos en urgencias o en centros de salud, si hay posibilidad de observación. En cualquier caso, si se decide realizar un ensayo terapéutico, este debería ser suspendido si tras su aplicación no se objetiva mejoría clínica | ||
| T.2.b.4. ¿Es más eficaz la adrenalina que el salbutamol? | II-1 | B |
| La adrenalina constituye el agente broncodilatador de primera elección en el tratamiento de la BA por su relación entre riesgos, beneficios y costes | ||
| T.2.c.1. ¿Es eficaz el bromuro de ipratropio nebulizado en el tratamiento de la BA? | II-1 | B |
| El bromuro de ipratropio no es eficaz en la BA | ||
| Corticoides | ||
| T.3.1. ¿Son eficaces los corticoides inhalados en el tratamiento de la BA? | I | A |
| Los corticoides inhalados no son útiles en el tratamiento de la BA por tener una relación beneficio-riesgo desfavorable | ||
| T.3.2. ¿Son eficaces los corticoides sistémicos en el tratamiento de la BA? | II-1 | B |
| Los corticoides sistémicos no parecen útiles en el tratamiento de la BA, aunque presentan equilibrio entre riesgos (potenciales, aunque poco constatados por el escaso tiempo de aplicación) y beneficios (diferencias significativas en niños atendidos en urgencias con corticoides orales durante 3–5 días, principalmente), por lo que no podría considerarse inadecuado su uso restringido | ||
| Ribavirina | ||
| T.4.1. ¿Es eficaz la ribavirina nebulizada en el tratamiento sistemático de la BA por VRS? | I y II1 | A |
| No se debe considerar su uso sistemático, dado el predominio de los riesgos (problemas de administración, efectos secundarios y teratogenicidad) sobre los beneficios (cierta mejoría en algunas variables, no consistente entre los estudios y marginal en la mayoría de los casos), sin perder en cuenta los costes económicos de su administración | ||
| T.4.2. ¿Es más útil la ribavirina en algún grupo de pacientes? (relación riesgo-beneficio) | IV | D |
| El efecto de la ribavirina tiene un escaso impacto clínico; no obstante, podría considerarse su uso restringido en pacientes con infecciones respiratorias por VRS graves de alto riesgo | ||
| Antibióticos | ||
| T.5.1. ¿Son eficaces los antibióticos en el tratamiento de la BA? | II-1 | B |
| Los antibióticos no son eficaces en la BA y su uso se considera inapropiado, por el claro predominio de riesgos (favoreciendo la exposición innecesaria y sus consecuencias sobre resistencias bacterianas, efectos adversos y costes) sobre beneficios (posibilidad de tratar pacientes con infección bacteriana, pero son infrecuentes y no graves en su mayoría) | ||
| Suero salino hipertónico | ||
| T.6.1. ¿Es eficaz el suero salino hipertónico nebulizado en el tratamiento de la BA? | I | A |
| El suero salino hipertónico es eficaz y útil en el manejo de la BA del niño hospitalizado, por tener una relación favorable entre riesgos (no constatados), beneficios (en días de hospitalización, mejoría clínica en los 3 primeros días y potencial disminución de la hospitalización) y costes (prácticamente nulo, salvo la adquisición del nebulizador). Se plantea la duda de que la pauta utilizada (2–4ml con dosis repetidas cada 8h (o más frecuentemente? y durante 5 días) sea factible en el medio ambulatorio (urgencias o domicilio) | ||
| T.6.2. ¿Debe usarse asociado a broncodilatadores? | IV | D |
| De momento los estudios publicados abogan por el uso simultáneo de las nebulizaciones de suero salino hipertónico con broncodilatadores (beta-2-adrenérgicos o adrenalina), si bien no hay datos que sugieran sinergia; caben dos consideraciones simultáneas: la aplicación actual de suero salino hipertónico con broncodilatadores tendría el teórico beneficio de evitar el potencial broncoespasmo de una solución hipertónica en el árbol bronquial; si se considera la utilización de broncodilatadores en el manejo de la BA, considerar vehiculizarlos mejor con salino hipertónico que con salino fisiológico | ||
| Inmunoglobulinas | ||
| T.7.1. ¿Es eficaz la inmunoglobulina IV en el tratamiento de la BA? | I | A |
| La inmunoglobulina intravenosa no es eficaz en el tratamiento de la BA, presentando un balance desfavorable entre riesgos (potenciales), beneficios (no constados) y costes (elevados) | ||
| T.7.2. ¿Es eficaz la inmunoglobulina aerosolizada en el tratamiento? | II-1 | B |
| La inmunoglobulina aerosolizada no es eficaz en el tratamiento de la BA | ||
| Medidas de soporte respiratorio | ||
| T.8.1. ¿Debe hacerse alguna recomendación específica sobre el tipo de soporte respiratorio en la BA? | ||
| El soporte respiratorio de la BA no requiere recomendaciones específicas respecto a otras entidades con dificultad respiratoria, salvo quizás el predominio en esta entidad del fracaso respiratorio hipercápnico y la utilidad de la ventilación no invasiva | III y IV | D |
| En la CPAP el balance entre riesgos (método de ventilación no invasiva, sin efectos adversos constatados) y beneficios (mejoría clínica y gasométrica a corto plazo, pero sin correlato con otras medidas de impacto clínico, como ingreso) puede ser favorable en las BA que presentan dificultad respiratoria moderada-grave o apnea recurrente, especialmente por la posibilidad de evitar intubación y ventilación mecánica de estos pacientes | II-2 y III | B |
| T.8.2. ¿Existen criterios clínicos que delimiten los pacientes que requieren un aumento del soporte respiratorio (CPAP, ventilación con presión positiva intermitente, ventilación de alta frecuencia y oxigenación con membrana extracorpórea)? | ||
| En la BA son aplicables los criterios habituales de manejo de pacientes con dificultad respiratoria y las distintas modalidades de ventilación mecánica | III y IV | D |
| Se ha propuesto la ventilación no invasiva (CPAP o BiPAP) como una alternativa o paso intermedio, antes de la ventilación invasiva, de forma particular en aquellos pacientes con crisis de apnea frecuentes | II-2 y III | B |
| T.8.3. ¿Es eficaz el heliox en el tratamiento de la BA? | II-1 y III | B |
| Se debe considerar el uso selectivo del heliox en BA moderada-grave utilizado con mascarilla con reservorio y de forma continua con un concentración 70/30; en los casos de BA grave y/o refractarios al tratamiento con heliox a través de mascarilla con reservorio se recomienda utilizar el heliox combinado con CPAP | ||
| T.8.4. ¿Es eficaz el surfactante en el tratamiento de la BA? | II-1 | B |
| Se puede considerar el uso selectivo del surfactante en los casos de BA grave que precisen ventilación mecánica, dada la favorable relación entre beneficios (menor días de ingreso en cuidados intensivos y necesidad de ventilación mecánica) y riesgos (nulo). Aunque no hay estudios de costes al respecto, es preciso tener en cuenta que las preparaciones de surfactante son caras | ||
| T.8.5. ¿Son eficaces las metilxantinas en el tratamiento de la BA? | ||
| No se recomienda el uso general de las metilxantinas en el tratamiento de la BA. | IV | D |
| Se podrían considerar como de uso alternativo en la BA con apnea en neonatos y/o en lactantes con antecedentes de prematuridad | III | C |
| T.8.6. ¿Es eficaz el óxido nítrico en el tratamiento de la BA? | IV | D |
| El óxido nítrico no es eficaz en el tratamiento de la BA | ||
| Fisioterapia | ||
| T.9.1. ¿Es eficaz la fisioterapia en el tratamiento de la BA | II-1 | B |
| No se recomienda el uso de fisioterapia respiratoria en el tratamiento de la BA | ||
| Otras intervenciones | ||
| T.10.1. ¿Es eficaz la DNAsa recombinante humana nebulizada en el tratamiento de la BA? | I | A |
| La DNAasa recombinante humana nebulizada no es eficaz en el tratamiento de la BA. | ||
| T.10.2. ¿Es eficaz el interferón IM en el tratamiento de la BA? | II-1 | B |
| El interferón IM no es eficaz en el tratamiento de la BA | ||
| T.10.3. ¿Es eficaz la furosemida nebulizada en el tratamiento de la BA? | II-1 | B |
| La furosemida nebulizada no es eficaz en el tratamiento de la BA | ||
| Prevención de la bronquiolitis aguda | ||
| Corticoides | ||
| PV.1.1. ¿Son eficaces los corticoides inhalados en la prevención de las sibilancias postbronquiolitis?. ¿Existe algún criterio clínico que permita predecir la eficacia de los corticoides inhalados? | I | A |
| Los corticoides inhalados no son útiles para prevenir las sibilancias postbronquiolitis. No se recomienda su uso tras un primer episodio de BA, aunque existen dudas sobre su utilidad en los pacientes que presentan BA y posteriormente sibilantes recurrentes | ||
| PV.1.2. ¿Son eficaces los corticoides orales en la prevención de las sibilancias postbronquiolitis? | II-1 | B |
| Los corticoides orales no son eficaces para prevenir las sibilancias postbronquiolitis | ||
| PV.1.3. ¿Es útil la realización de una prueba terapéutica con corticoides inhalados en los pacientes con BA con sibilancias mantenidas? | II-1 | B |
| Se aconseja limitar el uso de corticoides inhalados en los pacientes con BA. No se recomienda el ensayo terapéutico con corticoides inhalados en pacientes con síntomas persistentes (15–30 días) | ||
| Inhibidores de leucotrienos | ||
| PV.2.1. ¿Es eficaz el montelukast en la prevención de las sibilancias recurrentes postbronquiolitis?. ¿Existe algún criterio clínico que permita predecir la eficacia de montelukast? | II-1 | B |
| Montelukast no se considera útil en la prevención de sibilantes tras un primer episodio de BA por la ausencia de eficacia y los costes asociados. No es posible definir una pauta que sea más eficaz o segura, ni criterios clínicos que permitan predecir la respuesta | ||
| PV.2.3. ¿Es útil la realización de una prueba terapéutica con montelukast en los pacientes con sibilancias mantenidas? | II-1 | B |
| No se recomienda el ensayo terapéutico con montelukast en pacientes con síntomas persistentes (15–30 días) | ||
| Inmunoglobulinas | ||
| PV.3.1. ¿Es eficaz y útil la IgIV-VRS como tratamiento preventivo para disminuir la frecuencia y gravedad de la BA por VRS en población de riesgo? | II-1 | B |
| La IgIV-VRS no se considera útil como tratamiento preventivo de la BA, dado que el balance entre beneficios (disminución hospitalización) y riesgos (acceso i.v., sobrecarga de volumen, crisis de cianosis en cardiópatas, etc) es desfavorable, máxime por su no disponibilidad en nuestro medio y la existencia de la alternativa de los anticuerpos monoclonales (palivizumab) | ||
| Palivizumab | ||
| PV.4.1. ¿Es eficaz el palivizumab como tratamiento preventivo para disminuir la frecuencia y gravedad de la BA por VRS en población de riesgo? | I/II-1 | A/B |
| Palivizumab es eficaz como tratamiento preventivo del ingreso por BA por VRS en población de riesgo. Los beneficios de palivizumab (reducción de ingresos) parecen merecer la pena frente a los perjuicios (no diferencias significativas en los efectos adversos), pero no sabemos si frente a los costes (no se aborda en los ECA) | ||
| PV.4.2. ¿Es efectivo (en estudios observacionales) el palivizumab como tratamiento preventivo para disminuir la frecuencia y gravedad | II2/III | B/C |
| La efectividad de palivizumab en estudios observacionales parece similar a la eficacia observada en los ensayos clínicos originales, considerando que si es efectivo respecto a la hospitalización (aunque con una gran heterogeneidad entre países), pero no respecto a la frecuencia y gravedad (ingresos en UCI, necesidad de VM y mortalidad) de la BA | ||
| Evaluación económica de la bronquiolitis aguda | ||
| C.1. ¿En qué grupo de niños prematuros, por edad gestacional, patología asociada y edad postconcepcional, podemos considerar coste-efectiva la inmunoprofilaxis con palivizumab en nuestro medio? | ||
| Solo aceptando la asunción de que palivizumab reduce la mortalidad y el riesgo de asma, este tratamiento resultaría coste-efectivo en los grupos de mayor riesgo. No se ha alcanzado un consenso sobre los grupos de riesgo en los que palivizumab podría ser coste-efectivo. Las opciones propuestas varían desde la más restrictiva, limitada a prematuros de 23–32 SG con EPC, o sin EPC con múltiples factores de riesgo o con EPC grave, a la más amplia (vinculada a la aceptación de todas las asunciones) que contemplaría prematuros ≤32 SG (con ≤6 meses de edad) o ≤28 SG (con ≤12 meses de edad) o con EPC activa (con ≤2 años de edad) y prematuros de 32–35 SG (con ≤6 meses de edad) con dos factores de riesgo: edad | No se establece nivel de evidencia | |
| C.2. ¿En qué grupo de niños con cardiopatías congénitas, por tipo de cardiopatía y edad postconcepcional, podemos considerar coste-efectiva la inmunoprofilaxis con palivizumab en nuestro medio? | ||
| No se ha alcanzado un consenso sobre el grupo de niños con cardiopatía congénita en los que la inmunoprofilaxis con palivizumab podría ser coste-efectiva. No obstante se ha considerado que su uso podría ser eficiente en<2 años con cardiopatía congénita (no corregida o con intervención paliativa) con alteración hemodinámica significativa, en tratamiento con insuficiencia cardiaca, hipertensión pulmonar moderada o cardiopatías cianógenas | No se establece nivel de evidencia | |
| C.3. ¿Son aceptables las asunciones que se han empleado en los modelos económicos de coste efectividad de palivizumab? | ||
| Existen dudas sobre la validez de las asunciones de que la inmunoprofilaxis con palivizumab reduce la mortalidad o el riesgo de asma, ya que no se sustentan en los resultados de ensayos clínicos, sino que son extrapolaciones a partir de estudios observacionales sobre riesgos asociados a ingreso por infección por VRS | No se establece nivel de evidencia |
CC: cardiopatías congénitas; DBP: displasia broncopulmonar; ECA: ensayo clínico aleatorizado; EPC: enfermedad pulmonar crónica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; IM: intramuscular; IRA: infección respiratoria aguda; SatO2: saturación de oxígeno; SG: semanas de gestación; UCIP: Unidad de Cuidados Intensivos Pediátricos; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Miembros del grupo revisor especificados en anexo 1 y Miembros del panel de expertos especificados en anexo 2.
Avalado por la Asociación Española de Pediatría (AEP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP), Sociedad Española de Urgencias Pediátricas (SEUP), Sociedad Española de Infectología Pediátrica (SEIP), Sociedad Española de Neumología Pediátrica (SENP), Sociedad Española de Inmunología Clínica y Alergia Pediátrica (SEICAP), Sociedad Española de Cuidados Intensivos Pediátricos (SECIP), Sociedad Española de Neonatología (SEN), Sociedad Española de Cardiología Pediátrica (SECPCC).