El lupus eritematoso sistémico (LES) es un trastorno autoinmunitario crónico infrecuente en la infancia, con una incidencia estimada de 4 casos por millón y predominio en el sexo femenino (3:1), supervivencia a los 10 años de alrededor del 85%. Es un cuadro inflamatorio multisistémico de etiología desconocida, producido por el depósito tisular de autoanticuerpos e inmunocomplejos. Son característicos los autoanticuerpos sanguíneos de diverso tipo y el hallazgo de ANA (antinuclear antibodies ‘anticuerpos antinucleares’) es casi constante; la diversidad de síntomas clínicos se debe a las diferentes combinaciones de autoanticuerpos posibles. Su diagnóstico es fundamentalmente clínico (criterios de la Asociación Americana de Reumatología). El pronóstico depende básicamente de la participación del riñón y del sistema nervioso central (SNC), en la que la incidencia de la afectación neuropsiquiátrica es superior al 30%. El tratamiento es similar al de la edad adulta, y los corticoides son el pilar fundamental de éste. La presencia de una afectación grave y con riesgo vital, como lo es la neuropsiquiátrica, justifica el empleo altas dosis de corticoides combinados con inmunosupresores, incluso en casos con escasa respuesta.
A continuación se presenta el caso de un niño de 9 años sin antecedentes clínicos personales ni familiares de interés con diagnóstico de LES, controlado de manera ambulatoria, tratado con corticoides, y con adecuado control clínico y analítico.
El niño acudió al Servicio de Urgencias a los 6 meses del diagnóstico, con sintomatología de astenia y anorexia, así como fiebre alta de 4 días de evolución que no respondía a antitérmicos y con una tumefacción de los dedos de las manos. En la exploración física destacaron una afectación del estado general; fenómeno de Raynaud en las manos; adenopatías laterocervicales de consistencia dura, móviles, de tamaño inferior a 1cm, y un tenue exantema rosado macular en las mejillas. No presentaba artritis.
En el hemograma que se le realizó al ingreso, presentó 8.900leucocitos/uL (neutrófilos 66,5%; linfocitos 29,5%); hemoglobina de 12,6g/dL; hematocrito del 35%, y 271.000plaquetas/uL. En cuanto a la bioquímica, la GOT (glutamic oxaloacetic transaminase ‘transaminasa glutamicoxalacética’) fue de 58U/l y el resto, normal. La proteína C reactiva fue de 0,54mg/dl y la velocidad de sedimentación globular, de 32mm. La ecografía cervical evidenció adenopatías laterocervicales con características inflamatorias. El estudio de inmunidad mostró positividad para ANA, moteados al 1/280, antígeno nuclear extraíble y anticuerpos contra la ribonucleoproteína; el resto de los marcadores resultó negativo. La concentración de C3 fue de 197mg/dl y la de C4, de 23mg/dl. Se prescribió un tratamiento con metilprednisolona (1,5mg/kg/día) y ceftriaxona desde el ingreso. Al segundo día de evolución se observó sintomatología neuropsiquiátrica, caracterizada por hiperestesia generalizada y cefalea en el casco intensas, un deterioro progresivo del nivel de consciencia, fases de tendencia al sueño, agitación, lenguaje incoherente y alteración de la conducta.
Simultáneamente, se constató un aumento muy marcado de las adenopatías cervicales, que alcanzaron un tamaño de 3×4cm en el lado derecho. En dos tomografías computarizadas (TC) consecutivas del SNC no se evidenciaron alteraciones. La citoquímica del líquido cefalorraquídeo (LCR) mostró pleocitosis moderada, con 162 leucocitos/uL (90% de polimorfonucleares), proteínas de 140mg/dl, glucosa de 74mg/dl y adenosindesaminasa de 7,14U/l. Se añadió vancomicina al tratamiento mientras se esperaban los resultados de bacteriología. Los cultivos recogidos durante el ingreso, incluido el del LCR, fueron negativos, al igual que el resultado del test de Mantoux.
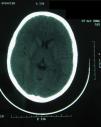
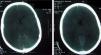
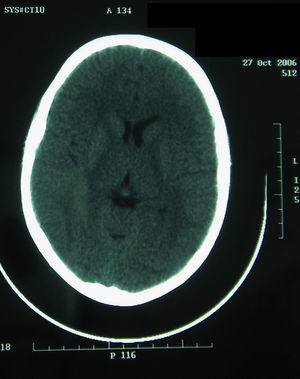
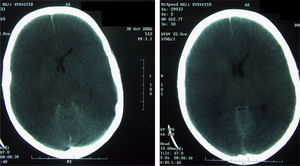
Al cuarto día del ingreso, se trasladó al sujeto a la unidad de cuidados intensivos (UCI) debido al deterioro clínico y al bajo nivel de consciencia, (escala de Glasgow: 11 puntos). Al llegar presentó un episodio brusco de desconexión del medio, hipertonía de miembros y postura de descerebración. Se procedió a la intubación y a la ventilación mecánica, y se inició el soporte inotrópico con dopamina y dobutamina. Una tercera TC, realizada en ese momento, fue normal (fig. 1). A las 18h presentó un episodio brusco de relajación de esfínteres y midriasis arreactiva; horas más tarde, se certificó muerte cerebral. Una cuarta TC, tras el citado episodio, mostró edema y daño anóxico e isquémico graves (fig. 2). La analítica realizada a su ingreso en la UCI dio los siguientes resultados: el hemograma evidenció 10.130leucocitos/uL (neutrófilos 88%), 115.000 plaquetas y hematocrito del 36%; la bioquímica mostró urea de 43mg/dl, creatinina de 0,74mg/dl, GOT de 663U/l y transaminasa glutámico pirúvica de 248U/l; en cuanto a la coagulación, el tiempo de protrombina fue de 18,1s, mientras que el tiempo parcial de tromboplastina activada fue de 36,6s.
En el estudio anatomopatológico se observaron meningoencefalopatía lúpica complicada con edema cerebral y enclavamiento, linfadenitis necrosante lúpica generalizada con predominio en cadenas ganglionares cervicales y afectación multisistémica con signos histológicos de LES en el hígado, el bazo y la médula ósea.
Como se sabe, el diagnóstico de LES puede incluir afectación del SNC y del sistema nervioso periférico hasta en el 40% de los sujetos pediátricos debido a la propia respuesta inmunológica descontrolada, en la que se ven implicadas citocinas y otros factores inflamatorios1.
Generalmente, la participación neurológica es un hallazgo tardío, que se correlaciona con la gravedad de la enfermedad y es de pronóstico negativo; los síntomas más frecuentes son cefalea y convulsiones. Según los diferentes estudios, la clínica neuropsiquiátrica tiene una incidencia cercana al 30% y se presenta en forma de alucinaciones táctiles o visuales, disfunción cognitiva y confusión, y, en ocasiones, ideación suicida. El caso de este niño corresponde al tipo “estado confusional agudo”, según la clasificación de la Academia Americana de Reumatología. Asimismo, y dada la gravedad extrema de las manifestaciones neurológicas y la afectación multisistémica grave encontrada2,3, cabe la posibilidad de un síndrome antifosfolipídico (SAF) secundario pese a la negatividad de los anticuerpos en el suero (SAF seronegativo).
El diagnóstico diferencial es muy amplio e incluye causas infecciosas, metabólicas e hipertensión, además es secundario a la ingesta de fármacos. Dada la negatividad de los cultivos realizados, la normalidad de las pruebas de función hepática hasta su ingreso en la UCI y los registros de presión arterial dentro del rango normal durante su ingreso4,5, estas entidades quedaron descartadas en el sujeto.
Hay que destacar que, a pesar de esto, los marcadores serológicos de actividad de la enfermedad lúpica pueden ser normales hasta en el 35% de los casos. Aunque los corticoides pueden originar sintomatología psiquiátrica, deben descartarse de entrada como causantes de la clínica6 en un sujeto con un brote de enfermedad lúpica, especialmente si es pediátrico. La punción lumbar suele mostrar pleocitosis moderada (menor de 300 células) e hiperproteinorraquia en ausencia de infección. Estos hallazgos se deben a la alteración de la permeabilidad de la barrera hematoencefálica, originada por el aumento de factores inflamatorios en el LCR (interleucina [IL]-2, factor de necrosis tumoral alfa IL-1β, IL-6, metaloproteasa de la matriz-9, prolactina).
Las técnicas de imagen (la, la resonancia magnética nuclear [RM], la angiografía con la SPECT [single photon emission computed tomography ‘tomografía computarizada por emisión de fotones simples o únicos’]) son especialmente útiles cuando hay una afección oclusiva arterial o venosa, aunque de escasa ayuda en ausencia de ésta.
En cualquier caso, ante la presencia de sintomatología neuropsiquiátrica en un sujeto con diagnóstico de LES, no debe posponerse un tratamiento intensivo con corticoides intravenosos (20mg/kg hasta un máximo de 1g, durante 3 días), puesto que debe considerársela como una manifestación grave y con un riesgo vital importante. En casos de respuesta escasa, es posible combinar inmunosupresores, inmunoglobulinas intravenosas y tratamientos nuevos, como el rituximab; también es posible contribuir ocasionalmente a la resolución, aunque por el momento los estudios al respecto son poco concluyentes3,7,8.