La leucoencefalopatía posterior reversible (LEPR) es un síndrome clínico-radiológico caracterizado por cefalea, vómitos, alteración de conciencia, problemas visuales y convulsiones, que presenta de forma concomitante lesions radiológicas, fundamentalmente en las regiones posteriors de la sustancia blanca debido al edema cerebral existente.
Este cuadro se asocia a múltiples situaciones médicas, como hipertensión arterial aguda, cáncer, enfermedades hematológicas, enfermedad renal, transfusión de globules rojos y múltiples fármacos, como inmunosupresores, y citostáticos, entre otras causas.
Presentamos dos casos en niños con leucemia aguda linfoblástica (LLA), asociados probablemente a utilización de vincristina.
Reversible posterior leukoencephalopathy syndrome is a clinical-radiological phenomenon associated with headache, vomiting, lethargy, visual disturbances and seizures, concomitant with radiological abnormalities predominantly within posterior cerebral white matter due to cerebral edema.
There are multiple triggers as acute hypertension, cancer, hematological disease, renal pathology, red cells transfusions and different drugs.
We present two patients with reversible posterior leukoencephalopathy under treatment for acute lymphoblastic leukemia because of the probable association with vinca alkaloids.
En 1996, Hinchey et al1 describieron una condición neurológica que llamaron síndrome de leucoencefalopatía posterior reversible (LEPR).
Este cuadro se define como una encefalopatía aguda o subaguda, transitoria, caracterizada por confusión, convulsiones y trastornos visuales asociada a hallazgos radiológicos específicos: señal hiperintensa en T2 por edema local predominantemente en sustancia blanca de regiones posteriores que se va resolviendo de forma progresiva2. Actualmente, se han descrito numerosas situaciones clínicas asociadas a LEPR, entre ellas fármacos inmunosupresores y citotóxicos3. Describimos dos casos en niños con leucemia aguda linfoblástica (LLA) probablemente asociados a utilización de vincristina.
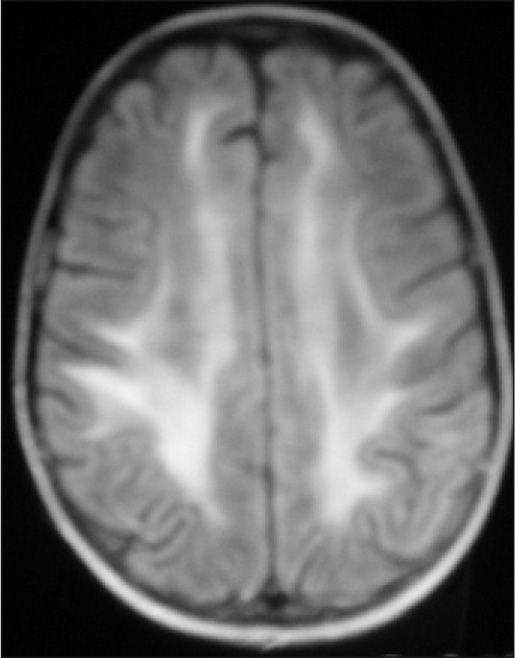
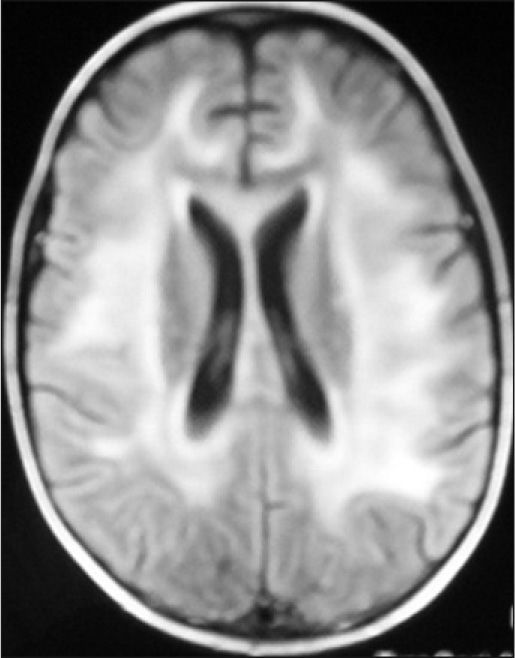
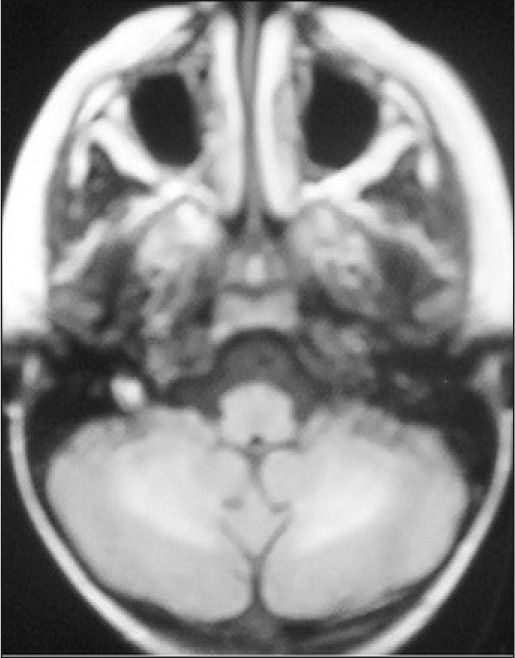
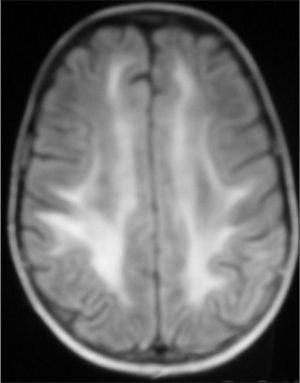
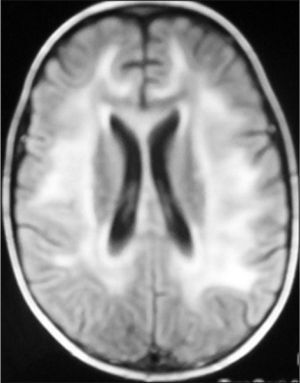
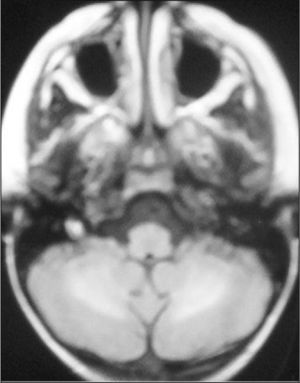
Observación ClínicaCaso 1La paciente es una niña de 7 años diagnosticada de leucemia linfoblástica aguda de alto riesgo con infiltración algodonosa en la retina en el momento del diagnóstico y normalidad del líquido cefalorraquídeo y resonancia magnética (RM) cerebral. Se inicia tratamiento con vincristina, altas dosis de metotrexato, daunorrubicina, ciclofosfamida, corticoides y triple terapia intratecal. A los 14 días apreciamos una aplasia grave medular con signos de toxicidad de grado IV en la mucosa oral, anal y vaginal, íleo paralítico con enterocolitis mucosanguinolenta y lesiones cutáneas. Comienza con deterioro neurológico progresivo, convulsiones, somnolencia y ausencia de respuesta a estímulos, con pérdida de visión. En dos ocasiones, se detecta aumento de presión arterial (PA) con cifras de 140/95. El electroencefalograma muestra ondas lentas difusas, y la RM revela áreas hiperintensas focales bilaterales, con afectación de cerebelo (figs. 1, 2 y 3). Se suspende la quimioterapia y se inicia radioterapia de globos oculares (12 Gy) y craneoespinal (18/12 Gy) por sospecha de infiltración leucémica del sistema nervioso central (SNC).
Mejora progresivamente de las alteraciones neurológicas a partir de los 7 días del inicio del cuadro, y se sospecha el diagnóstico de LEPR, que posteriormente se confirmó por la evolución. Se reinicia quimioterapia y se evita la administración de metotrexato por la radioterapia previa. Las imágenes de RM se normalizaron por completo a las 8 semanas del diagnóstico, así como la exploración neurológica, recuperando totalmente la visión. Actualmente, la niña permanece en remisión completa a los tres años de suspensión del tratamiento con un rendimiento cognitivo normal.
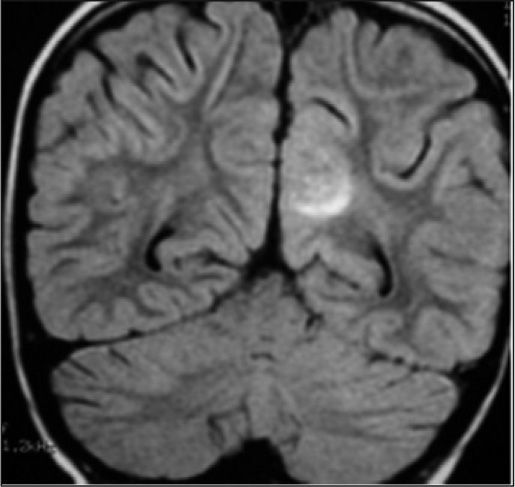
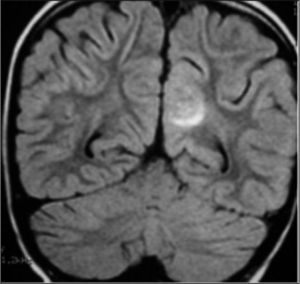
Caso 2La paciente es una niña de 6 años diagnosticada de LLA de riesgo normal. Se inicia tratamiento con vincristina, daunorrubicina, corticoides, dosis altas de metotrexato, asparraginasa, citarabina, mercaptopurina y triple terapia intratecal. Se alcanza la remisión completa con normalidad morfológica, de inmunofenotipo, citogenética y enfermedad residual menor del 0,1 %. Tras la primera reinducción de la fase de mantenimiento con vincristina, ciclofosfamida y corticoides se observa una aplasia grave con decaimiento, febrícula, vómitos, íleo paralítico, crisis convulsivas focales e hipertensión arterial (HTA) con cifras de 150/100 mmHg. Ingresa en la unidad de cuidados intensivos, se suspende la quimioterapia y se instaura tratamiento de soporte y sintomático. Se realiza estudio del líquido cefalorraquídeo (LCR) y médula ósea, así como tomografía computarizada (TC) craneal y electroencefalograma (EEG), que son normales. En la RM craneal se observa en la secuencia FLAIR T2 un aumento de señal en la zona subcortical de varios surcos de la zona medial occipital izquierda (fig. 4).
La evolución a los 7 días fue favorable, con normalización de la sintomatología neurológica, y el estudio de RM a las 4 semanas fue normal.
Se reinició tratamiento con quimioterapia optando por sustituir la vincristina por vinblastina por posible desencadenante del cuadro.
DiscusiónLa LEPR es una complicación poco frecuente asociada al tratamiento quimioterápico del cáncer. Nuestro conocimiento sobre este síndrome está limitado por los escasos casos que se han comunicado y por un mecanismo fisiopatogénico aún sin aclarar.
La hipertensión parece ser un importante factor de riesgo para desarrollar LEPR en niños con cáncer2,4,5, y es un signo presente también en nuestras dos pacientes.
La LEPR se ha asociado entre otros fármacos a ciclosporina A, tacrolimus, interferón alfa, cisplatino, citarabina y metotrexato2,6. Nuestras pacientes recibieron distintos citostáticos y, a pesar de no poder confirmarlo, optamos por suspender temporal o permanentemente el alcaloide de la vinca. La base para relacionar la vincristina al cuadro de LEPR fue la neuropatía periférica, el íleo paralítico que presentaron así como la enterocolitis y atonía vesical en uno de los pacientes (caso 1), quizá más como hipersensibilidad al fármaco que como una toxicidad. A pesar de ello, no podemos excluir otras causas desencadenantes como la ciclofosfamida y citarabina, u otros de los fármacos administrados. Sin embargo, a pesar de estas hipótesis, hay que destacar la importancia del diagnóstico precoz de este cuadro, y es importante diferenciarlo de una infiltración tumoral para poder actuar de forma adecuada, tal como lo planteamos en nuestra primera paciente7.
El mecanismo fisiopatológico responsable ha sido motivo de debate, y la hipótesis más aceptada es la que postula una alteración en la autorregulación del flujo sanguíneo cerebral originado por aumentos bruscos de la PA con dilatación arteriolar pasiva, y generación de edema vasogénico. Este mecanismo puede favorecer condiciones de retención de fluidos (insuficiencia renal, puerperio, esteroides) y la presencia de agentes que directamente dañan la barrera hemato-encefálica (p. ej., ciclofosfamida)1,3,8–11.
Esta disfunción endotelial podría ocurrir con el tratamiento de inducción que utiliza administración repetida de quimioterapia sistémica e intratecal2.
Una hipótesis alternativa propone la generación de edema citotóxico secundario a isquemia cerebral por vasospasmo como respuesta a HTA.
Estos cambios son transitorios, y las regiones más comprometidas son las parietooccipitales8 debido, probablemente, a la mayor susceptibilidad de estas regiones al edema vasogénico por el menor tono simpático de la circulación posterior. De todos modos, cualquier área cerebral puede estar implicada, con inclusión de áreas frontales y de sustancia gris.
Clínicamente, la LEPR suele manifestarse como una encefalopatía de inicio agudo o subagudo, aunque la secuencia de aparición de los síntomas es muy variable. La sintomatología incluye cefalea, náuseas, vómitos, alteraciones en la visión, sobre todo visión borrosa, y síntomas neurológicos focales con empeoramiento progresivo en el grado de conciencia. Las convulsiones pueden constituir el primer síntoma o aparecer tardíamente, y casi siempre son focales occipitales12–14.
Ante la sospecha de LEPR, se deben realizar pruebas de imagen, en especial, RM ya que es la técnica radiológica más sensible para la demostración del edema cerebral y puede evidenciar lesiones pequeñas y focales no demostradas con la tomografía. Suele observarse alteraciones de la sustancia blanca supratentorial e infratentorial de límites poco definidos consecuencia del edema cerebral. También puede verse afectación cortical con borrado de surcos y alteraciones en otras zonas, como la afectación cerebelosa de nuestra primera paciente. La RM mostraría en secuencias T1 una señal hipointensa, y en T2, FLAIR y densidad protónica, hiperintensa. Deben incluirse imágenes de difusión de la RM, interesantes desde el punto de vista diagnóstico, pero sobre todo pronóstico, que permite distinguir el edema vasogénico del citotóxico. El edema vasogénico en región posterior es la anormalidad de imagen clásicamente descrita y se asocia a un proceso reversible con pronóstico favorable por lesiones isquémicas precoces. En contraste, la progresión del edema vasogénico a citotóxico es un hallazgo atípico e indicativo de irreversibilidad, ya que implica conversión a infarto e incluso hemorragia cerebral2,14.
Clásicamente, las lesiones de la LEPR se definen por su carácter reversible y las anormalidades neurológicas suelen desaparecer completamente con tratamiento precoz y adecuado. La estrategia terapéutica depende de la causa de la LEPR y de sus manifestaciones clínicas. Lo más importante consiste en el control de la presión arterial y de las convulsiones. Nuestros pacientes se recobraron de sus déficits neurológicos en un período de entre 7 y 10 días, con normalización, asimismo, de las imágenes de RM entre 4 y 8 semanas. Si la LEPR no se trata adecuadamente, se produce una progresión del edema cerebral con infartos, hemorragias y, por tanto, con déficits neurológicos permanentes o incluso la muerte.
Varios estudios2,15,16 observan que la segunda exposición a las drogas que indujeron la LEPR puede volver a producir convulsiones, por lo que sugerimos que la reintroducción se haga cautelosamente. En nuestro primer caso, optamos por readministrar los citostáticos sin variaciones tras la recuperación clínica, sin observarse alteraciones tras su administración. En cambio, en nuestra segunda paciente, la vincristina se sustituyó por vinblastina sin presentar nuevos efectos.
A pesar de haberse descrito clásicamente el buen pronóstico de esta entidad, la LEPR asociada a niños con cáncer presenta hallazgos en la RM atípicos y secuelas crónicas (predominantemente, epilepsia), con mayor frecuencia que en la asociada a otras situaciones clínicas, según la serie descrita recientemente por Morris et al2, hecho que no hemos observado en ninguno de nuestros pacientes.
Como conclusión, el interés de nuestros casos es la descripción de la LEPR con relación al tratamiento con alcaloides de la vinca, y esta asociación está escasamente descrita en la literatura médica revisada.
El diagnóstico precoz de la LEPR como complicación durante el tratamiento oncológico en niños puede facilitar el tratamiento apropiado, previniendo, por tanto, las secuelas neurológicas irreversibles.