La asistencia respiratoria al recién nacido prematuro puede asociarse a complicaciones locales y sistémicas producto del traumatismo mecánico a los tejidos y la respuesta inflamatoria que en ellos se desencadena. Un objetivo fundamental, por tanto, es reducir su duración y efectos adversos. La ventilación ajustada neuralmente (NAVA), al mejorar la sincronización entre paciente y máquina, y optimizar los volúmenes de gas entregados a las necesidades de aquel, podría ser una herramienta fundamental en la consecución de dicho objetivo. Presentamos 2 casos de pacientes prematuros con síndrome de distrés respiratorio grave que pudieron ser satisfactoriamente destetados y extubados con esta modalidad asistencial. Nuevos estudios son necesarios para evaluar si los beneficios inmediatos se reflejan en mejores resultados a largo plazo.
Invasive and non-invasive ventilation of the preterm newborn may be associated with local and systemic complications due to mechanical trauma to lung tissues and their inflammatory response. A key objective of any type of mechanical ventilation, therefore, is to reduce its duration and the side effects related to it. Neurally Adjusted Ventilatory Assist (NAVA) may improve synchronization between patient and ventilator and optimize the gas volume delivered to the lungs, according to the patient needs, eventually reducing volu- and biotrauma. Two preterm babies with severe respiratory distress syndrome are presented, who were successfully weaned and extubated with the help of this ventilatory system. Further studies are needed to assess whether short-term benefits are reflected in better outcomes in the long run.
La asistencia respiratoria mediante ventilación mecánica al recién nacido prematuro (RNPT) con síndrome de distrés respiratorio (SDR) ha sido una herramienta fundamental en el incremento progresivo de la supervivencia de los pacientes desde su introducción y generalización a finales de los años 601. Sin embargo, pronto fue evidente que su uso también podría dar lugar a daño pulmonar importante2. Otras intervenciones se han ido incorporando posteriormente, contribuyendo de forma significativa a mejorar del pronóstico de estos niños: esteroides prenatales3, surfactante exógeno4, cafeína5, etc. Actualmente se recomienda la utilización de ventilación no invasiva (VNI) siempre que sea posible y, en aquellos casos en que se necesite intubación, que la duración de la misma sea lo más breve posible6. Las modalidades sincronizadas y con volumen garantizado son preferibles ya que han mostrado acortar los tiempos de ventilación invasiva y disminuir los episodios de hiperventilación7,8.
En la ventilación asistida ajustada neuralmente (NAVA), el ventilador es ciclado por cambios eléctricos en la actividad del diafragma (Edi), tanto en modalidades invasivas como no invasivas. El pico Edi es la cantidad de actividad eléctrica enviada desde el sistema nervioso central para generar la contracción diafragmática (esfuerzo inspiratorio neural), lo que determina el volumen corriente (VT) en cada respiración cuando la contractilidad diafragmática está preservada. El Edi mínimo refleja la actividad tónica del diafragma en reposo9. Por tanto, además de desencadenar el inicio de la respiración, el paciente controla el volumen corriente, la «meseta» inspiratoria y el final del ciclo respiratorio, con tiempos de respuesta más rápidos y un mejor nivel de sincronización que los tradicionales sistemas de flujo o presión, lo que le proporciona un mayor bienestar10.
En nuestro medio, existe escasa experiencia en la utilización de esta modalidad ventilatoria en el neonato. En el presente trabajo describimos 2 casos de RNPT con SDR grave, que fueron asistidos de forma eficaz con NAVA.
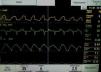
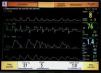
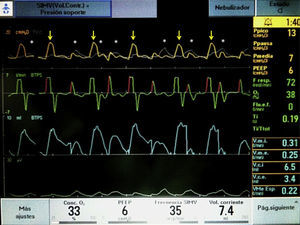
Caso 1RNPT, mujer, de 25 semanas de edad gestacional y 610g de peso al nacimiento. Madre de 26 años (2.a gestación, un aborto previo), recibió corticoides prenatales y sulfato de magnesio intraparto. Parto vaginal, Apgar 2/6. Intubada al nacimiento y administrada una dosis de surfactante (Curosurf®, 200mg/kg). A su ingreso en la UCIN se inició ventilación mecánica en la modalidad A/C+VG (6ml/kg) con el ventilador BABYLOG 8000 (Dräger, Lübeck, Alemania). FiO2 inicial 0,5. Durante la primera semana de vida, precisó tratamiento con ibuprofeno por ductus arterioso permeable hemodinámicamente significativo, sin respuesta. Ligadura quirúrgica al 10.° día. Posteriormente, necesitó aumento de los parámetros asistenciales, FiO2 1, y fármacos vasoactivos. Radiografía de tórax: patrón alvéolo-intersticial de predominio izquierdo. Antibioterapia empírica en varias ocasiones por sospecha de infección nosocomial. Hemocultivos negativos. Aspirado traqueobronquial: Stenotrophomonas maltophilia. Tras mejoría clínica y cultivos negativos, a los 25 días de vida se inician esteroides, siendo extubada a ventilación nasal intermitente (nIPPV) (Infant Flow, CareFusion), pero 4 días más tarde precisa reintubación y ventilación mecánica. A los 47 días, se decide monitorizar la actividad eléctrica diafragmática mediante un catéter Edi y módulo NAVA (SERVO-i, Maquet, Solna, Suecia) en la modalidad S-IMV (volumen control), objetivándose un alto grado de asincronía entre paciente y ventilador (fig. 1). Finalmente, se cambia a la modalidad NAVA invasiva con FiO2 0,3, presión positiva telespiratoria (PEEP) 5cmH2O y nivel de NAVA 3 para mantener un VT de 5ml/kg, con picos de presión inspiratorios (PIP) similares a los previos (15cmH2O). La sincronización paciente-ventilador mejora (fig. 2) y la niña se encuentra confortable, con picos Edi de 6-7 microvoltios y Edi Min de 2-3 microvoltios, que no se modifican sustancialmente durante el periodo de observación, manteniendo un VT de 5-6ml/kg. Tras la estabilización inicial, se objetiva una reducción de los PIP en 1-2cmH2O, y de la frecuencia respiratoria, con VT estable. SatO2 90-92%. Se disminuye la FiO2 a 0,21 y se retira la sedoanalgesia. Progresivamente, se reduce el nivel de NAVA hasta 1,5 y 12 h después se extuba a VNI sincronizada neuralmente (NIV-NAVA), manteniendo buenas SatO2 con FiO2 0,21-0,3. Controles gasométricos normales. Desde los 60 días de vida permanece estable en ventilación espontánea.
Paciente 1 en S-IMV (volumen control)+presión soporte. La señal Edi (4.° trazado) es transformada en la presión estimada (línea fina marcada con asteriscos) en el 1.er trazado superpuesta a la línea de presión (más gruesa, marcada con flechas). Puede apreciarse cómo la mayor parte de las curvas de presión no están sincronizadas con los esfuerzos de la paciente. El 2.° trazado corresponde a los cambios de flujo y el 3.° a los de volumen, mostrando gran irregularidad en ambos.
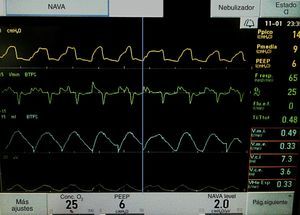
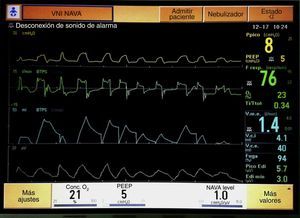
RNPT, mujer, primera gemela de 28 semanas de edad gestacional, 915g de peso al nacimiento. Madre de 43 años, primigesta. Recibió corticoterapia prenatal, sulfato de magnesio y antibioterapia intraparto. Parto vaginal, Apgar 8/9. VNI en sala de partos con buena respuesta. Se traslada a UCIN, conectándose a nIPPV (Infant Flow, CareFusion). A las 11 h de vida, ante incremento en necesidad de FiO2 se administra una dosis de surfactante (Curosurf®, 100mg/kg). A las 72 h presenta enterocolitis necrosante, perforación intestinal e importante deterioro cardiorrespiratorio. Fue intubada y se inició ventilación mecánica con A/C+VG (5ml/kg) (BABYLOG 8000). Cultivo de líquido peritoneal positivo a Pseudomonas aeruginosa. A los 8 días de vida, presentó neumotórax izquierdo que fue drenado, pasándose a ventilación de alta frecuencia oscilatoria, con PMAP 9-10 cmH2O y FiO2 máxima 1. Recibió antibioterapia empírica de amplio espectro y tratamiento antifúngico por candidiasis invasiva. Al 9.° día se pasa de nuevo a ventilación mecánica convencional y a los 27 días se inicia NAVA, con nivel de NAVA de 2 para alcanzar PIP de 15cmH2O y VT de 5-6ml/kg. La paciente permanece estable y perfectamente sincronizada con el ventilador, permitiendo reducir el nivel de NAVA a 1, sin cambios sustanciales en el pico Edi y Edi Min, por lo que 4 h más tarde se extuba a NIV-NAVA, con buena evolución (fig. 3).
DiscusiónEstos casos ilustran la eficacia de NAVA en el destete y la VNI en el RNPT. La mayoría de los ventiladores neonatales actuales utilizan los cambios de flujo en un sensor proximal a la vía aérea del paciente (pieza en Y) para desencadenar la ventilación mecánica con un volumen corriente o presión inspiratoria y tiempos inspiratorios predeterminados. Las insuflaciones que el paciente recibe pueden estar o no sincronizadas con sus esfuerzos, generándose incluso sin que este las inicie (autociclado) fuera de fase (tiempo inspiratorio mecánico superior al tiempo inspiratorio neural), o perdiéndose totalmente sin que la máquina responda al esfuerzo del niño11,12. Por otra parte, los dispositivos habitualmente utilizados para VNI no suelen tener sincronización. Todos ellos imponen alguna forma de restricción al sistema respiratorio del paciente (variable de trigger, forma de entrega del gas, criterio de finalización de ciclado, etc.). Como consecuencia, los tiempos de permanencia en el ventilador se prolongan y se incrementan los riesgos de daño inducido por el ventilador13 y la disfunción diafragmática (atrofia, estrés oxidativo y daño ultraestructural)14,15. En el recién nacido, además del riesgo de desarrollo de displasia broncopulmonar, otras complicaciones locales y sistémicas han sido descritas, incluyendo alteraciones en el neurodesarrollo16. Por todo ello, el destete y la extubación han de llevarse a cabo tan pronto como sea posible. No obstante, el establecimiento de criterios fiables y seguros que eviten el fracaso de la misma está lejos de ser conseguido17.
Algunos estudios han mostrado una mejoría en la interacción paciente-ventilador con la modalidad NAVA en el periodo neonatal18, incluso ante la presencia de grandes fugas aéreas19, como ocurrió en nuestras pacientes. La mayoría de los estudios no han encontrado eventos adversos significativos durante la asistencia con NAVA en el periodo neonatal20.
Una preocupación frecuente entre los clínicos durante la asistencia con esta modalidad ventilatoria es el posible desplazamiento de la sonda con la consiguiente pérdida de la señal Edi. En nuestras pacientes, se comprobó de forma periódica la situación del catéter, siendo necesario recolocarlo en algún momento. La pérdida de la señal, así como la presencia de apneas o respiraciones periódicas en el neonato, pudieran limitar la eficacia de esta modalidad. No obstante, aunque pudimos observar estos eventos ocasionalmente en nuestras pacientes, fueron superados con las opciones de rescate de que dispone el equipo: NAVA (PS) y NAVA (backup).
Una posible limitación de nuestro estudio es que se trata de una observación en 2 pacientes próximas a la extubación, por lo que no podemos establecer la utilidad de esta modalidad en fases más tempranas de la enfermedad ni en otras enfermedades respiratorias neonatales. Sin embargo, los beneficios observados en cuanto a la interacción paciente-ventilador podrían ser extensivos a otros escenarios clínicos. A pesar de todo, la experiencia en el RNPT sigue siendo limitada y nuevos estudios son necesarios para evaluar si estos beneficios iniciales se traducen en una reducción de la morbimortalidad a largo plazo en este grupo de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.