Introducción
La retinopatía del prematuro (RdP) es un trastorno del desarrollo de la vascularización de la retina que puede conducir a la ceguera. En el estudio internacional con mayor número de casos relevados en escuelas para niños ciegos (9.000 niños ciegos de 34 países) Gilbert et al1 comunicaron que la RdP es la cuarta causa de ceguera infantil en los países con alto ingreso per cápita con tasas de mortalidad infantil inferior a 10 ; la primera o segunda causa en los países con ingresos medios y tasas de mortalidad infantil entre 10 a 70 (abarcando en el análisis a países de América Latina y Europa del Este) y por último que la RdP es casi inexistente en países del África en los que la principales causas de ceguera son las infecciosas o nutricionales. En el año 1998, Visintin et al2 hallaron que la RdP era la causa de ceguera más frecuente entre los pacientes que concurrían al servicio de oftalmología del Hospital Nacional de Pediatría Garrahan en Buenos Aires (Argentina). La misma autora investigó los antecedentes de 2.009 niños matriculados en 28 escuelas para ciegos y disminuidos visuales del país, encontrando que 667 (33,2 %) habían padecido RdP2.
La enfermedad fue descripta en el año 1942 por Terry3 y fue responsable en la década siguiente, de más del 50 % de todas las cegueras infantiles en Estados Unidos y Europa Occidental. Algunas de las comunicaciones indicaban que la mayoría de los niños afectados tenían peso al nacer (PN) en el rango de 1.000-1.800 g4. Campbell5 en 1951 establece el rol del oxígeno suplementario no controlado como principal factor de riesgo. La incidencia de ceguera por la enfermedad disminuyó dramáticamente con limitación del uso del oxígeno, pero se estimó que por cada caso de ceguera evitado, 16 niños murieron6. Entre los años 1970 y 1990, el aumento marcado y progresivo de la sobrevida de recién nacidos con prematurez extrema desencadenó la denominada "segunda epidemia de RdP"7, pero en la medida que mejoró la calidad de los cuidados intensivos neonatales, pudo declinar la incidencia de RdP severa8. En la actualidad, el factor de riesgo más importante para la RdP severa en los países desarrollados es la prematurez más extrema (menos de 27 semanas y menos de 750-800 g de peso al nacer) pero existe gran variabilidad intercentro en las tasas de RdP y los buenos programas de pesquisa y tratamiento demuestran que la RdP es responsable del 5-15 % de la ceguera en la infancia9.
¿Qué está ocurriendo en los países en desarrollo? Estudios epidemiológicos han detectado que en la última década está ocurriendo lo que podemos denominar "la tercera epidemia de ceguera por RdP" y el mayor número de casos ocurre en países con ingreso económico medio. Esto podría vincularse con la aparición y establecimiento de unidades de cuidados intensivos neonatales (UCIN), sin programas claros ni guías precisas de cuidados. La evidencia disponible sugiere que en estos países hay muchos prematuros "grandes" con RdP severa y que los factores asociados a esta "tercera epidemia" serían una combinación de aquellos factores considerados determinantes de las llamadas primera y segunda epidemia de RdP en los países desarrollados.
Desafortunadamente, los datos de RdP comunicados a la fecha por diversos países en desarrollo son escasos e incompletos, lo que dificulta la planificación y el establecimiento de estrategias para el control de esta epidemia. Los datos en Argentina son también parciales y fragmentarios y la morbilidad por RdP es altamente preocupante. Por ejemplo, en los últimos años se ha registrado un aumento creciente y progresivo en el número de niños referidos al Hospital Garrahan (un centro nacional de derivación en Buenos Aires, Argentina) para recibir tratamiento de la RdP. En la actualidad, la RdP severa es la primera causa de internación en la UCIN de este Hospital.
La finalidad de este estudio es describir un diagnóstico situacional más preciso de la problemática de la RdP en un país en desarrollo. Iniciamos el estudio con tres hipótesis: la primera fue que la RdP severa no ocurriría sólo en los grupos de prematuros tradicionalmente considerados de riesgo; la segunda fue que los casos más severos de RdP no guardarían relación con la edad gestacional ni el peso al nacer de los niños, y la tercera que habría diferencias en la calidad de atención de los pacientes, según el área de procedencia y la distancia hasta la ciudad capital.
Métodos
Hospital
El hospital de Pediatría Prof. Dr. Juan P. Garrahan es una institución nacional del tercer nivel de atención, perteneciente al sector público de salud, ubicado en la Ciudad de Buenos Aires (Argentina). La UCIN de este hospital fue creada en el año 1988 y desde entonces recibe neonatos derivados de todo el país para ser tratados por patologías complejas.
Desde el inicio se establecieron pasos para un examen y evaluación oftalmológica detallados para la pesquisa y tratamiento de RdP, según guías y protocolos internacionales. El tratamiento inicialmente se realizaba con crioterapia y a partir de 1997 con láser. Dada la escasez de centros especializados en otras regiones del país, la mayoría de los niños atendidos en instituciones del sector público, deben ser referidos al Hospital Garrahan para el tratamiento. Los pacientes que provienen de unidades neonatales ubicadas a menos de 70 km de dicho hospital son trasladados en ambulancia para recibir evaluación y/o tratamiento, y luego regresan en el día a su unidad de procedencia. Cuando provienen de centros más alejados, se internan en la unidad de neonatología siendo contrarreferidos en los días posteriores a haber sido tratados.
Diseño del estudio
Observacional y transversal.
Población
Se incluyeron todos los pacientes que fueron derivados al servicio de neonatología y oftalmología para tratamiento de la RdP desde el 1 de enero de 1996 hasta el 31 de diciembre de 2003; cuyos registros de la caracterización de las lesiones en la retina estuvieran completos.
Clasificación de la RdP
Los datos fueron seleccionados de las historias clínicas. El examen oftalmológico se realizó en todos los casos mediante oftalmología indirecta por especialistas de reconocida experiencia. Los hallazgos fueron categorizados de acuerdo a la clasificación internacional10.
Se denominó RdP severa a la presencia en ambos ojos de: estadio 3 con extensión umbral; estadios 4 o 5; enfermedad plus en zona 1 o 2 y/o vasculopatía fulminante (enfermedad de Rush).
Se definen como casos inusuales a los pacientes con RdP severa, quienes por sus características biológicas se hubieran supuesto exentos de riesgo en países desarrollados (PN > de 1.500 g y/o EG > 31 semanas).
Variables analizadas
Peso de nacimiento (PN), edad gestacional (EG), edad cronológica en la que los pacientes fueron derivados, tiempo de oxigenoterapia en etapa neonatal, uso y duración de tratamiento con asistencia ventilatoria mecánica (AVM). Los pacientes se agruparon por año de ingreso y a su vez se clasificaron según peso al nacer: menor o igual a 1.000, 1.001 a 1.500 y mayor de 1.500 g; y según su edad gestacional: entre 24 y 27, 28 y 31, 32 y 35 y más de 35 semanas.
Para comparar las características de los pacientes según áreas de procedencia, se los clasificó en 2 grupos de acuerdo a la distancia entre la UCIN desde donde fueron derivados y el Hospital Garrahan. Grupo A: distancia menor o igual a 70 km y grupo B: distancia mayor a 70 km.
Análisis estadístico
Los datos fueron almacenados y procesados con el programa SPSS versión 10.0 para Windows, luego de ser aprobado por un Comité de Ética asegurándose la confidencialidad de los datos. Para evaluar diferencias entre las variables de los 2 grupos según área de procedencia, se utilizó la prueba t de Student para 2 muestras con igual variancia, o el test de la chi cuadrado según correspondiera, considerándose significativo un valor de p < 0,05.
Para el análisis multivariable de riesgo de RdP severa en el total de la población estudiada, se aplicó regresión logística.
Resultados
Durante los 8 años del período analizado, 826 pacientes fueron derivados para tratamiento de RdP. Se excluyeron 17 niños que no contaban con registros completos de los datos del examen ocular, por lo tanto 809 niños constituyen la población de este estudio.
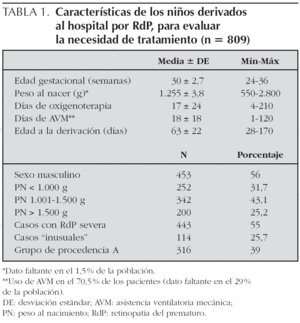
En la tabla 1 se describen las características neonatales de la población. El 29 % de los registros carecían de los datos en relación al uso de AVM, mientras que los porcentajes de datos faltantes para las otras variables analizadas fueron inferiores al 3 %. Durante todo el período analizado, 443 niños (55 %) tuvieron diagnóstico de RdP severa, de ellos 114 (25,7 %), fueron considerados "inusuales" por sus características. En el análisis de la procedencia, el 39 % de los pacientes correspondió al grupo A (más cercanos al Hospital Garrahan) y el 61 % al grupo B. (tabla 1). Al realizar un análisis multivariable mediante regresión logística, tanto para el total de la población como para las subpoblaciones según la procedencia, no se encontraron factores predictivos de RdP severa.
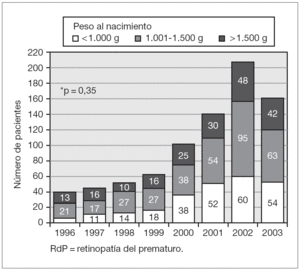
En la figura 1 se representa el número de pacientes derivados para tratamiento de RdP, en cada año del estudio clasificados según su PN. El número de niños aumentó progresivamente desde 1996 hasta 2003, registrándose un leve descenso en el último año del estudio. Los niños con PN < 1.000 g fueron aumentando con el tiempo en cantidad y proporción, cinco (13 %) en el primer año analizado y 54 (34 %) en el último. A su vez, los niños con PN > 1.500 g fueron 13 (33 %) en el año 1996 y 42 (26 %) en 2003. Estas diferencias en la distribución de las categorías de PN a través del tiempo son de importancia, pero no alcanzaron a significación estadística.
Figura 1.La proporción de los 3 grupos de peso de nacimiento en los pacientes derivados para evaluación de tratamiento por RdP no varió significativamente a través de los años (n = 809).
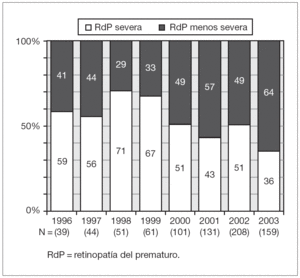
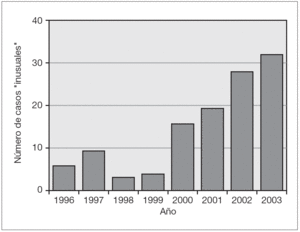
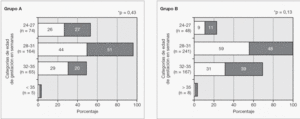
La figura 2 representa la distribución de porcentajes de formas de RdP severa y formas menos severas en cada año analizado en el total de los pacientes. Se observó que, con excepción de los años 1998 y 1999, la proporción de niños derivados con lesiones graves fue en progresivo aumento hasta el último año donde representaron el 64 % de las 159 derivaciones ocurridas. En la figura 3 se representa el aumento del ingreso de casos "inusuales" a través de los años. En relación a la RdP severa, no hubo diferencias en las proporciones entre las diferentes categorías de PN, siendo la RdP severa en 54 % de los recién nacidos de menos de 1.000 g, 53,5 % en los de 1.001 a 1.500 g, y 57 % en los de más de 1.500 g. Lo mismo sucedió en relación a la EG (54 % en los de menos de 28 semanas, 52 % en los de 28 a 31 y 58 % en los de 32 a 35 semanas). Las figuras 4 y 5 representan las distribuciones de porcentajes de RdP severa y de RdP menos severa de los pacientes según su PN y su EG, respectivamente, teniendo en cuenta las zonas de procedencia. En ninguno de los 2 grupos hubo diferencias significativas de distribución de severidad de las lesiones para las dos variables analizadas. Sin embargo, al comparar los grupos puede observarse que en el grupo A el 50 % de los casos de RdP severa se encontró en los recién nacidos de menos de 1.000 g y sólo el 16 % de los casos severos ocurrieron en recién nacidos de más de 1.500 g. Esto es muy distinto en el grupo B, de procedencia más alejada (p < 0,02), donde el 47 % de los recién nacidos con RdP severa pesaron entre 1.001 y 1.500 g y el 31 % > 1.500 g. Similar es lo que ocurre en relación a la EG (fig. 5) donde la proporción de casos con Rdp severa de niños con EG > 31 semanas del grupo B duplica a los del grupo A de igual categoría.
Figura 2. Porcentajes de casos considerados en la evaluación oftalmológica como RdP severa y menos severa en cada año del estudio.
Figura 3. Número de pacientes considerados "inusuales" en relación a su peso de nacimiento o su edad de gestación, en cada año del estudio (n = 114).
Figura 4. Distribución de los pacientes con RdP más y menos severa según su región de procedencia y el peso de nacimiento.
Figura 5. Distribución de los pacientes con RdP más y menos severa según su región de procedencia y la edad de gestación.
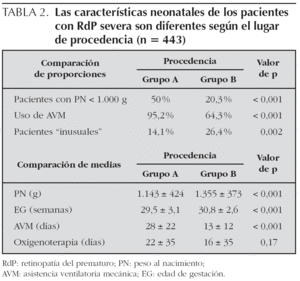
La tabla 2 muestra la comparación de proporciones y de medias en relación a PN, EG, AVM y casos "inusuales" en los 2 grupos. Si bien el porcentaje general de casos de RdP severa en ambos grupos fue similar, 53 % en el A y 56 % en el B (p = 0,38), se encontraron diferencias altamente significativas entre los grupos en las características neonatales en cuanto al PN, la EG, el uso y tiempo de AVM y el porcentaje de casos "inusuales" (tabla 2).
Un total de 718 pacientes (89 %) recibieron tratamiento con láser; de ellos, el 89 % requirió tratamiento en los 2 ojos. En 59 casos los niños fueron referidos tardíamente, perdiéndose así la oportunidad de tratarlos. Sólo en 32 niños no se corroboraron las lesiones que habían motivado la derivación, por lo que no fue necesario tratarlos.
La edad cronológica media al momento de la derivación fue de 9 ± 3,1 semanas. Dado que el desarrollo de la retinopatía depende de la EG, se puede estimar que el momento de máxima frecuencia de aparición de la enfermedad varía entre las 10,3 semanas posnatales para los de PN < 1.000 g y 8,6 semanas para los de mayor peso. Teniendo en cuenta la edad a la que se produjo la derivación, la posibilidad de tratamiento oportuno y adecuado resultó tardío para el 40 % de los sujetos en este estudio.
Discusión
Los resultados de este estudio observacional representan una alarmante situación en relación al progresivo aumento en el número de prematuros afectados por RdP severa, el cual ha ido adquiriendo características epidémicas.
De los 700.000 niños que nacen cada año en Argentina, 50.000 son de bajo peso de nacimiento (< 2.500 g), y alrededor de 7.000 de muy bajo peso (< 1.500 g). Nuestro estudio fue realizado en el único centro de referencia para el tratamiento y por lo tanto no representa a todos los niños con RdP severa de Argentina. Basados en los datos de este análisis es imposible estimar cuántos niños visualmente discapacitados por RdP severa ingresan a la sociedad Argentina por año. Sin embargo, los hallazgos de este estudio, con un promedio aproximado de 100 niños severamente afectados por año, sugieren una cifra alarmante de RdP severa en el país. Más alarmante aún es que los niños afectados fueron de mayor peso y EG que los referidos en la literatura especializada.
Además, en un análisis de datos correspondientes al año 2002 realizado por el Ministerio de Salud, y que fueron aportados por 36/47 servicios de neonatología del sector público de Argentina11, se identificó la ocurrencia de 209 casos de RdP severa. La muestra fue representativa del 37 % del total de prematuros de muy bajo peso del país durante ese año, por lo que se puede estimar que más de 560 niños han sido severamente afectados en Argentina.
La mortalidad neonatal en recién nacidos de bajo peso ha disminuido en los últimos años en Argentina según un análisis comparativo de los años 1990 y 1997 (de 47 a 25 % para los recién nacidos con PN entre 1.000 y 1.500 g y de 95 a 68 % en < 1.000 g)12. Lamentablemente, esto se ha acompañado de un rápido aumento del número de niños afectados por RdP severa. Sin embargo, el aumento del número de casos ingresados en este estudio no estaría relacionado únicamente a la mejor sobrevida ya que en todas las categorías de peso, la proporción de pacientes con retinopatía grave se incrementó o mantuvo estable a través de los años. Esto, junto con el elevado porcentaje de prematuros entre 1.000 y 1.500 g y de pacientes considerados "inusuales", demuestra que un gran número de niños con secuelas serias podrían haberse evitado. Contrariamente a lo demostrado por muchos autores, no hallamos una relación entre severidad de RdP y PN o EG, independientemente del lugar de procedencia. Es decir, que la secuela de RdP severa afectó por igual a niños muy pequeños y a aquellos que, en un país desarrollado no desarrollan RdP severa. Esto da sustento a que la vulnerabilidad biológica no es el único factor determinante de daño severo por RdP y enfatiza la importancia del control de la oxigenoterapia y del cuidado detallado en la administración y monitorización de oxígeno para disminuir tasas de RdP severa, demostrado en estudios recientes de Sola et al13-15,21.
La importante disparidad existente en las características consideradas de riesgo de retinopatía severa según la zona de procedencia tal vez es atribuible a una alarmante desigualdad en el nivel asistencial. En los niños del grupo B (de centros más distantes de capital federal) no se encontró relación alguna entre condición clínica y severidad de la RdP; ellos fueron más maduros, con mayor EG y PN y menor necesidad de asistencia respiratoria, sin una clara asociación entre el uso de la AVM y la gravedad de la secuela.
No dudamos que mejorar el conocimiento relacionado a la terapia con oxígeno, la ventilación artificial y la búsqueda de la estabilidad cardiorrespiratoria es importante para lograr la sobrevida de los recién nacidos prematuros. Sin embargo, parecería que aún hoy se subestiman los efectos tóxicos del oxígeno y que éste se utiliza sin un control meticuloso y detallado que permita evitar o disminuir significativamente la secuela ocular. El mayor conocimiento de la patogénesis de la retinopatía respalda la importancia del "estrés oxidativo" desencadenado por la hiperoxia. Desafortunadamente, muchos agentes de salud desconocen que el monitor de oxímetro de pulso no sirve para detectar hiperoxia, como ha sido bien descrito por Sola et al13-15. Con estos monitores de uso universal, un niño que respira oxígeno suplementario y que muestra un valor "normal" de saturación (94-100 %) puede tener una tensión de oxígeno muy elevada (hasta 200-300 mmHg de PaO2) en el 70 % de los casos, como lo acaba de demostrar el grupo del Dr. Sola22. En nuestro estudio, el examen de las historias clínicas demostró que el 30 % de los casos carece de datos en cuanto al tratamiento con oxígeno. Esto puede estar representando la falta de concienciación en relación a este importante factor de riesgo en RdP.
Casi la totalidad de los recién nacidos derivados recibieron tratamiento y en la mayoría el mismo fue realizado en ambos ojos. Esto coincide con los hallazgos del estudio Cryo Rop16,17 en el que 82,5 % de los niños tenían lesiones bilaterales. Sólo en 32 niños no fue considerado necesario realizar tratamiento. Un hallazgo alarmante de este estudio fue que un número importante de pacientes (59/809) perdieron su oportunidad de tratamiento por derivación tardía. Estos datos confirman que la calidad del cuidado intensivo neonatal es un importante factor en el desarrollo de RdP, en Argentina, y seguramente en muchos países de América Latina, con el agravante que muchos de los niños, por sus características de bajo riesgo, no deberían verse afectados ni carecer de diagnóstico y tratamiento oportuno.
Existen en Argentina recomendaciones para la pesquisa19, consensuadas por sociedades científicas de pediatría y oftalmología vigentes desde 1999, que establecen la población y momento oportuno para realizar el primer control. Deberían incluirse a todos los niños con 1.500 g o menos y 32 semanas o menos. También deben ser evaluados oportunamente los niños con PN entre 1.500 y 2.000 g o una EG de 32 semanas o más que hayan recibido oxígeno por un plazo mayor a 48-72 h.
La RdP es la enfermedad que más años de vida ciegos genera, la ceguera infantil afecta años de vida útil y significa la necesidad de educación especial18, discapacidad y, por último, pérdida de productividad. Además de estos perjuicios económicos para la sociedad, la RdP severa provoca graves efectos sobre el niño y su familia. La intervención que sea capaz de reducir la pérdida de tantos años de visión será trascendente como medida de salud pública. Estudios recientes realizados por el grupo de Sola et al13-15,21 demuestran que es posible la disminución de la incidencia de RdP severa si se implementan cambios en las prácticas neonatales de oxigenación para los recién nacidos de muy bajo peso al nacer. La esperanza y posibilidad de controlar esta devastadora enfermedad se apoya en la preocupación que sientan quienes se hacen cargo de asistir a recién nacidos prematuros. Es necesario disminuir la brecha entre el conocimiento y lo que recibe cada recién nacido enfermo, mejorando la difusión del conocimiento de las causas y prevención de RdP, aumentando el entrenamiento de especialistas para la detección precoz e intervención oportuna y, fundamentalmente, logrando el compromiso de las autoridades de la salud a proveer recursos necesarios y adecuados para el cuidado detallado y oportuno que estos niños merecen.
Con los hallazgos de este estudio y algunos otros difundidos por autores de grandes maternidades y por maestros de escuelas para niños ciegos de nuestro país, se logró tomar mayor conciencia de la grave problemática de la RdP en nuestro medio motivándonos a conformar un grupo de prevención de la ceguera en la infancia por RdP con base en el Ministerio de Salud de la Nación20, con participación de representantes de sociedades científicas de pediatría y oftalmología y con apoyo de expertos de reconocimiento internacional. En este ámbito se han comenzado a desarrollar acciones tendientes a continuar con la difusión del problema y efectivizar medidas de prevención de formas graves, publicando y distribuyendo recomendaciones para la administración de oxígeno en prematuros y reformulando las previamente existentes de cribado. El grupo se encuentra en pleno crecimiento.
Correspondencia: Dra. L. Bouzas.
Área de Neonatología y Seguimiento de Alto Riesgo.
Gaspar Campos, 740. (1638) Vicente López. Buenos Aires. Argentina.
Correo electrónico: arquerol@fibertel.com.ar
Recibido en septiembre de 2006.
Aceptado para su publicación en marzo de 2007.