El aumento en la prevalencia de obesidad en la edad pediátrica se asocia a mayor incidencia de diabetes mellitus tipo2 (DM2). El tipo de respuesta de la glucemia y de la insulina a la sobrecarga oral de glucosa (SOG) podría predecir el riesgo de DM2 en pacientes con obesidad.
ObjetivoValorar la respuesta a la SOG y relacionar con factores de riesgo de DM2 en niños y adolescentes obesos.
MétodosEstudio observacional retrospectivo sobre 588 pacientes (309 varones, 279 mujeres); 90,3% caucásicos; edad media 11,1±2,8años. Según el tipo de respuesta en la SOG se establecieron dos grupos: monofásico y bifásico. Se analizaron parámetros antropométricos, bioquímicos e índices relacionados con sensibilidad a la insulina y la función de la célulaβ.
ResultadosEl 50,2% de los pacientes tuvieron un patrón de glucosa monofásico (50,8% varones), el 48,5% bifásico (47,6% varones) y el 1,3% indeterminado. La respuesta monofásica mostró menor sensibilidad a la insulina y peor función de la célula β; los pacientes con patrón bifásico presentaron mayor índice de masa corporal, perímetro de cintura y presión arterial, sin ser estos resultados estadísticamente significativos. Los pacientes latinos tuvieron glucemias significativamente menores en la SOG a expensas de una mayor insulinemia.
ConclusionesEl patrón de respuesta de la SOG refleja fenotipos metabólicos diferentes. Los pacientes pediátricos con un patrón bifásico tienen un perfil con menor riesgo de desarrollar DM2. Una SOG en niños y adolescentes obesos podría ser útil para implementar estrategias de intervención precoz y prevenir la aparición de prediabetes o DM2 en esta población.
The onset of obesity at young ages is strongly associated with the early development of type 2diabetes (T2D). The shape of the curves of glucose and insulin curves during an oral glucose tolerance test (OGTT) could predict the risk of developing T2D.
ObjectiveTo analyse the morphology of the OGTT and determine T2D risk factors in a mainly Caucasian population of children and adolescents.
MethodsObservational retrospective study including 588 patients (309 males, 279 females) with a mean age of 11.1±2years, and of whom 90.3% were Caucasian. Risk factors for T2D were compared in patients with a monophasic or biphasic pattern during the performance of an OGTT, as well as anthropometric and biochemical variables, insulin resistance, and beta-cell function.
ResultsThe shape of the glucose curve was monophasic in 50.2% of patients (50.8% male), biphasic in 48.5% (47.6% males), and indeterminate in 1.3%. The monophasic pattern showed lower insulin-sensitivity and worse beta-cell function. Patients with a biphasic pattern had a higher BMI, waist circumference, and blood pressure, although the results were not significant. Latin-American patients had significantly lower serum glucose levels with higher insulin levels during the OGTT.
ConclusionsThe pattern of response to an OGTT reflects different metabolic phenotypes. Paediatric patients with a biphasic pattern have lower risk-profiling for T2D. The performing of an OGTT could be useful to implement early intervention strategies in children and adolescents with obesity, in order to prevent the development of pre-diabetes or T2D.
La incidencia de diabetes mellitus tipo2 (DM2) en adolescentes se ha incrementado en las últimas décadas, relacionado con el aumento en la prevalencia de obesidad en la edad pediátrica1. Algunos estudios comunican un mayor incremento en grupos específicos de adolescentes entre los 15 y los 19años de edad, con una incidencia de DM2 de 17,0-49,4/100.000 individuos/año2, pudiendo superar la de diabetes mellitus tipo1 en algunos grupos étnicos3. En adultos, la progresión de prediabetes a DM2 ocurre en aproximadamente 5-10años; en pacientes pediátricos esta evolución suele ser más rápida, probablemente en relación con la insulinorresistencia fisiológica de la pubertad4.
En Estados Unidos se ha descrito una mayor incidencia de DM2 en pacientes pediátricos con obesidad y datos bioquímicos de intolerancia a los hidratos de carbono5, sin poderse establecer las variables clínicas o determinaciones séricas puntuales que permitan predecir con certeza el riesgo de desarrollar diabetes en estos pacientes6. La valoración individual de la respuesta glucémica e insulinémica a la sobrecarga oral de glucosa (SOG) resulta importante para la determinación del perfil de riesgo individual en cada paciente7.
Se ha descrito que el riesgo de DM2 se asocia no solamente con la glucemia basal y a las 2h tras la SOG, sino que las características morfológicas de la respuesta individual a la SOG permiten determinar alteraciones metabólicas precoces que ayudan a predecir el riesgo de desarrollar DM28; en la respuesta monofásica hay un aumento gradual continuo en la glucemia plasmática, mientras que en la bifásica existe un aumento inicial de glucemia y descenso posterior con aumento final. En adultos, la respuesta monofásica se ha relacionado con insulinorresistencia, disminución de la función de la célulaβ y mayor riesgo de desarrollar DM2, mientras que los individuos con una tolerancia a la glucosa normal suelen presentar una curva bifásica7,9. Estas respuestas reflejan alteraciones de la sensibilidad y/o la secreción de la insulina, ambas involucradas en la DM29. Un estudio en adolescentes obesos latinos comunica resultados similares a los descritos en adultos, sugiriendo la utilidad de la SOG en la detección precoz de riesgo de DM2 en adolescentes5.
El objetivo del presente estudio es analizar el tipo de respuesta a una SOG en una cohorte pediátrica, predominantemente caucásica, y valorar si diferentes patrones se pueden relacionar con posibles factores de riesgo de DM2.
MetodologíaEstudio observacional retrospectivo. Se incluyeron 588 pacientes: 309 varones (52,5%) y 279 mujeres (47,5%), con edades 3-17años (media 11,1±2,8) que acudieron a la consulta de obesidad de un hospital terciario. Se recogieron medidas antropométricas: peso (kg), talla (cm), IMC (kg/m2), perímetro de cintura (cm), y presión arterial (mmHg). Para la medida de la presión arterial (PA) se empleó un tensiómetro digital en el brazo derecho del paciente en posición sentada; el brazalete utilizado dependía del tamaño del brazo, y si el resultado de la PA era >90 se repetía la medida de manera manual. Definimos los estadios puberales según los criterios de Tanner10. Definimos obesidad cuando el IMC era ≥2DE (tablas de Hernández)11. En la primera consulta se determinaron los niveles de HbA1c (HPLC Menarini, VN 5,31±0,31), colesterol total, cHDL, cLDL y triglicéridos. La SOG se realizó con el aporte de 1,75g/kg, con un máximo de 75g tras 10h de ayuno. Se tomaron muestras de sangre a los 0, 30, 60, 90 y 120min para la determinación de la concentración plasmática de glucemia e insulinemia según el método estandarizado12. Definimos alteración de la glucemia en ayunas (AGA) cuando era ≥100mg/dl, alteración de la tolerancia a la glucosa (ATG) cuando la glucemia a los 120min era ≥140mg/dl y diabetes (DM) cuando la glucemia en ayunas era ≥126mg/dl o a las 2h ≥200mg/dl. Las SOG con respuesta alterada fueron repetidas al menos en una ocasión para confirmar los resultados.
El fenotipo de respuesta a la SOG se clasificó en monofásica, bifásica o indeterminada siguiendo los criterios comunicados en estudios previos4,13. El cambio de 4,5mg/dl fue tomado para minimizar el sesgo de la fluctuación en los niveles de glucemia relacionada con el método de detección. Se definió como respuesta monofásica la que presentaba un aumento inicial progresivo en las concentraciones plasmáticas de glucosa, seguida posteriormente de un descenso a lo largo de los 120min. Una respuesta bifásica se caracterizó por un aumento inicial progresivo en los niveles de glucosa seguido por una caída ≥4,5mg/dl y un nuevo aumento ≥4,5mg/dl. Los pacientes con un incremento progresivo en los niveles de glucemia sin descenso posterior se clasificaron como indeterminados y se excluyeron del estudio.
Como parámetros de insulinorresistencia y función de la célulaβ se utilizaron los índices HOMA-β y HOMA-IR14,15, y para evaluar la sensibilidad a la insulina se utilizaron el índice de Matsuda14, el índice QUICKI16 y el índice insulinogénico14.
El estudio fue aprobado por el Comité ético de nuestro hospital, y tanto los pacientes como sus padres o tutores aceptaron participar en el estudio
Los resultados se analizaron en los programas SPSS® v15 y GraphPadprism® v6. Para la detección de diferencias entre los grupos se utilizaron las pruebas t de Student, U de Mann-Whitney y χ2.
ResultadosSe incluyeron 588 pacientes (309 varones y 279 mujeres) con una edad media de 11,1±2,8años, con un IMC promedio de 27,4±3,7kg/m2 (3,8±1,3DE). En la muestra incluida, el 90,3% de los pacientes fueron caucásicos y el 9,7%, latinos. En nuestra serie, el 50,2% de los pacientes tuvieron un patrón de respuesta de glucosa monofásico (50,8% varones) y el 48,5% bifásico (47,6% varones). Ocho pacientes mostraron un patrón indeterminado y fueron excluidos del análisis. Ambos grupos no mostraron diferencias en cuanto a edad y sexo, por lo que son grupos comparables. Consideramos una limitación del estudio el no disponer de datos relacionados con antecedentes familiares de DM o diabetes gestacional en la muestra estudiada. Las características generales de la muestra incluida aparecen resumidas en la tabla 1.
Características descriptivas de la muestra según el fenotipo de respuesta glucémica a la SOG
| Parámetro | Total | Monofásico | Bifásico | p |
|---|---|---|---|---|
| IMC (kg/m2) | 27,37±3,71 | 27,0±3,9 | 28,4±3,9 | 0,21 |
| IMC (DE) | 3,80±1,28 | 3,75±0,06 | 3,83±0,08 | 0,99 |
| Perímetro abdominal (cm) | 88,42±11,06 | 86,03±1,92 | 90,45±1,79 | 0,16 |
| PA sistólica (mmHg) | 113,56±10,9 | 114,0±0,7 | 112,9±0,7 | 0,38 |
| PA diastólica (mmHg) | 59,63±8,48 | 87,9±0,5 | 88,5±0,5 | 0,91 |
| HbA1c (%) | 4,64±2,82 | 5,3±0,04 | 5,4±0,2 | 0,32 |
| Colesterol total (mg/dL) | 159,27±31,02 | 160,4±1,9 | 159,4±1,9 | 0,92 |
| Colesterol HDL (mg/dl) | 43,94±14,28 | 44,2±0,9 | 45,1±0,8 | 0,66 |
| Colesterol LDL (mg/dl) | 91,69±33,21 | 92,1±1,9 | 91,7±1,9 | 0,87 |
| Triglicéridos (mg/dl) | 80,43±46,78 | 78,5±2,8 | 83,3±2,7 | 0,07 |
DE: desviación estándar; IMC: índice de masa corporal.
p representa la comparación de cada variable entre pacientes monofásicos y bifásicos.
Los datos sobre IMC, PA sistólica y diastólica fueron similares en ambos grupos de pacientes con patrón bifásico o monofásico (tabla 1). Se observó una discreta diferencia del perímetro de cintura no estadísticamente significativa (p=0,09), siendo este menor en pacientes con patrón monofásico. Tampoco se observaron diferencias estadísticamente significativas en el perfil lipídico entre ambos grupos. Aunque no se observaron diferencias estadísticamente significativas, los índices HOMA-IR y HOMA-β fueron mayores en pacientes con patrón monofásico, lo cual podría implicar una mayor insulinorresistencia en comparación con los pacientes con un patrón bifásico. Estos resultados son concordantes con el hallazgo en el grupo de pacientes con respuesta bifásica de un índice QUICKI estadísticamente superior frente a los monofásicos (0,026±0,0018 vs 0,0211±0,0014; p<0,001), así como la presencia en los primeros de un índice de sensibilidad a la insulina mayor y un menor índice de Matsuda (tabla 2).
Determinaciones de la homeostasis de glucemia, insulina y función de célula β
| Parámetro | Total | Monofásico | Bifásico | p |
|---|---|---|---|---|
| HOMA-β | 2,62±2,14 | 2,64±0,15 | 2,61±0,09 | 0,20 |
| HOMA-IR | 3,44±3,41 | 3,36±0,20 | 3,29±0,13 | 0,18 |
| Índice de sensibilidad a la insulina | 175,86±139,61 | 174,9±8,9 | 178,9±7,4 | 0,28 |
| QUICKI | 0,024±0,028 | 0,026±0,001 | 0,0211±0,001 | < 0,001 |
| Índice Matsuda | 4,72±2,91 | 4,81±0,18 | 4,68±0,17 | 0,54 |
| Índice insulinogénico | 1,79±1,91 | 1,63±0,13 | 1,97±0,9 | 0,96 |
p representa la comparación de cada variable entre pacientes monofásicos y bifásicos.
La función de la célulaβ estimada por el índice insulinogénico fue mayor en pacientes con patrón bifásico que en pacientes con patrón monofásico (1,97±0,9 vs 1,63±0,13), aunque el resultado no fue estadísticamente significativo. El área bajo la curva de glucosa fue mayor en pacientes con patrón monofásico, siendo en este grupo el área bajo la curva menor para la insulina (tabla 2).
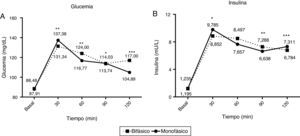
A lo largo de la curva de la SOG se demostraron diferencias estadísticamente significativas entre los valores de glucosa en los tiempos 30, 60, 90 y 120min (p<0,01, p<0,01, p<0,05 y p<0,001, respectivamente). La glucemia basal fue similar en ambos grupos. Los pacientes con patrón monofásico presentaron glucemias más elevadas en los minutos 30 y 90, con una mayor liberación de insulina en los primeros 30min, a pesar de que alcanzaron menores cifras de glucemia a los 120min, y siendo la diferencia en la insulinemia al final de la curva >6mU/l (fig. 1).
Curva de respuesta de la glucosa (A) y la insulina (B) durante la sobrecarga oral de glucosa (SOG) en grupos monofásicos (línea continua) y bifásicos (línea punteada).
La glucemia en los pacientes con perfil monofásico es significativamente mayor a los 30 y 90min tras la SOG, coincidiendo con una mayor insulinemia en el minuto30 y menor en el minuto90, siendo la respuesta de insulina mayor en el minuto120 para alcanzar una menor glucemia sérica.
*<0,05; **<0,001; ***<0,0001.
Al comparar los patrones de respuesta según el sexo, observamos que tanto en varones como en mujeres con perfil monofásico existe un pico de liberación de insulina a los 30min que coincide con niveles más elevados de glucemia y un pico de insulina a los 120min que permite alcanzar menores niveles de glucemia comparados con los pacientes con patrón bifásico en quienes el pico de insulina en el minuto30 es menor y posteriormente presenta un descenso progresivo a lo largo de la curva (figura complementaria 1).
Al comparar el comportamiento de la glucemia y de la insulina según el estadio puberal de los pacientes (varones: 194 prepúberes y 115 púberes; mujeres: 95 prepúberes y 184 púberes), se observó que en los púberes los niveles de glucemia e insulina fueron significativamente superiores en el tiempo0 y a partir de los 60min de la SOG (figura complementaria 2). En el minuto30 los pacientes prepúberes y púberes con patrón monofásico tuvieron insulinemias similares (figura complementaria 3).
En los varones, el 54,1% de los prepuberales y el 45,2% de los puberales tuvieron un patrón monofásico y el 44,8 y el 52,6%, respectivamente, patrón bifásico. En las mujeres, tuvieron patrón monofásico el 47,4% de las prepúberes y el 48,9% de las púberes, y patrón bifásico el 52,6% de las prepuberales y el 49,5% de las púberes.
En nuestra serie, 32 pacientes (12 mujeres/20 varones, de ellos 23 puberales) tuvieron AGA, y dentro de ellos el 50% mostraron un patrón monofásico. Veintisiete pacientes presentaron ATG, de los cuales el 19% presentaron patrón monofásico (14 hombres/13 mujeres, 18 púberes). Sin embargo, la HbA1c≥5,7%, definida como prediabetes, tuvo similar distribución en ambos grupos con respuesta monofásica o bifásica.
Una glucemia >155mg/dl a los 60min de la SOG se observó en el 8,3% (49/588) de los pacientes. Esto no se asoció con parámetros antropométricos ni bioquímicos basales, aunque sí se correlacionó directamente con mayores áreas bajo la curva de glucosa e insulina (p<0,001) y con la glucemia >140mg/dl a los 120min (p<0,001) e inversamente con el índice de Matsuda (p<0,05). No hubo correlación con la HbA1c>5,7%.
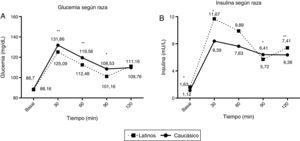
Al analizar la distribución de la respuesta a la SOG según el grupo étnico, observamos que en el grupo caucásico el 52% de los pacientes tuvieron un patrón de respuesta monofásico en comparación al 60% del grupo de pacientes latinos, sin que existan diferencias significativas. Sin embargo, existen claras diferencias entre la glucemia sérica y la insulinemia de ambos grupos, observándose una mayor insulinemia en el grupo de latinos en los minutos30, 60 y 120 de la SOG para alcanzar una glucemia similar a la de los caucásicos en el minuto120, lo que traduce un patrón de mayor insulinorresistencia (fig. 2). No se observaron diferencias en los índices Matsuda, HOMA-IR ni índice insulinogénico entre ambos grupos (p>0,05).
Curva de respuesta de la glucosa (A) e insulina (B) durante la SOG en caucásicos (línea continua) e latinos (línea punteada).
Los pacientes latinos tuvieron glucemias significativamente menores durante toda la curva pero alcanzaron un nivel similar al de los caucásicos en el minuto120. A su vez exhibieron insulinemia significativamente mayor de forma basal y a los 30, 60 y 120min.
*<0,05; **<0,001.
La identificación de pacientes obesos con un mayor riesgo de desarrollar DM2 es fundamental para intensificar las modificaciones en el estilo de vida, o incluso iniciar tratamiento farmacológico preventivo en aquellos pacientes que muestren una alteración en la SOG17,18. Por ello, desde hace varios años se buscan modelos predictivos para identificar poblaciones de riesgo de desarrollar DM2.
En la actualidad se considera la respuesta glucémica a la SOG como mejor predictor de riesgo de DM2 que la glucemia basal19. En adultos americanos se ha estratificado el riesgo de DM2 según la relación entre la glucemia basal y la respuesta glucémica a la SOG, y una recuperación más rápida de la glucemia a cifras basales o cifras inferiores al mismo se relaciona con menor de riesgo de DM29. Esta estrategia permite la identificación de dos grupos diferentes de pacientes: aquellos con anormalidad en la secreción de la insulina y aquellos con menor sensibilidad a la misma, ambos mecanismos fisiopatológicos relacionados con la DM29,20. En adultos caucásicos se han descrito resultados similares, a pesar de que los pacientes con glucemia basal alterada tienen más riesgo de DM2. Si los valores de glucemia descienden por debajo del basal a los 30 o 60min, el riesgo es menor que en los que no los disminuyen, ya que en estos últimos existe una insulinorresistencia hepática, periférica y disfunción de la célulaβ9.
Si bien es cierto que la AGA y la ATG son consideradas diagnósticas de prediabetes, el estudio del patrón de respuesta de la glucemia y la insulinemia de los pacientes a la SOG nos puede ofrecer información adicional sobre la sensibilidad a la insulina y la posibilidad de evolución a DM2 en cada individuo4,20. En nuestra serie, a pesar de que los pacientes con patrón monofásico mostraron mayor insulinorresistencia, no se observó mayor incidencia de prediabetes, lo que podría explicarse por la edad de los pacientes. El seguimiento de estos pacientes permitirá una mejor predicción del riesgo de desarrollar DM2 evolutivamente. Nuestros resultados sugieren que los pacientes con patrón bifásico tienen mayor sensibilidad a la insulina y mejor función de la célulaβ en comparación a aquellos con los que presentan respuesta monofásica, coincidiendo con los resultados previamente descritos en adultos y adolescentes latinos4,9. Destaca que en nuestro grupo de pacientes la respuesta a la SOG se relacionó mejor con la sensibilidad a la insulina que parámetros clínicos como el IMC, la PA y el perímetro abdominal, por lo que las alteraciones en la forma de la curva se podrían considerar un factor predictivo más sensible que estos últimos.
La SOG de 3h de duración en pacientes con sospecha de diabetes gestacional ha demostrado que un mayor número de fases en la misma se asocia a un perfil metabólico más saludable con mayor sensibilidad a la insulina, mayor función de célulaβ y menor incidencia de prediabetes o DM2, sugiriendo que un patrón de respuesta bifásico se asociaría a menor riesgo de DM en este grupo de población7.
Un análisis multivariante reciente propone la determinación de glucosa a los 60 o 90min como marcadores más sensibles para predecir riesgo de DM2 en adultos21, siendo la SOG un elemento importante en los modelos predictores de DM2. En nuestra serie, una glucemia al minuto60 >155mg/dl se correlacionó con la posibilidad de tener una glucemia a los 120min >140mg/dl, por lo que SOG más cortas pueden tener un importante valor predictivo si se modifican los puntos de corte. Llama la atención que en algunas publicaciones se considere que los niveles de glucemia a los 60 y 90min son mejores predictores de DM que el valor a los 120min12. Hay que tener en cuenta que todos los modelos, en general, disminuyen su capacidad de predicción a lo largo del tiempo, en especial aquellos que incluyan la SOG21.
Algunos autores consideran limitada la utilidad de la SOG en adolescentes obesos y sugieren que los índices basales de sensibilidad a la insulina pueden correlacionarse mejor con la insulinorresistencia de los pacientes comparados con la SOG independientemente del grado de tolerancia a la glucosa, siendo los índices HOMA y QUICKI similares en cuanto a su capacidad de predecir insulinorresistencia22. Sin embargo, la comparación realizada con la SOG toma en cuenta solo los valores absolutos en cada tiempo y no la forma de la curva. En nuestra serie, la forma de la curva sugiere modificaciones precoces en el patrón de respuesta a la hiperglucemia, aportando información adicional a la de los índices basales. Apoya esta lectura el hallazgo de que los índices QUICKI y de sensibilidad a la insulina fueron mayores en el grupo de pacientes con respuesta bifásica que en los monofásicos, y el índice de Matsuda, menor.
Comparado con adultos, la historia natural de la DM2 en la edad pediátrica es menos conocida, siendo la disfunción de la célulaβ la hipótesis que tiene mayor peso en la actualidad, desde el punto de vista fisiopatológico4. Estudios en adolescentes americanos han sugerido que la respuesta a la SOG permitiría diferenciar el riesgo de DM2 de manera independiente a la obesidad. Así, los pacientes con respuesta bifásica mostraron mejor función de célulaβ, mayor sensibilidad y secreción de insulina así como menor área bajo la curva de insulina y HbA1c4. Sin embargo, no se dispone de estudios prospectivos que lo confirmen.
Hasta la fecha no se había comparado la respuesta metabólica a la SOG entre pacientes caucásicos y latinos, observándose en nuestro estudio importantes diferencias en la glucemia y la insulinemia en ambos grupos. No obstante, nuestro número de pacientes latinos es pequeño comparado al de caucásicos, lo que limita el valor del análisis.
Comparando nuestros resultados con los descritos en adultos y adolescentes, la respuesta monofásica a la SOG sugiere un patrón de insulinorresistencia que implicaría mayor riesgo para el desarrollo de DM2. El análisis del patrón de respuesta de los pacientes a la SOG podría ser utilizado como un marcador precoz de disregulación en el metabolismo de los hidratos de carbono que permita intensificar las modificaciones en el estilo de vida de manera precoz en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.