La enfermedad meningocócica invasiva (EMI) constituye un grave problema de salud pública. A pesar de que el cultivo es la técnica de referencia para su diagnóstico, la administración previa de antibiótico altera su sensibilidad. Los objetivos de este estudio son el análisis epidemiológico de la EMI en nuestro medio, evaluar la utilidad de la reacción en cadena de la polimerasa (PCR) para incrementar el diagnóstico de confirmación de la EMI y valorar la asociación de la administración de antibiótico con el resultado negativo del cultivo.
Pacientes y métodosEstudio retrospectivo de los pacientes menores de 16 años diagnosticados de EMI mediante cultivo, PCR o ambos, que ingresaron en nuestro centro en el periodo 2004-2012.
ResultadosSe incluyó a 75 pacientes, de los cuales el 52% presentó sepsis, el 30,7% meningitis y el 17,3% sepsis con meningitis. La PCR fue positiva en todas las muestras de sangre y líquido cefalorraquídeo analizadas, mientras que el cultivo tuvo una positividad muy inferior (50,7%). Recibieron antibiótico antes de la extracción de las muestras 40 pacientes (53,3%) y el 40% de ellos fueron confirmados por la PCR.
ConclusionesGracias a la PCR se obtuvo un diagnóstico de confirmación de EMI en el 38,7% de los casos y del serogrupo, hecho relevante para la vigilancia epidemiológica y el estudio de la efectividad vacunal.
Invasive meningococcal disease (IMD) remains a serious public health problem. Although culture is the gold standard, previous antibiotic therapy reduces its sensibility. The aim of this study is the epidemiological analysis of IMD in our area, to assess the usefulness of polymerase chain reaction (PCR) to increase its diagnostic accuracy,and to show the association of antibiotic administration with the negative result of the culture.
Patients and methodsA retrospective study was conducted on all children younger than 16 years with microbiologically (positive culture and/or PCR) confirmed IMD, admitted to our hospital between 2004-2012.
ResultsSeventy-five patients were included, of whom 52% had sepsis, 30.7% meningitis, and 17.3% with both of them. PCR was positive in all samples, whereas a positive was seen 50.7% of the cultures. Previously administered antibiotic was documented in 40 patients (53.3%), and 40% of them were confirmed by PCR only.
ConclusionsPCR was the only test providing evidence for IMD diagnosis and serogroup determination in almost 39% of cases.
La enfermedad meningocócica invasiva (EMI) constituye un grave problema de salud pública en todo el mundo, con un gran impacto social y una alta tasa de morbimortalidad en todos los grupos de edad. A pesar de los avances en el conocimiento de la enfermedad, su diagnóstico y su tratamiento, y de la aplicación de nuevas estrategias de prevención, la EMI es endémica en muchos países del mundo, incluso en los más desarrollados, con tasas de ataque entre 1 y 5 por 100.000 habitantes1.
En España, según los datos del Sistema Nacional de Vigilancia Epidemiológica para el periodo comprendido entre 2004 y 2011, se observa una tasa de incidencia global de EMI de 0,92 a 1,67 casos por 100.000 habitantes2–4. En el niño, la mayor incidencia ocurre en los menores de un año, con tasas de 13 casos por 100.000 en la temporada 2009-20103. Los serogrupos B y C han sido los causantes de más del 90% de los casos de EMI en nuestro medio2,3,5. La introducción de la vacuna antimeningocócica C conjugada, en el año 2001, ha reducido la incidencia de la EMI por este serogrupo hasta un 88%6, a pesar de lo cual continúa siendo una enfermedad grave por las secuelas (11-19%)2,3 y la mortalidad que produce (5-14%)1–3.
La confirmación diagnóstica de la EMI se realiza demostrando la presencia de Neisseria meningitidis (N. meningitidis) en sangre o líquido cefalorraquídeo (LCR), o en ambos, mediante cultivo o detección del ácido desoxirribonucleico (ADN) bacteriano5,7, o por las 2 técnicas. El cultivo continúa siendo el método de referencia para el diagnóstico microbiológico y, además, permite la realización de pruebas de sensibilidad a los antimicrobianos y de estudios de tipificación de la cepa aislada. Sin embargo, no está exento de limitaciones, entre las que destaca su baja rentabilidad cuando las muestras provienen de enfermos que han recibido tratamiento antibiótico previo5,8–11.
A pesar de la realización del cultivo, los casos declarados de EMI sin confirmación microbiológica representan un porcentaje importante, lo cual limita el análisis de la evolución epidemiológica y del impacto de las vacunaciones.
La introducción de las técnicas de detección de ADN mediante la reacción en cadena de la polimerasa (PCR, polymerase chain reaction) ha supuesto un avance en el diagnóstico de confirmación y diversos estudios y guías de práctica clínica recomiendan su realización sistemática5,8,12–14.
Los objetivos de este estudio son el análisis epidemiológico de la EMI en nuestro medio, evaluar la utilidad de la PCR para el diagnóstico de la EMI y correlacionar la negatividad de los cultivos en los casos confirmados con la administración previa de antibiótico.
Pacientes y métodosSe realizó un análisis retrospectivo de las historias clínicas de los pacientes menores de 16 años con diagnóstico clínico de EMI, confirmado por cultivo, PCR o ambos métodos, que ingresaron en el Hospital Universitari Vall d’Hebron en el periodo comprendido entre enero del 2004 y diciembre del 2012. Todos los casos se seleccionaron a partir de los registros de resultados de los cultivos y de la PCR del Servicio de Microbiología.
Los datos recogidos incluyeron variables demográficas, clínicas y de laboratorio; además, se documentó si hubo administración de antibiótico previa a la extracción de la muestra.
Se obtuvieron muestras de sangre, LCR o ambas de los pacientes para la realización de cultivo y PCR (las 2 técnicas realizadas con la misma muestra), que fueron procesadas y analizadas en los laboratorios de diagnóstico molecular, de hemocultivos y de cultivos generales del Servicio de Microbiología. Para la PCR se analizaron las muestras de más de 100μl. Se extrajeron los ácidos nucleicos de las muestras mediante el sistema automatizado EasyMag® (bioMèrieux, Marcy, l’Etoile, Francia) y posteriormente se amplificaron mediante PCR multiplex para N. meningitidis (región ctrA, capsular transport gene), Haemophilus influenzae serogrupo b (bexA, capsulation gene) y Streptococcus pneumoniae (ply, pneumolysin gene) con sondas fluorescentes tipo TaqMan® en un termociclador Smartcycler® (Cepheid, Sunnyvale, EE. UU.)15. Para determinar el serogrupo de N. meningitidis se aglutinó la muestra con antisueros específicos, en los casos en que se de disponía de la cepa; en el resto, se determinó mediante PCR según la descripción de Mölling et al.16. Para la realización del hemocultivo, se utilizó la botella pediátrica con el sistema BacT/ALERT®3D (Biomèrieux, Marcy, l’Etoile, Francia). Para la realización del cultivo del LCR, se centrifugó la muestra a 1.500rpm durante 15 min, y el sedimento se inoculó en una placa con agar sangre y en medio de enriquecimiento LAN.
Se realizó un análisis descriptivo de la muestra para la detección de valores extremos o erróneos y, a continuación, se describieron las variables mediante el cálculo de frecuencias y sus correspondientes proporciones en el caso de variables discretas, y mediante las medias (o medianas) con sus desviaciones estándar (o rango intercuartílico) para las variables continuas. Se utilizó el test de la ji al cuadrado para valorar la significación estadística de la asociación entre la administración de antibiótico previa a la obtención de las muestras y el resultado negativo de los cultivos. Se consideró como punto de corte para la significación estadística una p < 0,05. El análisis estadístico se llevó a cabo con el paquete SPSS® versión 20.0 (SPSS, Chicago, EE. UU.).
Para la realización del estudio se obtuvo la aprobación del comité ético del hospital.
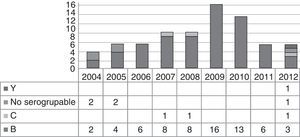
ResultadosEntre enero del 2004 y diciembre del 2012, ingresaron en nuestro centro 75 pacientes con diagnóstico clínico de EMI confirmado mediante cultivo, PCR o ambos. La distribución de los casos en los 9 años del estudio fue homogénea, a excepción de un aumento de la incidencia en los años 2009 y 2010 (29/75, 38,7%) (fig. 1). En la tabla 1 se resumen los datos demográficos y clínicos más relevantes de los pacientes.
Características demográficas y clínicas de los 75 pacientes con enfermedad meningocócica invasiva
| Edad media | 3,1 años | Cuadro clínico | |
| Menores de un año | 21 (28%) | Sepsis | 39 (52%) |
| Sexo | Meningitis | 23 (30,7%) | |
| Hombre | 46 (61,3%) | Sepsis con meningitis | 13 (17,3%) |
| Mujer | 29 (38,7%) | Estancia media hospitalaria | 10,9 días |
| Serogrupos | Ingreso en UCI | 56 (74,7%) | |
| B | 66 (88%) | Mortalidad | 4 (5,3%) |
| C | 3 (4%) | Secuelas | |
| Y | 1 (1,3%) | Sordera | 6 (8%) |
| No serogrupable | 5 (6,7%) | Otras | 2 (2,7%) |
| Vacunación incompleta | Déficit complemento (C5) | 1 (1,3%) | |
| frente a serogrupo C | 3 (4%) |
C5: fracción C5 del complemento; UCI: unidad de cuidados intensivos.
Los datos microbiológicos se recogen en la tabla 2. En 8 de los 36 pacientes con el diagnóstico clínico de meningitis (23 con meningitis y 13 con sepsis con meningitis), la confirmación fue solo mediante cultivo, ya que no se realizó el estudio molecular. En los 28 pacientes restantes se pudo estudiar el LCR mediante cultivo y PCR. La PCR fue positiva en el 100% de los casos y el cultivo en el 50%, es decir, el diagnóstico se obtuvo mediante PCR en la mitad de los pacientes (14 casos).
Características microbiológicas de los 75 pacientes con enfermedad meningocócica invasiva
| Muestras incluidasa | Muestras excluidas | |||
|---|---|---|---|---|
| N total=88 | LCR (N=28) | Sangre (N=47) | LCR (N=8) | Sangre (N=5) |
| Diagnóstico confirmado por PCR | 14/28 (50%) | 23/47 (48,9%) | – | – |
| Diagnóstico confirmado por cultivo y PCR | 14/28 (50%) | 24/47 (51,1%) | – | – |
| Diagnóstico confirmado por cultivob | – | – | 8/36 (22,2%) | 5/52 (9,6%) |
LCR: líquido cefalorraquídeo; N: número de muestras; PCR: reacción en cadena de la polimerasa.
En 5 de los 52 pacientes con el diagnóstico de sepsis (39 con sepsis y 13 con sepsis con meningitis), la confirmación fue solo mediante cultivo, ya que no se realizó el estudio molecular. En los 47 pacientes restantes se pudo realizar cultivo y PCR. La PCR fue positiva en el 100% de los casos y el cultivo en el 51,1%, es decir, el diagnóstico se obtuvo mediante PCR en el 48,9% de los pacientes (23 casos).
El serogrupo de meningococo pudo determinarse en el 88,6% de las muestras (78/88). La PCR permitió conocerlo en el 81,6% (31/38) de las muestras: el 95,8% de las de sangre periférica (22 B y un C) y el 57,1% de las de LCR (8 B) (tabla 3).
Distribución por serogrupos de las muestras de LCR y sangre periférica
| Total muestras (88) | Cepa disponible | Cepa no disponiblea | ||
|---|---|---|---|---|
| LCR (N=22) | Sangre (N=28) | LCR (N=14) | Sangre (N=24) | |
| Serogrupo | ||||
| B | 20 | 24 | 8 | 22 |
| C | – | 2 | – | 1 |
| Y | – | 1 | – | – |
| No serogrupable | 2 | 1 | 6 | 1 |
LCR: líquido cefalorraquídeo.
Un 53,3% de los pacientes (40/75) habían recibido alguna dosis de antibiótico antes de la extracción de las muestras, y de ellos el 40% (16) solo pudo ser diagnosticado por PCR. No se halló significación estadística en el cálculo de la asociación entre la administración previa de antibiótico y la negatividad de los cultivos (p=0,53).
DiscusiónLa EMI presenta formas clínicas de gravedad variable, como sepsis y meningitis. La progresión clínica puede ser rápida y los casos fulminantes cursan con púrpura, coagulación intravascular diseminada, shock y coma, muchas veces a pesar de un diagnóstico y un tratamiento precoces y apropiados1,5.
Los resultados clínicos y microbiológicos obtenidos en nuestra serie coinciden con lo descrito en la literatura, con un predominio de la incidencia de la enfermedad en los menores de un año, el serogrupo B como el más frecuente, y una tasa de secuelas asociadas y un porcentaje de letalidad importantes2–4.
El desarrollo de técnicas moleculares ha supuesto un avance en el diagnóstico microbiológico de la EMI. Estos métodos se utilizan cada vez más en los centros de referencia y tienen una serie de ventajas con respecto al cultivo: son más sensibles, específicos y rápidos, y su capacidad de detección no se ve afectada por la administración previa de antibiótico5,8,10–12; sin embargo, no están exentos de inconvenientes, como el alto coste y la necesidad de personal cualificado para llevarlos a cabo5,8,13. Los últimos datos publicados en el informe de la European Invasive Bacterial Diseases Surveillance Network17 de la temporada 2008-2009 muestran que, a pesar de que el cultivo sigue siendo la técnica de referencia para el diagnóstico de EMI (47,9% en 2008 y 44,7% en 2009), la proporción de casos confirmados solo por PCR es de un 25%, y aún mayor es en países como Grecia (42,7%), Reino Unido (51,6%) e Irlanda (58,3%). Además, recientemente, el Ministerio de Sanidad ha publicado una guía de práctica clínica para el tratamiento de la EMI en la cual se recomienda la utilización sistemática de la PCR en el diagnóstico, aunque la técnica de referencia continúa siendo el cultivo5,13. Esta guía, tras analizar la literatura, afirma que el incremento de casos de EMI con diagnóstico confirmado por PCR oscila entre el 30 y el 40%5. La introducción de la PCR multiplex en nuestro medio ha permitido el diagnóstico del 38,7% de los casos de EMI que no hubieran podido confirmarse, porcentaje similar al hallado en otros estudios5,13. Además, gracias a la PCR se ha podido conocer el serogrupo del 81,6% de aquellas muestras en que no disponía de la cepa de N. meningitidis, hecho relevante para la vigilancia epidemiológica y el estudio de la efectividad vacunal.
Son diversos los trabajos que han evaluado la sensibilidad de la PCR en comparación con el cultivo5,9,10,12,13. Las guías del National Institute for Health and Care Excellence de Reino Unido13 incluyen 4 estudios sobre la PCR que avalan su utilización sistemática. Los resultados muestran que tiene una sensibilidad del 87 al 88%, mientras que la del cultivo oscila entre el 17 y el 58%. Otro estudio incluido en la guía de práctica clínica del Ministerio de Sanidad5 evalúa el uso de la PCR en muestras de LCR para el diagnóstico de confirmación de EMI y encuentra una sensibilidad para la PCR del 92% y para el cultivo del 64%.
En nuestro estudio, en los pacientes en que se pudo comparar el resultado de ambas pruebas diagnósticas, la PCR fue positiva en el 100% de las muestras analizadas, mientras que el cultivo tuvo una positividad muy inferior (50,7%), lo que confirma la mayor sensibilidad de la PCR en comparación con el método de referencia. Hay que señalar que nuestro estudio no fue diseñado para el cálculo de la sensibilidad o el valor predictivo de las 2 técnicas microbiológicas, y que en el mismo no se han podido analizar los resultados de muestras por su escaso volumen recogido.
Además, otra importante limitación de nuestro trabajo es que la selección de la muestra parte de casos con diagnóstico de EMI ya confirmado microbiológicamente, y no incluye los casos sospechosos.
La asociación entre la negatividad de los cultivos y la administración de antibiótico previa a la recogida de las muestras es bien conocida5,8,10–13, aunque en nuestro estudio no ha tenido significación estadística probablemente debido al bajo tamaño muestral.
La introducción de técnicas moleculares microbiológicas ha supuesto un avance importante en el diagnóstico de la EMI, con un importante aumento de los casos confirmados. La PCR, a pesar de su alta sensibilidad y de las otras ventajas ya comentadas, no puede sustituir al cultivo como técnica de referencia. La recomendación de la realización simultánea de las 2 pruebas se basa en que ambas aportan beneficios destacables, como son la mayor sensibilidad gracias a la disminución de los falsos negativos y la determinación del serogrupo; además, la posibilidad de realizar un estudio de la resistencia antibiótica y la tipificación solo puede considerarse en las cepas aisladas en el cultivo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.