Los niños críticos pueden tener riesgo de trombosis venosa profunda (TVP), pero no conocemos ni su incidencia ni la eficacia de la tromboprofilaxis.
ObjetivoDescribir la tromboprofilaxis en niños críticos en España y Portugal, en comparación con datos internacionales.
Material y métodosAnálisis secundario del estudio multinacional PROTRACT, realizado en 59 unidades de cuidados intensivos pediátricos (UCIP) de 7 países desarrollados (4 de Portugal y 10 de España). Se incluyeron los pacientes menores de 18años que no recibieran anticoagulación terapéutica.
ResultadosSe analizaron 308 pacientes, que se compararon con 2.176 de UCIP internacionales. Los factores de riesgo: catéter en vena femoral (p=0,01), yugular (p<0,001), cáncer (p=0,03) y sepsis (p<0,001) fueron más frecuentes en las UCIP ibéricas. El porcentaje de pacientes con tromboprofilaxis farmacológica fue similar en ambos grupos (15,3% vs. 12,0%). La heparina de bajo peso molecular se utilizó con mayor frecuencia en las UCIP ibéricas (p<0,001). En los pacientes con profilaxis, la historia de trombosis (p=0,02), catéter venoso femoral (p<0,001), cáncer (p=0,02) y trauma craneal o craneotomía (p=0,006) fueron más frecuentes en las UCIP ibéricas. En solo el 6,8% de los candidatos de las UCIP ibéricas se utilizó tromboprofilaxis mecánica, en comparación con el 23,8% de los internacionales (p<0,001).
ConclusionesA pesar de que los pacientes ingresados en UCIP ibéricas suelen presentar factores de riesgo de TVP, la tromboprofilaxis es poco utilizada, siendo la heparina de bajo peso molecular la medida más habitual. La tromboprofilaxis pasiva se utiliza raramente. Se deberían consensuar las pautas de tromboprofilaxis en los niños críticamente enfermos.
Although critically ill children may be at risk from developing deep venous thrombosis (DVT), data on its incidence and effectiveness of thromboprophylaxis are lacking.
ObjectiveTo describe the use of thromboprophylaxis in critically ill children in Spain and Portugal, and to compare the results with international data.
Material and methodsSecondary analysis of the multinational study PROTRACT, carried out in 59 PICUs from 7 developed countries (4 from Portugal and 6 in Spain). Data were collected from patients less than 18years old, who did not receive therapeutic thromboprophylaxis.
ResultsA total of 308 patients in Spanish and Portuguese (Iberian) PICUS were compared with 2176 admitted to international PICUs. Risk factors such as femoral vein (P=.01), jugular vein central catheter (P<.001), cancer (P=.03), and sepsis (P<.001), were more frequent in Iberian PICUs. The percentage of patients with pharmacological thromboprophylaxis was similar in both groups (15.3% vs. 12.0%). Low molecular weight heparin was used more frequently in Iberian patients (P<.001). In treated children, prior history of thrombosis (P=.02), femoral vein catheter (P<.001), cancer (P=.02) and cranial trauma or craniectomy (P=.006), were more frequent in Iberian PICUs. Mechanical thromboprophylaxis was used in only 6.8% of candidates in Iberian PICUs, compared with 23.8% in the international PICUs (P<.001).
ConclusionsDespite the presence of risk factors for DVT in many patients, thromboprophylaxis is rarely prescribed, with low molecular weight heparin being the most used drug. Passive thromboprophylaxis use is anecdotal. There should be a consensus on guidelines of thromboprophylaxis in critically ill children.
La trombosis venosa profunda (TVP) y el embolismo pulmonar (EP) son complicaciones graves pero poco reconocidas en los niños hospitalizados y críticamente enfermos1,2. En adultos ingresados en una UCI, la prevalencia de TVP o EP con manifestaciones clínicamente evidentes es superior a 20 por 1.000 pacientes, con una incidencia mayor de 14,5 por 1.000 pacientes a pesar de la tromboprofilaxis farmacológica (TPF) que se realiza3, por lo que dicha tromboprofilaxis está justificada a menos que exista alguna contraindicación formal para la anticoagulación4.
En niños ingresados en una unidad de cuidados intensivos pediátricos (UCIP), los escasos datos disponibles estiman la prevalencia de TVP o EP con manifestaciones clínicas en unos 9 casos por 1.000 pacientes y su incidencia en 7 episodios por 1.000 niños5, sin que se disponga de recomendaciones específicas acerca de la TPF en dichos pacientes6.
En una encuesta realizada a profesionales de UCIP norteamericanos, su opinión era favorable a prescribir TPF en adolescentes sometidos a ventilación mecánica, en condiciones de hipercoagulabilidad, en casos con antecedentes de TVP o con anastomosis cavopulmonar7.
El estudio prospectivo multicéntrico PROTRACT concluyó que la frecuencia baja y la gran variabilidad en las prácticas de tromboprofilaxis en UCIP hacen necesaria la realización de investigaciones bien diseñadas cuyos resultados puedan servir de base para sentar las indicaciones de la TPF en niños1. En el presente estudio, análisis secundario de dicha investigación1, hemos analizado la frecuencia de tromboprofilaxis en niños críticamente enfermos en España y Portugal, tratando de identificar las características de los pacientes y de las UCIP en dichos casos.
Material y métodosDiseñoSe ha realizado un análisis secundario de los datos del estudio prospectivo observacional multicéntrico multinacional PROTRACT1 llevado a cabo en 4 fechas de 2012 (1 de febrero, 1 de mayo, 1 de agosto y 1 de noviembre) en 59 UCIP de 7 países desarrollados (Estados Unidos de América, Canadá, Australia, Nueva Zelanda, Singapur, Portugal y España), que incluyó 2.484 pacientes. En el presente estudio se han analizado los datos de los pacientes correspondientes a las 4 UCIP de Portugal y a las 10 de España incluidos en dicha investigación y se han comparado con los demás pacientes (ingresados en UCIP de otros países).
La metodología completa del estudio PROTRACT se ha publicado previamente1. Fueron incluidos los pacientes menores de 18años ingresados en las UCIP los días de estudio, a menos que estuvieran recibiendo anticoagulación terapéutica o estuvieran ingresados en UCIP por falta de cama en otras áreas hospitalarias. Los datos de cada paciente fueron recogidos a las 9 de la mañana de cada fecha de estudio, incluyendo los datos demográficos, los antecedentes y los datos clínicos del ingreso. Se recogieron las características clínicas con relación conocida con la TVP o el EP2,6,8–11, indicaciones y contraindicaciones de TPF basadas en las recomendaciones pediátricas del American College of Chest Physicians (ACCP)6 y la aplicación real de tromboprofilaxis. También se contabilizaron los catéteres venosos centrales (CVC) presentes en los pacientes, ya que su presencia es el factor de riesgo más significativo para la TVP en niños12,13. Se recogieron los tratamientos concomitantes que pudieran tener relación con el riesgo de TVP y que pudieran condicionar la tromboprofilaxis o influir en sus resultados (agentes vasoactivos, nutrición parenteral, ventilación mecánica, tratamiento con L-asparaginasa, reposo en cama, y cirugía previa o programada). Los datos fueron recogidos y manejados mediante el sistema Research Electronic Data Capture (REDCap) de la Washington University y la St. Louis School of Medicine14.
Definiciones y medidas de pronósticoHemos definido a un paciente como candidato a recibir TPF si: a)estaba ingresado en la UCIP, y b)basándonos en las recomendaciones pediátricas del ACCP, presentaba una miocardiopatía dilatada, anastomosis cavopulmonar, cardiopatía congénita cianógena, enfermedad renal terminal o hipertensión pulmonar, sin contraindicación para la anticoagulación. Se consideró contraindicada la anticoagulación en caso de: cirugía programada, trombocitopenia inducida por heparina, hemorragia intracraneal o hemorragia no intracraneal que requiriese transfusión de productos hemáticos6,15.
Todo paciente al que se le administrara un fármaco tromboprofiláctico (aspirina, heparina de bajo peso molecular, heparina no fraccionada intravenosa o subcutánea, warfarina o clopidogrel), o tromboprofilaxis mecánica en las 24h previas a la fecha de estudio, se consideró que recibía tromboprofilaxis. Se consideró que la administración de >10unidades/h de heparina no fraccionada a través del CVC constituía una dosis tromboprofiláctica, mientras que dosis inferiores eran un tratamiento para mantener la permeabilidad del catéter12.
La medida pronóstica primaria fue la frecuencia de TPF, definida como la proporción de todos los pacientes ingresados en la UCIP que recibían TPF. El objetivo secundario era identificar los factores asociados con la prescripción de tromboprofilaxis. Solo se incluyeron los niños de 8 o más años en el análisis de la tromboprofilaxis mecánica, ya que solo se utiliza a partir de dicha edad12.
Análisis estadísticoLos pacientes fueron divididos en 3 franjas de edad: lactantes menores de un año, niños entre 1 y 13años, y adolescentes mayores de 13años, de acuerdo con la distribución bimodal de la TVP en la infancia12,13. Se han combinado los datos de las 4 fechas de recogida de datos. Las variables continuas se expresan como mediana y rango intercuartílico (IQR) y las categóricas como valores absolutos y porcentajes. Los análisis estadísticos se realizaron con el programa Stata 12 (StataCorp LP, College Station, TX). Se consideró estadísticamente significativa una p<0,05 con 2 colas. Se calcularon odds ratio (OR) e intervalos de confianza del 95%. Los detalles completos del análisis estadístico se han publicado previamente1.
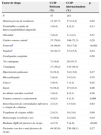
ResultadosCaracterísticas de los pacientes y las unidades de cuidados intensivos pediátricosSe incluyeron un total de 308 (12,4%) pacientes ingresados en 14 UCIP de España y Portugal, que se han comparado con 2.176 (87,6%) ingresados en 45 UCIP de otros países. Los pacientes estuvieron distribuidos de forma similar en las 4 fechas de estudio. En la tabla 1 se muestran sus características, así como las de las UCIP. La distribución por grupos de edad fue significativamente diferente en los 2 subgrupos, con mayor porcentaje de pacientes menores de un año y mayores de 13años en las UCIP internacionales (p=0,02). En cuanto a la raza de los pacientes, mientras que en las UCIP internacionales el 24,3% eran de raza no blanca, ese porcentaje fue solo del 6,2% en las UCIP ibéricas (p<0,001). El tamaño de las UCIP fue muy diferente, de modo que la mayoría de las UCIP ibéricas (64,3%) tenían 10 camas o menos, mientras que el 88,9% de las internacionales tenían más de 10 camas (p<0,001).
Características de los pacientes y de las unidades de cuidados intensivos pediátricos (UCIP). Resultados en número (%)
| España y Portugaln (%) | UCIP internacionalesn (%) | p | |
|---|---|---|---|
| Pacientes | 308 (12,4) | 2.176 (87,6) | |
| Grupos de edad | 0,02 | ||
| < 1 año | 121 (39,3) | 904 (41,5) | |
| 1-13 años | 166 (53,9) | 1.025 (47,1) | |
| > 13 años | 21 (6,8) | 247 (11,4) | |
| Sexo masculino | 163 (52,9) | 1.226 (56,3) | 0,26 |
| Raza: | < 0,001 | ||
| Blanca | 271 (88,0) | 1.426 (65,5) | |
| Negra | 14 (4,6) | 355 (16,3) | |
| Asiática | 4 (1,3) | 130 (6,0) | |
| Otra o desconocida | 19 (6,1) | 265 (12,2) | |
| UCIP | 14 (23,7) | 45 (76,3) | |
| Tipo de hospital | 0,76 | ||
| Universitario/académico | 10 (71,4) | 34 (75,6) | |
| Otro/privado | 4 (28,6) | 11 (24,4) | |
| Tipo de UCIP | 0,48 | ||
| Cardíaca | 0 (0) | 4 (8,9) | |
| Médica o quirúrgica | 5 (35,7) | 17 (37,8) | |
| Mixta | 9 (64,3) | 24 (53,3) | |
| Número de camas | < 0,001 | ||
| ≤ 10 | 9 (64,3) | 5 (11,1) | |
| 11-20 | 5 (35,7) | 22 (48,9) | |
| > 20 | 0 (0) | 18 (40,0) |
Los factores de riesgo de TVP presentes en los pacientes se muestran en la tabla 2. Al comparar las 2 muestras se observó que la presencia de catéteres en vena femoral (p=0,01), yugular (p<0,001), cáncer (p=0,03) y sepsis (p<0,001) fue más frecuente en las UCIP ibéricas. La mediana de factores de riesgo por paciente fue significativamente superior en las UCIP ibéricas que en las internacionales (3 vs. 2, p<0,001), si bien los porcentajes de pacientes con más de 2 factores de riesgo simultáneos fueron similares (tabla 2).
Factores de riesgo de trombosis venosa profunda. Resultados en número (porcentaje)
| Factor de riesgo | UCIP ibéricasn (%) | UCIP internacionalesn (%) | p |
|---|---|---|---|
| n | 308 | 2.176 | |
| Historia previa de trombosis | 17 (5,5) | 100 (4,6)) | 0,47 |
| Trombofilia o estado de hipercoagulabilidad adquirido | 4 (1,3) | 17 (0,8) | 0,35 |
| Obesidad | 3 (1,0) | 43 (2,0) | 0,22 |
| Catéter venoso central | 173 (56,2) | 1.139 (52,3) | 0,21 |
| Femorala | 63 (33,0) | 292 (22,3) | 0,001 |
| Yugulara | 70 (36,6) | 287 (21,3) | < 0,001 |
| Cardiopatía congénita | 0,42 | ||
| No cianógena | 36 (11,7) | 205 (9,4) | |
| Cianógena | 40 (13,0) | 272 (12,5) | |
| Hipertensión pulmonar | 28 (9,1) | 137 (6,3) | 0,07 |
| Miocardiopatía | 7 (2,3) | 33 (1,5) | 0,32 |
| Cáncer | 26 (8,4) | 117 (5,4) | 0,03 |
| Sepsis | 53 (17,2) | 200 (9,2) | < 0,001 |
| Accidente vascular cerebral | 6 (2,0) | 34 (1,6) | 0,62 |
| Trauma craneal o craneotomía | 29 (9,4) | 147 (6,8) | 0,09 |
| Inmovilización de extremidades inferiores | 9 (2,9) | 37 (1,7) | 0,14 |
| Cirugía de columna | 15 (4,9) | 68 (3,1) | 0,11 |
| Trasplante de órgano sólido | 5 (1,6) | 34 (1,6) | 0,94 |
| Hemorragia (cerebral o no) | 17 (5,5) | 102 (4,7) | 0,52 |
| Mediana (IQR) de factores de riesgo | 3 (1-5) | 2 (1-4) | < 0,001 |
| Pacientes con 2 o más factores de riesgo | 221 (71,8 | 1.491 (68,5) | 0,25 |
IQR: rango intercuartílico
De las 14 UCIP analizadas, 9 (64,3%) disponían de un protocolo formal de tromboprofilaxis, en comparación con 26 de las 45 internacionales (57,8%) (p=0,67).
Tromboprofilaxis farmacológicaUn total de 47 pacientes (15,3%) de las UCIP ibéricas recibieron algún tipo de TPF, siendo esa cifra de 261 (12,0%) en la cohorte internacional (p=0,10). Los fármacos empleados se muestran en la tabla 3. La heparina de bajo peso molecular se utilizó con mayor frecuencia en los pacientes tratados en las UCIP ibéricas que en las internacionales (p<0,001), mientras que las heparina no fraccionada por vía subcutánea fue más utilizada en estas últimas, aunque el número de casos es muy pequeño y, por lo tanto, este dato es poco valorable.
Medidas de tromboprofilaxis farmacológica utilizadas
| Fármaco | UCIP ibéricasn (%) | UCIP internacionalesn (%) | p |
|---|---|---|---|
| Aspirina | 11 (3,6) | 132 (6,1) | 0,08 |
| Heparina de bajo peso molecular | 31 (10,1) | 82 (3,8) | <0,001 |
| Heparina no fraccionada intravenosa | 5 (1,6) | 60 (2,8) | 0,24 |
| Heparina no fraccionada subcutánea | 3 (0,1) | 5 (0,2) | 0,03 |
| Antagonista de vitamina K | 1 (0) | 14 (0,6) | 0,50 |
| Clopidogrel | 0 (0) | 2 (0,1) | 0,60 |
| Total | 47 (15,3) | 261 (12,0) | 0,10 |
Los factores de riesgo presentes en dichos pacientes se muestran en la tabla 4, y otros tratamientos concomitantes, en la tabla 5. Fue más frecuente la historia previa de trombosis (p=0,02), la presencia de un catéter venoso femoral (p<0,001), el cáncer (p=0,02) y el trauma craneal o craneotomía (p=0,006) en las UCIP ibéricas, mientras que la mediana de factores de riesgo en los pacientes con TPF fue superior en las UCIP internacionales (5 vs. 4, p<0,001). La presencia de tratamientos concomitantes fue similar en ambas series, con la excepción de la cirugía programada (pacientes ingresados en UCIP y en los que estaba previsto algún tipo de cirugía en un plazo de 2 días), que fue más frecuente en las UCIP ibéricas (p=0,007).
Factores de riesgo de trombosis venosa profunda en los pacientes que recibieron tromboprofilaxis farmacológica
| Factor de riesgo | UCIP ibéricasn (%) | UCIP internacionalesn (%) | p |
|---|---|---|---|
| N | 47 | 261 | |
| Historia previa de trombosis | 13 (27,7) | 37 (14,2) | 0,02 |
| Trombofilia o estado de hipercoagulabilidad adquirido | 3 (6,4) | 6 (2,3) | 0,13 |
| Obesidad | 3 (6,4) | 11 (4,2) | 0,51 |
| Catéter venoso central | 37 (78,8) | 186 (71,3) | 0,29 |
| Femorala | 18 (40,9) | 38 (17,8) | <0,001 |
| Yugulara | 10 (22,7) | 33 (15,5) | 0,24 |
| Cardiopatía congénita | 0,50 | ||
| No cianógena | 7 (14,9) | 28 (10,7) | |
| Cianógena | 17 (36,2) | 116 (44,4) | |
| Hipertensión pulmonar | 9 (19,2) | 34 (13,0) | 0,27 |
| Miocardiopatía | 3 (6,4) | 14 (5,4) | 0,78 |
| Cáncer | 3 (6,4) | 3 (1,2) | 0,02 |
| Sepsis | 9 (19,2) | 27 (10,3) | 0,08 |
| Accidente vascular cerebral | 3 (6,4) | 8 (3,1) | 0,26 |
| Trauma craneal o craneotomía | 4 (8,5) | 4 (1,5) | 0,006 |
| Inmovilización de extremidades inferiores o cirugía de columna | 2 (4,3) | 13 (5,0) | 0,83 |
| Trasplante de órgano sólido | 2 (4,3) | 10 (3,8) | 0,89 |
| Hemorragia (cerebral o no) | 5 (10,6) | 12 (4,6) | 0,10 |
| Mediana (IQR) de factores de riesgo | 4 (2-5) | 5 (4-6) | <0,001 |
| Pacientes con dos o más factores de riesgo | 44 (93,6) | 230 (88,1) | 0,27 |
IQR: rango intercuartílico
Tratamientos concomitantes recibidos por los pacientes con tromboprofilaxis farmacológica
| Tratamiento | UCIP ibéricasn (%) | UCIP internacionalesn (%) | p |
|---|---|---|---|
| Agentes vasoactivos | 21 (44,7) | 84 (32,2) | 0,10 |
| Nutrición parenteral | 17 (36,2) | 65 (24,9) | 0,11 |
| Ventilación mecánica | |||
| Invasiva | 25 (53,2) | 111 (42,5) | 0,18 |
| No invasiva | 12 (25,5) | 51 (19,5) | 0,35 |
| L-asparaginasa | 1 (2,3) | 1 (0,4) | 0,17 |
| Reposo en cama | 26 (55,3) | 109 (41,8) | 0,09 |
| Cirugía | |||
| Programada | 8 (17,0) | 15 (5,8) | 0,007 |
| Previa | 25 (53,2) | 101 (38,7) | 0,06 |
| Catéter venoso central | 37 (78,7) | 186 (71,3) | 0,29 |
La tromboprofilaxis mecánica se realizó solo en 5 de 73 (6,8%) pacientes candidatos (mayores de 8años) en las UCIP ibéricas, en comparación con 156 de 655 (23,8%) de la cohorte internacional (p<0,001). En todos los casos ibéricos se utilizaron medias elásticas, en contraste con la cohorte internacional, en la que se usaron dispositivos neumáticos de compresión secuencial en el 85,9% y medias de compresión gradual en el 22,4% de los pacientes (p<0,001).
DiscusiónEl tromboembolismo es una causa significativa de morbimortalidad en adultos hospitalizados, habiéndose comunicado incidencias entre el 10 y el 40%2,16. En niños, su incidencia parece ser mucho más baja, alrededor del 0,5% de las hospitalizaciones2,17–19. Cuando los niños están críticamente enfermos, los factores de riesgo de TVP se incrementan, por lo que se debería esperar que se incrementara su frecuencia, aunque no se dispone de datos fiables al respecto1.
Según esto, la utilización de alguna pauta de tromboprofilaxis en niños ingresados en UCIP podría estar justificada, aunque se trata de un tema controvertido. Por un lado, su uso indiscriminado podría exponer de forma innecesaria a los niños de «riesgo bajo» a un riesgo incrementado de sangrado o a complicaciones como la trombocitopenia inducida por la heparina2. Por otro, la omisión de la tromboprofilaxis en niños de «riesgo elevado» podría resultar en episodios de TVP o EP que pudieran haberse evitado2. Además de las medidas farmacológicas, la tromboprofilaxis mecánica (indicada habitualmente en los mayores de 8años) podría ofrecer una prevención exenta de riesgos para el paciente.
En la práctica, los profesionales reconocen que utilizan como guía para la prescripción de tromboprofilaxis la presencia de uno o más factores de riesgo, como la presencia de CVC, ventilación mecánica, cardiopatías o hipercoagulabilidad1,7,20.
El estudio multicéntrico PROTRACT, que incluyó un número importante de UCIP y pacientes de varios países desarrollados, del que nuestro estudio es un análisis secundario, mostró que existe una gran variabilidad en el uso de la tromboprofilaxis en los niños críticamente enfermos1. Dicho estudio ha identificado una serie de características que se asociaron al uso de TPF, como las cardiopatías congénitas, la inmovilidad, la obesidad, la historia previa de trombosis o anastomosis cavopulmonar, la presencia de uno o más CVC y la adolescencia1.
Sin embargo, dada la variabilidad comentada, era preciso comparar los resultados obtenidos en las UCIP de nuestro medio (la península ibérica) de cara a tener una imagen más real de lo que ocurre en nuestras unidades. Nuestros resultados indican que las UCIP ibéricas y sus pacientes tienen características diferenciadas del resto de la muestra, de modo que se trata de UCIP con un menor número de camas, un menor porcentaje de pacientes en los extremos de edad (menos de un año y más de 13años) y un pequeño porcentaje de enfermos de raza no blanca. A pesar de ello, los factores de riesgo de TVP presentes en nuestros pacientes fueron similares a los de las UCIP internacionales, si bien se observó una incidencia significativamente superior de factores como los CVC (femoral y yugular), cáncer y sepsis. Si bien nuestro estudio no tiene un diseño que permita establecer o descartar una causalidad, consideramos que el número de camas de las UCIP o la edad de los pacientes no deberían ser factores determinantes en este sentido.
Si bien el porcentaje de pacientes que recibieron TPF fue similar en las UCIP ibéricas e internacionales, las pautas fueron diferentes, de modo que en nuestras UCIP el fármaco más empleado fue la heparina de bajo peso molecular, mientras que en las internacionales lo fue la aspirina, lo que traduce un mejor seguimiento de las recomendaciones actuales en las UCIP ibéricas1,6.
Muchos de los pacientes ingresados en UCIP presentan condiciones clínicas complejas, por lo que tienen más de un factor de riesgo para TVP. En nuestra serie la mediana fue de 3, mientras que en las UCIP internacionales era de 2 factores. En los casos que recibieron TPF fue superior la mediana de factores de riesgo en las UCIP internacionales (5 vs. 4).
A pesar de su sencillez (en el caso de las medias elásticas) y su seguridad (ya que no plantean riesgo de sangrado), las medidas de tromboprofilaxis mecánica fueron utilizadas en muy pocos casos en las UCIP ibéricas, mientras que lo fueron en la cuarta parte de los pacientes candidatos en las UCIP internacionales. Si bien no se dispone de evidencias concluyentes sobre su eficacia1, consideramos que este podría ser un punto de mejora en la prevención de la TVP, que debería ser tenido en cuenta por los profesionales en los niños mayores de 8años con algún factor de riesgo.
¿Por qué se usan tan poco las medidas de tromboprofilaxis en los niños críticamente enfermos? Es posible que a este hecho contribuyan varios factores, como la falta de evidencias pediátricas, la subestimación del riesgo de TVP por los pediatras, los protocolos basados en opiniones de expertos (y, por lo tanto, poco vinculantes) o el caso relativo que en la práctica se hace a algunas recomendaciones1,6, así como el temor al riesgo de sangrado al administrar heparina u otros fármacos antiagregantes o anticoagulantes7,17. La disponibilidad de un protocolo formal de tromboprofilaxis debería ser una medida para estandarizar esta pauta. Dicho protocolo, que existe en algo más de la mitad de las UCIP tanto ibéricas como internacionales, tiene el inconveniente de que debe basarse en la extrapolación de los datos y protocolos de adultos, así como las opiniones y preferencias de los profesionales de cada unidad1.
Nuestros resultados tienen algunas limitaciones que deben ser consideradas. Al igual que en el estudio global PROTRACT, no se ha recogido la evolución clínica de los pacientes en cuanto a TVP, EP o sangrado, ya que se trataba de un estudio diseñado para conocer solo la prevalencia de los factores de riesgo y las medidas de tromboprofilaxis. Sería por tanto interesante llevar a cabo un nuevo estudio que implique a un número suficiente de UCIP, con una metodología que permita establecer la significación clínica de los factores de riesgo de TVP y EP, así como los efectos positivos y riesgos (individuales y comparativos) de las medidas de tromboprofilaxis1. Dicho estudio podría servir de base para la elaboración de un protocolo de tromboprofilaxis en UCIP sustentado por evidencias.
La participación de las UCIP fue voluntaria, lo que podría introducir algún sesgo en cuanto a las características de los pacientes. De todos modos, en este sentido consideramos que, por sus características, tanto las UCIP portuguesas como las españolas participantes reflejan la realidad de la asistencia intensiva en nuestros países. En cuanto a la posible heterogeneidad de las UCIP internacionales, consideramos que se trata de UCIP de países desarrollados que, si bien tienen sistemas de organización y trabajo variables, pueden ser comparables en términos de dotación humana y material, tipología de pacientes ingresados y procedimientos realizados. El hecho de que por razones de índole organizativa las UCIP ibéricas sean de menor tamaño (menor número de camas) que las internacionales pudiera suponer un cierto sesgo de los resultados, por lo que debe tenerse en cuenta.
ConclusionesA pesar de que muchos de los niños críticamente enfermos presentan más de un factor de riesgo de TVP, las medidas de tromboprofilaxis son poco utilizadas en estos pacientes, tanto en España y Portugal como a nivel internacional. En las UCIP ibéricas es más frecuente y unánime la utilización de la heparina de bajo peso molecular, mientras que es anecdótico el uso de medidas de tromboprofilaxis pasiva, que sí es utilizada en las UCIP internacionales. Se debería tratar de consensuar las indicaciones y pautas de aplicación de la tromboprofilaxis en los niños críticamente enfermos.
FinanciaciónEl Dr. E.V. Faustino recibió ayuda de las Becas CTSA número UL1 TR000142 y KL2 TR000140.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría dar las gracias a todos los participantes en el estudio PROTRACT por su colaboración en el presente estudio.
Akron Children's Hospital: Ann-Marie Brown, MSN; Alberta Children's Hospital: Leena Desai, MSc, y Elaine Gilfoyle, MD, MMEd; Baylor College of Medicine: Michelle Goldsworthy, BN, Nancy Jaimon, BSN, MSN, y Laura Loftis, MD; Baystate Medical Center: Michael Canarie, MD; Boston Children's Hospital: Daniel Kelly, MD, y Adrienne Randolph, MD, MSc; Centre Hospitalier Universitaire de Sherbrooke: Miriam Santschi, MD, MSc; Centre Mere-Enfant Soleil du CHU de Quebec: Marc-Andre Dugas, MD, MSc, y Louise Gosselin, BN; Centro Hospitalar Lisboa Norte: Joana Rios, MD; Children's Hospital and Medical Center, Omaha and Nebraska Medical Center: Edward Truemper, MD, MS, y Brenda Weidner, BSN; Children's Hospital and Research Center Oakland: Heidi Flori, MD, y Julie Simon, RN; Children's Hospital at Westmead: Marino Festa, MD, Karen Walker, PhD, y Nicola Watts, PhD; Children's Hospital of Philadelphia: Daniela Davis, MD, MSCE, Mary Ann DiLiberto, BS, William Kamens, BA, Rebecca McIntosh, BA, Brooke Park, BSN, y Janice Prodell, RN; Children's Hospital of Wisconsin: Sheila Hanson, MD, MS, Kathleen Murkowski, BS, y David Triscari, BS; Children's Hospitals and Clinics of Minnesota: Chris Leonard, BA, Jeffrey Nowak, MD, y Alison Overman, BA; CHU Sainte-Justine University of Montreal: Mariana Dumitrascu, MD, Jacques Lacroix, MD, y Marisa Tucci, MD; Cohen Children's Medical Center of New York: Aaron Kessel, MD, James Schneider, MD, y Todd Sweberg, MD; Complexo Hospitalario Universitario A Coruna: Angela Ferrer Barba, MD, y Carmen Ramil, MD; Connecticut Children's Medical Center: Christopher Carroll, MD, MS; Dell Children's Medical Center of Central Texas: LeeAnn Christie, MSN, y Renee Higgerson, MD; Doernbecher Children's Hospital: Aileen Kirby, MD; Duke University Medical Center: Ira Cheifetz, MD, Kyle Rehder, MD, y Samantha Wrenn, BS; Gregorio Maranon General University Hospital: Jesus Lopez-Herce, MD, PhD; Helen DeVos Children's Hospital: Nabil Hassan, MD, y Akunne Ndika, MBBS, MPH; Hospital Clínico Universitario de Santiago: Antonio Rodriguez-Nunez, MD, PhD, y Sara Trabazo-Rodriguez, MD; Hospital Dona Estefania: Maria Ventura, MD; Hospital Infantil Universitario Miguel Servet: Juan Pablo Garcia Íñiguez, MD, y Paula Madurga Revilla, MD; Hospital Infantil Universitario Niño Jesús: Maria Isabel Iglesias Bouzas, MD; Hospital Pediatrico Coimbra: Maria Dionisio, MD; Hospital Regional Universitario Materno Infantil Carlos Haya: Patricia García Soler, MD; Hospital Sao Joao: Miguel Fonte, MD; Hospital Universitario Materno Infantil Las Palmas de Gran Canaria: Antonio Jimenez, MD; Joseph M Sanzani Children's Hospital at Hackensack University Medical Center: Shira Gertz, MD; KK Women's and Children's Hospital: Loh Tsee Foong, MBBS, MMed, y Anuradha Menon, MBBS; Maria Fareri Children's Hospital: Simon Li, MD, MPH; Mater Children's Hospital: Sara Mayfield, BHSc, y Andreas Schibler, MD; Montreal Children's Hospital: Yasser Kazzaz, MBBS, y Samara Zavalkoff, MDCM; Nationwide Children's Hospital: Sue Cunningham, BSN, Kristin Greathouse, MS, BSN, Dianna Hidalgo, BS, Sarah O’Brien, MD, MSc, Kami Perdue, BS, y Lisa Steele, BSN; Nuestra Señora de Candelaria Hospital: Jose Sebastian Leon Gonzalez, MD; Penn State Children's Hospital: Debra Spear, RN, y Robert Tamburro, MD; Princess Margaret Hospital: Simon Erickson, MBBS; Riley Hospital for Children: Stephanie Fritz, RN, Christi Rider, LPN, y Mark Rigby, MD, PhD; Royal Children's Hospital Brisbane: Debbie Long, PhD, Anthony Slater, MBBS, y Tara Williams, BSN; Royal Children's Hospital Melbourne: Warwick Butt, MBBS, Carmel Delzoppo, BSc, y Sophie Syddall, PhD; Sant Joan de Deu Hospital: Iolanda Jordan, PhD, y Lluisa Hernandez, MD; St. Louis Children's Hospital: Rachel Jacobs, BA, Philip C. Spinella, MD, y Cindy Terrill, CCRP; Starship Children's Hospital: John Beca, MBChB, Tracey Bushell, BA, Miriam Rea, BN, y Claire Sherring, RN; Stony Brook University Medical Center: Kathleen Culver, DNP, y Margaret Parker, MD; Sydney Children's Hospital: Gary Williams, MBBS, y Janelle Young, MApSc, MPH; University Hospital of Salamanca: Mirella Gaboli, MD, PhD, y Pedro Gomez de Quero, MD; University of California at San Francisco: Victoria Lo, BS, y Anil Sapru, MD, MAS; University of Rochester Medical Center: Jill M. Cholette, MD, y L. Eugene Daugherty, MD; University of Virginia: Robin Kelly, RN, y Douglas Willson, MD; Women's and Children's Hospital, Adelaide: Georgia Letton, BA, y Michael Yung, MD; Yale-New Haven Children's Hospital: Edward Vincent S. Faustino, MD, Kim Marohn, MD, Veronika Northrup, MPH, Li Qin, PhD, Sree Pemira, MD, Joana Tala, MD, Elyor Vidal, MPH