La influencia de la obesidad parental sobre la de los hijos y sus comorbilidades, aunque asumida, está insuficientemente caracterizada.
Pacientes y métodosEstudio retrospectivo de 800 pacientes obesos (45,2% niñas; edad: 10,35±3,40 años, índice de masa corporal [IMC]:+4,22±1,68 standard deviation score[SDS]). Se realizaron comparaciones entre grupos según la presencia de obesidad en ningún (n=347) o algún progenitor (n=453), diferenciando entre presencia de obesidad en el padre (n=185), la madre (n=151) o ambos progenitores (n=117). Variables consideradas: edad al inicio de la obesidad y en primera consulta, peso neonatal (PRN), IMC-SDS, glucemia, insulinemia, índice homeostatic model assessment (HOMA), colesterol total (CT), HDL, LDL, triglicéridos, 25-OH-vitaminaD, área bajo la curva (AUC) de insulinemia en el test de tolerancia oral a la glucosa (TTOG), whole body insulin sensitivity index (WBISI), cocientes LDL/HDL y CT/HDL y reducción ponderal en los 12 primeros meses de seguimiento.
ResultadosNo hubo diferencias la distribución por sexo, etnia y pubertad entre grupos. Aquellos pacientes con algún progenitor obeso presentaron mayor PRN-SDS e IMC-SDS (p<0,01), mayor afectación del metabolismo hidrocarbonado (insulinemia, AUC-insulina, HOMA, HbA1c [p<0,01] y menor WBISI [p<0,05]) que aquellos sin ningún progenitor obeso. Entre aquellos con un único progenitor obeso, se observó mayor PRN-SDS, insulinemia y HOMA y menor 25-OH-vitaminaD (p<0,05) cuando el antecedente era materno. Existía mayor prevalencia de síndrome metabólico cuando ambos progenitores eran obesos (χ2=5,96, p<0,05). De todos ellos, 132 disminuyeron el IMC≥1,5SDS y/o el peso ≥10%, sin influencia del antecedente de obesidad parental.
ConclusionesLa obesidad en algún progenitor determina mayor gravedad de la obesidad y de las alteraciones del metabolismo hidrocarbonado en sus hijos; acentuándose cuando la obesidad es materna o de ambos progenitores, pero sin influir en la posibilidad de éxito terapéutico.
The influence of parental obesity on their obese offsprings is acknowledged but insufficiently characterised.
Patients and methodsRetrospective study of 800 obese patients (45.2% girls; age: 10.35±3.40 years, body mass index [BMI]:+4.22±1.68 standard deviation score [SDS]). Group comparison according to the presence of obesity in none (n=347) or any of the parents (n=453), and then whether the obese parent was the father (n=185), the mother (n=151), or both parents (n=117) were performed. The parameters analysed were: Age at the onset of the obesity and at their first visit, birth weight (BW), BMI-SDS, blood glucose, insulin level, homeostatic model assessment (HOMA) index, total cholesterol (TC), HDL, LDL, triglycerides, 25-OH-vitamin-D, area under the curve (AUC) for insulin in the oral glucose tolerance test (OGTT), whole body insulin sensitivity index (WBISI), LDL/HDL and TC/HDL ratios, and weight loss after 12 month follow-up.
ResultsNo differences were observed between groups as regarding gender, ethnic background, or pubertal stage. Patients with one obese parent showed higher BW-SDS and BMI-SDS (P<.01), more severe impairment of carbohydrate metabolism (blood insulin, insulin-AUC, HOMA, HbA1c [P<.01] and lower WBISI [P<.05]) than those with no obese parent. Among those patients with a single obese parent, higher BW-SDS, insulin, HOMA, and lower 25-OH-vitamin D (P<.05) was observed when obesity was present in the mother. There was a higher prevalence of metabolic syndrome when both parents were obese (χ2=5.96, P<.05). A total of 132 patients reduced their BMI by ≥1.5SDS, or their weight by ≥10%, with no influence of the background of parental obesity.
ConclusionsObesity in any parent determines a higher severity of their offspring obesity and metabolic comorbidities, more importantly when obesity is present in the mother or in both parents, but without interference in the options of therapeutic success.
Los cambios socioeconómicos producidos en estas últimas décadas han ocasionado la aparición de nuevos modelos de alimentación y de vida más sedentarios facilitando el desarrollo de obesidad en las generaciones pediátricas actuales1. Además, los hijos de padres obesos podrían presentar mayor riesgo de obesidad añadido debido a la influencia de los hábitos de vida familiares junto con una base genética de mayor susceptibilidad para el desarrollo de la enfermedad. De hecho, un porcentaje elevado de los niños y adolescentes actualmente obesos tienen progenitores obesos.
Está claramente definido que ciertos patrones dietéticos y alimentarios presentes en las familias pueden desencadenar obesidad en sus miembros más jóvenes. Mediante métodos de observación directa se han identificado las conductas de las comidas familiares (relaciones interpersonales y con los alimentos) beneficiosas y perjudiciales para la obesidad infantil2, extendiéndose la influencia familiar más allá de los progenitores. Tienen mayor riesgo de desarrollar obesidad los niños que conviven con alguno de sus abuelos, cada vez más involucrados en su cuidado3. Los abuelos tienden a complacer, sobrealimentar y proteger de las tareas físicas a sus nietos, lo que aumenta su riesgo de obesidad. El motivo subyacente de esta acción es el afecto por su nieto y se deriva de experiencias personales, malentendidos y el escaso reconocimiento de los efectos adversos para la salud de la obesidad infantil3.
Los padres y su situación ponderal influyen en el desarrollo de la obesidad de sus hijos, así como en su tratamiento. Diversos estudios destacan las diferencias patentes entre los progenitores a la hora de percibir la obesidad infantojuvenil como una enfermedad y en la actitud de los padres frente a la obesidad de sus hijos, pero sin entrar a valorar la existencia de obesidad en estos progenitores. En general, un alto porcentaje de padres perciben erróneamente el estado ponderal de su hijo, lo que aumenta casi en 12 veces la probabilidad de tener un hijo obeso4, y transfieren la responsabilidad en la obesidad infantil a las escuelas e instituciones públicas5. Estudios recientes de niños y adolescentes que entran en un programa de reducción ponderal con involucración parental describen un mejor entendimiento de las pautas de tratamiento de la obesidad infantojuvenil, por parte de padres no obesos, basado en una mejor comunicación con mayor capacidad de atención y el uso del tiempo necesario para comprender las pautas de tratamiento6. Además, existen estudios que han demostrado que los niños con padres y hermanos obesos tienen menor probabilidad de éxito en los programas de pérdida ponderal, incidiendo alguno de ellos en una menor respuesta asociada a la obesidad materna. Las comorbilidades parentales relacionadas con la obesidad se han asociado también con una peor respuesta al tratamiento de la obesidad infantil, siendo esta asociación más fuerte si ambos padres presentan comorbilidades. Otros estudios establecen que la disminución de peso parental influye de manera importante en el resultado del tratamiento de los niños obesos. En conjunto, un limitado número de estudios indica que la obesidad parental puede influir en el resultado del tratamiento de la obesidad infantil. Sin embargo, la implicación de la obesidad parental en la gravedad de la obesidad infantojuvenil y sus comorbilidades asociadas continúa siendo controvertida, y su posible influencia sobre el éxito del tratamiento está insuficientemente caracterizada7.
Por este motivo, el objetivo prioritario de este estudio es analizar la gravedad de la obesidad, las comorbilidades metabólicas observadas y la respuesta al tratamiento en los niños y adolescentes obesos en relación con la presencia de obesidad en uno o ambos progenitores, analizando la posible influencia adicional de quién es el progenitor afecto.
Pacientes y métodosSe desarrolló un estudio retrospectivo sobre 800 pacientes obesos (361 niñas [45,2%] y 439 niños [54,8%]; edad: 10,35±3,40 años (rango: 0,33-17,84 años); índice de masa corporal [IMC]:+4,22±1,68standard deviation score [SDS]) atendidos en la consulta de obesidad del Servicio de Endocrinología de un hospital terciario desde el año 2009 hasta el año 2014, con el IMC parental registrado tras pesar y tallar a ambos padres y un año completo de seguimiento. De estos, 434 (54,2%) eran prepuberales (estadio Tanner I) y 366 (45,8%), puberales (estadio Tanner ≥II). La cohorte estaba mayoritariamente formada por pacientes caucásicos (n=599 [72,7%]) e hispanos (n=179 [21,7%]).
Se registraron y estandarizaron en la visita inicial las siguientes variables: peso, talla, IMC8,9 y presión arterial10 sistólica y diastólica (media de 3 determinaciones, Critikon®-Dinamap™ Vital-Sign-Monitor: 8100) de todos los pacientes. Se consideraron obesos aquellos pacientes con un IMC>+2SDS tanto para referencias nacionales8 como de la International Obesity Task Force (IOTF)9. Se recogió la edad de inicio de la obesidad y el peso neonatal (PRN), que fue estandarizado según sexo y edad gestacional11. Se determinaron en su evaluación inicial: glucemia, insulinemia, HbA1c, ácido úrico, colesterol total (CT), colesterol-HDL, colesterol-LDL, triglicéridos, 25-OH-vitaminaD, TSH y T4L en suero tras 12h de ayuno. Se realizó un test de tolerancia oral a la glucosa (TTOG [1,75mg glucosa/kg, máximo: 75g]) en 555 pacientes. Se calculó el área bajo la curva (AUC) de glucosa e insulina con la siguiente fórmula: 0,25×basal+0,5×valor-30́+0,75×valor-60́+0,5×valor-120. El índice HOMA (homeostatic model assessment) fue calculado como glucosa basal (mg/dl)×insulina basal (μU/ml)/405, y el índice WBISI (whole body insulin sensitivity index) como 10.000/√ glucosa en ayunas×insulina en ayunas×media de glucosa en el TTOG×media de insulina en el TTOG12. Se diagnosticó síndrome metabólico (SM) en los pacientes mayores de 10 años (n=454 [56,8%]) de acuerdo con los criterios propuestos por la International Diabetes Federation (IDF)13.
En todos los pacientes se instauró, tras el diagnóstico inicial de obesidad y la exclusión de patología orgánica subyacente, un tratamiento conservador centrado en tres aspectos: 1) la modificación conductual dirigida a la ralentización de la ingesta, la disminución del tamaño de las raciones y la organización de los momentos de ingesta (fundamentada en el condicionamiento clásico, el análisis del refuerzo y la identificación y control de los pensamientos negativos automáticos); 2) recomendaciones alimentarias (adecuada distribución de grupos alimentarios en un programa semanal, sin restricción calórica específica [indirectamente sustentada en la ralentización de la ingesta]), y 3) actividad física (indicación diaria de una hora de juego o ejercicio aeróbico ajustado a la edad y condiciones del paciente, sugiriendo aumento progresivo de intensidad). Independientemente de la intensidad de la obesidad en los pacientes, se programaron revisiones clínicas estructuradas del siguiente modo: visita inicial, primera revisión al mes y revisiones trimestrales posteriormente. Se invitó a la incorporación de todos los miembros de la familia a la implementación de las recomendaciones sugeridas con el objetivo de facilitar el cumplimiento por parte del paciente.
Se consideró que los pacientes habían alcanzado una reducción ponderal significativa cuando consiguieron reducir su IMC≥1,5SDS y/o su peso ≥10% en 12 meses de seguimiento.
Se realizó una evaluación comparativa entre grupos según el antecedente de obesidad (IMC>30kg/m2)14 en ninguno de los progenitores (NO; n=347) o al menos en algún progenitor (OB; n=453), diferenciando posteriormente en estos últimos entre un único progenitor obeso (1-Ob; n=336) o ambos progenitores (2-Ob; n=117). En los casos con un progenitor obeso, se diferenció si el obeso era el padre (P; n=185) o la madre (M; n=151).
Para el análisis estadístico se utilizó el software Statistical Package for Social Sciences (SPSS v.15.0. MapInfo Corporation, Troy, NY, EE.UU.). Se empleó la prueba de Kolmogorov-Smirnov para determinar el ajuste a la distribución normal de las variables (lo cumplían: glucemia, CT y colesterol-LDL). Para su comparación, entre grupos independientes, se usó la prueba de la t de Student; mientras que para la comparación del resto de variables (que seguían una distribución no normal) se usó la prueba de la U de Mann-Whitney. Para comparar el porcentaje de pacientes con SM entre los grupos de estudio se empleó el test de la χ2. Se estableció un valor de p<0,05 como nivel de significación.
Pese a que se incluyeron en el estudio todos los pacientes que cumplían los criterios descritos, atendidos en el periodo 2009-2014, se realizó una estimación del tamaño muestral necesario para alcanzar los objetivos del estudio. Asumiendo una prevalencia de hiperinsulinemia del 30% en el grupo de pacientes sin progenitores obesos, el cálculo del tamaño muestral requerido por grupo fue de n=362, para unos errores alfa del 5% y beta del 10%, con el fin de detectar un incremento esperado del 10% en la prevalencia de hiperinsulinemia en el grupo de pacientes con algún progenitor obeso vs. aquellos sin progenitores obesos.
ResultadosNo se observaron diferencias significativas entre los grupos (NO vs. OB, 1-Ob vs. 2-Ob, P vs. M) en la distribución de sexo, etnia y desarrollo puberal, ni en la edad referida al inicio de la obesidad ni en su primera consulta (tabla 1).
Comparación entre los distintos grupos de antecedente de obesidad parental
| Ningún progenitor obeso (n=347) | Algún progenitor obeso (n=453) | Ambos progenitores obesos (n=117) | Padre obeso (n=185) | Madre obesa (n=151) | |
|---|---|---|---|---|---|
| Edad (años) | 10,27±3,5 | 10,37±3,31 | 10,06±3,61 | 10,39±3,27 | 10,59±3,11 |
| Edad al inicio de la obesidad (años) | 6,41±3,2 | 6,25±3,11 | 6,28±3,01 | 5,99±3,33 | 6,55±2,9 |
| PRN_SDS | 0,14±1,4 | 0,39±1,45 | 0,7±1,6 | 0,13±1,26 | 0,45±1,5 |
| Talla_SDS | 0,94±1,28 | 1,04±1,18 | 0,97±1,28 | 1,09±1,09 | 1,03±1,23 |
| Talla diana_SDS | −0,26±0,97 | −0,34±0,98 | −0,23±0,96 | −0,23±0,96 | −0,40±1,00 |
| IMC_SDS | 3,91±1,46 | 4,46±1,80 | 4,82±2,07 | 4,20±1,52 | 4,52±1,87 |
| Glucosa basal (mg/dl) | 92,60±6,53 | 92,89±7,04 | 92,02±7,17 | 92,87±6,48 | 93,59±7,55 |
| Insulina basal (μU/ml) | 13,05±6,80 | 15,45±11,15 | 16,52±12,76 | 14,02±7,6 | 16,31±13,10 |
| HOMA | 3,01±1,64 | 3,59±2,75 | 3,80±3,00 | 3,23±1,87 | 3,84±3,35 |
| AUC_insulina (μU/ml) | 84,50±49,33 | 101,49±64,22 | 103,47±61,85 | 93,52±56,54 | 109,17±73,23 |
| WBISI | 3,79±1,99 | 3,41±1,75 | 3,18±1,65 | 3,64±1,79 | 3,31±1,78 |
| Colesterol total (mg/dl) | 158,44±28,68 | 159,04±31,01 | 158,98±32,75 | 161,29±31,02 | 156,26±29,54 |
| Colesterol LDL (mg/dl) | 96,34±24,29 | 96,76±25,97 | 98,09±28,60 | 97,74±24,36 | 94,49±25,71 |
| Triglicéridos (mg/dl) | 77,97±50,52 | 82,94±52,02 | 82,53±48,46 | 83,37±56,10 | 82,72±49,76 |
| 25-OH-vitaminaD (ng/ml) | 23,05±9,45 | 21,15±8,31 | 23,37±10,37 | 22,89±7,96 | 19,40±8,35 |
AUC: área bajo la curva; IMC: Índice de masa corporal; PRN: peso de recién nacido; SDS: standard deviation score; WBISI: whole body insulin sensitivity index.
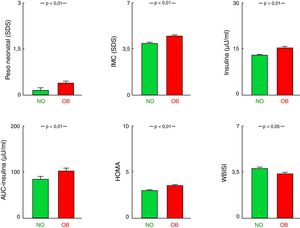
Los pacientes del grupo OB, es decir, con algún progenitor obeso (padre, madre o ambos) presentaron mayor PRN-SDS e IMC-SDS en su primera consulta que los que no tenían ningún progenitor obeso (NO vs. OB, p<0,01). Se observó, además, en el grupo OB, una afectación más intensa del metabolismo hidrocarbonado con mayores niveles de insulinemia, AUC de insulina, HOMA, HbA1c (todos p<0,01) y menor WBISI (p<0,05), aunque con similar glucemia y AUC de glucosa (tabla 1; fig. 1). Los niveles de triglicéridos tendían a ser mayores en los pacientes con antecedentes de obesidad parental, pero sin alcanzar significación (p=0,076). No se encontraron diferencias en el resto de los parámetros estudiados. Cuando la comparación se establecía frente a los pacientes en quienes ambos progenitores eran obesos (NO vs. 2-Ob), los hallazgos fueron similares (tabla 1).
Comparación entre los grupos sin antecedente parental de obesidad (NO) y con antecedente de obesidad en al menos un progenitor (OB). Datos representados como media± EE.
AUC: área bajo la curva; EE: error estándar; HOMA: homeostatic model assessment; IMC: índice de masa corporal; SDS: standard deviation score; WBISI: whole body insulin sensitivity index.
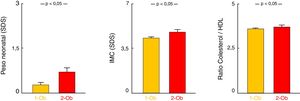
Se observó mayor prevalencia de SM (χ2=5,96; p<0,05) en aquellos pacientes con ambos progenitores obesos (23,08%) que en los pacientes con un progenitor obeso (15,77%) y los pacientes sin antecedente de obesidad parental (13,54%). Los pacientes con ambos progenitores obesos tenían mayor PRN-SDS (p<0,01) e IMC-SDS (p<0,05) en la visita inicial que los pacientes con un progenitor obeso. En cuanto a las comorbilidades metabólicas, los pacientes con ambos progenitores obesos presentaron mayor CT/HDL (p<0,05) (tabla 1; fig. 2). No se hallaron diferencias significativas en ninguno de los restantes parámetros estudiados (tabla 1).
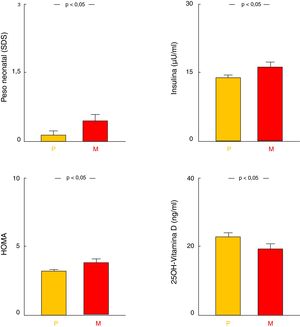
Influencia del progenitor afectoEntre los pacientes que tenían un progenitor obeso, se observó mayor PRN-SDS, mayores niveles de insulinemia y HOMA y menores niveles de 25-OH-vitaminaD (todos p<0,05) cuando el antecedente era materno. Asimismo, existía en estos pacientes una tendencia a presentar mayor IMC-SDS, pero sin alcanzar significación (tabla 1; fig. 3). No se encontraron diferencias en el resto de los parámetros analíticos estudiados.
Respuesta al tratamientoDe todos los pacientes que formaban el conjunto de la cohorte (n=800), 132 (16,5%) lograron una reducción ponderal intensa en 12 meses de tratamiento (disminución del IMC≥1,5SDS y/o del peso ≥10%), sin observarse diferencias significativas en el porcentaje de pacientes con pérdida ponderal en relación con el antecedente de obesidad en ninguno, uno o ambos padres.
DiscusiónLos resultados del estudio muestran cómo las características y comorbilidades de la obesidad infantojuvenil se ven influidas en varios aspectos por el IMC parental.
Los niños y adolescentes con algún progenitor obeso pesaron más al nacer y su obesidad (valorada por IMC) era más intensa en el momento de consultar. Estos dos aspectos se agravaban en aquellos pacientes con ambos progenitores obesos. Este hecho, aunque controvertido, es apoyado por otros autores, sobre todo en la influencia en edades tempranas de la infancia (<10 años), pues posteriormente también puede ser clave en el mantenimiento o desarrollo de obesidad en el adulto15-17.
Cuando solo uno de los progenitores era obeso y este era la madre, los niños y adolescentes tenían mayor PRN y tendían a un mayor IMC en el momento de consultar por su obesidad. La asociación de la obesidad materna con la macrosomía del recién nacido, y el mayor riesgo de obesidad y comorbilidades metabólicas en las futuras etapas vitales del niño, está claramente afianzada18,19. Nuestro estudio indica que esta asociación es más fuerte con la obesidad materna que con la paterna. Esta influencia materna puede explicarse —al menos en parte— por la existencia de factores prenatales y perinatales asociados al desarrollo de obesidad en etapas posteriores20-22.
Dentro de las comorbilidades del metabolismo hidrocarbonado asociadas a obesidad, la resistencia a la acción de la insulina (RI) se objetivó más intensa en aquellos pacientes con el antecedente de obesidad parental. Sin embargo, esto no se reflejó en la glucemia, que fue similar, independientemente del antecedente de obesidad parental. A pesar de las dificultades expuestas por algunos autores para la definición de RI23, estudios previos de nuestro grupo24,25 y colaborativos en nuestro entorno nacional26 han puesto de manifiesto que la RI antecede con mucho las alteraciones glucémicas en niños obesos (como un rasgo diferencial frente a los adultos). Más aún, este resultado corrobora los aportados por estudios previos que también describen un mayor riesgo de RI y mayor hiperinsulinemia en los pacientes con padres obesos, relacionándolo con otros factores de riesgo cardiovascular (FRCV) (obesidad, dislipidemia e hipertensión arterial) que conforman el SM, más prevalente en nuestra cohorte en aquellos pacientes con antecedente de obesidad en ambos padres27-29, aunque cabe destacar que Halvorsen et al. encuentran también asociación entre la presencia de FRCV y SM en padres e hijos, independientemente del IMC de ambos. Para Monzani et al., la obesidad parental es el único factor de riesgo necesario para el desarrollo de SM en la infancia, a diferencia de la adolescencia, etapa en la que son necesarios otros hábitos obesogénicos.
En relación con la definición de SM empleada, es preciso señalar que esta se restringe a los pacientes con más de 10 años, siendo esperable una prevalencia superior si se hubiesen empleado criterios pediátricos dirigidos a un rango etario más amplio. El empleo de los criterios de la IDF para la definición del SM está basado en la ausencia de consenso existente en el momento actual en la literatura internacional referente a la idoneidad del establecimiento del diagnóstico de SM en la edad pediátrica. Así, si bien existen criterios específicos postulados para su definición en población pediátrica, otros autores discrepan de este diagnóstico en edades tempranas de la vida, recomendando (como es el caso de la IDF) el diagnóstico y tratamiento de las alteraciones metabólicas de forma individualizada, sin establecer una categoría diagnóstica de SM13.
En nuestra cohorte, la obesidad parental también determinó mayor prevalencia de SM, mayor aún cuando ambos progenitores eran obesos, representando un mayor riesgo de enfermedad cardiovascular y metabólica futura en estos niños y adolescentes. De hecho, la prevalencia de SM en nuestra cohorte fue mayor que la de otros estudios que también relacionan SM y obesidad tanto de uno como de ambos progenitores30,31. Este hecho podría estar relacionado con la obesidad más grave de los pacientes incluidos en nuestro estudio (representado por el elevado IMC-SDS medio) y por tratarse de una cohorte hospitalaria en la que la presencia de alteraciones metabólicas detectadas por los facultativos de Atención Primaria pueden establecer un sesgo en la derivación de los pacientes a atención especializada. A pesar de este hallazgo, no existían diferencias destacables en el perfil lipídico, salvo un mayor CT/HDL en los pacientes con ambos padres obesos, de manera contraria a otros estudios previos que sí establecen mayores niveles de triglicéridos y colesterol-LDL y menores niveles de colesterol-HDL en niños y adolescentes con padres obesos y afectos de SM27,28, aunque esto podría estar relacionado con la menor edad media de los pacientes de nuestra cohorte.
La comparación de las comorbilidades metabólicas en los pacientes con un progenitor obeso determinó que la RI era más intensa en los casos asociados a obesidad materna. Este hallazgo corrobora observaciones previas en las que está demostrada la influencia de la obesidad materna en el desarrollo de RI y obesidad incluso en niños que nacen con un peso adecuado para la edad gestacional32, siendo novedosa la aportación del carácter diferencial frente a la obesidad paterna.
También es destacable el hallazgo de los niveles de 25-OH-vitaminaD menores en los pacientes con antecedente de obesidad materna. La relación de la obesidad y la vitaminaD es un tema de actual interés, englobando a la obesidad dentro de una serie más amplia de factores de riesgo para la insuficiencia y deficiencia de vitaminaD33. Estos factores de riesgo pueden afectar a varios miembros de una misma familia con los mismos hábitos dietéticos y de ocio. Sin embargo, la relación de la obesidad materna con los niveles de 25-OH-vitaminaD en los descendientes está solo parcialmente estudiada, aunque en ella pudiera influir una posible deficiencia materna de vitaminaD durante el embarazo secundaria a su obesidad, entre otros posibles factores34.
De forma aparentemente contraria a lo esperable, un hallazgo novedoso de este estudio radica en que el antecedente de obesidad parental no influyó en la posibilidad de obtener una buena respuesta al tratamiento conservador, previamente descrito, durante los 12 meses de seguimiento. Este hecho se opone a lo expresado por la escasa evidencia científica publicada, que relaciona el antecedente de obesidad parental con una peor respuesta al tratamiento en los niños y adolescentes obesos7. Es ciertamente innegable que la implicación familiar, independientemente del IMC, constituye uno de los principales factores de los que depende la respuesta satisfactoria al tratamiento35-37. Sin embargo, nuestro hallazgo parece indicar que incluso los progenitores afectos de obesidad son capaces de fomentar en sus descendientes comportamientos saludables, con una tasa de éxito similar a la de los padres no obesos. Asimismo, la observación de las dificultades y comorbilidades parentales por parte de los hijos (particularmente los de mayor edad) pueden estimular las iniciativas autónomas para el control ponderal por parte de estos. Sin embargo, el registro del grado de implementación de las recomendaciones por parte de los progenitores de los pacientes y de la evolución ponderal de aquellos podría haber aportado información adicional a este respecto, siendo una limitación de este estudio el no haber llevado a cabo tal registro.
Nuestro estudio tampoco está exento de las limitaciones propias de los estudios de cohortes, con la imposibilidad de determinar causalidad (pudiendo expresar solamente asociación), así como por el tiempo necesario para alcanzar el tamaño muestral necesario y completar su seguimiento, lo que puede dificultar la homogeneidad de las condiciones de estudio para todos los pacientes estudiados.
En conclusión, nuestros resultados en este estudio retrospectivo sobre una amplia cohorte de pacientes pediátricos obesos demuestran que el antecedente de obesidad en algún progenitor determina mayor gravedad de la obesidad infantojuvenil y de la RI asociada en sus hijos afectos de obesidad, acentuándose dichos hallazgos cuando la obesidad está presente en la madre o en ambos progenitores. Sin embargo, el antecedente de obesidad parental no empeora la probabilidad del éxito terapéutico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa: 37.o Congreso de la Sociedad Española de Endocrinología Pediátrica (SEEP). Valencia, España, 2015.