El SARS-CoV-2 afecta principalmente a adultos, y en ellos se produce el mayor número de ingresos en UCI y la mayor mortalidad1. Aunque en niños la enfermedad se describe como menos grave y con un tiempo de recuperación más corto2, presentamos el caso de una paciente de 16años, sana y sin contactos conocidos con COVID-19, que sufrió una neumonía grave por SARS-CoV-2 que requirió ECMO veno-venosa y que se ha recuperado por completo.
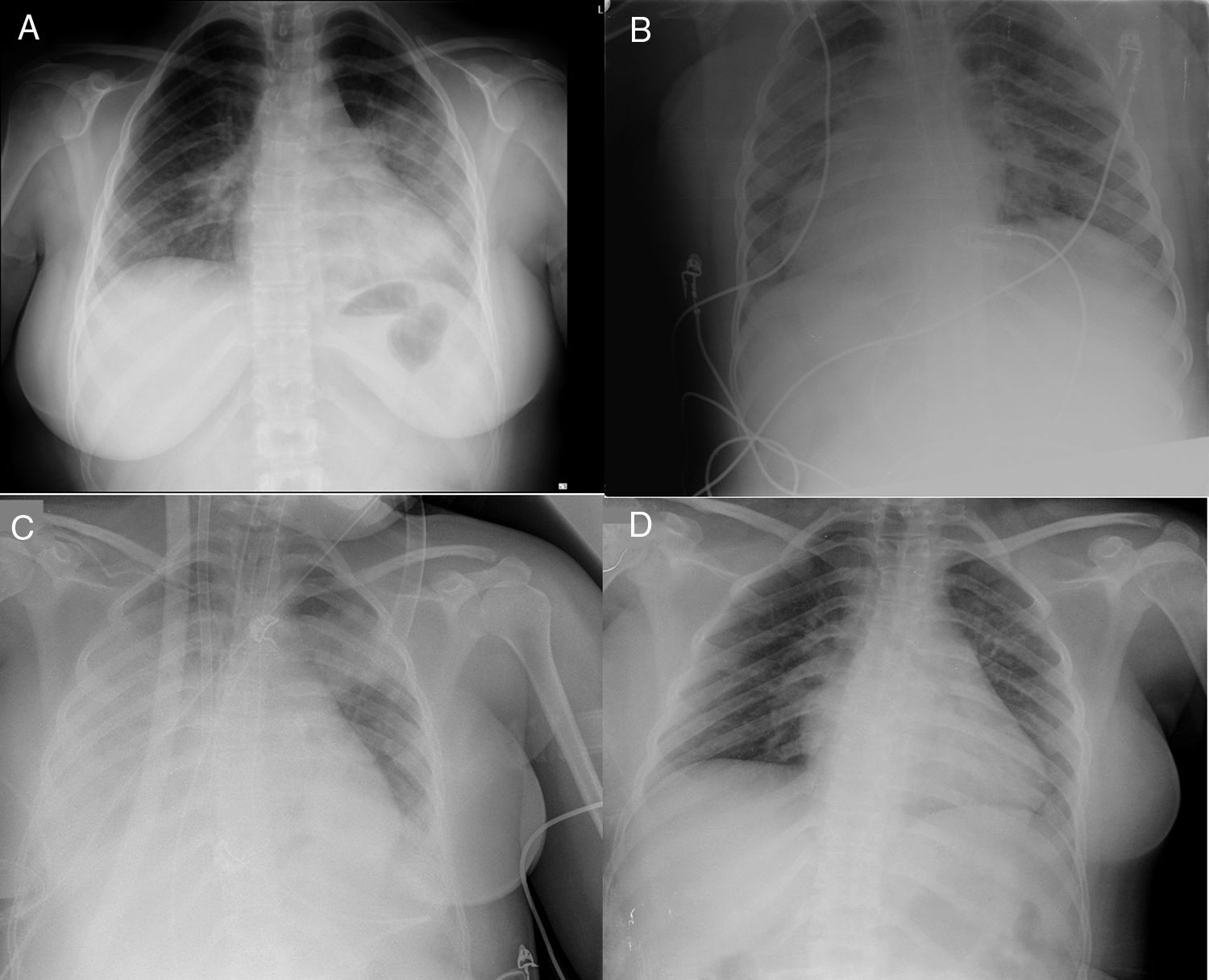
La enferma acudió a Urgencias del hospital de su Departamento de Salud por presentar tos y fiebre persistente durante 6días. La radiografía de tórax mostró una neumonía (fig. 1A), e ingresó en la sala de hospitalización. A las 48h del ingreso se constató la positividad de la PCR SARS-CoV-2, por lo que se le prescribió ritonavir/lopinavir (hasta 7días), hidroxicloroquina (hasta 10días), azitromicina (hasta 5días) e interferón β-1b (hasta 7días). Ese mismo día empeoró, con taquicardia, taquipnea, disnea, fiebre (39,9°C) y SaO2 de 90% (4l/min de oxígeno suplementario). Fue trasladada a UCI, requiriendo de inmediato intubación orotraqueal y ventilación mecánica invasiva (fig. 1B). Durante las siguientes 72h se instauró bloqueo neuromuscular, presión positiva al final de la espiración (PEEP) de 12-14cmH2O, óxido nítrico inhalado y ventilación en decúbito prono (2sesiones). Transcurridos 4días en UCI, la PaO2 y la PaO2/FiO2 empeoraron (esta última a 70mmHg durante 6h), por lo que se activó al equipo ECMO-móvil del hospital terciario de referencia en nuestra comunidad autónoma. Se colocó in situ una ECMO veno-venosa femoral-yugular (Cardiohelp®, Maquet Cardiopulmonary AG, Hirrlingen, Alemania) (fig. 1C): cánula de succión multiperforada 21F y retorno yugular 19F.
Radiografía simple de tórax. A) Radiografía de tórax en urgencias del hospital departamental. B)Radiografía de tórax al ingreso en la UCI del hospital departamental (prono). C)Radiografía de tórax al ingreso en la UCI tras el traslado interhospitalario al hospital de referencia (día0 de ECMO). D)Radiografía de tórax en la planta del hospital de referencia (día del alta hospitalaria).
Tras el implante fue trasladada a la UCI del hospital de referencia. A su llegada, el pulso era de 77latidos/min y la presión arterial de 131/61mmHg con noradrenalina a 0,1μg/kg/min. Fue ventilada con un volumen corriente de 3ml/kg peso, FiO2 50% y PEEP 14cmH2O. Flujo sanguíneo inicial de la ECMO de 4,2l/min con FiO2 100% (a 4l/min). Destacaba una linfopenia, una marcada elevación de interleucina-6, proteína C reactiva, ferritina y dímerosD, con troponina negativa (tabla 1). Al ingreso en nuestra UCI iniciamos tocilizumab (600mg primera dosis y 400mg 12h después), metilprednisolona (1mg/kg/24h, 3 dosis) y cambiamos el tratamiento antiviral a remdesivir (200mg primera dosis y 100mg/24h, 4días).
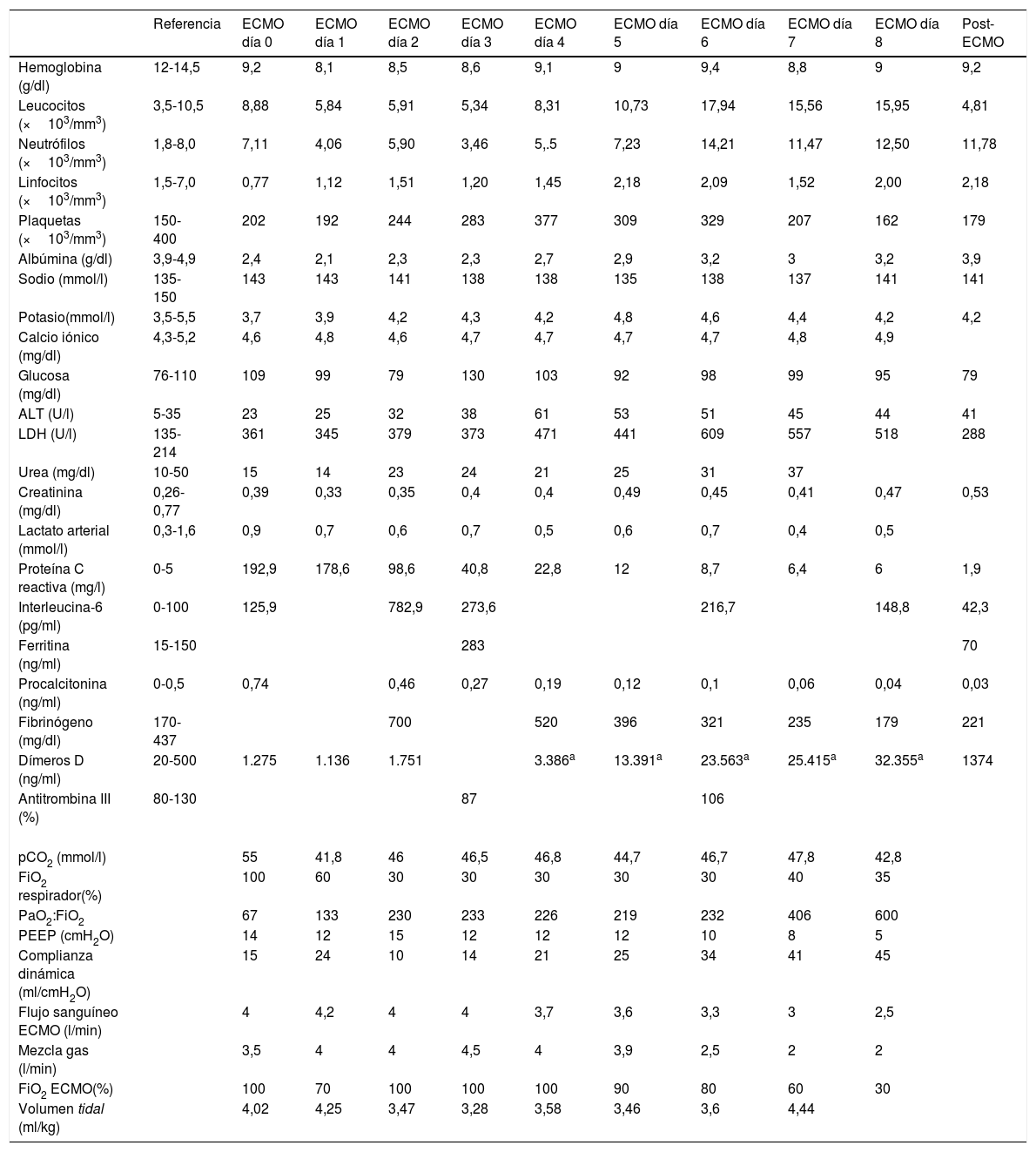
Datos analíticos. Parámetros ventilatorios y de la ECMO
| Referencia | ECMO día 0 | ECMO día 1 | ECMO día 2 | ECMO día 3 | ECMO día 4 | ECMO día 5 | ECMO día 6 | ECMO día 7 | ECMO día 8 | Post-ECMO | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl) | 12-14,5 | 9,2 | 8,1 | 8,5 | 8,6 | 9,1 | 9 | 9,4 | 8,8 | 9 | 9,2 |
| Leucocitos (×103/mm3) | 3,5-10,5 | 8,88 | 5,84 | 5,91 | 5,34 | 8,31 | 10,73 | 17,94 | 15,56 | 15,95 | 4,81 |
| Neutrófilos (×103/mm3) | 1,8-8,0 | 7,11 | 4,06 | 5,90 | 3,46 | 5,.5 | 7,23 | 14,21 | 11,47 | 12,50 | 11,78 |
| Linfocitos (×103/mm3) | 1,5-7,0 | 0,77 | 1,12 | 1,51 | 1,20 | 1,45 | 2,18 | 2,09 | 1,52 | 2,00 | 2,18 |
| Plaquetas (×103/mm3) | 150-400 | 202 | 192 | 244 | 283 | 377 | 309 | 329 | 207 | 162 | 179 |
| Albúmina (g/dl) | 3,9-4,9 | 2,4 | 2,1 | 2,3 | 2,3 | 2,7 | 2,9 | 3,2 | 3 | 3,2 | 3,9 |
| Sodio (mmol/l) | 135-150 | 143 | 143 | 141 | 138 | 138 | 135 | 138 | 137 | 141 | 141 |
| Potasio(mmol/l) | 3,5-5,5 | 3,7 | 3,9 | 4,2 | 4,3 | 4,2 | 4,8 | 4,6 | 4,4 | 4,2 | 4,2 |
| Calcio iónico (mg/dl) | 4,3-5,2 | 4,6 | 4,8 | 4,6 | 4,7 | 4,7 | 4,7 | 4,7 | 4,8 | 4,9 | |
| Glucosa (mg/dl) | 76-110 | 109 | 99 | 79 | 130 | 103 | 92 | 98 | 99 | 95 | 79 |
| ALT (U/l) | 5-35 | 23 | 25 | 32 | 38 | 61 | 53 | 51 | 45 | 44 | 41 |
| LDH (U/l) | 135-214 | 361 | 345 | 379 | 373 | 471 | 441 | 609 | 557 | 518 | 288 |
| Urea (mg/dl) | 10-50 | 15 | 14 | 23 | 24 | 21 | 25 | 31 | 37 | ||
| Creatinina (mg/dl) | 0,26-0,77 | 0,39 | 0,33 | 0,35 | 0,4 | 0,4 | 0,49 | 0,45 | 0,41 | 0,47 | 0,53 |
| Lactato arterial (mmol/l) | 0,3-1,6 | 0,9 | 0,7 | 0,6 | 0,7 | 0,5 | 0,6 | 0,7 | 0,4 | 0,5 | |
| Proteína C reactiva (mg/l) | 0-5 | 192,9 | 178,6 | 98,6 | 40,8 | 22,8 | 12 | 8,7 | 6,4 | 6 | 1,9 |
| Interleucina-6 (pg/ml) | 0-100 | 125,9 | 782,9 | 273,6 | 216,7 | 148,8 | 42,3 | ||||
| Ferritina (ng/ml) | 15-150 | 283 | 70 | ||||||||
| Procalcitonina (ng/ml) | 0-0,5 | 0,74 | 0,46 | 0,27 | 0,19 | 0,12 | 0,1 | 0,06 | 0,04 | 0,03 | |
| Fibrinógeno (mg/dl) | 170-437 | 700 | 520 | 396 | 321 | 235 | 179 | 221 | |||
| Dímeros D (ng/ml) | 20-500 | 1.275 | 1.136 | 1.751 | 3.386a | 13.391a | 23.563a | 25.415a | 32.355a | 1374 | |
| Antitrombina III (%) | 80-130 | 87 | 106 | ||||||||
| pCO2 (mmol/l) | 55 | 41,8 | 46 | 46,5 | 46,8 | 44,7 | 46,7 | 47,8 | 42,8 | ||
| FiO2 respirador(%) | 100 | 60 | 30 | 30 | 30 | 30 | 30 | 40 | 35 | ||
| PaO2:FiO2 | 67 | 133 | 230 | 233 | 226 | 219 | 232 | 406 | 600 | ||
| PEEP (cmH2O) | 14 | 12 | 15 | 12 | 12 | 12 | 10 | 8 | 5 | ||
| Complianza dinámica (ml/cmH2O) | 15 | 24 | 10 | 14 | 21 | 25 | 34 | 41 | 45 | ||
| Flujo sanguíneo ECMO (l/min) | 4 | 4,2 | 4 | 4 | 3,7 | 3,6 | 3,3 | 3 | 2,5 | ||
| Mezcla gas (l/min) | 3,5 | 4 | 4 | 4,5 | 4 | 3,9 | 2,5 | 2 | 2 | ||
| FiO2 ECMO(%) | 100 | 70 | 100 | 100 | 100 | 90 | 80 | 60 | 30 | ||
| Volumen tidal (ml/kg) | 4,02 | 4,25 | 3,47 | 3,28 | 3,58 | 3,46 | 3,6 | 4,44 |
La evolución posterior fue favorable. Las citoquinas proinflamatorias disminuyeron y mejoró la función pulmonar: aumentó la relación PaO2:FiO2 y mejoró la compliance dinámica con menor PEEP (tabla 1). Después de 180h pudo retirarse la ECMO y ser extubada. Tras 8días en la UCI y 7 en planta del hospital de referencia, fue dada de alta sin oxigenoterapia suplementaria y deambulando sin ayuda (PCR SARS-CoV-2 negativa) (fig. 1D).
La ECMO debe considerarse como una terapia de rescate en casos refractarios a la ventilación mecánica convencional, ventilación en prono y/o a maniobras de reclutamiento3. La tasa de utilización de la ECMO durante la pandemia COVID-19 es del 0,5-1% del total de los pacientes ingresados. En Europa, hasta el 7 de mayo de 2020, 1.068 pacientes adultos han necesitado soporte ECMO4. Aunque se han descrito casos de neumonía por SARS CoV-2 en neonatos5, niños6 y adultos jóvenes1, su evolución ha sido, generalmente, favorable, siendo marginal la necesidad de apoyo extracorpóreo. Nuestra paciente sufrió una neumonía grave, refractaria a la terapia convencional, y requirió ECMO. Un escaso número de enfermos están incluidos en el registro europeo de ECMO neonatal-pediátrico (entre ellos nuestra paciente)4. Los pacientes COVID-19 adultos necesitan entre 20 y 50días de soporte extracorpóreo para recuperarse. En este caso, la ECMO durante 7días fue suficiente para mantener la oxigenación y permitió realizar una ventilación ultraprotectora hasta que la respuesta inflamatoria disminuyó. No detectamos efectos adversos en la combinación de los tratamientos antivirales y antiinflamatorios utilizados. Tampoco tuvimos que modificar su posología, por lo que consideramos que no ha habido alteraciones farmacocinéticas relacionadas con el circuito o con la membrana extracorpórea.
Muchos artículos publicados durante la actual pandemia muestran el curso clínico de pacientes que todavía están en UCI (incluso en ECMO). La nuestra es la primera paciente pediátrica sometida a ECMO veno-venosa totalmente recuperada y dada de alta a su domicilio sin secuelas. La terapia extracorpórea en su caso se ha mostrado eficaz y segura (incluyendo un traslado interhospitalario), por lo es una opción terapéutica para niños y adolescentes en el tratamiento de la COVID-19 si su condición clínica así lo requiriese.