Valorar la eficacia y la seguridad del tratamiento con infusión subcutánea continua de insulina (ISCI) en niños menores de 6 años durante periodos prolongados de tiempo y evaluar si alcanzan criterios de adecuado control glucémico.
MétodosEstudio retrospectivo de 27 niños que iniciaron tratamiento con ISCI entre 2003-2014. Edad de inicio de ISCI: 4 años (2,9-4,7); 56% varones. Se recogen: edad de inicio de diabetes, tiempo de evolución de diabetes, HbA1c (HPLC Menarini, valor normal 5,1±0,31%), dosis insulina (u/kg/día), número de controles de glucosa capilar/día, número de tramos basales/día, porcentaje de insulina basal, ratios insulina/ración hidratos carbono (I/HC), episodios de hipoglucemia grave y de CAD (episodios/100 pacientes-año), porcentajes de normoglucemia (70-180mg/dl), hiperglucemia (>180mg/dl) e hipoglucemia (<70mg/dl), glucemia media, desviación estándar y coeficiente variación ([desviación estándar/glucemia media]×100). Análisis estadístico por SPSS.
ResultadosLa HbA1c disminuye de 6,9%(6,7-7,5) a 6,8%(6,4-7,1) el primer año, posteriormente se mantiene <6,8% durante el periodo de seguimiento (mediana 5 años [3-6]). Antes de ISCI el 74% tenían HbA1c <7,5% y al año el 96%. Media de controles de glucosa capilar/día de 10(9-11). No se observaron cambios significativos en la dosis de insulina. Hubo un episodio de CAD y un episodio de hipoglucemia grave durante el seguimiento. La ratio I/HC al desayuno fue superior a la de otras ingestas (0,92u/r vs. 0,55, 0,6 y 0,5 en comida, merienda y cena).
ConclusionesEl tratamiento con ISCI es eficaz y seguro en menores de 6 años durante periodos prolongados de tiempo. Permite alcanzar los objetivos de buen control metabólico recomendados por la Asociación Americana de Diabetes y la Sociedad Internacional de Diabetes Pediátrica y del Adolescente, sin incremento de efectos adversos.
The aims of the study are to evaluate the efficacy and safety of continuous subcutaneous insulin infusion (CSII) treatment in pre-school children with type I diabetes, and to assess whether the criteria of good metabolic control are achieved.
MethodA review was performed on the medical charts of patient's<6 years of age who started CSII treatment between 2003 and 2014. The cohort consisted of 27 patients (mean age 4 (2.9-4.7) years, 56% males). An analysis was made including the age at onset, type I diabetes duration, HbA1c (HPLC, Menarini, normal value 5.1±0.31%), insulin dose (u/kg/day), number of capillary blood glucose measurements, number of baseline processes per day, % baseline/total insulin (B/TI), insulin ratios (I/HC) at different meals, severe hypoglycaemia (HS episodes/100 patients years), DKA events, percentages of normal blood glucose (70-180mg/dl), hyperglycaemia (>180mg/dl), and hypoglycaemia (<70mg/dl), mean blood glucose, standard deviation and coefficient of variation (SD/mean glucose ×100). Statistical analysis was performed using SPSS.
ResultsHbA1c decreased from 6.9% (6.7-7.5) to 6.8% (6.4-7.1) after one year of CSII. Afterwards, it remained under 6.8% during the follow-up (median 5 years [3-6]). Prior to CSII, 74% of children had HbA1c levels < 7.5%. It increased to 96% after one year of CSII. Median blood glucose measurements /day was 10 (9-11). Total insulin dose did not change significantly. During the follow-up, there was one episode of DKA and one episode of HS. I/HC at breakfast were higher than at other meals (0.92 vs. 0.55, 0.6 and 0.5, respectively).
ConclusionsCSII is effective and safe in pre-school children. It allows good metabolic control (based on Society for Paediatric and Adolescent Diabetes / American Diabetes Association criteria) to be achieved and maintained for long periods of time without an increase in adverse events.
El estudio Diabetes Control and Complication Trial1 demostró que es necesario mantener un buen control metabólico para evitar o retrasar la aparición de las complicaciones crónicas en la diabetes tipo 1 (DM1). Diferentes estudios han puesto en evidencia que estas complicaciones comienzan a desarrollarse ya en la edad pediátrica2–4 lo que hace imprescindible mantener un correcto control metabólico desde el diagnóstico también en este grupo de edad. Asimismo, cada vez hay datos más concluyentes que demuestran la vulnerabilidad del cerebro en desarrollo a la hipoglucemia, a la hiperglucemia crónica y a la variabilidad glucémica, con disminución de volúmenes de sustancias blanca y gris5–7. Por todas estas razones, las guías actuales de las sociedades internacionales de diabetes recomiendan que el tratamiento actual de la diabetes en la edad pediátrica debe tener como objetivo principal alcanzar valores de glucemia lo más próximos posible a la normalidad, manteniendo unos niveles de HbA1c inferiores a 7,5% durante toda la infancia8,9. Sin embargo, esto parece difícil de alcanzar y mantener en la práctica clínica diaria10–12.
El tratamiento de la diabetes en los niños más pequeños supone retos específicos relacionados con las características propias de esta edad, como son una alta sensibilidad a la insulina, patrones irregulares de ingesta y ejercicio físico, imposibilidad para verbalizar la hipoglucemia y una mayor repercusión de las oscilaciones glucémicas sobre las funciones neurocognitivas13.
En la actualidad, la terapia con infusión subcutánea continua de insulina (ISCI) es el método disponible más fisiológico de administración de insulina, ya que es capaz de simular mejor el patrón fisiológico de secreción pancreática con una administración basal ajustada por tramos a lo largo de las 24 h del día y la administración de insulina en forma de distintos tipos de bolos prandiales o para corrección de hiperglucemias. En los niños pequeños nos ofrece la posibilidad de programar tasas basales muy bajas y variables para minimizar el riesgo de hipoglucemia nocturna, posibilidad de fraccionar los bolos de las comidas (administrando parte del bolo antes de la comida y completar después la insulina necesaria dependiendo de la ingesta) en niños malos comedores o el hecho de poder administrar pequeños bolos correctores para corregir hiperglucemias.
La mayoría de los estudios realizados en niños tratados con ISCI han demostrado una mejoría, fundamentalmente al inicio del tratamiento, de los niveles de HbA1c14–16. Generalmente, estos estudios valoran tiempos de evolución cortos. Aunque recientemente se han publicado estudios con datos recogidos durante periodos de tiempo más largos, con mejoría de los niveles de HbA1c17, estos evidencian unos valores de HbA1c superiores a los recomendados como adecuados por las sociedades científicas12,18.
El objetivo del estudio es evaluar si el tratamiento con ISCI es eficaz y seguro en niños menores de 6 años durante periodos prolongados de tiempo, y si permite mantener un buen control metabólico, siguiendo los criterios recomendados por International Society for Pediatric and Adolescent Diabetes (ISPAD), American Diabetes Association (ADA) e (International Diabetes Federation (IDF)8,9.
Material y métodosSe revisan las historias clínicas de todos los niños con DM1 que iniciaron tratamiento con ISCI entre 2003 y 2014, y que en el momento de iniciar el tratamiento con ISCI tenían edad <6 años.
En cada visita médica se recogían las siguientes variables: edad, sexo, talla, peso, HbA1c, dosis de insulina total (u/kg/día), porcentaje de insulina basal, ratio insulina/ración de hidratos de carbono (I/HC), número de tramos basales/día, número de controles de glucemia capilar/día (CGD), episodios de hipoglucemia grave definidos por episodios de hipoglucemia grave con alteración de la conciencia, convulsiones o coma, calculados como el número de episodios/100 pacientes/año y episodios de CAD. La HbA1c es medida mediante el método HPLC (Menarini, valor normal 5,1±0,31%), calibrado para el Diabetes Control and Complication Trial y el IFCC. Para el análisis de los datos se utiliza la media de las tres últimas HbA1c. En cada visita médica se descargan los datos de la bomba y del glucómetro, recogiéndose: glucemia media, desviación estándar, porcentaje de normoglucemias (70-180mg/dl), hipoglucemias (<70mg/dl) e hiperglucemias (>180mg/dl). Se calcula el coeficiente de variación (CV) de la glucemia según la fórmula: (desviación estándar de la media/media) x 100.
Las principales indicaciones para el cambio de terapia a ISCI fueron: mejoría del control metabólico (disminuir los niveles de HbA1c y/o la variabilidad glucémica), disminuir los episodios de hipoglucemia y mejorar la calidad de vida.
El tratamiento con ISCI se inicia siguiendo el protocolo de nuestra Unidad de Diabetes19. Previamente al inicio del tratamiento con ISCI, todos los pacientes, sus familias y las personas encargadas de su cuidado completan el programa de educación diabetológica específica para ISCI. Este comienza con una evaluación, una semana antes del inicio de la nueva terapia, de los conocimientos generales sobre el manejo de la diabetes. El programa de formación para ISCI consiste en 25 h de adiestramiento durante 4 días consecutivos. La implantación del sistema de infusión se realiza el segundo día. Todos los pacientes utilizan previamente el recuento de hidratos de carbono. Durante los 4 días de educación, se realizan controles de glucemia frecuentes para poder ajustar los tramos basales de insulina, así como calcular los índices de I/HC en cada comida. También se calcula el índice de sensibilidad por tramos horarios. Los bolos correctores son administrados siempre que no se alcancen los objetivos generales de buen control glucémico recomendados por las sociedades internacionales de diabetes8. El sistema de infusión es implantado en glúteo.
Los niños y sus familias tienen la posibilidad de contacto telefónico diario con el equipo diabetológico. Las visitas posteriores se realizan las semanas 1.ª y 4.ª tras la implantación de ISCI. Posteriormente las revisiones habituales de la Unidad de Diabetes son cada 2-3 meses. En cada visita médica se descargan los datos de la bomba de insulina y del glucómetro, analizándose cuidadosamente todos ellos con el paciente y la familia. Se valora si los objetivos glucémicos son alcanzados, y si hay necesidad de reciclaje por parte de las educadoras. El equipo de infusión se cambia cada 2-3 días.
El estudio fue aprobado por el Comité Ético del Hospital Ramón y Cajal. Se obtuvo consentimiento informado por parte de padres y pacientes.
Análisis estadísticoEl análisis estadístico de los datos fue realizado con el programa SPSS (Evanston, IL) versión 21 para Windows. Para el estudio de las variables cuantitativas se utiliza la mediana, rango intercuartílico (percentil 25-75) y rango global (mínimo–máximo). Para la descripción de las variables cualitativas se utilizan las frecuencias absolutas y relativas.
Debido al número de sujetos analizados se utilizan test no paramétricos. Los niños actúan como sus propios controles, eliminando de esta forma posibles factores de confusión. Los datos son comparados con los previos al inicio de ISCI. Las diferencias son consideradas estadísticamente significativas si tienen una p<0,05.
ResultadosDemografíaEl número final de menores de 6 años con más de un año de tratamiento con ISCI fue de 27 (56% varones). La edad media al comienzo de ISCI fue de 4 años (2,93-4,67). Seis niños comenzaron la nueva terapia con menos de 3 años. El tiempo medio de evolución de la diabetes hasta el comienzo del tratamiento con bomba de insulina fue de 1,58 años (0,92-2,10). Dos niños comenzaron la terapia con ISCI con menos de 6 meses de evolución de la diabetes (a los 11 meses y a los 3 años de edad, respectivamente), en estos niños para minimizar el posible efecto del periodo de remisión se ha utilizado como dato previo de comparación la HbA1c realizada justo en el momento del inicio del nuevo tratamiento. Todos los niños utilizaban previamente un régimen basal-bolo de insulina (múltiples dosis de insulina). Veintitrés niños utilizaban como insulina basal la insulina detemir, 3 niños insulina NPH y un niño insulina glargina en una dosis.
El 74% de los pacientes alcanzaba los objetivos ISPAD/IDF/ADA de buen control metabólico con una HbA1c<7,5% antes de comenzar el tratamiento con ISCI.
En la tabla 1 se pueden observar los datos demográficos al comienzo de ISCI.
Datos demográficos en la visita previa al inicio de ISCI y en la última visita registrada. La HbA1c es la media de los últimos 3 valores realizados
| Visita previa al inicio ISCI | Última revisión | |
|---|---|---|
| Edad (años) | 4 (2,23-4,67) | 8,5 (5,9-9,67) |
| Tiempo evolución de DM (años) | 1,58 (0,92-2,1) | 5,8 (3,8-7,6) |
| Tiempo de evolución de ISCI (años) | – | 5 (3-6) |
| HbA1c (%) | 6,9 (6,7-7,5) | 6,8 (6,4-7,1)* |
| Dosis de insulina (u/kg/día) | 0,61 (0,45-0,78) | 0,67 (0,41-0,97) |
| Insulina basal (%) | 40 (36-50) | 36 (26-47) |
| Cumplen criterios buen control ISPAD/ADA (%) | 74 | 93,5 |
La HbA1c inicial fue de 6,9% (6,7-7,5) (52 [50-57] mmol/ml IFCC). Después de un año de tratamiento los niveles de HbA1c llegan a 6,8% (6,4-7,1) (51 [47-54] mmol/mol IFCC) (p 0,004). El 70% de los niños mejoran su HbA1c durante el primer año de tratamiento y un 7% la mantienen. Al final de este primer año solo un niño tiene la HbA1c ≥ 7,5%. Esta mejoría inicial persiste durante todos los años de seguimiento (datos en tabla 2), manteniendo durante los años de seguimiento una HbA1c media ≤6,8%. En un corte transversal del último año de tratamiento con ISCI la mediana de la hemoglobina glucosilada es de 6,8 (6,4-7,1) (51 [47-54] mmol/ml IFCC), diferencia estadísticamente significativa respecto a la HbA1c al inicio de la terapia con bomba de insulina (tabla 1). Durante todo el periodo de seguimiento (mediana de 5 años [3-6], rango 1-9) el 95% de los niños alcanzan los objetivos de buen control metabólico recomendados por las sociedades internacionales de diabetes para la edad pediátrica.
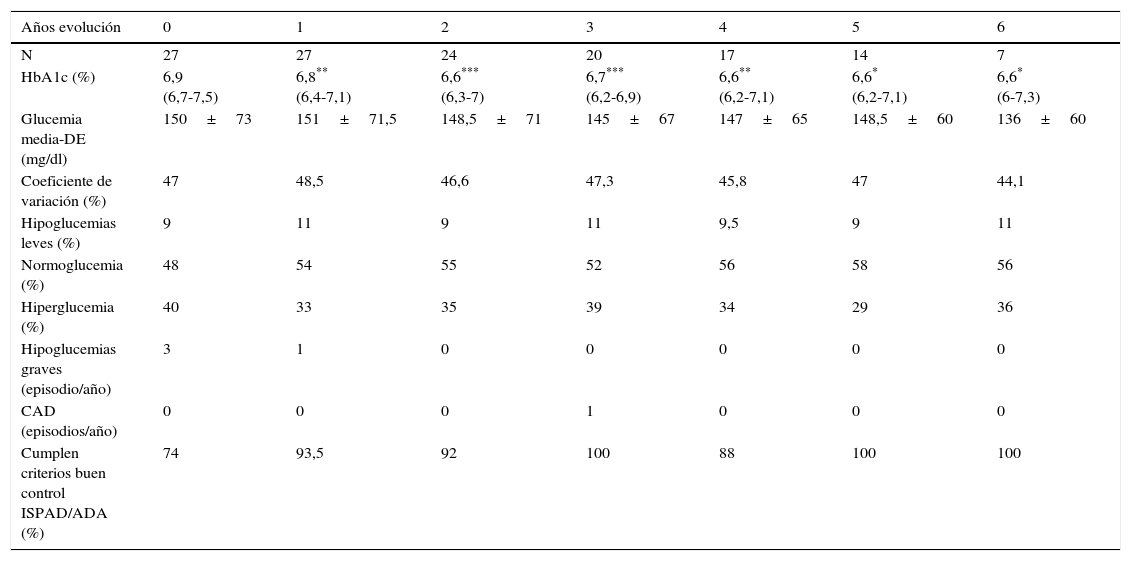
Evolución de la HbA1c, glucemia media, SD de la glucemia media, coeficiente de variación (CV%); porcentaje de hipoglucemia (< 70mg/dl), normoglucemia (70-180mg/dl) e hiperglucemia (>180 mg/dl), episodios de CAD e hipoglucemias graves a los largo de la evolución con ISCI
| Años evolución | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
|---|---|---|---|---|---|---|---|
| N | 27 | 27 | 24 | 20 | 17 | 14 | 7 |
| HbA1c (%) | 6,9 (6,7-7,5) | 6,8** (6,4-7,1) | 6,6*** (6,3-7) | 6,7*** (6,2-6,9) | 6,6** (6,2-7,1) | 6,6* (6,2-7,1) | 6,6* (6-7,3) |
| Glucemia media-DE (mg/dl) | 150±73 | 151±71,5 | 148,5±71 | 145±67 | 147±65 | 148,5±60 | 136±60 |
| Coeficiente de variación (%) | 47 | 48,5 | 46,6 | 47,3 | 45,8 | 47 | 44,1 |
| Hipoglucemias leves (%) | 9 | 11 | 9 | 11 | 9,5 | 9 | 11 |
| Normoglucemia (%) | 48 | 54 | 55 | 52 | 56 | 58 | 56 |
| Hiperglucemia (%) | 40 | 33 | 35 | 39 | 34 | 29 | 36 |
| Hipoglucemias graves (episodio/año) | 3 | 1 | 0 | 0 | 0 | 0 | 0 |
| CAD (episodios/año) | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| Cumplen criterios buen control ISPAD/ADA (%) | 74 | 93,5 | 92 | 100 | 88 | 100 | 100 |
La mediana diaria del número de controles de glucemia realizados al año del nuevo tratamiento fue de 10 (9-11) CGD, no estando recogido en todos los pacientes el número de CGD previos al inicio de la terapia con ISCI.
En cuanto a los datos recogidos sobre la glucemia media y su desviación estándar, el porcentaje de hipoglucemias leves, de hiperglucemias y normoglucemias, no se encontraron diferencias estadísticamente significativas entre los datos previos y tras el tratamiento con ISCI. Tampoco observamos cambios significativos en el coeficiente de variación de la glucemia durante la evolución (tabla 2).
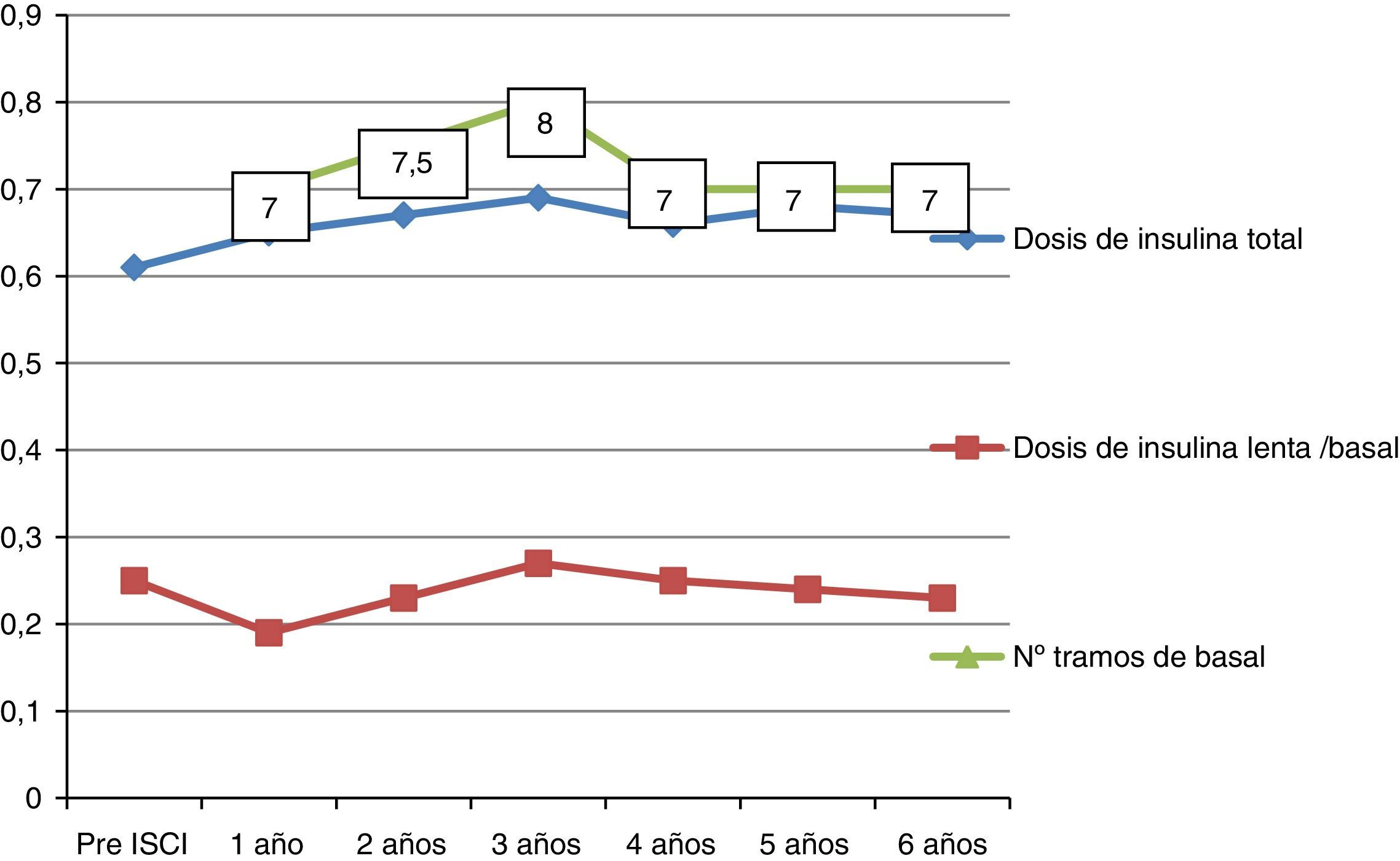
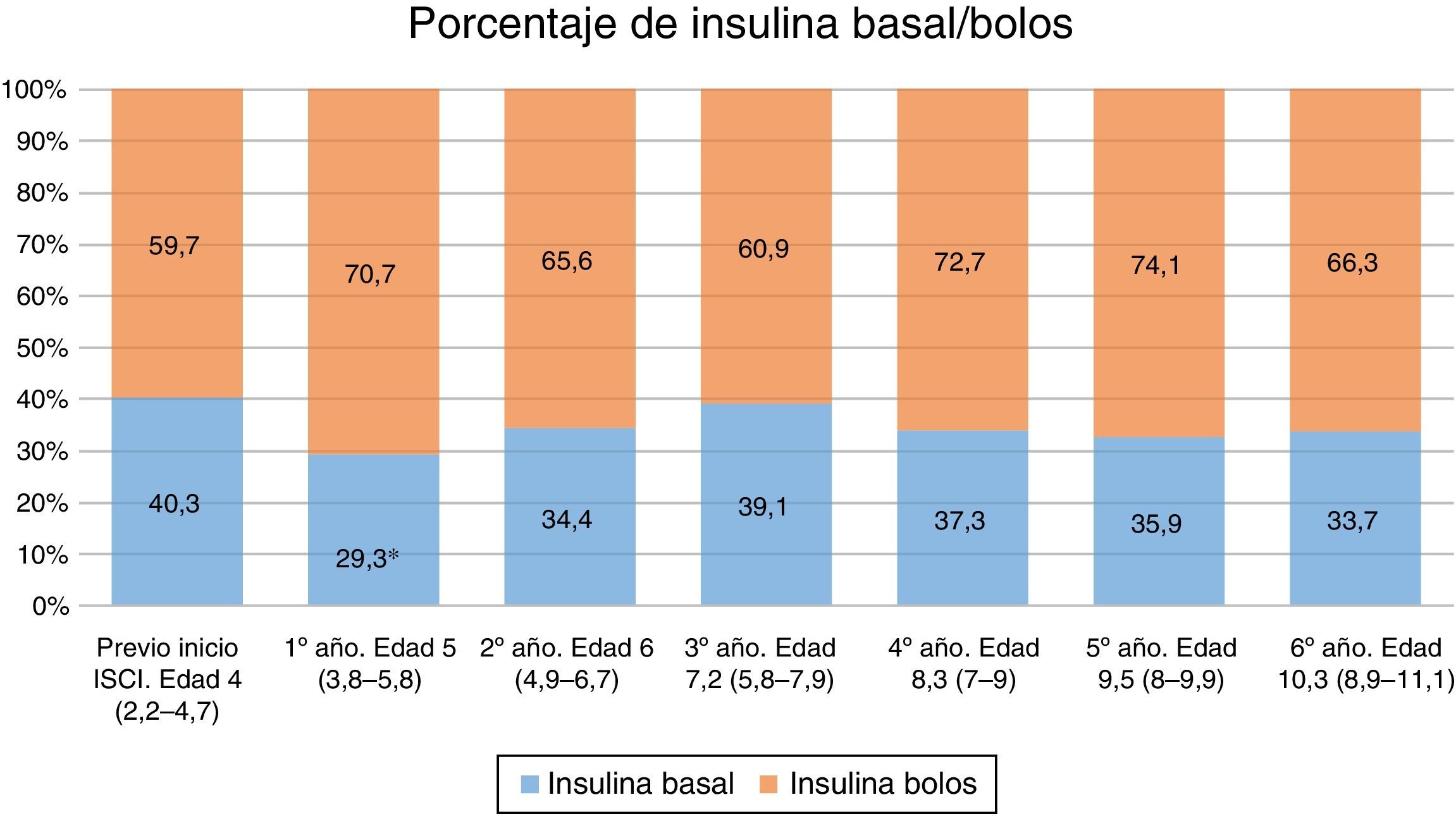
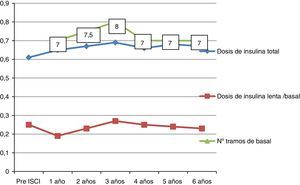
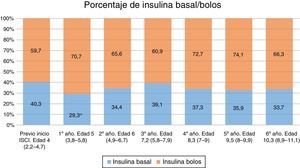
Dosis de insulinaLa dosis de insulina aumenta discretamente al año del tratamiento con ISCI de 0,61 a 0,65 u/kg/día (fig. 1). La proporción insulina basal/insulina total disminuye de manera significativa (40 a 29% al año de ISCI) (fig. 2). Posteriormente aumenta discretamente.
El número de tramos basales diarios al año de tratamiento es de 7 (6-8), sin cambios significativos en el número de tramos basales a lo largo de la evolución (fig. 1). El número de bolos (para cubrir ingestas y correcciones) no ha sido recogido debido a las variaciones existentes en su número entre unos días y otros.
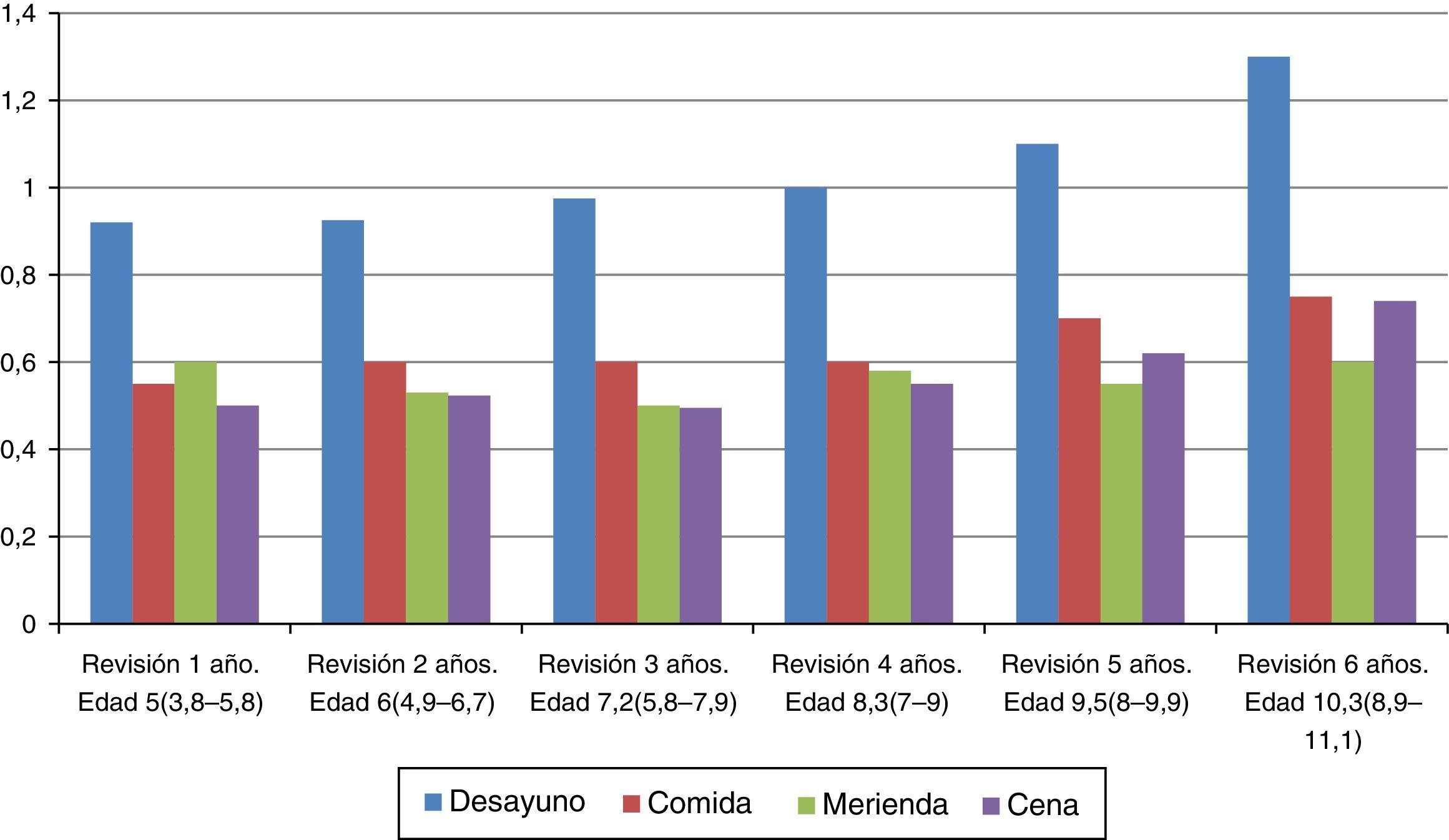
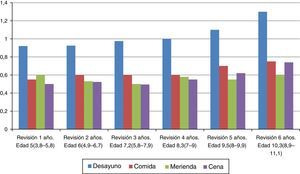
La ratio I/HC en el desayuno es significativamente mayor en relación con la necesaria en el resto de las ingestas, durante toda la evolución. Aunque la ratio I/HC aumenta con la edad, es más llamativo el aumento de necesidades en el desayuno, incrementándose de 0,92 u/ración el primer año de ISCI hasta 1,3 u/ración a los 6 años de tratamiento. Las necesidades en la merienda permanecen estables durante toda la evolución (fig. 3).
Efectos adversosDurante el periodo de seguimiento (mediana 5 años [3-6]) hubo un episodio de hipoglucemia grave, ocurrido durante el primer año de tratamiento. El porcentaje de hipoglucemias leves no varía de forma significativa durante los años analizados, oscilando entre un 8,5-11% (tabla 2).
Hubo un episodio de CAD durante todo el periodo de seguimiento.
La tasa de abandono del tratamiento es del 3,7%. Una niña dejó el tratamiento tras 3 años de terapia por decisión propia. La HbA1c de esta paciente en el momento de dejar el tratamiento con ISCI era de 7,2% y no había presentado episodios de hipoglucemia grave ni CAD.
DiscusiónLa utilización de la terapia con ISCI en DM1 se ha incrementado de forma llamativa en la última década, demostrando su eficacia comparada con el tratamiento con MDI. Registros internacionales extensos como el T1D Exchange Clinic Registry en EE. UU., el Prospective Diabetes Follow-up Registry (DPV) en Alemania y Austria o el National Pediatric Diabetes Audit en Reino Unido han demostrado una HbA1c 0,5% más baja en niños con DM1 tratados con ISCI12. Sin embargo, la HbA1c media en usuarios de ISCI fue de 8%. Concretamente el T1D Exchange Clinic Registry analiza a los menores de 6 años, teniendo este grupo de edad una HbA1c media de 7,9%, frente al 8,5% de los preescolares tratados con MDI18. En este estudio observacional solo el 32% de los niños tratados con ISCI alcanzan niveles de HbA1c menores de 7,5%, valor que es propugnado por las sociedades internacionales de diabetes como criterio de buen control metabólico de la edad pediátrica. En nuestro grupo de preescolares la HbA1c disminuye el primer año de tratamiento con ISCI de 6,9%(6,7-7,5) a 6,8%(6,4-7,1), y se mantiene durante todo el periodo de seguimiento con valores inferiores a esa cifra. Globalmente, el 95% de nuestros niños tratados con ISCI alcanzan los objetivos de buen control glucémico durante todo el seguimiento clínico.
El éxito del tratamiento recae, fundamentalmente, en la educación diabetológica impartida en la Unidad de Diabetes. La cantidad de horas dedicadas al inicio del tratamiento, así como posteriormente durante el seguimiento clínico son fundamentales para obtener unos resultados favorables. Nuestro programa educativo de ISCI consta de cuatro días consecutivos de formación, en los que se incluyen el conocimiento y manejo de todas las opciones de la bomba: diferentes tipos de bolos, calculador de bolos, basales temporales, alarmas, etc. Se ajustan de manera individualizada, sistemática y minuciosa las tasas basales y las ratios I/HC en función de numerosos controles de glucemia. Todas las familias cuantifican y pesan las raciones de hidratos de carbono. El índice de sensibilidad se calcula por tramos horarios introduciéndose este dato en el programa de ayuda de bolos.
Una de las razones fundamentales para explicar estos resultados es la frecuencia de controles de glucemia capilar diarios. Ya ha sido demostrado en estudios previos que un número mayor de CGD mejora la HbA1c de forma significativa. Ziegler et al.20 observaron en el estudio DPV que por cada control de glucemia adicional la hemoglobina glucosilada disminuía un 0,2%. Recientemente, datos similares han sido encontrados por Olsen en el estudio danés21. Los niños preescolares de nuestra Unidad de Diabetes realizaron una mediana de 10 (9-11) CGD durante el primer año de tratamiento con ISCI, incluyendo siempre una determinación de glucemia nocturna a las 3:00-4:00 am. En la última visita en la que se recogieron los datos, tras una mediana de 5 años de evolución de tratamiento con ISCI, los CGD medios diarios fueron 10,5 (9-12). Esto supone 2,5 controles diarios más cada día que los niños de la misma edad del estudio DPV. Ciertamente, la realización de una determinación de glucemia capilar durante la noche puede ser molesto para el niño y su familia, sin embargo se realiza cumpliendo las guías de la ISPAD que recomiendan la realización de una glucemia antes de acostarse, durante el periodo nocturno y al despertarse, con el objetivo fundamental de detectar y prevenir hipo- e hiperglucemias nocturnas así como ajustar las tasas basales de insulina8. En la actualidad, la utilización de sistemas de monitorización continua de glucosa intersticial (SMCG) facilita la valoración de la glucemia nocturna y el poder disponer de una bomba con parada con predicción de hipoglucemia ha permitido disminuir el número de hipoglucemias fundamentalmente nocturnas22.
Una de las principales indicaciones para comenzar el tratamiento con ISCI en nuestros preescolares fue disminuir la variabilidad glucémica, ya que cada vez hay más estudios que demuestran lo lesivos que pueden ser los cambios de glucemia para un cerebro en desarrollo5,7. Para estudiar la variabilidad glucémica se ha utilizado el coeficiente de variación. Las recomendaciones actuales son tener el CV lo más bajo posible23. En nuestro caso, no hemos encontrado cambios en el CV con la utilización de ISCI (47% previo al inicio de ISCI, 44,1-48,5% durante los años de seguimiento). Creemos que, aunque el número de determinaciones de glucemia capilar al día es elevado, es insuficiente para poder valorar apropiadamente los cambios en el CV, y que, para poder ser evaluado correctamente, se deberían utilizar SMCG. En este campo estamos actualmente trabajando, intentando determinar modificaciones en el CV en niños con ISCI y SMCG. Situación similar ocurre con el porcentaje de normoglucemia, ya que, a pesar de haber encontrado una disminución significativa de la HbA1c, no hemos encontrado diferencias significativas en el porcentaje de normoglucemia, aunque se observa una tendencia al aumento progresivo durante el seguimiento. Nuestra explicación a la diferencia entre la disminución estadísticamente significativa de la HbA1c y a la no variación en porcentajes de hipo-, hiper- o normoglucemia (tabla 2), es porque a pesar del elevado número de CGD de los niños, siguen siendo insuficientes para poder estudiar apropiadamente los cambios en los porcentajes de glucemias dentro o fuera de objetivos, y se necesitaría un SMCG para conseguir dicho objetivo.
Como en estudios previos24, el porcentaje de insulina basal en este grupo de edad disminuye al inicio del tratamiento y aumenta con la edad de los niños de manera progresiva.
Es gratificante observar que, a pesar de los niveles de HbA1c, no se ha objetivado un aumento de las hipoglucemias graves. Durante el año previo al inicio con ISCI hubo 3 episodios de hipoglucemia grave: 11,1 episodios/100 pacientes/año; durante los años de seguimiento la tasa disminuye a 0,87 episodios/100 pacientes/año. Datos muy similares a los encontrados recientemente en Eslovenia de 1,21 episodios/100 pacientes/año25. Dentro de las posibles razones para explicar la tasa tan baja de hipoglucemias graves estarían el elevado número de CGD realizados y el metódico ajuste de tasas basales y bolos que se realiza periódicamente en la consulta y también por parte de los padres. En nuestro estudio se observa claramente cómo las necesidades de insulina varían en las diferentes comidas del día, siendo superiores en el desayuno, datos concordantes con estudios previos26.
Se precisan estudios de más larga duración y en mayor número de niños preescolares para poder confirmar nuestros datos. También necesitamos estudios en niños tratados con ISCI y SMCG para poder valorar de forma más precisa la variabilidad glucémica y la frecuencia de episodios de hipos e hiperglucemias.
Como conclusión, nuestra experiencia sugiere que el tratamiento con ISCI es seguro y eficaz en niños menores de 6 años durante periodos prolongados de tiempo. Ha demostrado que los objetivos metabólicos recomendados por las sociedades científicas internacionales pueden ser alcanzados y mantenidos.
Conflicto de interesesRaquel Barrio es miembro de los Advisory Boards de NovoNordisk, Lilly y Medtronic, y ponente en conferencias patrocinadas por Lilly, NovoNordisk, Roche, Medtronic y Lifescan.
El resto de autores declaran no tener ningún conflicto de interés.
Presentado previamente en el 55th Annual ESPE Meeting. París, Francia, 10-12 de septiembre de 2016.