Introducción
El término diabetes mellitus se refiere a un grupo de enfermedades metabólicas caracterizadas por hiperglucemia, que puede ser debida a defectos en la secreción de insulina, en la acción de la insulina o a una combinación de ambas. Según criterios del Comité de Expertos en el Diagnóstico y Clasificación de la Diabetes Mellitus de la American Diabetes Association (ADA)1,2, se denominan diabetes mellitus tipo 1 (DM1), antes llamada diabetes mellitus dependiente de insulina, aquellos casos cuya causa es la destrucción de células betapancreáticas y que puede presentarse con cetoacidosis. Esta destrucción se debe en la mayoría de los casos a un proceso autoinmune, expresado por la presencia de autoanticuerpos (anticuerpos anticélulas de los islotes pancreáticos [ICA], antidescarboxilasa del ácido glutámico [GAD], antitromboplastina [anti-TP] [IA2, IA2B], antiinsulina), mediado por linfocitos T, que ocurre en una población genéticamente predispuesta (ligada a la región antígenos de histocompatibilidad [HLA] de clase II) y expuesta a factores ambientales no bien conocidos. Los anticuerpos reflejan la naturaleza autoinmune del subtipo de DM1A. La DM1B o DM1 idiopática se produce por supuestos mecanismos lesivos directos sobre la célula beta y potencialmente sobre otros componentes del páncreas endocrino y no endocrino1-3.
Puesto que es una de las enfermedades crónicas más frecuentes de la infancia y la adolescencia, estudiarla en una población determinada es necesario, tanto para intentar conocer los factores determinantes de su etiopatogenia, como para la provisión de recursos sociosanitarios a corto, medio y largo plazo4. Por ello, una de las recomendaciones prioritarias de la Declaración de San Vincent incluye la necesidad de realizar estudios epidemiológicos5, y la Organización Mundial de la Salud (OMS) puso en marcha en 1990 el proyecto DIAMOND entre cuyos principales objetivos estuvo el investigar los modelos de incidencia de DM1 en niños hasta el año 20006.
Otro aspecto importante es la forma de presentación de la enfermedad, que si bien es de instauración progresiva, se presenta de forma aguda en la mayoría de los casos y se asocia a cetoacidosis en el momento del diagnóstico en más de la tercera parte, porcentaje que aumenta en los niños de menor edad7. Esta grave descompensación metabólica es una importante causa de morbimortalidad8,9. No hay datos, sin embargo, de que los diferentes niveles de riesgo estén asociados a diferentes modelos de presentación clínica al diagnóstico10. Los síntomas predominantes y más frecuentes son poliuria, polidipsia y pérdida de peso pero, aunque éstos siguen un modelo uniforme en el momento del diagnóstico, la presentación clínica y el tiempo de duración de los síntomas pueden variar11. Se estima que más del 80 % de los pacientes afectados presentan una historia clínica de menos de 3 semanas de evolución y, en ocasiones, inferior a una semana. En el resto de los casos, la historia clínica puede ser más prolongada, y se presentan síntomas intermitentes o moderados durante meses o años12.
El objetivo que nos hemos propuesto en el presente trabajo es conocer la incidencia y las características clínicas de presentación de la diabetes en el paciente pediátrico de Galicia. El estudio se realizó sobre la totalidad de los ingresos por inicio de DM1 que se produjeron durante los años 2001 y 2002 en los hospitales del Servicio Gallego de Salud.
Pacientes y métodos
Se trata de un estudio prospectivo que incluyó a todos los niños con edades entre 0 y 14 años, residentes en Galicia (España), que ingresaron en los hospitales del Servicio Gallego de Salud (Sergas), desde el 1 de enero del año 2001 hasta el 31 de diciembre de 2002 y que fueron diagnosticados de DM1 según criterios de la ADA.
Galicia, situada en el extremo noroccidental de la península Ibérica, tiene una extensión de 29.574 km2, dividida en cuatro provincias, de las cuales tres se abren al mar. La población total gallega, según el Censo de Población y Vivienda de 2001 (Instituto Nacional de Estadística), es de 2.695.880 habitantes, de los que el 11,8 % están en la edad estudiada (0-14 años) y, de ellos, 164.104 son niños y 155.451, niñas.
La recogida de datos se realizó según cuestionario confeccionado previamente, uniforme para todos, por una misma persona en cada centro y que se rellenó durante el ingreso hospitalario. Los datos analizados fueron: la edad al diagnóstico, sexo, predominio estacional, presencia de lactancia materna, antecedentes familiares de DM1 o DM2, así como los síntomas iniciales de diabetes y su duración. Se estudió su afectación metabólica: forma de manifestación (hiperglucemia aislada o cetoacidosis), glucemia media al diagnóstico y grado de hiperglucemia previa mediante la determinación de las concentraciones de hemoglobina A1c [HbA1c].
Se definió cetoacidosis cuando la glucemia fue superior a 250 mg/dl, había cetonuria y pH sanguíneo inferior a 7,3 y/o el bicarbonato inferior a 15 mEq/l. Los datos se expresan en porcentaje, media, rango y desviación estándar (DE). Se excluyó la patología tiroidea autoinmune mediante la determinación de anticuerpos antitiroideos (antimicrosomales y antitiroglobulina) y la enfermedad celíaca mediante la determinación anticuerpos antigliadina y antiendomisio.
Resultados
El total de ingresos durante los 2 años fue de 109 niños (todos los ingresos se hicieron a través de los servicios de urgencias). Se diagnosticaron 61 pacientes en el año 2001 (55,9 %) y 48 (44,0 %) en 2002. La distribución por sexos fue 48 niñas (44,0 %) y 61 niños (55,9 %). La incidencia estacional se distribuyó así: 36 pacientes en invierno (33 %), 28 en primavera (26 %), 23 en otoño (21,3 %) y 22 durante los meses de verano (20,3 %).
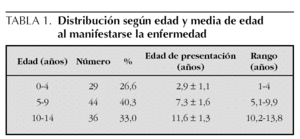
Se han diferenciado tres grupos según la edad: de 0 a 4 años, de 5 a 9 años y de 10 a 14 años. El grupo de 0 a 4 años lo constituyeron 29 pacientes, 26,6 % del total, y la edad media de manifestarse la enfermedad fue 2,9 ± 1,1 año (rango, 1-4 años). El grupo más numeroso fue el de 5 a 9 años, formado por 44 pacientes (40,3 %), la media de edad fue 7,3 ± 1,6 años (rango, 5,1-9,9 años). El de 10 a 14 años lo constituyeron 36 pacientes (33,0 %) y la media de edad de presentación fue 11,6 ± 1,3 años (rango, 10,2-13,8 años) (tabla 1).
El 55,7 % de los niños habían recibido lactancia materna por lo menos durante el primer mes de vida. En 3 pacientes se diagnosticó tiroiditis autoinmune asociada (2,8 %) y en cinco enfermedad celíaca (4,6 %).
En cuanto a los antecedentes familiares, 7 pacientes (6,4 %) tenían un familiar en primer grado con DM1 y 2 pacientes (1,8 %) con DM2; 43 pacientes (39,4 %) tenían algún familiar en segundo o tercer grado con DM1 o DM2.
La incidencia de niños diagnosticados por ingreso en nuestra comunidad supone el 17,6/100.000/año, sin que se hayan encontrado diferencias significativas interprovinciales (19,1 año 2001 y 15,0 año 2002).
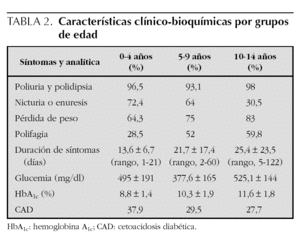
En cuanto a las características clínico-bioquímicas, la poliuria y la polidipsia fueron con diferencia los síntomas más frecuentes y lo describieron más del 90 % de los pacientes, alcanzando el 98 % en el grupo de 10 a 14 años. El síntoma siguiente en orden de frecuencia referido por el paciente o la familia fue la nicturia o enuresis. La pérdida de peso la refirieron el 83,3 % de los pacientes de 10 a 14 años y el 64,3 % en el grupo de 0 a 4 años. La polifagia fue un síntoma poco frecuente y lo refirieron el 59,8 % de los pacientes de 10 a 14 años, el 52 % en el grupo de 5 a 9 años y el 28,5 % de los de 0 a 4 años. La duración media de los síntomas previos al ingreso fue de 13,6 ± 6,7 días (rango, 1-21 días) en el grupo de 0 a 4 años, de 21,7 ± 17,4 días (rango, 2-60) en el grupo de 5 a 9 años y de 25,4 ± 23,5 días de media (rango, 5-122 días) en los pacientes de 10 a 14 años (tabla 2).
Los valores plasmáticos de glucemias fueron 495 ± 191 mg/dl en el grupo de 0 a 4 años; 377,6 ± 165 mg/dl en los pacientes de 5 a 9 años y 525,1 ± 144 mg/dl en el grupo de 10 a 14 años. La HbA1c fue más elevada en los pacientes de más edad (11,6 ± 1,8 %) y más baja en el grupo de 0 a 4 años (8,8 ± 1,4 %). La forma de presentación más brusca y grave, la cetoacidosis diabética, fue más frecuente en el grupo de menor edad, que se manifestó en el 37,9 % frente al 27,7 % de los diabéticos de más de 10 años (tabla 2).
Discusión
La incidencia de DM1 en Galicia en niños diagnosticados por ingreso en los hospitales del Sergas supone el 17,6/100.000/año de dicha población. Puesto que la cobertura del sistema público en Galicia se calcula entre el 99 y 100 % de la población, la incidencia de la DM1 en niños y adolescentes podría ser muy discretamente superior, no inferior.
Una incidencia de 17,6/100.000/año se considera una tasa elevada13, similar a la de Cantabria14, y más elevada que la de otras áreas del norte de España (Asturias y País Vasco)15. Si se comparan nuestras cifras con otras zonas del sur de España la nuestra es inferior; por ejemplo, Málaga que tuvo una media de 20,1 durante los años 1996-200216. Por lo tanto, el gradiente norte-sur no se cumple en España. En cualquier caso, las cifras de incidencia en España ofrecen gran variabilidad17-25. Existe una notable heterogeneidad entre países y regiones13,26.
En la mayoría de los estudios de diabetes mellitus en niños, las tasas de incidencia son más elevadas en el grupo de 10-14 años, y la edad puberal se considera un factor de riesgo para la diabetes. Nosotros, sin embargo, tenemos una incidencia más alta en el grupo de 5-9 años que se explicaría, quizá, por el desplazamiento a edades inferiores, relacionado con procesos infecciosos que, por sí mismos, constituyen un factor de riesgo, por pérdida de pacientes en el último tramo de edad al no necesitar ingreso hospitalario, por un desarrollo más tardío, etc. Creemos que no debe existir factores diferentes a otras comunidades, para que la incidencia de pacientes del grupo de 10 a 14 años sea inferior al de 5 a 9 años, salvo el peor registro, pues los niños mayores ingresan menos en el hospital al manifestarse la enfermedad21,22.
Se ha descrito una incidencia similar en cuanto al sexo, existiendo variaciones puntuales en algunos países a favor de los varones19,24,27. Nosotros también tenemos un porcentaje más elevado en varones, sin diferencias significativas como ocurre en algunas comunidades españolas.
De acuerdo con la mayoría de los estudios, la incidencia es más elevada en invierno12,14,28.
Al no contar con estudios previos en nuestra Comunidad, no se puede valorar la evolución de la incidencia, claramente al alza en todo el mundo, según la mayoría de los estudios, así como que esta tasa de incidencia está aumentando en niños por debajo de 5 años de edad29,30.
En nuestro grupo, la poliuria y polidipsia fueron los síntomas referidos con más frecuencia en el momento del diagnóstico (95,8 % del total) y similar al de otros estudios10,11,30. Estos síntomas se asociaron a nicturia y enuresis en el grupo de menor edad. El tercer grupo de síntomas, por orden de frecuencia, fueron pérdida de peso y polifagia, ambos relacionados directa y proporcionalmente con el tiempo de duración de los síntomas y con el grupo de más edad.
El grupo de niños de menor edad fue diagnosticado más pronto y con HbA1c más baja, pero con una mayor frecuencia de cetoacidosis diabética; ésta puede estar asociada a una pobre reserva de célula betapancreática, fuerte autoinmunidad contra las células de islotes e insulina y fuerte susceptibilidad asociada a HLA y que se ha observado que afecta sobre todo a niños menores de 2 años 7. El grupo que tuvo una glucemia y una HbA1c más elevada es el de 10 a 14 años, que fue diagnosticado más tardíamente, lo que demuestra que el proceso de destrucción de las células betapancreáticas es más lento y menos agresivo que en niños pequeños.
El 31,7 % del total de los niños ingresaron con cetoacidosis diabética, elevándose esta cifra a 37,9 % en el grupo de niños de 0-4 años. En estudios amplios, la incidencia total de cetoacidosis diabética es del 40 %, y no encuentran diferencias significativas entre grupos de edad10. Otros estudios identifican una edad menor al diagnóstico como un factor de riesgo para desarrollarla31,32.
Los mismos autores que no encontraron diferencias entre grupos de edad sí las encontraron entre zonas geográficas distintas10, mostrando una relación inversa entre las tasas de incidencia y la cetoacidosis diabética; puesto que las tasas de incidencia en Europa están fuertemente asociadas con indicadores de salud y un alto nivel de vida, lo cual quiere decir que una alta calidad de la medicina y un diagnóstico precoz de la diabetes reduce el riesgo de cetoacidosis diabética. Programas realizados para diagnóstico precoz de la diabetes han reducido la enfermedad en esa área al 12 %33.
Hay autores que por las particularidades clínicas de esta forma de presentación con cetoacidosis postulan la posibilidad de un particularmente agresivo subtipo de diabetes32. La presentación total de cetoacidosis diabética en los niños de Galicia durante estos 2 años es menor del 40 % reseñado en los estudios anteriores, lo que pone de manifiesto el fácil acceso del paciente a los medios sanitarios. Sin embargo, creemos que es una cifra todavía significativa y se mejoraría con programas encaminados con este fin.
La frecuencia de antecedentes de DM1 encontrada por nosotros en familiares de primer grado es muy inferior a estudios publicados. La frecuencia de lactancia materna es muy baja en estos pacientes y nuestros datos son inferiores al estudio nacional realizado por la Comisión de Diabetes Pediátrica Española34.
La DM1 con frecuencia se asocia a otras enfermedades autoinmunes. La presencia de enfermedad celíaca al diagnóstico en el 6,8 % de los pacientes se encuentra en un término medio entre los diferentes estudios35,36. La asociación con alteraciones tiroideas es la más común, variando según los países37. En nuestra muestra esta asociación se da en 3 pacientes, uno de los cuales tiene una edad inferior a 10 años y además tenía hipotiroidismo.
En conclusión, la incidencia en nuestra comunidad es alta, con una mayor frecuencia en el grupo de 5 a 9 años. Un tercio de los pacientes es diagnosticado con cetoacidosis, por lo que creemos que la promoción de programas de educación diabetológica favorecería un diagnóstico precoz, que además de disminuir la tasa de cetoacidosis acortaría el tiempo entre la aparición de los primeros síntomas y el diagnóstico de la enfermedad. Además de los síntomas clásicos las familias destacan la enuresis secundaria como un síntoma importante y precoz.
Grupo de Diabetes Infantil de Galicia
J.L. Chamorro Martín (Hospital Xeral-Cíes de Vigo, Pontevedra); A. Pavón Freire (Hospital Provincial de Pontevedra, Pontevedra); P. Lázaro Lázaro (Hospital Materno-Infantil Teresa Herrera, La Coruña); M. Rodríguez Blanco (Hospital de Barbanza, La Coruña); I. Quintela Fernández (Hospital Virxe da Xunqueira, La Coruña); M.J. Pita Pérez (Hospital Comarcal de Monforte, Lugo); M.M. Rodicio García (Hospital da Costa Burela, Lugo); P. Fariña Guerrero (Hospital Cristal Piñor, Orense); M. Caramés Varela (Hospital Comarcal Valdeorras, Orense); M. Santos Tapia (Hospital Arquitecto Marcide de El Ferrol, La Coruña); A. Novo Rodríguez (Hospital Arquitecto Marcide de El Ferrol, La Coruña.