Introducción
Los pacientes con hipotiroidismo subclínico presentan concentraciones elevadas de tirotropina (TSH) sérica, con concentraciones normales de tiroxina libre (T4L) y triyodotironina libre (T3L), con o sin manifestaciones clínicas1. Paoli-Valeri et al2 comunican una frecuencia de 6,4 % de hipotiroidismo subclínico en un grupo de niños de la Región de los Andes Venezolanos, la cual es elevada si se compara con el estudio de Loviselli et al3 quienes publicaron una frecuencia de 0,95 % de hipotiroidismo subclínico en niños italianos. La mayoría de los pacientes (50 a 70 %) tienen tiroiditis autoinmune crónica (Hashimoto), con concentraciones séricas altas de anticuerpos antiperoxidasa (anti-TPO)4-6. Estudios sobre autoinmunidad tiroidea en niños con hipotiroidismo subclínico son muy escasos; en el estudio realizado en nuestra región, se encontró que sólo uno de 12 niños con hipotiroidismo presentó anticuerpos antitiroideos elevados2.
En el hipotiroidismo, tanto la presencia de dislipemia como la respuesta al tratamiento son controvertidas, quizá debido a la variedad de métodos para medir lípidos y a las diferentes definiciones de la disfunción tiroidea. En el estudio poblacional más grande realizado hasta ahora sobre la prevalencia de enfermedades tiroideas realizado en Colorado (EE.UU.)7, se comunicó un aumento del colesterol total (CT), del colesterol unido a las lipoproteínas de baja densidad (c-LDL) y de los triglicéridos en los individuos con elevaciones moderadas de TSH. En un trabajo nuestro, pacientes femeninas con hipotiroidismo subclínico presentaron un aumento significativo del colesterol unido a las lipoproteínas de alta densidad (c-HDL) y mejoría del perfil lipídico en general, al tratarlas con levotiroxina8. En los niños con hipotiroidismo subclínico no hay estudios al respecto. El proceso de aterosclerosis se inicia desde la edad infantil9-11 y se ha demostrado una asociación entre las estrías grasas y las placas fibrosas arteriales con la elevación del c-LDL y disminución del c-HDL12. Dada la importancia de detectar y tomar medidas preventivas en niños con factores de riesgo para enfermedad aterosclerótica, se realizó este estudio con el fin de evaluar el perfil lipídico en una población de niños venezolanos en edad preescolar y escolar con hipotiroidismo subclínico.
Pacientes y métodos
Sujetos
Se seleccionaron 40 niños de ambos sexos con edades comprendidas entre 2 y 9 años, 17 con hipotiroidismo subclínico (grupo de estudio), determinado por concentraciones séricas de T4L dentro del rango de referencia normal y de TSH por encima del límite superior del rango normal (4,65 μU/ml), y 23 niños eutiroideos, que representaron el grupo control. Estos sujetos fueron captados al realizar una detección de trastornos tiroideos en dos institutos escolares de la ciudad de Mérida, Venezuela. El punto de corte del nivel de TSH para diagnosticar hipotiroidismo subclínico de 4,65 μU/ml, fue calculado por el promedio + 2 desviaciones estándar (DE) de las concentraciones séricas de TSH obtenidos de 283 niños sanos, de ambos sexos, de 2 a 9 años de edad.
Se excluyeron niños con enfermedades o que ingerían medicamentos conocidos de modificar la función tiroidea y el metabolismo lipídico como síndrome de Cushing, hipopituitarismo, diabetes mellitus, obesidad, alteraciones renales y gastrointestinales graves, uso de glucocorticoides, diuréticos y anticonvulsivos.
Protocolo
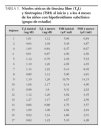
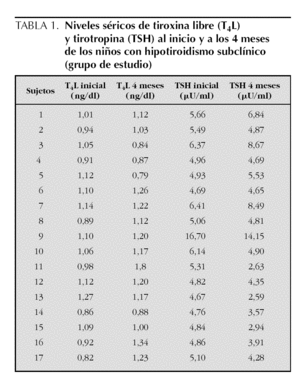
Con el objeto de excluir los niños con hipotiroidismo subclínico transitorio, los niños del grupo de estudio se mantuvieron en observación, sin realizar ninguna intervención, durante de 4 meses, al cabo de los cuales se les tomó una nueva muestra de sangre para confirmar el diagnóstico. Se excluyeron 7 niños que tuvieron los niveles de TSH por debajo de 4,65 μU/ml, ya que normalizaron de manera espontánea los valores y no cumplían con el diagnóstico de hipotiroidismo subclínico. Así, el grupo de estudio quedó formado por 10 niños.
A los niños seleccionados, con el previo consentimiento por escrito por parte de sus representantes, así como con la aprobación del Comité de Ética del Instituto Autónomo Hospital Universitario de Los Andes, se les realizó una historia clínica que incluyó el interrogatorio sobre síntomas de hipofunción tiroidea y antecedentes familiares de trastornos tiroideos (hasta tercera generación) y un examen físico para determinar la talla (medida con estadiómetro Holtain y calculada por el promedio de tres tomas), el peso, el índice de masa corporal (IMC = peso/talla2) y la presencia de bocio o de signos de hipofunción tiroidea. Se les tomó muestra de sangre después de 10 a 12 h de ayuno, de la vena antecubital, y se centrifugó para la obtención de plasma y suero. Se realizó el lipidograma que incluyó la determinación plasmática de triglicéridos, CT y c-HDL. El c-LDL se estimó por la fórmula de Friedewald13. Se calcularon los índices aterogénicos CT/c-HDL y c-LDL/c-HDL. El suero se almacenó a 70 °C y posteriormente se hizo la medición de anticuerpos anti-TPO y anticuerpos antitiroglobulina (anti-TG).
Métodos de laboratorio
La determinación de T4L y de TSH se realizó mediante la técnica de inmunofluorescencia (Delphia Wallac, Finlandia), en el Laboratorio del Centro de Desarrollo Infantil de Mérida (CDI). El rango normal de T4L del estuche comercial utilizado fue de 0,76 a 1,31 ng/dl. El coeficiente de variación interanálisis e intraanálisis para TSH fue de 6 y 5,4 % y para T4L fue de 4,1 y 3 %, respectivamente. La determinación de triglicéridos, CT y c-HDL se realizó por métodos enzimáticos con reactivos de la Boehringer Mannheim Diagnostica y autoanalizador Technicon. El c-HDL se obtuvo después de precipitación con cloruro de manganeso 2M14. Los anticuerpos anti-TPO y anti-TG se determinaron por la técnica de quimioluminiscencia, siendo el coeficiente de variación interanálisis e intraanálisis de 7,8 a 10,5 % y 3,5 a 5,6 %, respectivamente, para anti-TPO y de 4,2 a 9,1 % y 2,3 a 3,9 %, respectivamente para la anti-TG. El lipidograma y los anticuerpos se analizaron en el Laboratorio de Hormonas del IAHULA. Todas las determinaciones se realizaron por duplicado y se procesaron en el mismo análisis.
Análisis estadístico
Las variables estudiadas se presentan en promedios ± DE. Las variables continuas estudiadas no se ajustaron a una distribución normal, por lo que la significancia estadística de las diferencias entre los grupos de estudio y control, se determinó mediante la aplicación del test de Mann-Whitney. Además, se realizó una comparación con la tabla de los niveles promedio de c-HDL de niños de Estados Unidos de 5 a 9 años de edad, presentada en percentiles en el Reporte del Panel de Expertos15. Para establecer asociaciones estadísticas entre las variables categóricas se aplicó el test de la chi cuadrado. Se consideró significativo estadísticamente un valor de p < 0,05.
Resultados
En la tabla 1 se presentan los niveles de TSH y de T4L iniciales y a los 4 meses de observación, en los 17 niños que presentaron hipotiroidismo subclínico. Se observa que a los 4 meses, 7 (41,2 %) de estos niños presentaron niveles de TSH dentro del rango normal (TSH < 4,65 μU/ml), por lo que fueron excluidos. Los siguientes análisis se realizaron con los 10 sujetos restantes, 8 niños y 2 niñas, que mantenían elevados los valores de TSH y cumplían el diagnóstico.
Los niveles séricos de TSH, T4L y de anticuerpos anti-TG y anti-TPO de los dos grupos estudiados se presentan en la tabla 2; el nivel sérico promedio de TSH en el grupo de niños con hipotiroidismo subclínico (6,74 ± 3,04 μU/ml) se encuentra por encima del límite superior normal (4,65 μU/ml) mientras que en los controles (1,74 ± 0,66 μU/ml) está dentro de los límites normales (p < 0,0001); las concentraciones séricas promedio de T4L se encuentran dentro del rango normal tanto en el grupo de estudio (1,06 ± 0,17 ng/dl) como en el control (1,13 ± 0,22 ng/dl). Así, el valor de TSH diferencia claramente los dos grupos (estudio y control). No se encontraron concentraciones séricas elevadas de anticuerpos anti-TPO ni anti-TG, ni diferencias significativas entre los dos grupos estudiados.
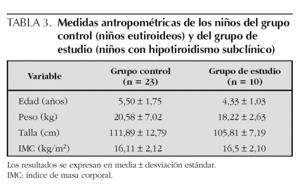
La edad y las medidas antropométricas de los grupos de estudio se muestran en la tabla 3. No se apreciaron diferencias significativas en cuanto a la edad, peso, talla e IMC, entre los niños con hipotiroidismo subclínico y los eutiroideos.
La presencia de síntomas de hipofunción tiroidea, los cuales se determinaron por un minucioso interrogatorio del paciente y su representante, fueron más frecuentes, aunque no significativamente, en los niños con hipotiroidismo subclínico (60 %) que en los controles (43,5 %); los síntomas más frecuentemente referidos fueron estreñimiento, sobrepeso y piel seca. Los antecedentes familiares de patología tiroidea estuvieron presentes en el 34,8 % de los controles y en el 20 % de los niños con hipotiroidismo subclínico. Durante el examen físico se encontró bocio en el 30,4 % de los niños controles y en el 20 % de los sujetos con hipotiroidismo, siendo en todos los casos del tipo difuso grados IA o IB (datos no mostrados).
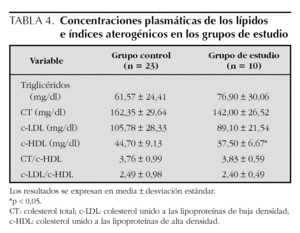
En la tabla 4 se presentan los valores promedio de los lípidos; no se observaron diferencias significativas en los niveles de triglicéridos, CT, c-LDL e índices aterogénicos entre los grupos de estudio, pero se encontró que los niveles promedio del c-HDL estuvieron significativamente más bajos en el grupo de estudio en relación con el control (37,5 ± 6,7 frente a 44,7 ± 9,1; p < 0,05). Comparando con la tabla de los niveles promedio de c-HDL de niños de Estados Unidos de 5 a 9 años de edad, presentada en el Reporte del Panel de Expertos15, se observa que los niños con hipotiroidismo subclínico tienen niveles promedio entre los percentiles 5 y 10 de ese grupo, que corresponden a 37 y 39 mg/dl en promedio respectivamente, mientras que los niveles de los niños controles, se encuentran entre los percentiles 10 y 25 (39 y 48 mg/dl, respectivamente).
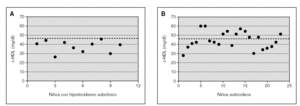
En la figura 1 se muestra la distribución individual de los niveles de c-HDL en los controles y en los niños con hipotiroidismo subclínico. La línea punteada representa el valor de 48 mg/dl de c-HDL que corresponde al percentil 25 de la tabla mencionada en niños norteamericanos15; se observa que todos los niños con hipotiroidismo subclínico (100 %) se encuentran por debajo del P25 y el 40 % (4 niños) tiene niveles muy bajos de c-HDL, por debajo del P5 (37 mg/dl). Entre los controles, se observa que el 44 % (10 niños) presenta sus valores por encima del P25, e incluso algunos tienen niveles superiores al promedio. Al aplicar el test de la chi cuadrado, se observa una asociación estadística significativa (p < 0,013) entre la presencia de hipotiroidismo y la mayor frecuencia de niveles bajos (< P5) del c-HDL.
Figura 1.Niveles plasmáticos individuales de c-HDL de los niños del grupo de estudio con hipotiroidismo subclínico(A)y de los del grupo control, eutiroideos (B). Asociación estadística significativa (p < 0,013) entre la presencia de hipotiroidismo subclínico y niveles de c-HDL en niños de Estados Unidos de 5 a 9 años de edad (NIH, 2001).
Discusión
En los pacientes con hipotiroidismo subclínico se ha observado una evolución variable, desde la remisión espontánea de los valores de TSH en algunos casos16, hasta la progresión a hipotiroidismo manifiesto en otros17. En este grupo de estudio se observó que de un total de 17 niños que inicialmente presentaron hipotiroidismo subclínico, en casi la mitad (41,2 %) se normalizaron espontáneamente los niveles de TSH. Este hallazgo es similar al de Moore en 199616, quien realizó un seguimiento de 5 años en promedio, a un grupo de niños y adolescentes con tiroiditis autoinmune crónica e hipotiroidismo subclínico, encontrando que el 38,8 % se hicieron eutiroideos a lo largo del seguimiento. Este comportamiento sugiere que el hipotiroidismo subclínico, en este grupo de edad, puede ser un evento transitorio que podría remitir sin tratamiento alguno. Estas observaciones enfatizan la importancia de realizar un seguimiento de algunos meses a los niños y como mínimo tener dos determinaciones de TSH antes de establecer un diagnóstico definitivo o de iniciar tratamiento médico con levotiroxina. Además, en vista de que el diagnóstico de hipotiroidismo subclínico se fundamenta en el hallazgo de un valor de TSH alto, es indispensable establecer el límite superior de éste en la población estudiada, con el fin de evitar errores diagnósticos2,18.
Este grupo de estudio no presentó niveles elevados de anticuerpos anti-TPO ni antitriglicéridos en comparación con los controles, lo que ya había sido publicado anteriormente por nosotros en niños más pequeños con hipotiroidismo subclínico2, concluyéndose que en esta región de Los Andes, la elevada frecuencia de este proceso no está relacionada a la autoinmunidad tiroidea, a pesar del antecedente de ser una zona con deficiencia de yodo corregida. Estos hallazgos son diferentes a los de Loviselli et al3 quienes comunicaron que en escolares de 6 a 15 años de edad en Cerdeña (Italia), los títulos de anticuerpos antitiroideos estuvieron más frecuentemente elevados en los niños con hipotiroidismo subclínico (15,6 %), en comparación con los niños que presentaban niveles normales de TSH (2,8 %).
Los síntomas de hipofunción tiroidea estuvieron presentes en mayor proporción en los niños con hipotiroidismo que en los niños eutiroideos; así, aunque el diagnóstico de esta condición es por definición un diagnóstico bioquímico (TSH alta; T4L y T3L normales), la mayoría de los pacientes se quejan de síntomas, como también lo refieren otros autores19,20.
Los resultados de las determinaciones de lípidos séricos son contradictorios en el hipotiroidismo subclínico. En este estudio, los niños mostraron un perfil lipídico aterogénico, a expensas de niveles bajos de c-HDL, factor de riesgo reconocido de enfermedad cardíaca aterosclerótica. En la revisión de la literatura especializada no se encontraron estudios sobre niveles de lípidos en niños preescolares y escolares con hipotiroidismo subclínico que sirvieran de comparación a nuestros datos, sin embargo, en estudios realizados en adultos, algunos autores8,21,22 encontraron concentraciones séricas disminuidas de c-HDL, los cuales mejoraron luego del tratamiento con levotiroxina. En el metaanálisis de Danese et al23, de los 10 estudios comunicados en pacientes con hipotiroidismo, cinco mostraron aumento del c-HDL con el tratamiento de levotiroxina, cuatro mostraron más bien disminución y uno no presentó cambios. Se puede observar que hay controversias en cuanto al efecto del hipotiroidismo subclínico sobre los valores del c-HDL.
La disfunción tiroidea produce cambios en el metabolismo de las lipoproteínas debido a la regulación ejercida por las hormonas tiroideas sobre las enzimas clave en el metabolismo de las lipoproteínas y sobre la actividad de los receptores24-27. La alteración más reportada en el hipotiroidismo es la reducción en el número de receptores de LDL en el hígado, lo que conduce a una disminución en el aclaramiento de esta lipoproteína y un aumento del c-LDL en sangre24. El efecto ejercido por las hormonas tiroideas sobre el c-HDL es más complicado y al parecer es mediado a través del efecto sobre la lipasa hepática, la proteína transferidora de ésteres de colesterol (CETP) y la formación y degradación de la apolipoproteína AI (Apo AI), principal componente proteico de la HDL25-27. En este sentido, en el hipotiroidismo, se ha observado una actividad disminuida de la lipasa hepática y la CETP que conllevan a un aumento de la HDL, ya que la primera está involucrada con el catabolismo de esta lipoproteína a nivel hepático y la segunda con la transferencia de lípidos entre las lipoproteínas y en el metabolismo del c-HDL25. Este mecanismo podría explicar el hallazgo de niveles de c-HDL elevados comunicados en algunos casos de hipotiroidismo manifiesto23,26,28; sin embargo, no da explicación satisfactoria al hallazgo de c-HDL bajo comunicado por nosotros y otros autores21,22 en el hipotiroidismo subclínico.
Por otro lado, el estudio experimental de Huesca-Gómez et al27 muestra que en ratas tiroidectomizadas, que no presentan actividad de CETP, los niveles de HDL están bajos debido a una importante disminución en la síntesis de la Apo AI, a pesar de que su catabolismo también se encuentra reducido. Es posible que este trastorno en la síntesis de la Apo AI también esté presente en el ser humano con hipotiroidismo, donde a diferencia de las ratas, la actividad disminuida de la CETP, que tiene una correlación inversa con el HDL, puede en ciertos casos, atenuar o enmascarar los niveles bajos esperados de HDL27. Basándose en estas evidencias, se propone que el grado de deficiencia de hormonas tiroideas podría tener efectos diferentes; así, una deficiencia leve de la función tiroidea, como se observa en el hipotiroidismo subclínico, podría no tener actividad sobre la acción de la CETP, pero sí sobre la síntesis de Apo AI, mientras que en las deficiencias más graves como en el hipotiroidismo manifiesto, se observaría tanto una disminución de la actividad de la CETP como de la síntesis de Apo AI. Esto podría explicar los niveles bajos de c-HDL observados en el tipo subclínico frente a los niveles normales o altos observados en el hipotiroidismo manifiesto8,26. Se deben realizar otros estudios para aclarar definitivamente el efecto de las hormonas tiroideas sobre el metabolismo del c-HDL.
Los resultados de este estudio muestran que una elevación aún leve de TSH se asocia con dislipemia, ya que los pacientes presentaban un grado leve de disfunción tiroidea, y sólo uno tuvo valores mayores de 10 μU/ml. Resultados similares fueron comunicados en el Estudio de Prevalencia de Enfermedades Tiroideas de Colorado7, donde se encontró dislipemia en sujetos con niveles de TSH entre 5,1 y 10 μU/ml. Sin embargo, en el estudio de Staub et al29, la dislipemia se presentó sólo cuando la concentración de TSH era mayor de 12 μU/ml.
El estudio Rotterdam30 y otros más31,32 demuestran que existe un riesgo aumentado de aterosclerosis e infarto de miocardio en pacientes mayores con hipotiroidismo subclínico. En 1997, Perk y O'Neill33 encontraron, a través de angiografía coronaria, una mayor progresión de las lesiones ateroscleróticas en pacientes hipotiroideos bajo terapia con levotiroxina pero con niveles de TSH similares a los de los pacientes con hipotiroidismo subclínico, en comparación con pacientes cuyos niveles de TSH se mantuvieron asiduamente en el nivel normal. El hallazgo de un perfil lipídico aterogénico (c-LDL alto; c-HDL bajo) podría ser el mecanismo por el cual se observa una mayor frecuencia de enfermedad aterosclerótica en el hipotiroidismo subclínico y por lo que se debe considerar como un factor de riesgo cardiovascular, aún desde temprana edad, ya que los cambios que pueden favorecer la enfermedad cardíaca aterosclerótica en el adulto se inician desde la edad infantil; las estrías grasas encontradas en las arterias de los niños podrían progresar a placas fibrosas y luego a lesiones ateromatosas clínicamente significativas en la vida adulta9-11.
De acuerdo con nuestros resultados se concluye que los niños con hipotiroidismo subclínico presentan una disminución significativa en los niveles de c-HDL, lo cual sugiere un patrón lipídico aterogénico en esta entidad.