Introducción
El conducto (ductus) arterioso es una estructura que permanece abierta durante el desarrollo fetal por efecto de los niveles elevados de prostaglandinas 1. Tras el nacimiento, disminuyen los niveles de prostaglandinas y la tendencia natural del ductus es a cerrarse espontáneamente en los primeros 3 días de vida. En los recién nacidos prematuros, especialmente en aquellos con enfermedad pulmonar, estos cambios no se producen de igual forma, y es probable que el conducto se mantenga abierto tras el nacimiento 2 (ductus arterioso persistente [DAP]). La persistencia de un conducto arterioso con un cortocircuito significativo aortopulmonar puede complicar la evolución de los pretérmino; se ha observado que condiciona un aumento del riesgo de hemorragia intraventricular, enterocolitis necrosante, displasia broncopulmonar y fallecimiento 2-5. La incidencia del DAP varía en función de la edad gestacional y del peso al nacimiento, y es mayor cuanto menor es el peso y la edad gestacional; en prematuros de muy bajo peso al nacimiento con síndrome de distrés respiratorio se aproxima al 40 % en el tercer día de vida 2,6,7. En nuestro servicio la incidencia actual del DAP es del 29 % en los menores de 1.500 g y asciende al 50 % en los menores de 1.000 g.
La indometacina, un inhibidor de la síntesis de prostaglandinas, ha sido el tratamiento más utilizado en el cierre del DAP (bien de forma profiláctica o una vez diagnosticado) 2,4,5,8. Sin embargo, a pesar de su eficacia demostrada, su uso se ha asociado a complicaciones debidas a la disminución de la perfusión cerebral, renal y mesentérica 9-15.
En los últimos años han aparecido estudios que concluían que el ibuprofeno, otro inhibidor de la síntesis de prostaglandinas, era igual de eficaz en el cierre del DAP, pero con menores efectos hemodinámicos 16-23, no condicionando un descenso en el flujo sanguíneo del cerebro, intestino y riñones.
Por todo ello se ha diseñado un estudio prospectivo aleatorizado para comparar la eficacia y la seguridad del ibuprofeno frente a la indometacina en prematuros con DAP sintomático. El objetivo primario fue el cierre del conducto tras el tratamiento asignado y los objetivos secundarios la tasa de reapertura, necesidad de una segunda tanda de tratamiento farmacológico de rescate, necesidad de cierre quirúrgico, incidencia de complicaciones (enterocolitis necrosante, perforación intestinal, afectación renal, hemorragia intraventricular, otras hemorragias, displasia broncopulmonar) y fallecimiento.
Paciente y métodos
Diseño del estudio
Ensayo clínico prospectivo, con distribución aleatoria y grupo control, que fue aprobado por la comisión de investigación y el comité de ética de nuestro centro.
Protocolo
Se realizó el estudio en la Unidad de Cuidados Intensivos del Servicio de Neonatología del Hospital Universitario La Fe de Valencia (Unidad de nivel III, referencia de comunidad, con 16 camas y 460 ingresos anuales). Se seleccionaron a los pacientes entre enero de 2003 y julio de 2004, previo consentimiento informado de los padres.
Los criterios de inclusión utilizados fueron prematuros con edad gestacional inferior a 34 semanas, en la primera semana de vida, que presentasen DAP con shunt hemodinámicamente significativo, diagnosticado mediante ecocardiografía y que precisaran soporte ventilatorio. En todos los niños se realizó un completo estudio ecocardiográfico Doppler (Hewlett Packard Sonos 2000 con un transductor de 7,5 MHz) por cardiólogos pediatras de la unidad neonatal, considerándose como shunt hemodinámicamente significativo la presencia de cortocircuito aortopulmonar dominante con relación DAP/tronco pulmonar > 0,3 e inversión del flujo diastólico en aorta abdominal 16,24.
Se excluyeron aquellos pacientes que presentaron una diuresis inferior a 1 ml/kg/h en las 8 h previas al tratamiento, creatinina superior a 1,8 mg/dl, plaquetas inferiores a 60.000/μl, hemorragia activa (traqueal, digestiva o renal), hemorragia periintraventricular reciente (grados 3-4) o hiperbilirrubinemia grave.
Después de obtener el consentimiento informado de sus padres, los pacientes fueron aleatorizados para recibir una de las dos intervenciones:
1.Indometacina (Inacid DAP intravenosa MSD), a 0,2 mg/kg/dosis cada 12 h, un total de 3 dosis, administrada en perfusión intravenosa durante 30 min.
2.Ibuprofeno (ibuprofen Orphan Europe®), que se empleó con una dosis inicial de 10 mg/kg seguido de 2 dosis de 5 mg/kg cada 24 h, en perfusión intravenosa durante 20 min.
Transcurridas un mínimo de 48 h desde el inicio de este primer ciclo de tratamiento, se realizó un control ecocardiográfico. Si el conducto continuaba abierto y con repercusión clínica significativa, se administró como rescate otra tanda de 3 dosis de la misma medicación inicialmente asignada. Si este segundo tratamiento también falló o estuvo contraindicada su administración y el conducto seguía teniendo repercusiones significativas, se procedió al cierre quirúrgico.
Se definió la existencia de displasia broncopulmonar como necesidad de oxígeno suplementario a los 28 días de vida.
Se valoró la función renal midiendo la diuresis y las cifras de creatinina en el curso del tratamiento. Se consideró que existió disfunción renal transitoria (DRT) cuando se produjo un descenso de la diuresis al 50 % del ritmo basal, pero sin llegar a menos de 1 ml/kg/h o un aumento de la creatinina del 50 % sobre el nivel basal pero inferior a 1,8 mg/dl. Se definió insuficiencia renal transitoria (IRT) como un descenso de la diuresis por debajo de 1 ml/kg/h o un ascenso de la creatinina por encima de 1,8 mg/dl.
Todos los pacientes se manejaron siguiendo las guías clínicas y protocolos del servicio y se les realizaron los controles analíticos y cardiológicos considerados adecuados hasta su alta hospitalaria.
Cálculo del tamaño muestral
El cálculo del tamaño muestral se basó en la variable dependiente principal del estudio. Se sabe que, en una población similar a la nuestra, la proporción de cierres espontáneos de DAP es del 35 % y la indometacina consiguió una tasa de cierres del 79 % 4. Asumiendo una proporción del 0,79 en el grupo control (indometacina), aceptando un riesgo α de 0,05 y un riesgo β de 0,20 en un contraste bilateral (poder estadístico del 80 %), y estimando una tasa de pérdidas de seguimiento del 5 %, se precisa una muestra global de 48 sujetos para detectar una diferencia igual o superior al 40 % entre ambos grupos del estudio. Se ha utilizado la aproximación del Arcoseno, realizada con el programa Granmo 5,2 25.
Distribución aleatoria
Para procurar un número similar de pacientes en ambos grupos, se generó una secuencia de aleatorización en dos grupos mediante un procedimiento de bloques balanceados de cuatro elementos. Se utilizó una serie de números aleatorios generados por ordenador mediante la función «Aleatorio» del programa MS-Excel XP®, y a esta se aplicó el procedimiento descrito por Friedman et al 26. Una vez generada, la secuencia de aleatorización se mantuvo oculta utilizando la técnica de los sobres opacos lacrados.
Análisis estadístico
La estrategia de análisis se ha basado en el principio de intención de tratar. Para hacer los cálculos se ha utilizado el programa SPSS® 11 para Windows®. Las variables categóricas se describen con el recuento numérico (porcentaje) de cada categoría, y se comparan, si se cumplen los supuestos de aplicación, con la prueba de ji cuadrado de Pearson, y si no, con el test exacto de Fisher. Las variables continuas se representan con los gráficos de cajas y patillas (box-plot) de Tuckey. Si las variables continuas son normales (p > 0,05 en la prueba de Shapiro-Wilk) se describen con la media ± desviación estándar, y se comparan utilizando la prueba de la t de Student testando primero la hipótesis de igualdad de las varianzas mediante la prueba de Levene. Si no son normales, se describen con mediana (P25, P75) y se comparan con la prueba no paramétrica de la U de Mann-Whitney. La comparación entre ambos grupos de las medidas repetidas en el tiempo se realiza mediante la prueba de análisis de la varianza (ANOVA) de dos vías, probando primero la hipótesis de esfericidad de Mauchly y rechazándola con una p < 0,05. Los tiempos de supervivencia se expresan con su mediana (intervalo de confianza del 95 % [IC 95 %]), y la comparación entre grupos se realiza con la prueba de log-rank. En todo el estudio se acepta como límite de significación estadística una p ≤ 0,05. La magnitud del efecto se cuantifica con la diferencia de riesgos (expresada en porcentaje), y su precisión se indica con los IC 95 %. La redacción del manuscrito se ha realizado siguiendo la versión revisada del protocolo Consort 27.
Resultados
La figura 1 muestra un diagrama de flujo en el que se representa los pacientes participantes en cada uno de los estadios del estudio.
Figura 1. Diagrama de flujo de participantes y seguimiento.
De los 50 pacientes que se consideraron candidatos a participar, previamente a la aleatorización se excluyeron tres: uno porque los padres rehusaron dar su consentimiento; otro porque no cumplía uno de los criterios de inclusión (su edad posnatal superaba los 7 días), y otro porque cuando se iba a proceder a su aleatorización se objetivó que no se disponía de uno de los dos fármacos en la farmacia del servicio. El azar distribuyó finalmente a 24 para tratamiento con indometacina y 23 con ibuprofeno, siguiéndose todos hasta el final.
La tabla 1 indica que la aleatorización generó dos cohortes totalmente comparables e intercambiables en sus características basales previas a la administración del fármaco en estudio.
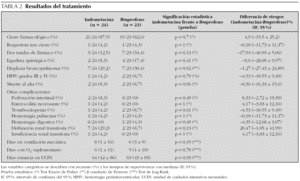
Se consiguió un cierre farmacológico del conducto en el 85,1 % (IC 95 % exacto = 71,7-93,8) de todos los prematuros. Como se aprecia en la tabla 2, la frecuencia de cierre farmacológico fue similar en ambas cohortes: 87,5 % en el grupo que recibió indometacina y 82,6 % en el que recibió ibuprofeno (p = 0,7).
Tampoco se encontraron diferencias estadísticamente significativas entre ambas cohortes en cuanto a reaperturas tras el cierre, necesidad de dos tandas de fármaco, ni proporción de ligaduras quirúrgicas. De los 9 pacientes en los que no se consiguió cierre farmacológico, uno falleció, dos no se ligaron por no presentar repercusión clínica ni hemodinámica y en los seis restantes se practicó la ligadura quirúrgica: dos en el grupo de indometacina y cuatro en el de ibuprofeno.
La tasa de otras complicaciones fue similar en ambos grupos (tabla 2). Ningún paciente tratado con ibuprofeno presentó enfermedad abdominal, que sí apareció en el grupo de indometacina (dos perforaciones intestinales y una enterocolitis necrosante). Siete pacientes (29 %) del grupo de indometacina sufrieron DRT frente a dos (9 %) en el de ibuprofeno. En el grupo de indometacina uno desarrolló IRT y ninguno en el de ibuprofeno.
Ninguna de las dos cohortes tuvieron mayor incidencia de displasia broncopulmonar (30 % de indometacina frente a 29 % de ibuprofeno), hemorragia periintraventricular grave (grados III-IV) (el 4 % en el grupo de indometacina frente al 9 % en el de ibuprofeno) ni muertes (8,3 % frente a 8,7 %) (tabla 2). Los 4 pacientes fallecidos tenían un peso al nacimiento menor de 750 g y edad gestacional inferior a 26 semanas; fallecieron a los 5, 7, 9 y 131 días.
De igual forma no se encontraron diferencias estadísticamente significativas en la duración de la ventilación mecánica (p = 0,19), en la duración del aporte de O2 suplementario (p = 0,78), ni en la duración de la estancia en la unidad de cuidados intensivos neonatales (UCIN) (p = 0,92).
Discusión
El objetivo primario de este estudio fue determinar si el ibuprofeno administrado como tratamiento del conducto significativo diagnosticado en prematuros en la primera semana de vida era igual de efectivo que la indometacina. En nuestra serie ambos fármacos se han mostrado igual de eficaces en el cierre del DAP sintomático con una tasa de cierre similar a la encontrada en otros estudios 16,17,21,28.
El ibuprofeno ya ha demostrado su efectividad en el cierre del conducto en animales 20,29. En humanos, un metaanálisis de la revisión Cochrane 30 analiza ocho estudios que incluyen un total de 509 pacientes comparando la efectividad del ibuprofeno frente a la indometacina en el cierre del conducto y concluye que ningún estudio encuentra diferencias significativas en la eficacia de cierre del DAP ni tampoco el metaanálisis.
Más recientemente el uso profiláctico de ibuprofeno 23,31 dentro de las primeras horas de vida ha sido defendido y se están realizando ensayos para valorar su eficacia y seguridad en el descenso de la incidencia del DAP.
Las complicaciones renales (disfunción e insuficiencia renal transitorias) fueron menores en el grupo tratado con ibuprofeno (2 casos [9 %]), que en el de indometacina (8 casos [33 %]). En este último aparecieron 3 (12,5 %) complicaciones digestivas (2 perforaciones intestinales y 1 ECN) por ninguna en el grupo tratado con ibuprofeno. Estos resultados podrían explicarse por los hallazgos referidos en estudios previos que señalan menores efectos secundarios intestinales y renales del ibuprofeno 16,17,19-21,32. Aunque ambos fármacos son inhibidores no selectivos de la ciclooxigenasa, enzima encargada de la síntesis de prostaglandinas, se ha visto que los dos tienen diferentes efectos hemodinámicos. La indometacina origina vasoconstricción y reducción del flujo sanguíneo renal y mesentérico y reduce también el flujo sanguíneo cerebral 9-15, mientras que el ibuprofeno no afecta a la hemodinámica renal, intestinal ni cerebral 18,22,33-35. Así, Mosca et al 22 y Patel et al 18 mediante estudios de espectroscopia cercana al infrarrojo, miden el flujo sanguíneo cerebral, el volumen sanguíneo cerebral y la liberación de oxígeno a nivel cerebral en prematuros con conducto arterioso durante su tratamiento con indometacina o ibuprofeno y concluyen que la indometacina origina cambios significativos en los mismos y no así el ibuprofeno. Pezzati et al 19, por su parte, miden con ecografía Doppler la velocidad del flujo sanguíneo mesentérico y renal observando que la indometacina causa un descenso significativo en la velocidad del flujo mesentérico y renal, lo que no ocurre con el ibuprofeno. Aunque el mecanismo exacto del diferente efecto de los dos fármacos no está claro, los datos disponibles hasta el momento permiten plantear distintas teorías. Por un lado, se postula que de las dos isoenzimas conocidas de la ciclooxigenasa (COX-1 y COX-2), la COX-1 sería la implicada mayoritariamente en la fisiología basal renal y, aunque las dos isoformas son inhibidas por el ibuprofeno y la indometacina, esta última sería más potente frente a la COX-1, de ahí su mayor efecto renal 17-19,21,36. Por otra parte, se piensa que la indometacina actúa por otros mecanismos diferentes a la inhibición de la síntesis de prostaglandinas 20,37, ya que estudios experimentales muestran que su efecto tiene lugar antes de que se produzcan cambios en la concentración de prostaglandinas.
En nuestro estudio no se ha comprobado que el grupo tratado con ibuprofeno presente un mayor riesgo de displasia broncopulmonar, pese a requerir con más frecuencia una segunda tanda de tratamiento, aunque esto sí se ha observado en el metaanálisis Cochrane 2003 al valorar en conjunto dos estudios que por separado no mostraban diferencias significativas 17,21,30. La diferencia puede estar en la incidencia de otros factores asociados a la displasia o en el pequeño tamaño de nuestra muestra.
Tampoco se han encontrado diferencias significativas en la tasa de hemorragia intracraneal grave. No se ha valorado la evolución neurológica a largo plazo, lo que sería muy interesante para próximas revisiones, ya que experimentalmente se ha observado un menor efecto del ibuprofeno sobre la circulación y la oxigenación cerebral 18,22, con los beneficios que ello podría tener sobre el neurodesarrollo.
En ninguno de nuestros pacientes se produjeron episodios de hipoxia indicativos de hipertensión pulmonar tras la administración de ibuprofeno, como describe Gournay et al 38,39, quien encuentra 3 casos de hipertensión pulmonar tras dar ibuprofeno de forma profiláctica a prematuros de menos de 28 semanas de gestación en las primeras 6 h de vida. La causa de esta complicación no se conoce y se ha relacionado con la precocidad en la administración del fármaco, la prematuridad extrema de la población estudiada y la dilución utilizada para su uso (THAM, trishydroxy aminomethane). En nuestro análisis, tanto el ibuprofeno como la indometacina se diluyeron con suero salino fisiológico o suero glucosado al 5 %.
En conclusión, en nuestro estudio el ibuprofeno se mostró igual de eficaz que la indometacina en el cierre del DAP. No hubo diferencias significativas en la incidencia de complicaciones entre ambos grupos, aunque los tratados con ibuprofeno tuvieron menos complicaciones renales y ninguna intestinal. No se produjeron cambios sobre la evolución respiratoria ni sobre la supervivencia. Sería conveniente realizar nuevos estudios que analizaran más extensamente las complicaciones pulmonares y la evolución neurológica a largo plazo.
Agradecimientos
Deseamos expresar nuestro agradecimiento al Dr. V. Modesto por su colaboración en el análisis estadístico del estudio.