El hiperinsulinismo congénito es la causa más frecuente de hipoglucemia mantenida en la infancia. El reconocimiento y tratamiento tempranos son necesarios para prevenir el daño neurológico por episodios recurrentes o prolongados de hipoglucemia.
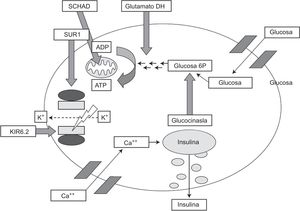
Se han descrito diversas mutaciones genéticas responsables, siendo las canalopatías y metabolopatías las alteraciones principales1–3. El gen GLUD1 codifica la enzima glutamato deshidrogenasa que proporciona la señal necesaria para la secreción de insulina (fig. 1). El 5% de los casos de hiperinsulinismo son debidos a alteraciones en dicho gen1.
Fisiopatología de la secreción de insulina en la célula beta pancreática.
Imagen tomada de J. Guerrero-Fernández et al. Hiperinsulinismo congénito. Revisión de 22 casos7.
SCHAD: 3-hidroxiacil-CoA deshidrogenasa de cadena corta. SUR1: receptor de la sulfonilurea 1. ADP: adenosín difosfato. ATP: adenosín trifosfato. KIR6.2: subunidad del canal de potasio. Glucosa 6 P: glucosa 6-fosfato.
A diferencia de los episodios típicos de hipoglucemia aislada, que se producen con mayor frecuencia después de períodos de ayuno o después de hacer ejercicio intenso, los episodios de hipoglucemia en estos pacientes también pueden ocurrir después de la ingesta de alimentos, especialmente proteínas. Clásicamente se ha denominado síndrome de hiperinsulinismo-hiperamoniemia por su asociación con niveles elevados de amonio en sangre, pero esta alteración no siempre está presente en todos los pacientes. El diagnóstico se basa en la obtención de una muestra de sangre en el momento de una hipoglucemia (< 50 mg/dL) espontánea o provocada y la respuesta glucémica al glucagón1,2.
El tratamiento se realiza mediante pautas dietéticas y tratamiento farmacológico, siendo el diazóxido el fármaco de elección4,5.
Presentamos un caso de hiperinsulinismo congénito debido a una variante probablemente patogénica en el gen GLUD1 que también se objetivó en dos miembros sintomáticos de la familia. La expresividad clínica de esta variante en los distintos familiares ayudará a completar el fenotipo de dicha mutación.
Se trata de una lactante mujer de 17 meses de edad, que acude a la consulta de neurología por cuadro de dos meses de evolución de astenia, hipersomnia y episodios de hipotonía, sobre todo tras el ayuno nocturno y no relacionados con ningún tipo de ingesta. Su padre, de 40 años, fue diagnosticado de narcolepsia en la infancia. Se le solicita una analítica sanguínea con amonio que resulta normal. El desarrollo psicomotor era normal y el electroencefalograma objetiva una actividad paroxística intercrítica multifocal, de incidencia moderada, con escasa tendencia a la difusión.
Un mes después, acude por disminución del nivel de consciencia. A la exploración física, presenta peso 11,4 kg (0,45 SDS), talla 82 cm (0,8 SDS), IMC 16,9 (-0,04 SDS) y un examen físico normal, salvo un Glasgow de 14 sobre 15. El estudio analítico evidencia glucemia de 27 mg/dL, insulinemia de 14,7 mcU/mL, amonio 28 μmol/L, péptido C 3,7 ng/mL, cetonuria y cetonemia negativas. Precisa aportes totales de glucosa de 11,9 mg/kg/min. Se realiza un test de glucagón que resulta positivo, confirmando el hiperinsulinismo. Se inicia tratamiento con diazóxido con buena respuesta a una dosis de 8,6 mg/kg/día.
El estudio genético confirmó la existencia de una variante c.1466C>A [p.(Pro489His)] en heterocigosis en el exón 11 del gen GLUD1, que generaba un cambio de aminoácido p.(Pro489His). Tanto su padre como su hermana de cuatro años, que presentaba síntomas compatibles con hipoglucemia antes de las comidas, presentaban la misma variante. El estudio genético de la madre fue normal. El padre, además, refería episodios de astenia y sudoración tras la ingesta de proteínas.
En el hiperinsulinismo congénito, se produce una secreción inapropiada de insulina que puede resultar en hipoglucemias graves. La etiología es genética pero sólo se detecta mutación en el 50% de los casos4,6. Las mutaciones más frecuentes son aquellas que implican una disfunción del canal ATPk, seguidas de las mutaciones en el gen GLUD1. La familia descrita presentaba mutación en este último gen, con la particularidad de que se trata de una variante de significado real, desconocida hasta ahora. La variante c.1466C>A y el cambio de aminoácido p.(Pro489His) consiguiente no están descritos en bases de datos de SNPdb ni en ClinVar, aunque los estudios de predicción funcional la clasifican como probablemente patogénica. La expresividad clínica de la familia descrita en nuestro caso confirma la repercusión clínica de dicha alteración en diferentes etapas de la vida. De hecho, el padre del caso índice presentó síntomas en la primera infancia, pero fue catalogado como narcolepsia. Nuestro diagnóstico posterior sugiere que se trataban en realidad de episodios de hipoglucemia sintomática.
La gravedad de las manifestaciones clínicas de esta enfermedad suele relacionarse con el tipo de mutación encontrada, por lo que el análisis genético resulta fundamental para establecer el pronóstico y la estrategia terapéutica a seguir, en función del tipo de alteración detectada. La descripción de los hallazgos clínicos de pacientes con variantes nuevas en los genes implicados en esta enfermedad serviría para completar la relación genotipo-fenotipo. Más aún, si se trata de la descripción de varios miembros afectados en una misma familia, como es nuestro caso.
Afortunadamente este tipo de mutaciones responden al tratamiento, como en el caso de nuestra paciente. Sin embargo, las mutaciones del gen ABCC8 suelen provocar un hiperinsulinismo resistente al diazóxido1,5. En estos casos, estaría indicado el tratamiento con octreótido. Niños no respondedores a ambos fármacos pueden requerir un manejo intensivo con alimentación enteral continua o cirugía5.
En conclusión, la identificación del genotipo responsable en pacientes con hiperinsulismo congénito resulta de gran relevancia para interpretar el fenotipo clínico y determinar la mejor opción terapéutica. La variante c.1466C>A en el gen GLUD1 descrita se correlaciona con un fenotipo clínico de hiperinsulinismo clásico.
Presentación previa en congresos: XXXV Congreso de la Sociedad Valenciana de Pediatría. Calpe. 6 de Abril de 2019.