El cribado de tuberculosis (TB) gestacional mediante la realización de la prueba de tuberculina (PT) se recomienda a las embarazadas con síntomas compatibles, contacto íntimo con TB bacilífera o riesgo de progresión a formas activas. Las nuevas técnicas de diagnóstico interferon gamma release assay (IGRA) están indicadas en gestantes sin factores de riesgo, con PT positiva y antecedente de vacunación BCG, y en inmunodeprimidas con sospecha clínica y PT negativa. El diagnóstico de enfermedad es difícil, ya que los síntomas pueden ser inespecíficos y hay más formas extrapulmonares, por el retraso en las exploraciones radiológicas y por la mayor tasa de anergia a la tuberculina. La TB neonatal puede adquirirse de forma intrauterina (TB congénita) o por vía respiratoria tras el parto (TB posnatal). La TB congénita es excepcional, no produce malformaciones fetales y, aunque puede estar presente en el nacimiento, suele iniciarse a partir de la segunda semana de vida. En ausencia de antecedentes familiares, la TB neonatal debe sospecharse en caso de neumonía con patrón miliar, hepatoesplenomegalia con lesiones focales o meningitis linfocitaria con hipoglucorraquia, especialmente si la madre procede de áreas de alta endemia de TB. La PT es habitualmente negativa y la sensibilidad de los IGRA es inferior a la de niños de más edad. Sin embargo, la baciloscopia y el cultivo de jugo gástrico tienen una rentabilidad superior, especialmente en la TB congénita. Las técnicas de diagnóstico molecular permiten un diagnóstico precoz y la detección de mutaciones de resistencia farmacológica. El riesgo de formas diseminadas y la mortalidad son elevados.
Tuberculosis (TB) screening in pregnancy using tuberculin skin test (TST) is recommended in case of symptoms of TB disease, close contact with a patient with infectious TB, or high risk of developing active disease. The new interferon gamma release assay (IGRA) tests are recommended in BCG-vaccinated pregnant women with positive TST and no known risk factors for TB, and in those immunocompromised, with clinical suspicion of TB but negative TST. TB diagnosis is difficult due to the non-specific symptoms, the increased frequency of extrapulmonary disease, the delay in radiological examinations, and the high rate of tuberculin anergy. Neonatal TB can be acquired in utero (congenital TB), or through airborne transmission after delivery (postnatal TB). Congenital TB is extremely rare and does not cause fetal malformations. It may be evident at birth, although it usually presents after the second week of life. In newborns with no family history of TB, the disease should be considered in cases of miliary pneumonia, hepatosplenomegaly with focal lesions, or lymphocytic meningitis with hypoglycorrhachia, especially in those born to immigrants from high TB-burden countries. TST is usually negative, and IGRAs have lower sensitivity than in older children. However, the yield of acid-fast smear and culture is higher, mostly in congenital TB. Molecular diagnosis techniques enable early diagnosis and detection of drug resistance mutations. There is a substantial risk of disseminated disease and death.
La epidemiología de la tuberculosis (TB) ha cambiado drásticamente en los últimos 5 años con una incidencia media mundial de 130 casos/100.000 habitantes, que evidencia, según el informe de la OMS del año 20121, un descenso franco en países desarrollados, mayor carga de enfermedad en Asia y África, e incremento en población joven y con factores de riesgo. El resultado es un aumento de la enfermedad en adultos jóvenes, incluyendo mujeres en edad fértil, lo que aumenta la posibilidad de TB gestacional y neonatal. La incidencia media de TB en España en 2011 fue de 14,74 casos/100.000 habitantes, y aunque no existen datos en gestantes, las mujeres en edad fértil suponen el 39% del total de casos2.
La prevalencia de infección tuberculosa latente (ITBL) en gestantes refleja la de la población general. En EE. UU. se estima que el 4,2% de las gestantes tienen ITBL, pero se calcula que este porcentaje se multiplica por 10 entre gestantes nacidas fuera de EE. UU. Es difícil estimar la prevalencia de ITBL en áreas de alta endemia, ya que muchas mujeres no tienen acceso al sistema sanitario durante la gestación3; en estudios reducidos se calcula que entre el 18 y el 34% de las gestantes en India y casi la mitad de las embarazadas infectadas por el VIH en Sudáfrica presentan ITBL4,5.
La TB gestacional es infrecuente en países desarrollados (4-39 casos nuevos/100.000 habitantes), pero la incidencia es mucho más alta en áreas endémicas (>60 casos nuevos/100.000)6. Se ha constatado un aumento de la prevalencia de TB durante la gestación y el posparto en gestantes en EE. UU. e Inglaterra, que oscila en la actualidad entre el 0,13 y el 1%3; esta prevalencia es claramente inferior a la de países en desarrollo (3,4% en India y 2,8% en Kenia), especialmente entre las mujeres con infección por el VIH (10% en Tanzania y 7,9% en Ruanda).
La TB neonatal puede ser el resultado de una infección intrauterina o en el canal del parto (TB congénita) o de una transmisión aérea desde la madre u otras fuentes de contagio en los primeros días de vida (TB posnatal)7. La importancia de diferenciar entre TB congénita o posnatal conlleva implicaciones epidemiológicas, en cuanto a la identificación de la fuente de contagio, pero no en el tratamiento, que es el mismo para ambas entidades.
Diagnóstico de la tuberculosis en el embarazoA partir de la segunda mitad del siglo xx, la mayoría de estudios demostraron que ni la gestación ni el puerperio influían sobre la progresión de la TB o el paso de ITBL a TB activa8–11. No obstante, estudios recientes indican que los cambios inmunológicos que ocurren durante la gestación y el puerperio pueden incrementar la susceptibilidad para la ITBL o la reactivación de la enfermedad3,12. Es, por tanto, importante considerar la posibilidad de TB gestacional, especialmente en las gestantes que pertenecen a grupos de riesgo (infectadas por el VIH, inmunodeprimidas, inmigrantes procedentes de países endémicos), ya que la TB activa no tratada es una causa importante de morbimortalidad materna y se asocia a un mayor riesgo de aborto, retraso de crecimiento intrauterino, prematuridad y muerte fetal3. Sin embargo, el diagnóstico clínico es complicado, ya que los síntomas pueden ser inespecíficos, hay más frecuencia de formas extrapulmonares, mayor tasa de anergia a la tuberculina y suele haber retraso en la realización de pruebas radiológicas.
Cribado de la tuberculosis durante la gestaciónÚnicamente está indicado en pacientes con riesgo elevado de desarrollar la enfermedad durante el embarazo y que por tanto se beneficiarían de un tratamiento inmediato3,10,13,14. Esto incluiría a las gestantes con un cuadro clínico compatible y a aquellas expuestas a un caso de TB bacilífera. También está indicado en las embarazadas con factores de riesgo de progresión a formas activas si no se ha realizado el cribado antes de la gestación (tabla 1). Un test diagnóstico positivo obliga a realizar una radiografía de tórax para investigar formas activas de la enfermedad y a descartar coinfección por el VIH. A la inversa, un test positivo para VIH durante el embarazo obliga a realizar cribado de TB.
Indicaciones de diagnóstico de infección tuberculosa durante la gestación
| Sospecha clínica de enfermedad |
| Sospecha de infección recientea: contacto con caso de tuberculosis bacilífera |
| Riesgo de progresión a forma activab: infección VIH, inmunosupresión, UDVPc, residencia en condiciones de hacinamiento y marginación social |
En caso de contacto reciente y PT o prueba de la producción de interferón gamma (IGRA) negativas es recomendable repetir la prueba a las 8-12 semanas15.
Es la prueba estándar para el diagnóstico de la infección tuberculosa y su utilización durante el embarazo se considera válida y segura10,13. El antígeno que se utiliza es el purified protein derivate (PPD) y en España se emplea la variante RT-23. Se realiza una inyección intradérmica de 2UT en la cara ventral del antebrazo y la lectura se realiza a las 48-72 h. Se debe medir el diámetro transversal de la induración. En España la prueba se considera positiva cuando es ≥ 5mm en las personas que no han sido vacunadas con BCG15. En pacientes inmunodeprimidas (infectadas por el VIH, trasplantadas, en tratamiento con corticoides) puede haber menor respuesta y se acepta como positiva cualquier induración de la PT15. En las personas vacunadas no se ha establecido un dintel claro, ya que no es posible descartar el efecto de la vacuna. Sin embargo, se considera que en los colectivos con elevado riesgo de enfermar (contacto con paciente bacilífero, lesiones residuales en la radiografía de tórax con bacteriología negativa, infección por VIH) no debe tenerse en cuenta el antecedente de vacunación y se debe interpretar también como positiva una prueba de tuberculina (PT) ≥ 5mm.
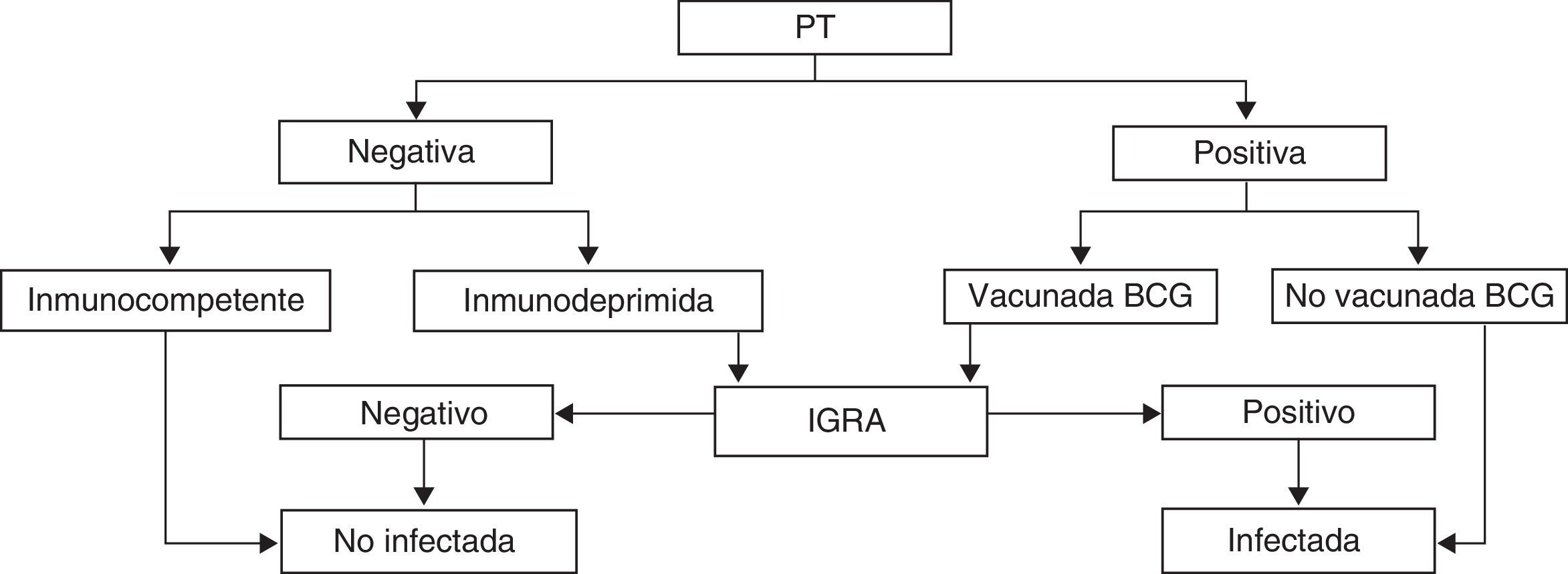
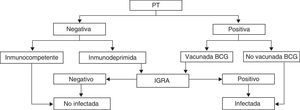
Pruebas de determinación de la producción de interferón gammaRecientemente se han desarrollado técnicas de detección del interferón gamma en sangre (interferon gamma release assay [IGRA]) que se libera como respuesta a la estimulación de las células T sensibilizadas con antígenos específicos de M. tuberculosis. Las 2 técnicas IGRA comerciales disponibles para el diagnóstico de la infección tuberculosa miden la cantidad de IFN-γ (QuantiFERON-TB-Gold®-In tube) o el número de linfocitos que lo producen (T-SPOT.TB®). Estas técnicas no interfieren con la vacunación BCG y presentan una mayor sensibilidad que la PT en inmunodeprimidos15. Tienen además la ventaja de no requerir una segunda visita para su interpretación. Son técnicas más costosas, pero su uso se ve compensado por una disminución en los falsos positivos de la PT y, por tanto, en la necesidad de radiografías de tórax y de tratamiento, lo que es especialmente importante durante la gestación. Los CDC las consideran una alternativa a la PT, especialmente en pacientes vacunados o con seguimiento difícil16. Las técnicas IGRA se consideran seguras en el embarazo y probablemente son tan efectivas para el diagnóstico de la ITBL como fuera de la gestación, pero han sido escasamente evaluadas y con resultados contradictorios17,18. No obstante, las opiniones recientes de los expertos recomendarían su utilización en pacientes seleccionadas igual que fuera de la gestación3,19. Sus principales indicaciones serían las gestantes sin factores de riesgo, con PT positiva y antecedente de vacunación BCG y las embarazadas inmunodeprimidas con sospecha clínica de TB y PT negativa20 (fig. 1).
Algoritmo de utilización de la prueba de tuberculina (PT) y técnicas de determinación del interferón gamma (IGRA) para el diagnóstico de la infección tuberculosa durante la gestación (adaptación para la gestante de la propuesta de la SEPAR para la población general20).
El estudio radiológico se realizará con protección abdominal adecuada, ante un resultado positivo de la PT o IGRA y en casos con sintomatología característica (hemoptisis, tos persistente de más 3 semanas, fiebre de origen desconocido). Los hallazgos radiológicos son superponibles a los encontrados fuera de la gestación.
Diagnóstico microbiológicoLas técnicas diagnósticas que se realizan durante el embarazo no difieren de las que se realizan en el resto de población adulta10.
- -
Microscopia o baciloscopia. Son técnicas de tinción (Ziehl-Neelsen, auramina-rodamina) que permiten la identificación del bacilo de forma rápida y sencilla. Deben estudiarse siempre al menos 3 muestras de esputo. Una muestra respiratoria positiva indica TB activa, pero una baciloscopia negativa nunca descarta la enfermedad. La baciloscopia permite realizar el seguimiento de la eficacia del tratamiento15.
- -
Cultivo. En toda gestante con sospecha de TB se debe realizar un cultivo para micobacterias que es la prueba de referencia. Permite identificar la especie y realizar estudios de resistencia a los fármacos antituberculosos. Tiene el inconveniente de que son necesarias de 2 a 4 semanas para obtener el resultado definitivo. La negativización del cultivo durante el tratamiento (2 muestras negativas consecutivas en un periodo de 2 meses) es el principal criterio de curación microbiológica3,15.
- -
Técnicas moleculares. Reacción en cadena de la polimerasa (PCR). Se basan en la amplificación de fragmentos genéticos de M. tuberculosis. Muestran alta especificidad y una sensibilidad algo mayor que los cultivos, siendo su principal ventaja que los resultados están disponibles en pocas horas. El sistema Gene-Xpert® MTB/RIF permite además detectar mutaciones relacionadas con la resistencia a rifampicina, que suele ser un marcador de multirresistencia. Las nuevas técnicas de diagnóstico molecular permiten la detección simultánea de mutaciones de resistencia a isoniazida y rifampicina y a fármacos de segunda línea para la identificación de cepas multirresistentes y extremadamente resistentes. El coste de las técnicas moleculares es alto, por lo que se utilizan como técnicas complementarias en casos con elevada sospecha de infección activa o de resistencia farmacológica15.
- -
Exposición a tuberculosis. Gestante asintomática con contacto conocido y PT/IGRA negativos.
- -
Infección tuberculosa latente. Gestante asintomática con PT o IGRA positivo y radiografía de tórax normal. Puede tener factores de riesgo de progresión a TB activa si cumple alguno de los criterios recogidos en la tabla 1.
- -
Enfermedad tuberculosa: Embarazada con clínica compatible, alteraciones radiológicas sugestivas y PT/IGRA positivo o identificación de M. tuberculosis en una muestra clínica. En la gestante, algunos signos específicos de la enfermedad pueden quedar enmascarados (anorexia, pérdida de peso) o se pueden confundir con la propia sintomatología del embarazo (malestar general, astenia, cansancio)3,21. Además, la presentación de la enfermedad puede cursar de forma atípica, con un incremento de las formas extratorácicas que dificulta el diagnóstico. La TB genital suele ser silente o cursar con síntomas inespecíficos (dolor abdominal o pélvico, trastornos menstruales) y es una causa frecuente de esterilidad de causa tubárica en países en vías de desarrollo. Se debe pensar en ella antes de iniciar un tratamiento de reproducción asistida en mujeres con esterilidad de causa tubárica, especialmente en inmigrantes procedentes de países con alta endemia de TB. Por otro lado, siempre que se diagnostique una TB congénita en un recién nacido y la madre se encuentre asintomática, hay que pensar en una posible TB genital materna y descartarla mediante estudio endometrial.
Se produce únicamente cuando la madre desarrolla enfermedad activa durante el embarazo, si bien esta puede ser silente (especialmente en la TB genital) o manifestarse tras el parto22. La tasa de transmisión fetal oscila entre el 0 y el 16%, siendo excepcional cuando la madre tiene TB exclusivamente pulmonar y ha recibido un tratamiento correcto antes del parto y más frecuente en las formas miliares y del tracto genital23,24. Es una enfermedad rara, con menos de 300 casos publicados en la literatura científica, y su frecuencia es inferior a la de la TB posnatal. En un estudio realizado en el Hospital Universitario La Paz sobre 343 niños con TB diagnosticados durante un periodo de 24 años (1988-2011), se identificaron 6 casos de TB congénita, lo que representa un 1,75% de las TB en edad pediátrica25.
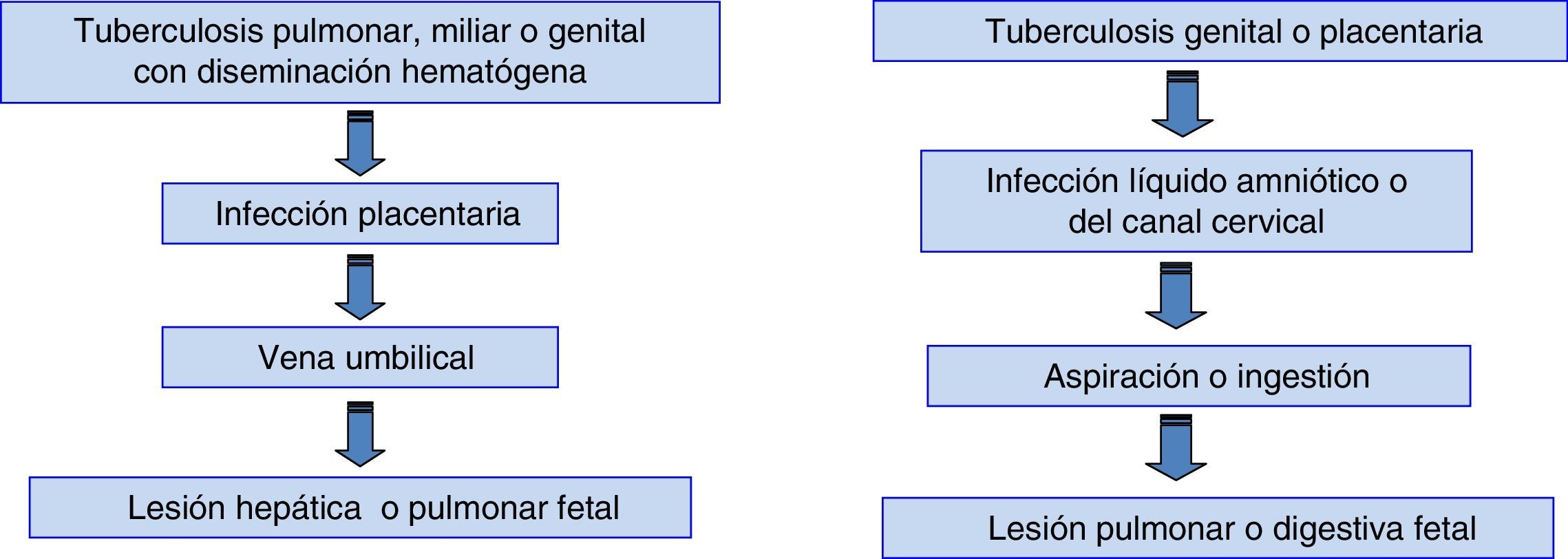
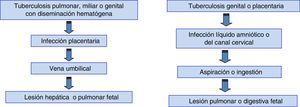
Vías de transmisiónLas vías de transmisión de la infección y la localización de las lesiones se recogen en la figura 2. Cada una de estas vías es responsable de aproximadamente el 50% de los casos10. La única lesión neonatal patognomónica de TB congénita es la presencia de complejo primario con granulomas caseificantes en el hígado26.
ClínicaLa TB congénita debe sospecharse en todo recién nacido hijo de madre con historia gestacional de TB diseminada o extrapulmonar o con TB activa en el parto o en el puerperio, aunque la exploración física al nacimiento sea normal27. La infección intrauterina puede causar abortos espontáneos, pero no se han descrito alteraciones fetales. La aparición de síntomas durante la primera semana de vida es diagnóstica, pero lo más frecuente es que se inicien en la segunda o tercera semana, a pesar de que existen casos de inicio tardío (hasta los 3 meses de vida)26. Son frecuentes la prematuridad y el bajo peso para la edad gestacional. En la mayoría de casos existe afectación pulmonar, y con frecuencia se produce diseminación miliar, con afectación hepatoesplénica y del sistema nervioso central (tabla 2)7. La mortalidad es elevada, en torno al 50%, condicionada por las dificultades para el diagnóstico y la escasa sospecha clínica10. El pronóstico es mejor en aquellos casos con tratamiento precoz22.
Manifestaciones clínicas sugestivas de tuberculosis en el neonato
| – Neumonía con patrón miliar, nodular, intersticial o adenopático con empeoramiento clínico progresivo a pesar de antibioterapia de amplio espectro |
| – Hepatoesplenomegalia, lesiones focales hepatoesplénicas, distensión abdominal, adenopatías, o ascitis de etiología no filiada |
| – Meningitis de predominio linfocitario con hipoglucorraquia e hiperproteinorraquia o focalidad neurológica de causa no aclarada, especialmente con parálisis de pares craneales |
| – Sepsis con cultivos negativos y evolución desfavorable a pesar de tratamiento antibiótico |
| – Sintomatología inespecífica prolongada y de causa no aclarada (tos pertusoide, dificultad respiratoria progresiva, otorrea persistente, ictericia, pausas de apnea, letargia o irritabilidad, estancamiento ponderal, rechazo de tomas), especialmente asociada a febrícula o fiebre persistente, leucocitosis con desviación izquierda y aumento de reactantes de fase aguda |
Actualmente se emplean los propuestos por Cantwell en 199426, que se basan en la presencia de TB confirmada microbiológicamente en el recién nacido o lactante (PCR o cultivo) y al menos uno de los siguientes:
- 1.
Aparición de los síntomas en la primera semana de vida.
- 2.
Demostración de complejo primario o granulomas caseificantes en el hígado.
- 3.
Infección de la placenta o del tracto genital materno.
- 4.
Exclusión de transmisión posnatal con investigación minuciosa de los contactos (incluyendo personal de maternidad).
Es el mismo que el de la TB posnatal.
Diagnóstico de la tuberculosis en el recién nacidoAnamnesisLa TB neonatal requiere un alto índice de sospecha ya que la presentación clínica suele ser atípica y tiene una elevada morbimortalidad. Los antecedentes de ITBL o TB durante el embarazo o posparto son de enorme importancia como apoyo diagnóstico7. En ausencia de antecedentes maternos, se debe realizar una anamnesis detallada sobre la presencia de síntomas constitucionales o tos productiva en la familia, e interrogar sobre casos cercanos de neumonía, sepsis o meningitis con cultivos bacterianos negativos28.
Manifestaciones clínicasLa clínica de la TB neonatal es variada e inespecífica (tabla 2). Los neonatos con clínica sospechosa y aquellos con antecedentes epidemiológicos de TB confirmada deben ingresar para estudio.
Pruebas diagnósticas (tabla 3)Primer nivel- -
Estudio microbiológico y anatomopatológico de la placenta y líquido amniótico. Es muy útil como prueba diagnóstica de infección congénita, y debe realizarse siempre que exista el antecedente de TB materna durante el embarazo. La infección de la placenta no es suficiente para hacer el diagnóstico, ya que incluso en presencia de corioamnionitis masiva no se produce siempre infección fetal10.
Tabla 3.Pruebas diagnósticas en el recién nacido
Primer nivel 1. Hemograma, bioquímica, proteína C reactiva 2. Prueba de tuberculina 3. Fondo de ojo 4. Técnica interferon gamma release assay (IGRA) - Quantiferon®-TB-Gold In-Tube - T-SPOT®.TB 5. Radiografía de tórax (TC torácica si dudas diagnósticas) 6. Ecografía abdominal 7. Jugos gástricos (x3) para PCR, BK y cultivo inmediatos 8. Estudio anatomopatológico y microbiológico de placenta y líquido amniótico si hay antecedente de tuberculosis gestacional Segundo nivel 1. Líquido cefalorraquídeo (citotoquímico, ADA, PCR, BK y cultivo) 2. Ecografía cerebral/RM cerebral 3. Otras pruebas invasivas (broncoscopia, biopsia tisular) si anteriores no concluyentes y fuerte sospecha clínica ADA: adenosin deaminasa; BK: baciloscopia; PCR: reacción en cadena de la polimerasa; RM: resonancia magnética; TC: tomografía computarizada;
- -
Hemograma y bioquímica con función hepática. Suele aparecer alteración de las 3 series con leucocitosis a expensas de neutrófilos, anemia y trombocitopenia. Desde el punto de vista bioquímico se observa hipertransaminasemia y elevación de la proteína C reactiva22.
- -
Prueba de tuberculina. Habitualmente es negativa en el primer mes de vida7,22, pero hasta en un 20% de neonatos puede ser positiva, un dato que es muy útil para el diagnóstico.
- -
Fondo de ojo. En la TB diseminada pueden apreciarse tubérculos coroideos29.
- -
Interferon gamma release assays (IGRA). En recién nacidos y lactantes pequeños la inmadurez del sistema inmune condiciona una menor producción de interferón en respuesta a los estímulos antigénicos30. Existen pocos datos sobre la rentabilidad diagnóstica de los IGRA en neonatos, pero parecen tener buena especificidad, menor sensibilidad y mayor tasa de resultados indeterminados que en niños mayores31,32. No obstante, al igual que en otras poblaciones, parece que su sensibilidad es superior a la de la PT y pueden positivarse antes del inicio de la clínica. Se han descrito resultados positivos tanto en casos de TB neonatal como en el estudio de contactos de recién nacidos expuestos a TB33,34. Tanto la PT como los IGRA deberán repetirse a las 12 semanas si el resultado inicial es negativo35.
- -
Jugos gástricos. Se debe realizar PCR, baciloscopia y cultivo en 3 muestras en ayunas en días consecutivos, que deberán procesarse de inmediato. En el recién nacido intubado se obtendrá muestra de aspirado traqueal. En la TB congénita la carga bacilar es mayor, por lo que la rentabilidad de las técnicas diagnósticas rápidas y del cultivo es mayor que en la TB posnatal. Las técnicas de diagnóstico molecular por PCR permiten realizar un diagnóstico precoz y detectar simultáneamente si existen mutaciones de resistencia a isoniazida y rifampicina36.
- -
Radiografía de tórax. Es patológica en la mayoría de los casos, presentando la mitad de pacientes un patrón miliar, aunque puede haber formas intersticiales, nodulares o adenopáticas. En algunos casos es normal inicialmente, pero sin tratamiento se observa una rápida progresión radiológica22. Si la radiografía es normal pero existe una alta sospecha clínica o un contacto muy íntimo, se debe valorar la realización de TC torácica37.
- -
Ecografía abdominal. Se puede observar hepatoesplenomegalia, lesiones nodulares múltiples en hígado y bazo, adenopatías mesentéricas y ascitis22.
Una vez que se han realizado las pruebas diagnósticas de primer nivel, si el caso es muy sugestivo o se ha confirmado la infección debe completarse el estudio realizando punción lumbar y ecografía cerebral. La afectación meníngea está presente en el 20-30% de las TB neonatales22, por lo que debe solicitarse estudio citoquímico, tinción, cultivo y PCR para M. tuberculosis en líquido cefalorraquídeo. En caso de afectación del sistema nervioso central, la ecografía o resonancia magnética cerebral pueden demostrar ventriculomegalia, engrosamiento y calcificaciones meníngeas, tuberculomas e infartos38. En casos de alta sospecha y diagnóstico no concluyente, puede ser necesaria la realización de pruebas invasivas (broncoscopia, biopsia transbronquial, hepática o adenopática) para confirmar el diagnóstico39.
Diagnóstico diferencialDada la inespecificidad de la clínica, es preciso el diagnóstico diferencial con la sepsis bacteriana, la neumonía neonatal (virus, bacterias, Candida, P. jirovecii)10 y otras infecciones de transmisión vertical (toxoplasmosis, citomegalovirus, rubeola, herpes, VIH)28.
Estudio de contactosSi la madre no ha tenido TB documentada durante el embarazo, y el niño se diagnostica en el primer mes de vida, debe hacerse PT y radiografía de tórax a la madre. Se realizará biopsia endometrial en caso de PT positiva, radiografía de tórax normal y ausencia de contacto familiar conocido (especialmente indicada en casos de fecundación in vitro por esterilidad tubárica). Si se descarta TB materna debe realizarse un estudio exhaustivo de TB en el medio familiar que incluya PT, radiografía de tórax y baciloscopia de esputo si hay alteraciones radiológicas sugestivas. En caso de negatividad del estudio familiar, debe ampliarse el estudio a los contactos extrafamiliares conocidos del lactante, incluyendo al personal sanitario40.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ana Alarcón Allen, Servicio de Neonatología, Hospital Universitari Sant Joan de Déu, Esplugues de Llobregat, Barcelona y Unidad de Neonatología, Oxford University Hospitals NHS Trust, Reino Unido; Fernando Álvez González, Unidad de Infectología y Vacunas, GENVIP, Hospital Clínico Universitario Santiago de Compostela, La Coruña; Fernando Baquero-Artigao, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; Daniel Blázquez Gamero, Sección de Inmunodeficiencias y Niños Pequeños, Servicio de Pediatría, Hospital 12 de Octubre, Madrid; Marta Cabrera Lafuente, Servicio de Neonatología, Hospital La Paz, Madrid; José Antonio Couceiro Gianzo, Unidad de Infectología, Servicio de Pediatría, Complexo Hospitalario de Pontevedra; María de la Calle Fernández-Miranda, Unidad de Tocología de Alto Riesgo, Servicio de Obstetricia y Ginecología, Hospital La Paz, Madrid; Teresa del Rosal Rabes, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; Claudia Fortuny Guasch, Unidad de Infecciones, Servicio de Pediatría, Hospital Sant Joan de Déu, Universitat de Barcelona, Esplugues de Llobregat, Barcelona; Anna Goncé Mellgren, Servicio de Medicina Maternofetal, Institut Clínic de Ginecologia, Obstetrícia i Neonatologia, Hospital Clínic, Barcelona; Teresa Hernández-Sampelayo Matos, Sección de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Gregorio Marañón, Madrid; Andrea Martín-Nalda, Unidad de Patología Infecciosa e Inmunodeficiencias de Pediatría, Hospital Materno-Infantil Vall d’Hebron, Barcelona; Leticia Martínez Campos, Unidad de Infectología Pediátrica, Hospital La Inmaculada de Huercal Overa, AGS Norte de Almería; María José Mellado Peña, Servicio de Pediatría, Enfermedades Infecciosas y Patología Tropical, Hospital Infantil La Paz, Madrid; María Méndez Hernández. Servicio de Pediatría, Unidad de Enfermedades Infecciosas e Inmunología Clínica, Hospital Universitario Germans Trias i Pujol, Universidad Autónoma de Barcelona; David Moreno Pérez, Unidad de Infectología, Hospital Materno-Infantil Carlos Haya, Málaga; María Luisa Navarro Gómez, Sección de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Gregorio Marañón, Madrid; Antoni Noguera Julián, Unidad de Infecciones, Servicio de Pediatría, Hospital Sant Joan de Déu, Universitat de Barcelona, Esplugues de Llobregat, Barcelona; Félix Omeñaca Teres, Servicio de Neonatología, Hospital La Paz, Madrid; José Tomás Ramos Amador, Servicio de Pediatría, Hospital Clínico San Carlos, Madrid.