Introducción
El síndrome de apneas-hipopneas del sueño (SAHS) es un problema muy frecuente en los niños que hasta los últimos años ha sido poco reconocido. El SAHS infantil difiere del SAHS del adulto, tanto en su etiología como en sus manifestaciones clínicas, diagnóstico y tratamiento. Se ha comprobado que el SAHS produce complicaciones importantes en los niños que lo padecen que pueden evitarse con un tratamiento adecuado. Desgraciadamente los pediatras con frecuencia no reconocen esta patología por lo que está muy infradiagnosticada e infratratada en los niños de nuestro país. Por este motivo la Sociedad Española de Neumología Pediátrica, a través de su Grupo de Trabajo de Técnicas, nos ha encomendado la tarea de realizar esta guía que pretende ser una herramienta sencilla para que el pediatra conozca más a fondo este problema, lo que esperamos redundará en beneficio de los niños que lo sufren y sus familias.
Definición y prevalencia
El SAHS es un trastorno respiratorio durante el sueño (TRS) caracterizado por una obstrucción parcial prolongada de la vía aérea superior y/u obstrucción intermitente completa que interrumpe la ventilación normal durante el sueño y los patrones normales del mismo 1.
Su prevalencia no es bien conocida pues no existen estudios epidemiológicos suficientemente amplios que hayan utilizado una técnica diagnóstica adecuada. La prevalencia de su síntoma principal, el ronquido, es muy variable según las distintas series publicadas: entre el 7 y el 16,7 % en niños desde 6 meses hasta 13 años de edad 2,3 y entre 5 y 14,8 % en adolescentes 4-6. La prevalencia del verdadero SAHS se estima en alrededor del 2-3 % 2,7 de los niños o incluso algo mayor 8. Parece ser similar en niños que en niñas 9 y máxima en la edad preescolar coincidiendo con el momento en que el tejido linfoide del anillo de Waldeyer es mayor en relación al tamaño de la vía aérea.
No se conoce la historia natural ni el pronóstico a largo plazo del SAHS pediátrico no tratado. Se ha descrito la existencia de recurrencias en adolescentes que tuvieron SAHS durante la infancia y fueron tratados con éxito mediante adenoamigdalectomía 10. Los niños con esta patología tienen mayor probabilidad de recaer cuando son adultos si adquieren factores de riesgo como obesidad o ingestión de alcohol. Por otro lado, los niños con ronquido primario no tienden a progresar a SAHS con el tiempo 11.
Fisiopatología
La faringe es colapsable para permitir la fonación y la deglución. Las funciones de la faringe como son deglutir, proteger la vía aérea y mantenerla abierta, se logran por la acción de varios grupos musculares que actúan de forma coordinada. Durante la inspiración se produce una presión negativa intensa que favorece el colapso de los tejidos hacia el interior que se contrarresta por la acción de los músculos dilatadores de la faringe. Las alteraciones de la función faríngea pueden aparecer tanto por factores anatómicos que provoquen un aumento de la resistencia de la vía aérea superior como por factores neurológicos que impidan el funcionamiento normal de los músculos dilatadores. El sueño es el factor funcional más evidente que predispone al SAHS. Durante su fase REM (rapid eye movement) se produce una reducción tan marcada de la actividad de los músculos que mantienen la vía aérea permeable, que el SAHS pediátrico podría considerarse una enfermedad de la fase REM del sueño 12.
Los factores predisponentes más frecuentes para el SAHS en niños se expresan en la tabla 1. La causa más frecuente es la hipertrofia del tejido linfoide amigdalar y adenoideo. Sin embargo, la gravedad del SAHS no está siempre en relación con el tamaño de las amígdalas o de las adenoides 13 y muchos niños con importante hipertrofia adenoamigdalar no tienen patología respiratoria durante el sueño. La hipertrofia adenoamigdalar, por sí sola, no es suficiente para producir SAHS. Deben coexistir otros factores como alteraciones anatómicas de la vía aérea superior o alteraciones en el control de la ventilación durante el sueño.
Los cuadros que producen obstrucción nasal marcada como la rinitis alérgica también pueden favorecer el SAHS.
Varios rasgos craneofaciales condicionan con frecuencia la existencia del SAHS infantil. Los niños con barbilla pequeña y triangular, con retrognatia, facies larga y estrecha, paladar duro elevado, paladar ojival o paladar blando alargado, tienen con más frecuencia alteraciones respiratorias durante el sueño.
Los niños con malformaciones craneofaciales pueden tener alteraciones como obstrucción nasal, malformación de la base craneal o del macizo facial central, macroglosia e hipoplasia de la mandíbula inferior, que provocan obstrucción de la vía aérea superior y se relacionan con frecuencia con SAHS. Los niños con hipoplasia nasofaríngea secundaria a malformaciones de la base craneal o del macizo facial medio, como ocurre en los síndromes de Apert o Crouzon o en el síndrome de Down, tienen un espacio faríngeo muy reducido y pueden sufrir una obstrucción importante, incluso con amígdalas y adenoides de tamaño relativamente normal. Entre el 30 y el 45 % de los niños con síndrome de Down tienen SAHS y muy frecuentemente se encuentra este problema aún no existiendo sospecha clínica 14.
En los pacientes con enfermedades neuromusculares en los que aparece hipotonía o parálisis de los músculos dilatadores de la faringe se produce también con más frecuencia SAHS.
La obesidad, uno de los factores más frecuentemente relacionado con el SAHS en adultos, es sin embargo poco frecuente en niños con esta patología, aunque podría ser importante en los adolescentes cuyo patrón de la enfermedad recuerda más al SAHS del adulto 5.
Manifestaciones clínicas
Las manifestaciones clínicas de los trastornos respiratorios del sueño pueden variar desde el ronquido nocturno simple a formas graves del SAHS.
El síntoma guía es el ronquido; su ausencia prácticamente descarta la existencia de un SAHS pero su presencia no indica necesariamente la existencia del mismo. Hablamos de ronquido primario o ronquido simple cuando éste no se acompaña de alteraciones polisomnográficas (apneas-hipopneas, desaturaciones, hipercapnias o fragmentación del sueño) 15.
Aunque el ronquido primario suele resolverse con el tiempo en un porcentaje superior al 50 % 16, en el momento actual se cuestiona su inocuidad, ya que se ha encontrado asociación entre éste y trastornos neurocognitivos (falta de atención, hiperactividad, problemas de conducta o rendimiento escolar, episodios prolongados de taquicardia, concentraciones de hemoglobina mayores y secreción anormal de hormona de crecimiento) 8,17-21. Sólo un subgrupo de los niños roncadores presenta SAHS, y generalmente tienen otros síntomas además del ronquido (tabla 2).
Síntomas nocturnos
Los síntomas nocturnos observados habitualmente por los padres o cuidadores son, además del ronquido: aumento del esfuerzo respiratorio (incluyendo movimientos paradójicos de la caja torácica), apneas o pausas respiratorias, normalmente precedidas de un esfuerzo ventilatorio creciente y que pueden seguirse de un movimiento o un despertar, sueño intranquilo no reparador y posturas anormales para dormir (cuello en hiperextensión, o incluso la cabeza colgando fuera de la cama, posición prono con las rodillas bajo el abdomen) para mantener permeable la vía aérea. El mayor esfuerzo respiratorio conlleva un aumento del gasto energético que se ha asociado a sudoración profusa, muy frecuente en estos niños.
El incremento de la presión negativa intratorácica, secundaria a la obstrucción de la vía aérea superior, favorece el reflujo gastroesofágico (RGE) que puede manifestarse como náuseas o vómitos durante el sueño y ocasionalmente como despertares con ansiedad y sensación de disnea 22.
En ocasiones los padres refieren enuresis, que aunque es un síntoma relativamente frecuente en niños y que en la mayoría de los casos no está relacionado con SAHS, cuando coexisten ambas patologías, a veces se resuelve tras el tratamiento del SAHS 23,24.
Se describen mayor frecuencia de parasomnias, como pesadillas, bruxismo, terrores nocturnos o sonambulismo en estos pacientes 25.
Síntomas diurnos
Los síntomas diurnos más frecuentes son los propios de la obstrucción de la vía aérea superior secundaria a la hipertrofia adenoamigdalar o a la rinitis como la respiración bucal y ruidosa durante el día 22 que se agrava durante las infecciones respiratorias de vías altas.
Los niños con SAHS habitualmente no presentan somnolencia diurna como ocurre en los adultos, probablemente porque, en la edad pediátrica, la mayoría de los episodios respiratorios no son seguidos de un despertar, y en consecuencia tienen el sueño menos fragmentado. Los adolescentes con SAHS sí pueden manifestarse con hipersomnolencia diurna pero hay que tener en cuenta que este síntoma es muy frecuente en los adolescentes sanos 5 y generalmente debido a otras causas. En general, los niños presentan síntomas de somnolencia diurna por una de tres razones: a) no duermen el tiempo que necesitan; b) la calidad del sueño es mala (mayor fragmentación del sueño), en este grupo estaría incluido el SAHS, o c) la necesidad del sueño está incrementada (mayor impulso del sueño), en este grupo se incluiría la narcolepsia.
Pueden presentarse cefaleas tanto en el ronquido primario como en las formas más graves del SAHS.
En algunos casos, los niños pueden tener alteraciones de conducta y del carácter, como agresividad e hiperactividad, pudiendo mostrar conductas antisociales o incluso desarrollar un síndrome de déficit de atención-hiperactividad 26.
En niños con epilepsia y SAHS puede haber un aumento de las crisis debido a la fragmentación y privación crónica de sueño.
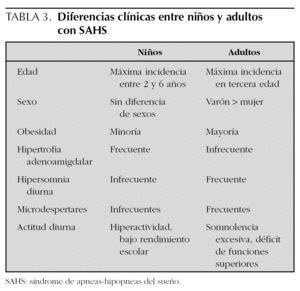
En la tabla 3 se resumen las diferencias clínicas del SAHS infantil con el del adulto.
Consecuencias del SAHS en los niños
No se conoce suficientemente la prevalencia de las complicaciones del SAHS en los niños pues la mayoría de los estudios son series retrospectivas o están realizados sin grupo control 27,28.
Las consecuencias del SAHS en el niño pueden ir desde una disminución del rendimiento escolar, problemas de comportamiento o somnolencia diurna, hasta complicaciones más serias como hipertensión arterial, insuficiencia cardíaca, retraso del desarrollo psicomotor o falta de crecimiento. Se cree que la mayoría de las complicaciones son consecuencia de las desaturaciones nocturnas o de la desestructuración del sueño como consecuencia de los despertares, aunque no existe mucha información sobre la relación entre el grado de severidad del SAHS y los síntomas/complicaciones de esta entidad. Se admite en general, que cualquier grado de hipoxia nocturna es perjudicial para un niño en pleno desarrollo neuropsicológico 29.
Alteraciones cardiovasculares
Se ha descrito la existencia de hipertrofia y alteración de la función ventricular en niños y adolescentes con SAHS relacionada directamente con la gravedad de las apneas, mejorando dicha función ventricular tras el tratamiento 30-33. Estas manifestaciones se describen hoy día con menor frecuencia debido a un diagnóstico más precoz 34.
Los niños con apnea obstructiva del sueño presentan más frecuentemente presión arterial diastólica elevada tanto durante el sueño como en las horas de vigilia 30,34. Las cifras de presión arterial se correlacionan positivamente con la gravedad del SAHS. Los niños con ronquido primario no tienen alteraciones de la presión arterial cuando se comparan con niños no roncadores 35.
Alteraciones neuroconductuales
Los niños con trastornos del sueño, desde el ronquido simple hasta el SAHS tienen una mayor prevalencia de problemas de conducta, hiperactividad, labilidad emocional e incluso agresividad 7,36. Por otro lado, también se han objetivado trastornos del sueño en un porcentaje elevado de niños con problemas de conducta 18,19.
En niños en edad escolar se ha observado que los TRS también pueden provocar déficit neurocognitivos como alteraciones de la memoria, hiperactividad y déficit de atención, problemas de relación social y disminución del rendimiento intelectual y escolar 37. Probablemente roncar en los primeros años de vida tiene repercusiones sobre el rendimiento escolar incluso en la adolescencia. Los niños con peor rendimiento escolar a los 14 años tienen más probabilidad de haber roncado o haber precisado adenoamigdalectomía que los niños con mejor rendimiento escolar 21. La mejoría de algunos de estos trastornos se ha comprobado tras la adenoamigdalectomía 38,39.
Los niños con SAHS pueden tener una menor calidad de vida 40 y más síntomas depresivos que los del grupo control 41. Incluso la apnea leve puede afectar a la calidad de vida de los niños 42 que mejora tras el tratamiento del SAHS 43,44. Sin embargo, la validez y generalización de estos datos es limitada, dado el diseño de los estudios y la selección de los pacientes.
Alteraciones del crecimiento
En los primeros casos descritos de SAHS se encontraron cifras elevadas de niños con retraso de crecimiento 45, aunque este hallazgo es hoy en día inusual 34. Algunos estudios han demostrado aumento de la velocidad de crecimiento tras adenoamigdalectomía incluso en niños con talla previamente normal 46,47.
Existen distintos factores que pueden influir en la alteración del crecimiento: falta de ingesta calórica debido a la hipertrofia adenoamigdalar, incremento del gasto calórico por el esfuerzo respiratorio durante el sueño, liberación reducida de la hormona de crecimiento debido a la fragmentación del sueño y resistencia periférica a los factores de crecimiento. La secreción de hormona de crecimiento medida por concentraciones del factor de crecimiento tipo insulina (IGF-1) y proteína 3 de unión de IGF (IGFBP-3) está alterada en niños con SAHS. Todo ello puede mejorar con el tratamiento del SAHS 46.
Diagnóstico del SAHS pediátrico
Historia clínica y examen físico
Historia clínica
El diagnóstico del SAHS se fundamenta en una historia clínica compatible confirmada mediante una serie de exploraciones complementarias y que permiten diferenciar al roncador simple del SAHS. En muchos casos permitirán también acercarse a un diagnóstico etiológico y plantear un tratamiento adecuado. La historia clínica debe ser lo más sistemática y precisa posible, aunque por sí misma es poco fiable para confirmar la existencia y gravedad del SAHS 48,49, precisándose de las otras pruebas diagnósticas para su confirmación.
Anamnesis. Hay que interrogar sobre la frecuencia e intensidad del ronquido, de las apneas y de los otros síntomas ya referidos anteriormente (tabla 2). El ronquido más frecuentemente asociado al SAHS es el que se acompaña de ruidos intensos, asfícticos y sonidos entrecortados. Las apneas suelen describirse como pausas respiratorias precedidas de un esfuerzo ventilatorio creciente, que suelen terminar con un despertar o sonidos asfícticos, e incluso con movimientos de todo el cuerpo. No obstante, la ausencia de apneas referidas por los padres no descarta el SAHS por lo que en los niños roncadoreshabrá que buscar otros síntomas sugestivos de la enfermedad 8,11,17-21,50
Se han desarrollado cuestionarios clínicos para determinar qué niños tienen más probablemente SAHS 51 pero estudios posteriores han demostrado que son de escasa utilidad 52-54.
La hipersomnolencia diurna es excepcional en la infancia aunque más frecuente en la adolescencia 5, en caso de manifestarse puede cuantificarse mediante la escala de Epworth 55 más utilizada en adultos.
Antecedentes familiares. Se deberá investigar la existencia de otros casos de SAHS en la familia; existen estudios publicados de familias con múltiples miembros afectados de SAHS 56-59. Así mismo situaciones medioambientales o socioeconómicas desfavorables 60 o el hábito tabáquico familiar, sobre todo de la madre 61, tendrían importancia en el desarrollo del SAHS.
Antecedentes personales. A diferencia del adulto, el sexo no es un factor de riesgo. En la anamnesis deberá recogerse la existencia de hipertrofia adenoamigdalar y de otros factores de riesgo o predisponentes para el desarrollo de SAHS en la infancia (tabla 1).
En los niños con síndrome de Down hay que tener un alto índice de sospecha de SAHS debido a que presentan diversos factores predisponentes y a que sus padres con frecuencia no refieren los síntomas por considerarlos normales en éstos 62-64.
Examen físico
Se deben evaluar los valores antropométricos, incluidos talla, peso e índice de masa corporal buscándose escaso medro en niños pequeños y obesidad en adolescentes.
En la inspección se valorará también la existencia de respiración bucal, en especial si esta es habitual y ruidosa, y si se presenta sin coincidir con infecciones de vías aéreas superiores; por su alta asociación con SAHS 22. Sólo en casos muy graves o de diagnóstico tardío encontraremos signos secundarios a la hipoxemia crónica: cianosis, hipertensión pulmonar o cor pulmonale30,33.
La exploración por aparatos incluye una exploración otorrinolaringológica completa, valorándose el morfotipo facial tanto del maxilar superior como inferior, la existencia de micrognatia o retrognatia, así como de asimetrías. Se debe realizar exploración nasal buscando signos de rinitis, hipertrofia adenoidea, deformidades del tabique o poliposis. En la cavidad bucal se valorará la existencia de macroglosia y glosoptosis, así mismo se buscará hipertrofia y flacidez uvulopalatina, así como confirmar la existencia de hipertrofia amigdalar. Aunque la hipertrofia amigdalar es el principal factor de riesgo de padecer SAHS, no existe una relación directa entre el tamaño de las amígdalas en la exploración y la gravedad del SAHS 13. Se ha comprobado que existe una mejor correlación entre el índice apnea-hipopnea (IAH) y el tamaño amigdalar cuando este es valorado en la radiografía lateral de cráneo como la relación tamaño amigdalar/tamaño faríngeo 65 de forma que un índice amígdalas/faringe mayor de 0,48 tiene una sensibilidad del 95,8 % y una especificidad del 81,8 % para predecir un IAH > 10 66.
La exploración física de las estructuras craneofaciales se puede complementar con la realización de estudios de cefalometría para medir las estructuras faciales y cervicales (radiología simple, tomografía computarizada o resonancia magnética). Su indicación dependerá probablemente de la necesidad de recurrir a técnicas quirúrgicas complejas en el caso de no mejoría adecuada del SAHS tras adenoamigdalectomía o de malformaciones craneofaciales.
Si bien en algunos casos las exploraciones serán normales y con ello disminuirá la probabilidad de SAHS, el diagnóstico definitivo también en estos casos será mediante polisomnografía (PSG).
Polisomnografía
La PSG convencional es la prueba que registra simultáneamente y de manera continua las variables neurofisiológicas y cardiorrespiratorias durante el sueño 27,67. Los parámetros neurofisiológicos son necesarios para conocer si el niño está durmiendo en un momento determinado y en qué fase del sueño está, además permiten conocer la arquitectura del sueño y determinar la existencia de microdespertares electroencefalográficos. El sueño durante la prueba debe ser espontáneo, no inducido farmacológicamente. Los estudios de sueño en niños deben ser realizados en laboratorios específicamente diseñados para ellos, con personal de enfermería acostumbrado al manejo de los niños e interpretados por médicos con experiencia en patología del sueño infantil 67.
Parámetros neurofisiológicos
Para determinar el estado de sueño se precisan 2 canales de electroencefalografía, dos de electrooculografía para valorar los movimientos oculares y uno de electromiografía para valorar la actividad muscular (generalmente en musculatura submentoniana).
Parámetros cardiorrespiratorios
1.Electrocardiografía (ECG). Registra la frecuencia y ritmo cardíacos.
2.Flujo aéreo oronasal. Registra el flujo de aire a nivel de fosas nasales y boca mediante diversos dispositivos:
*Termistor. El flujo oronasal se registra por cambios de temperatura del aire inspirado y espirado.
*Cánula nasal 68. Registra el flujo por cambios de presión. Parece ser más sensible que el termistor para detectar las apneas y en particular las hipopneas en SAHS en niños. También tiene la ventaja de detectar en la curva de presión la limitación al flujo aéreo cuando existe un aumento de la resistencia de la vía aérea superior. Si el paciente respira por la boca se le tiene que asociar un termistor. Ambos deben estar en fase con los movimientos de las bandas torácicas y abdominales, con deflexión a la par.
3.Movimientos respiratorios. Se emplean bandas torácicas y abdominales para registrar el esfuerzo muscular en la respiración, si las bandas se encuentran en inversión de fase se puede tratar de respiración de tipo paradójico.
4.Pulsioximetría. Cuantifica las variaciones en la oxigenación asociadas a las apneas-hipopneas 69.
5.Micrófono. Detecta la intensidad del sonido del ronquido y su frecuencia.
Otras variables que se suelen incorporar
1.Detector de la posición corporal. Para valorar la existencia de episodios respiratorios en las diferentes posiciones.
2.Electrodos en el tibial anterior. Para evaluar los movimientos periódicos de miembros por su frecuente relación con el SAHS.
3.Capnografía. Permite valorar el síndrome de hipoventilación, pero no está generalizada su determinación en los estudios del sueño.
La PSG nocturna es el patrón oro para el diagnóstico del SAHS pero también la más cara, laboriosa, compleja e incómoda. Requiere personal durante su realización, contempla un gran número de variables, la interpretación precisa una preparación adecuada, y que el paciente duerma fuera del domicilio.
La ausencia de estudios sobre la variabilidad de la PSG en noches diferentes ha generado controversia sobre el valor del registro de una sola noche para el diagnóstico de SAHS en niños. En un estudio reciente en que se realizaban 2 PSG a un grupo de niños se comprobó que el estudio del primer día identificó correctamente el 84 % de los casos siguiendo el criterio de peor índice de apneas (IA) de las 2 noches y que los no detectados en la primera noche tenían un IA en el límite de la normalidad 70. Otros autores refieren que la variabilidad entre noches es mínima en los SAHS graves 71,72.
Es importante definir algunas variables:
Apnea obstructiva: cese del flujo aéreo en nariz y boca durante más de 2 ciclos respiratorios mientras se mantienen los movimientos toracoabdominales.
Apnea central: cese de flujo aéreo y de los movimientos toracoabdominales durante más de 2 ciclos respiratorios.
Apnea mixta: es una apnea que comienza como obstructiva y termina como central o viceversa.
Hipopnea: reducción del flujo aéreo mayor del 50 % que se acompaña de una caída de la SaO2 ≥ 4 % y/o con un microdespertar.
Índice de apnea obstructiva o central: número de apneas obstructivas o centrales por hora de sueño.
Índice de apneas-hipopnea (IAH): número de apneas e hipopneas por hora de sueño.
Desaturación: caída de la SaO2 ≥ 4 %. Índice de desaturación: número de desaturaciones por hora de sueño.
Los criterios polisomnográficos para el diagnóstico de SAHS en niños y su correlación clínica no están suficientemente definidos. Recientemente se han publicado algunos estudios sobre los valores de normalidad de la PSG en niños 73-76.
Aunque se considera anormal la presencia de más de una apnea obstructiva por hora de sueño se desconoce en realidad su significado clínico. La ATS considera diagnóstico de SAHS en el niño un IAH ≥ 3 siempre y cuando exista una clínica compatible con la enfermedad. Las apneas centrales son frecuentes en los niños y sólo se consideran patológicas si duran más de 20 s o se acompañan de desaturaciones.
Otros métodos diagnósticos
Si bien la PSG es el método ideal para el diagnóstico del SAHS, su complejidad técnica, y alto coste limitan su disponibilidad en la práctica clínica 77.
Existen otras pruebas diagnósticas alternativas que pueden ser de utilidad como la poligrafía respiratoria (PR), la pulsioximetría o las grabaciones sonoras o audiovisuales del sueño 78.
Poligrafía respiratoria
La PR es un método abreviado donde se monitorizan durante el sueño los parámetros cardiorrespiratorios (esfuerzo respiratorio, flujo aéreo, SaO2 y electrocardiograma [ECG] o frecuencia cardíaca), excluyendo del estudio las variables neurofisiológicas (electroencefalograma [EEG], electrooculograma [EOG], electromiograma [EMG]). Es posible su realización no vigilada por un técnico e incluso su uso en el mismo domicilio del paciente. Se trata de una técnica validada para el diagnóstico del SAHS en adultos (sensibilidad 97 % y especificidad 90 %) y pendiente de validación en niños 79. A pesar de presentar algunas limitaciones, se considera una técnica de cribado adecuada para el estudio del SAHS en la infancia 80,81.
La PR presenta algunas limitaciones diagnósticas. La ausencia de variables neurofisiológicas impide saber el tiempo de sueño real, por lo que se utiliza el tiempo en la cama como denominador de los distintos índices (apneas, hipopneas, desaturaciones), lo que puede producir falsos negativos al ser el tiempo en la cama mayor que el tiempo de sueño real. Por otro lado, al no detectar los microdespertares electroencefalográficos no permitiría diagnosticar el síndrome de resistencia aumentada de la vía aérea superior, si bien algunos estudios han relacionado la presencia de microdespertares electroencefalográficos con otras variables, como la disminución del tiempo de tránsito de pulso 82,83, el aplanamiento del asa del flujo inspiratorio o la disminución de la amplitud de las bandas seguido de una hiperventilación 84.
En los últimos años se están comercializando multitud de polígrafos 85, algunos de ellos extraordinariamente portátiles que permiten su uso en el domicilio del paciente 75,86. Hay que tener en cuenta que muchos de ellos no están validados con la PSG por lo que se desconoce su fiabilidad real. Además, los estudios no vigilados presentan con mayor frecuencia pérdida de datos o resultados equívocos que dificultan el diagnóstico final y que pueden requerir la repetición del estudio 87.
Algunos organismos internacionales (American Thoracic Society, American College of Chest Physicians y American Association of Sleep Medicine) han analizado los estudios clínicos disponibles sobre el uso de dispositivos portátiles y encuentran algunas evidencias sobre su utilidad cuando se llevan a cabo de forma vigilada en un laboratorio de sueño tanto para apoyar como para descartar el diagnóstico de SAHS en el adulto. No obstante, recomiendan el análisis manual de los datos obtenidos y evitar su utilización en pacientes con otras enfermedades concomitantes o cuando sea necesario titular la presión positiva continua en vía respiratoria (CPAP). Además, hay que tener en cuenta la posibilidad de infravalorar el índice de apneas-hipopneas y por tanto los pacientes sintomáticos con un estudio negativo deben realizarse un estudio exhaustivo para comprobar el origen de sus síntomas 88.
Una revisión reciente ha encontrado que la PR es una buena alternativa a la PSG 87 y su uso en la práctica clínica está aumentando de forma considerable en las unidades de sueño 77. Su principal indicación sería el estudio de pacientes con alta o baja probabilidad de padecer un SAHS, mientras que los pacientes con probabilidad mediana y aquéllos con comorbilidad asociada deberían realizarse una PSG completa, al igual que aquéllos con resultados negativos en la PR, pero con alta sospecha clínica de padecer un SAHS 89. En cualquier caso, conviene tener en cuenta que la mayoría de estos estudios clínicos y recomendaciones para el uso de la PR están realizados para adultos existiendo pocos datos en niños.
Medición de la saturación de oxígeno
La pulsioximetría nocturna puede resultar de utilidad, ya que la aparición de desaturaciones durante el sueño orienta el diagnóstico de SAHS si la clínica es sugestiva y no existen otras patologías en el niño. La fiabilidad de la prueba depende del criterio empleado para considerarla positiva. Si se requiere un índice de desaturaciones alto (p. ej., > 15) para considerar la pulsioximetría patológica, aumenta su especificidad diagnóstica pero baja su sensibilidad, mientras que si se considera patológico una frecuencia menor de desaturaciones, aumenta la sensibilidad a costa de la especificidad. De cualquier forma, las desaturaciones pueden tener una causa distinta (p. ej., apneas centrales) y además son frecuentes los casos de SAHS que no presentan desaturaciones, por lo que las limitaciones de la pulsioximetría como método aislado de diagnóstico son evidentes. Se considera que esta técnica, en niños con hipertrofia adenoamigdalar y sin otras patologías, tiene un alto valor predictivo del test positivo pero un bajo valor predictivo del test negativo 90. por tanto, una pulsioximetría patológica en un niño con clínica sugestiva sería prácticamente diagnóstica de SAHS, pero en el caso de ser normal no descartaría su presencia. Recientemente se ha publicado un sistema de puntuación de la pulsioximetría nocturna que ayuda a decidir la necesidad de tratamiento con adenoamigdalectomía en niños con clínica sugestiva de SAHS y sin otras patologías (tabla 4) 91.
Grabación en vídeo o audio del sueño
La grabación por parte de los padres de un período sintomático durante el sueño del niño (es suficiente con unos minutos) es útil para que el pediatra pueda visualizar las alteraciones referidas por los padres. Es especialmente válido si se graba junto con una pulsioximetría nocturna 92. La grabación del sonido durante algunos minutos del sueño del niño, valorando entre otros el ronquido y las pausas de apnea ha mostrado una alta sensibilidad pero con una especificidad muy variable 93,94. La grabación de audio o vídeo exclusivamente están desaconsejadas para el diagnóstico del SAHS 27, pero la realización conjunta con una PR o una pulsioximetría, ya sea en ámbito hospitalario o domiciliario, son prometedores 95.
En resumen, existen métodos diagnósticos abreviados para el estudio de SAHS, que junto con sus indudables ventajas (mayor disponibilidad y facilidad de utilización y análisis) presentan algunas limitaciones que hay que conocer. Se requieren estudios adicionales que posicionen el papel de cada uno de ellos en el estudio del SAHS en el niño.
Tratamiento del SAHS infantil
El SAHS pediátrico es el resultante de una combinación de factores anatómicos y funcionales; por ello, el abordaje terapéutico debe ser multidisciplinario. Se ha de tener muy en cuenta, ante un determinado paciente, cuáles son los factores causantes de su patología y actuar en consecuencia. El objetivo del tratamiento no es sólo controlar los síntomas, sino evitar las complicaciones a largo plazo.
Tratamiento quirúrgico (tabla 5)
Adenoamigdalectomía
La hipertrofia adenoamigdalar es la causa fundamental de SAHS en la gran mayoría de los niños y el tratamiento consistirá, por tanto, en la adenoamigdalectomía. Aún en niños con amígdalas aparentemente no muy hipertróficas, no suele ser suficiente con extirpar sólo las adenoides, sino que se deben extirpar ambas.
En otros casos, la etiología es distinta o puede que exista contraindicación para la cirugía o no se haya producido mejoría completa tras la misma. En dichas situaciones se deben utilizar otros tratamientos que se comentarán más adelante.
Existen escasos estudios aleatorizados con relación al tratamiento del SAHS pediátrico 96. Una revisión Cochrane de 2003 concluye que la adenoamigdalectomía es útil en el tratamiento del SAHS en niños pero que el clínico debe asegurarse de sus beneficios en cada caso concreto y valorarla como parte de un enfoque clínico completo. La adenoamigdalectomía ha demostrado resolver los trastornos respiratorios 97,98 y los síntomas nocturnos 99 en el 75 a 100 % de los niños sin otra patología de base y se considera el tratamiento de primera elección en niños con rasgos craneofaciales normales.
Es importante tener en consideración que existe un riesgo elevado de complicaciones respiratorias postoperatorias (hasta un 27 %) 100 en niños con SAHS grave, por lo que debe monitorizarse el postoperatorio en la unidad de vigilancia intensiva (UVI) o reanimación en ciertos casos (tabla 6) 101.
Los casos que no mejoran tras la cirugía deben ser reevaluados para descartar otras alteraciones que puedan justificar la persistencia de la sintomatología. Es conveniente repetir la PSG 2 a 3 meses tras la cirugía cuando haya dudas de la resolución del cuadro.
Otros procedimientos quirúrgicos
1. Uvulofaringopalatoplastia: Se ha empleado en niños con SAHS y retraso psicomotor que presentaban paladar y úvula hipertróficos 102. Sólo es útil en los casos en que la obstrucción está principalmente localizada en el paladar blando. Esta cirugía conlleva el riesgo de insuficiencia velofaríngea, complicación más frecuente en los niños que en los adultos.
2. Tratamientos de ortodoncia. Corrigen las anomalías maxilomandibulares. Consisten fundamentalmente en técnicas de distracción maxilar rápidas o lentas a través de la colocación de distractores anclados en los molares que, mediante presión, separan ambas mitades del maxilar o mandíbula, permitiendo el crecimiento de hueso a partir del cartílago medial. La distracción maxilar rápida puede asociarse a distracción mandibular, pero esta última suele ser menos eficaz. Mediante estos procedimientos se pueden corregir paladares ojivales y oclusiones nasales 103,104. Se ha observado una normalización del IAH en tan sólo 4 meses en niños con SAHS sin hipertrofia adenoamigdalar ni obesidad tras la distracción rápida del maxilar superior 103.
3. Cirugía maxilofacial. Está indicada en situaciones de malformación del macizo facial o de la base del cráneo (microsomía hemifacial, síndromes de Treacher Collins, Nager, Moebius), en los síndromes de craneosinostosis (Crouzon, Apert, Pfieffer), en síndrome de Pierre-Robin, Síndrome de Down, retrognatia, atresia de coanas o alteraciones del tabique nasal 105. Se deben vigilar las estenosis e insuficiencias velofaríngeas.
4. Traqueotomía. Sólo se realizaría si las alteraciones anatómicas presentadas por el paciente no fuesen posibles de corregir en ese momento, las apneas obstructivas fuesen muy severas y no se pudiesen realizar otros tratamientos menos agresivos.
Presión positiva continua en vía respiratoria
La segunda línea de tratamiento en el SAHS infantil es el empleo de la CPAP 106-108 si la adenoamigdalectomía fracasa o está contraindicada 109,110. La CPAP se realiza mediante un pequeño compresor y una mascarilla nasal o facial. La cantidad de presión de CPAP se debe titular individualmente mediante PSG; el objetivo es conseguir la presión óptima que elimine las apneas y minimice el ronquido resultando a la vez tolerable por el niño 111. Gracias a la CPAP, la vía aérea superior se mantiene abierta durante todo el ciclo respiratorio evitándose su colapso. Aunque la experiencia en niños es más limitada, en adultos este tratamiento está muy establecido habiéndose apreciado sus efectos beneficiosos sobre la calidad del sueño y la remisión de los síntomas diurnos 112. Para facilitar un buen cumplimiento del tratamiento es fundamental que la indicación haya sido correcta, que el paciente haya recibido amplia información sobre su uso y que realicemos un seguimiento muy estrecho sobre todo en las primeras semanas para ir solucionando los problemas de manejo que se presenten. En general, los efectos secundarios inmediatos suelen ser: irritación o erosión local, que se previenen mediante el uso de elementos protectores de la piel (Comfeel®, Varihesive®) y evitando la excesiva presión de la mascarilla sobre la misma, conjuntivitis (por fuga de aire hacia la conjuntiva ocular), sequedad nasal o faríngea (en los que se suele añadir humidificador al circuito), rinorrea, aerofagia, epistaxis, etc. Una complicación frecuente en niños, que se suele observar a medio plazo, es la hipoplasia de tercio medio de cara 113. Para que el funcionamiento de la CPAP sea correcto se deben evitar las fugas que se producen fundamentalmente por la boca (en ocasiones es necesario el uso de una mentonera o el empleo de mascarilla nasobucal en lugar de la nasal).
En lugar de CPAP se puede utilizar presión positiva continua binivel (BiPAP) 114 siendo especialmente útil en pacientes con SAHS y con otra patología crónica concomitante 115.
Otras medidas generales
Existen otras medidas que pueden ser útiles para tratar el SAHS leve o que son complementarias a los tratamientos previamente descritos:
Higiene de sueño: la deprivación de sueño reduce el tono muscular e incrementa el colapso de la vía aérea superior (VAS); es conveniente por tanto, reeducar al paciente en sus hábitos de sueño.
Tratamiento de la congestión nasal: la nariz supone el 50 % de la resistencia al paso del aire hacia los pulmones. Los niños con rinitis crónica o con congestión nasal secundaria a foco otorrinolaringológico pueden sufrir empeoramiento de su patología del sueño (ronquido, apneas) mientras duran estos procesos. Se benefician, por tanto, del empleo de medicaciones tópicas como anticongestivos o corticoides tópicos nasales 116-118 en el caso de rinitis alérgica 119. Se pueden emplear como paso previo a la adenoamigdalectomía pero no deben retrasar la misma. Las tandas de corticoides sistémicos no han demostrado ser útiles. Los corticoides tópicos pueden contribuir también a mejorar la tolerancia a la CPAP en caso de obstrucción nasal 120. En un estudio se utilizó montelukast en pacientes con SAHS leve, no susceptibles de adenoamigdalectomía, con buenos resultados 121.
Oxigenoterapia nocturna: puede ser útil en algunos casos, sola o asociada a ventilación no invasiva. Si se administra sola, puede ocasionar un empeoramiento en la ventilación y es conveniente vigilar la posible aparición de hipercapnia.
Inhibidores de la bomba de protones en casos seleccionados, como los pacientes con RGE 122, ya que se ha demostrado que la migración proximal de ácido instilado en la parte distal del esófago está favorecida durante el sueño 123.
En adultos se ha empleado la estimulación eléctrica transcutánea o transmucosa durante el día a modo de entrenamiento de la musculatura encargada de mantener la VAS abierta 124.
Tratamiento del SAHS en situaciones especiales
Síndrome de hipoventilación central
Puede ser congénito (síndrome de Ondina) o adquirido. Estos pacientes tienen durante el sueño una disminución de la frecuencia respiratoria y del volumen corriente precisando asistencia respiratoria (invasiva mediante traqueotomía o no invasiva cuando llegan a la adolescencia). La dependencia de la ventilación mecánica se mantiene toda la vida.
Síndrome de obesidad-hipoventilación
La obesidad mórbida provoca infiltración grasa de los tejidos blandos del paladar y la hipofaringe disminuyendo la luz de la VAS durante el sueño; también, el cinturón de grasa abdominal disminuye la eficiencia del diafragma y de los músculos abdominales provocando hipoventilación durante la fase hipotónica del sueño. En estos casos, la pérdida de peso constituye el tratamiento fundamental del SAHS, especialmente en adolescentes y adultos obesos.
Malformación de Arnold-Chiari tipo II asociada a mielomeningocele
Hasta un 62 % de estos niños presenta trastornos respiratorios durante el sueño 104, debido a cuatro mecanismos: apneas centrales, apneas obstructivas, hipoventilación central o enfermedad pulmonar restrictiva exacerbada por el sueño. Cada uno de ellos requiere un tratamiento específico. La derivación ventriculoperitoneal o la descompresión de la fosa posterior no suponen en todos los casos que lo precisen una remisión completa de los trastornos del sueño.
En resumen, deberemos de adaptar el tratamiento a la patología de base, aunque en la mayor parte de los casos, el SAHS pediátrico responde a la adenoamigdalectomía.
Correspondencia: Dr. J.R. Villa Asensi.
Sección de Neumología. Hospital Infantil Universitario Niño Jesús. Madrid.
Avda. Menéndez Pelayo, 65. 28009 Madrid. España.
Correo electrónico: jrvilla@gmail.com
Recibido en julio de 2006.
Aceptado para su publicación en julio de 2006.