la autoadministración semanal de gammaglobulina subcutánea (GGSC) domiciliaria es una alternativa en el tratamiento de las inmunodeficiencias primarias con déficit de producción de anticuerpos. El objetivo es comparar y evaluar la eficacia, la seguridad, la calidad de vida y el coste anual de GGSC y gammaglobulina intravenosa (GGIV) en nuestro medio.
Material y métodosestudio observacional y descriptivo de los pacientes pediátricos con inmunodeficiencia común variable (IDCV) que reciben GGSC en nuestro centro (noviembre 2006-abril 2008), en comparación con el último año de GGIV.
Resultadosse incluyó a 11 pacientes afectos de IDCV. Mediana de edad, 15 años. Mediana de IgG plasmática valle con GGIV, 622mg/dl. En los pacientes en que se mantuvo o se disminuyó la dosis de GGSC respecto a la de GGIV previa (7/8), la mediana de IgG fue 850mg/dl (p<0,0005). Tasa de infección/paciente/año de 2,22, sin diferencias estadísticamente significativas respecto a GGIV (p=0,212). Se produjeron 58 reacciones adversas (45 locales, 13 sistémicas) en 41/506 infusiones. Las reacciones adversas locales más frecuentes fueron dolor y picor y como sistémicas, la cefalea. Todos los pacientes refirieron una mejora en su calidad de vida. El tratamiento con GGSC supuso un importante ahorro económico.
Conclusionesla terapia subcutánea es una alternativa coste-efectiva a la GGIV con una eficacia similar y un aumento de calidad de vida en los pacientes con IDCV. Las concentraciones plasmáticas valle de IgG obtenidas son iguales o mayores. Las reacciones adversas locales son frecuentes, pero leves y autolimitadas.
Weekly home-based subcutaneous immunoglobulin (SCIg) therapy is an alternative to intravenous immunoglobulin (IVIg) in the treatment of patients with primary antibody deficiencies. The objective of this study was to investigate the efficacy, safety, related quality of life and cost effectiveness of SCIg in our area.
Materials and methodsObservational and descriptive study including paediatric patients with common variable immunodeficiency (CVID) receiving SCIg in our hospital (November 2006 to April 2008). Obtained data were compared with those from the last year with IVIg.
ResultsEleven patients with CVID were included. Median age was 15 years. The median trough serum IgG level was 622mg/dl with IVIg. In patients in whom the SCIg dose was maintained or reduced compared to IVIg, the median trough serum IgG level was 850mg/dl (p<0.0005). Annual rate of infection was 2.22 per patient-year, without significant differences to IVIg (p=0.212). There were 58 treatment-related adverse events (AE) reported with SCIg (45 local AE and 13 systemic AE). The most frequent treatment-related adverse event was infusion-site reaction. Switching to home-based subcutaneous IgG treatment led to significant improvements in quality of life and substantial cost savings.
ConclusionsWe conclude that subcutaneous administration of 16% SCIg is a safe and cost-effective alternative to IVIg for replacement therapy of primary antibody deficiencies. Median trough serum IgG levels were higher with SCIg. Local AE were common but mild and the incidence decreased over time. Quality of life is significantly improved.
Las inmunodeficiencias primarias (IDP) son un grupo de enfermedades determinadas genéticamente, causadas por la alteración cuantitativa y/o funcional de distintos mecanismos implicados en la respuesta inmunitaria. Afectan aproximadamente a 1/10.000 recién nacidos (RN), y el déficit de inmunoglobulina A (IgA) es el más frecuente (1/700 RN de etnia caucásica). La prevalencia de la inmunodeficiencia común variable (IDCV) es de 1,2 a 5/100.000 habitantes1. Clínicamente, se caracteriza por una predisposición aumentada a las infecciones, principalmente del tracto respiratorio, enfermedades autoinmunitarias y procesos neoplásicos. El diagnóstico, según criterios de la European Society for Immunodeficiencies (ESID, www.esid.org), se establece por un descenso de IgG, IgA y/o IgM por debajo de los valores de normalidad para cada edad y por la falta de respuesta a vacunas previamente administradas en pacientes mayores de 2 años, excluidas otras causas de hipogammaglobulinemia. Su tratamiento es la terapia sustitutiva con gammaglobulina (GG) inespecífica humana para obtener una concentración plasmática de IgG similar a los valores fisiológicos.
La gammaglobulina por vía intravenosa (GGIV) ha sido hasta ahora el tratamiento estándar en estos pacientes2. Una pauta de 200–600mg/kg cada 21–28 días permite alcanzar concentraciones plasmáticas valle de IgG⩾600mg/dl3. En ocasiones, el difícil acceso venoso y los efectos secundarios sistémicos potencialmente graves limitan su uso4.
A partir de 1991, se empieza a utilizar la gammaglobulina subcutánea (GGSC) en Europa y Estados Unidos. La administración de 100mg/kg/semana o 200mg/kg/14 días5–11 permite alcanzar concentraciones de IgG similares a las obtenidas con GGIV. Los valores de IgG obtenidos con GGSC son más estables, ya que la administración semanal de dosis menores evita máximos de concentración y concentraciones plasmáticas mínimas por catabolismo rápido de las dosis administradas12.
Se ha evaluado la eficacia de la GGSC en varios estudios en adultos5,7,8,13,14 y niños menores de 13 años13 sin demostrar diferencias estadísticamente significativas respecto al número y la gravedad de las infecciones durante el tratamiento7,13.
El perfil de seguridad de la GGSC es diferente, con un menor porcentaje de reacciones adversas (RA) sistémicas graves (<3,3%)5,7,11,13,15,16. Por el contrario, las RA locales (dolor, eritema, induración, picor, etc.) se manifiestan en la mayoría de los pacientes al inicio del tratamiento; habitualmente son de carácter leve y autolimitadas5,7,8,13,15–18.
La GGSC ofrece, además, la posibilidad de aplicación por el propio paciente en el domicilio familiar, lo que supone una mejora de la calidad de vida del paciente y su familia. Este aspecto se ha evaluado mediante diversos índices y cuestionarios validados, como el índice de calidad de vida (LQI), el Child Health Questionnaire-Parenteral Form 50 (CHQ-PF50) para pediatría y su versión resumida para adultos (SF-36)3,13,19–21.
Diversos estudios económicos realizados6,8,15,22,23 demuestran que el tratamiento domiciliario con GGSC conlleva un ahorro anual importante respecto al tratamiento previo con GGIV.
En noviembre de 2006, la Agencia Española de Medicamentos y Productos Sanitarios registró una gammaglobulina subcutánea (Vivaglobin®; CSL Behring GmbH, Malburg, Alemania, Alemania) para el tratamiento de IDP, mieloma y leucemia linfática crónica con hipogammaglobulinemia secundaria grave e infecciones recurrentes10. A partir de ese momento, se inició su administración en pacientes pediátricos diagnosticados de IDP en nuestro centro.
Los objetivos primarios del estudio fueron: comparar los valores valle de IgG con GGIV y GGSC, determinar la incidencia y la gravedad de las infecciones y valorar la seguridad de la GGSC. Respecto a lo objetivos secundarios, se valoró el grado de satisfacción y calidad de vida con GGSC en domicilio y se comparó el coste anual por paciente con GGIV y GGSC.
Material y métodosDiseño del estudioEstudio observacional, descriptivo, longitudinal de carácter retrospectivo. En cada paciente, se evaluó el último año de tratamiento con GGIV y desde el inicio con GGSC hasta abril de 2008, con visitas de seguimiento pasados 1, 3, 6 y 12 meses del cambio a GGSC durante el primer año. Los datos demográficos, analíticos y clínicos se recogieron de manera retrospectiva a través de la historia clínica (HC). Una vez iniciado el tratamiento subcutáneo se realizaron dos entrevistas a paciente y/o familiares.
PacientesSe incluyó a los pacientes con GGSC desde noviembre de 2006 hasta abril de 2008 y que durante el último año hubieran recibido GGIV. Los criterios de inclusión fueron: a) pacientes menores de 18 años y peso<70kg; b) diagnóstico confirmado de IDCV, y c) buen nivel sociocultural para entender los procedimientos y el manejo adecuado en caso de aparición de efectos adversos con GGSC. Criterios de exclusión: a) pacientes mayores de 18 años; b) incapacidad para comprender el procedimiento; c) discrasias sanguíneas graves; d) alteraciones cutáneas que impidan la administración de GGSC; e) embarazo, y f) negativa del paciente y/o familiares para entrar en el estudio.
Los familiares y el propio paciente (si era mayor de 16 años) recibieron información oral y escrita sobre el cambio de terapia de GGIV a GGSC, y firmaron el consentimiento informado de administración de GGSC. El estudio fue aprobado por el Comité Ético de Investigación Clínica del centro.
Medicación, dosis y técnica de administración de GGIV y GGSCTodos los pacientes recibieron Vivaglobin® al 16% (160mg/ml).
La dosis mensual total (DMT) de GGIV (Endobulin®) se calculó a partir de la dosis y la frecuencia de administración de las últimas 3 dosis recibidas de GGIV y se dividió por 4 para establecer la dosis inicial de GGSC semanal. El tratamiento con GGSC semanal se inició una semana después de la última dosis de GGIV.
La GGSC se administró con una bomba de infusión portátil (modelo Infusa T1, de Medis). Dosis superiores a 20ml se dividieron en dos lugares de punción. El lugar de punción fue la pared abdominal y la velocidad de administración de 10–22ml/h10.
Antes de iniciar la terapia en el domicilio, se realizaron 8 sesiones de entrenamiento en el hospital. Se informó sobre el manejo de la bomba y la técnica de perfusión, la importancia de escribir un diario de tratamiento y la técnica de administración de adrenalina intramuscular en caso de aparición de RA grave. Se realizaron visitas de seguimiento pasados 1, 3, 6 y 12 meses de iniciar GGSC.
Determinaciones analíticasSe realizaron analíticas periódicas cada 3 meses para conocer la evolución plasmática de IgG, IgA e IgM mediante técnicas nefelométricas.
InfeccionesSe registró cualquier infección desde el último año con GGIV hasta abril de 2008. Las infecciones se clasificaron según su localización: a) infecciones del tracto respiratorio superior (ITRS): rinitis, faringitis, laringitis, catarro de vías altas (CVA), conjuntivitis, sinusitis y otitis media aguda (OMA); b) infecciones del tracto respiratorio inferior (ITRI): bronquitis y neumonía; c) infecciones gastrointestinales, y d) otras infecciones. Las infecciones que requirieron ingreso hospitalario se consideraron graves (meningitis, neumonía, sepsis, osteomielitis y abscesos viscerales).
SeguridadPara evaluar la seguridad biológica de GGSC, 3 meses antes y 3 meses después de iniciar GGSC, se verificó la ausencia de infección viral por hepatitis B (HbsAg mediante EIA), hepatitis C (ARN-VHC mediante PCR a tiempo real, sistema Tacqman-Roche®) y carga viral de VIH (NASBA). Enfermería registró en la HC, y el paciente en su diario, cualquier signo o síntoma relacionado con una RA sistémica o local derivado de la medicación. La RA se consideró grave si requirió la hospitalización del paciente.
Grado de satisfacción y calidad de vida con GGSCPara valorar el grado de aceptación de la GGSC, se diseñaron dos entrevistas para este procedimiento (no adaptadas a los cuestionarios LQI o CHQ-PF50 validados para pediatría). La primera entrevista se realizó una vez finalizado el periodo de formación de los pacientes en el hospital y la segunda a los 4 meses de iniciar la GGSC.
Evaluación económica anual de GGIV y GGSCSe comparó el coste anual del último año de tratamiento con GGIV (Endobulin®) y el primer año o siguientes con GGSC (Vivaglobin®). El precio de venta al laboratorio (PVL) más IVA de la medicación y accesorios se obtuvo del laboratorio fabricante de cada especialidad farmacéutica (consulta, abril de 2008).
Análisis estadísticoEl análisis estadístico de los datos se realizó con el programa estadístico SPSS (V15.0) y Excel. Se estudiaron las siguientes variables: a) eficacia: IgG plasmática valle, rendimiento de cada GG, número de infecciones; b) seguridad: reacciones adversas locales y sistémicas, infecciones virales (VHB, VHC, VIH); c) grado de satisfacción según los cuestionarios administrados, y d) coste: gasto anual por paciente.
Para determinar la eficacia con la concentración plasmática valle de IgG se obtuvo un término de rendimiento para cada tipo de GG utilizada, dividiendo la concentración plasmática valle de IgG (mg/dl) entre la dosis de GG recibida [mg/(kg/semana)] [unidades del rendimiento: (kg/semana)/dl]. La comparación del rendimiento entre ambos grupos se realizó con una comparación de medias para muestras no apareadas. La influencia de las variables «IgG basal en el momento del diagnóstico» y «vía de administración» en la concentración plasmática de IgG obtenida (mg/dl) se evaluó por regresión lineal múltiple. Se compararon las tasas de infección y las proporciones de RA sistémicas y locales por paciente durante el tratamiento con GGIV y GGSC con la prueba no paramétrica t de Wilcoxon. Los valores de las variables edad, peso e IgG plasmática del paciente, dosis y frecuencia de GG se expresaron con la mediana y la amplitud intercuartílica.
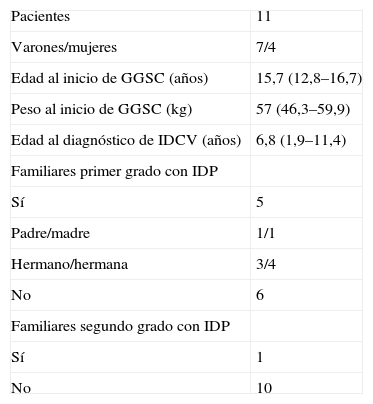
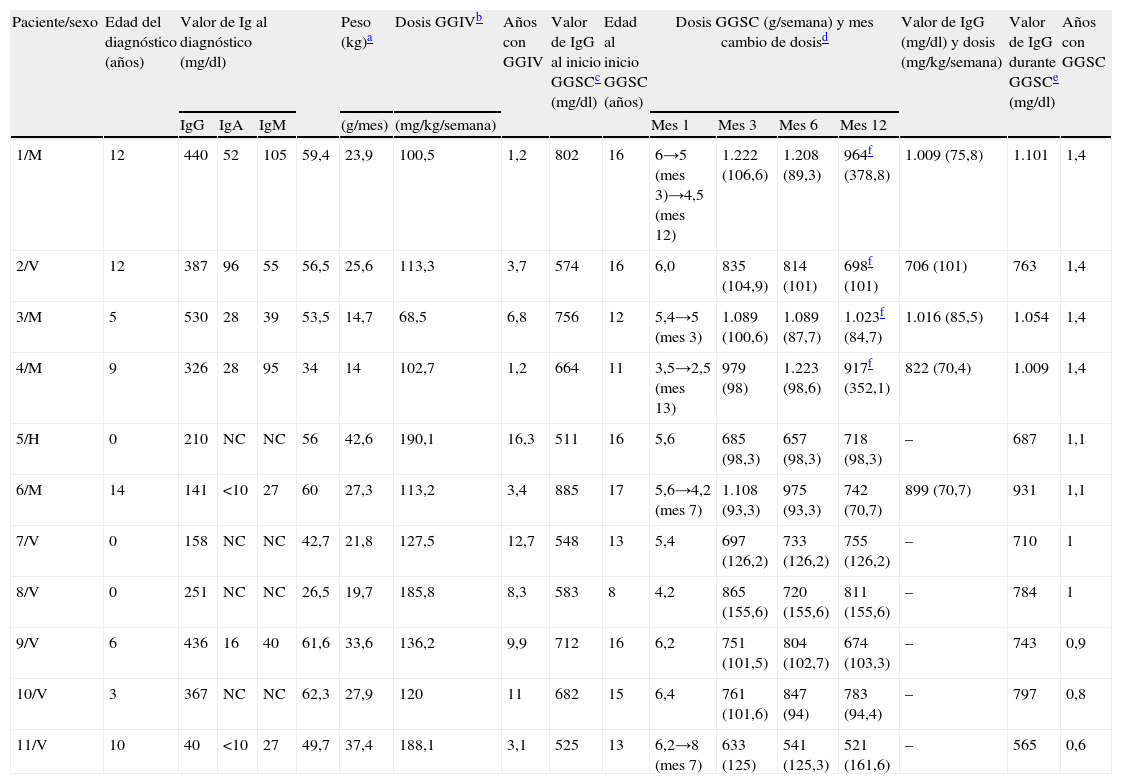
ResultadosPoblación estudiadaSe incluyó a 11 pacientes (7 niños y 4 niñas) diagnosticados de IDCV según los criterios de la ESID, excluidos otros diagnósticos según la práctica clínica habitual. No se perdió a ningún sujeto durante el estudio. La tabla 1 recoge los datos demográficos y clínicos más importantes. Los 3 pacientes diagnosticados antes de los 2 años presentaban manifestaciones clínicas y antecedentes familiares de IDC, y en todos los casos se corroboró este diagnóstico en edades más avanzadas.
Características demográficas y clínicas de los pacientes
| Pacientes | 11 |
| Varones/mujeres | 7/4 |
| Edad al inicio de GGSC (años) | 15,7 (12,8–16,7) |
| Peso al inicio de GGSC (kg) | 57 (46,3–59,9) |
| Edad al diagnóstico de IDCV (años) | 6,8 (1,9–11,4) |
| Familiares primer grado con IDP | |
| Sí | 5 |
| Padre/madre | 1/1 |
| Hermano/hermana | 3/4 |
| No | 6 |
| Familiares segundo grado con IDP | |
| Sí | 1 |
| No | 10 |
GGSC: gammaglobulina subcutánea; IDCV: inmunodeficiencia común variable.Los datos expresan mediana (amplitud intercuartílica) o pacientes, n.
Durante el último año con GGIV, la mediana de dosis administrada fue 124mg/kg/semana (amplitud intercuartílica, 107–172mg/kg/semana). La frecuencia de administración presentó una mediana de 26 (21–29) días. Antes de iniciar GGSC, 5 pacientes presentaban una IgG<600mg/dl.
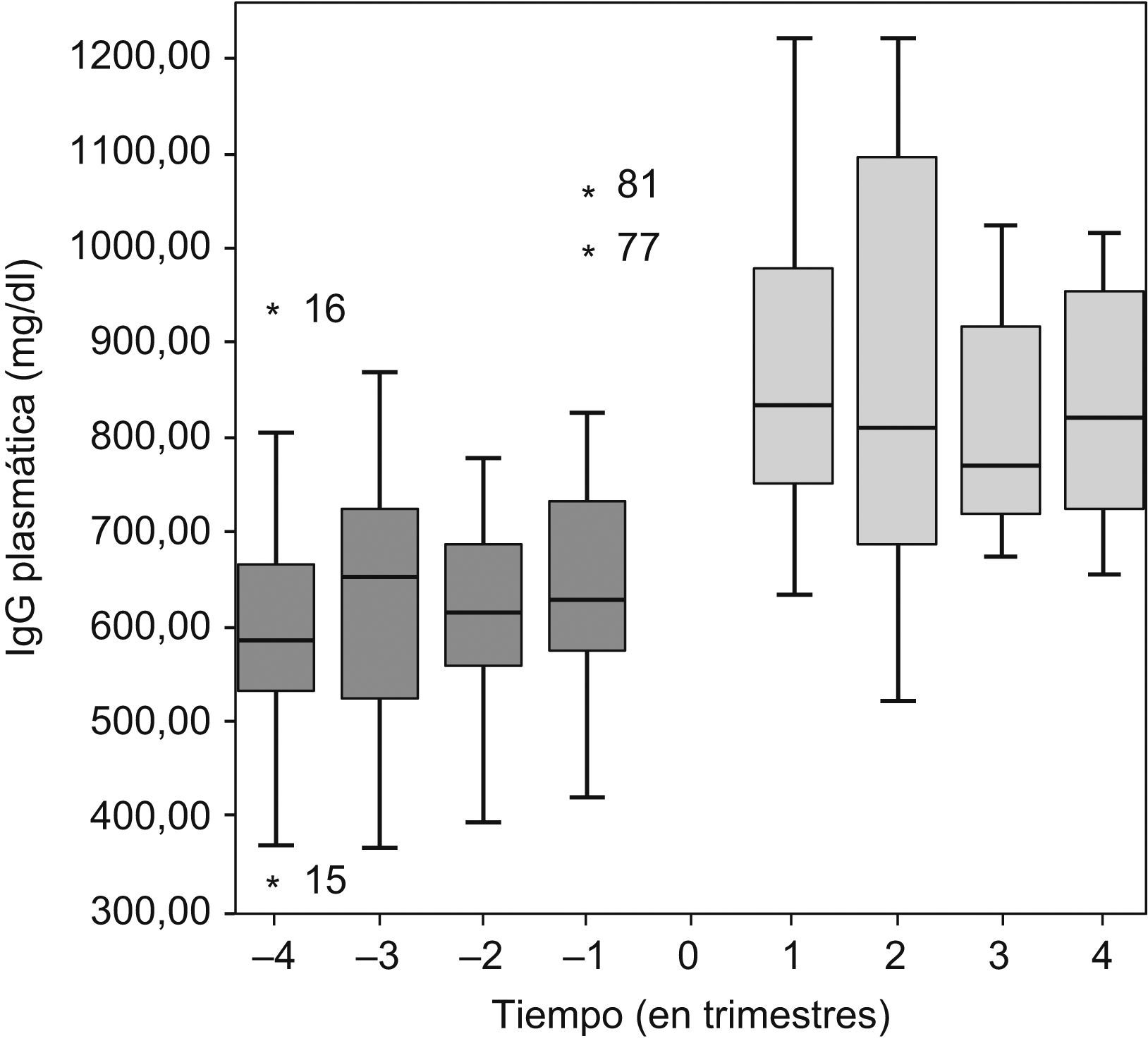
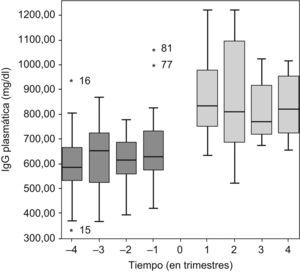
Al iniciar GGSC, la DMT de GGSC, respecto a la GGIV, se redujo en 6 pacientes, en 4 se mantuvo y en 1 caso se aumentó, según los valores valle de IgG (objetivo, 600–800mg/dl) y el volumen a infundir. Durante el tratamiento con GGSC, en 5 pacientes se ajustó la dosis (4 reducciones y 1 aumento). La mediana de la dosis de GGSC administrada fue 102 (98–125)mg/kg/semana. En los pacientes en que se mantuvo o disminuyó la dosis de GGIV a GGSC, la mediana de IgG durante el último año con GGIV y el primer año con GGSC (se excluyó a los pacientes 9, 10 y 11 por llevar menos de 1 año de tratamiento con GGSC hasta abril de 2008) fue 622 (558–706)mg/dl para GGIV frente a 850 (730–1.013)mg/dl con GGSC (fig. 1).
Evolución de la concentración plasmática valle de inmunoglobulina G (IgG) antes y después del inicio del tratamiento con gammaglobulina subcutánea (t=0). El diagrama de caja de cada trimestre queda representado por la mediana (línea horizontal) y el percentil 25 y 75 (márgenes de la caja).
El rendimiento de la concentración valle obtenida con GGSC fue 8,5kg/semana/dl frente a 5,5 con GGIV (p<0,0005; intervalo de confianza [IC] del 95% de la diferencia media, 1,35–4,64). La concentración plasmática de IgG basal y la vía de administración influyeron en la concentración de IgG según la ecuación de la recta de regresión lineal múltiple obtenida (r2=0,498). La tabla 2 recoge la evolución analítica de los 11 pacientes.
Evolución analítica de los once pacientes
| Paciente/sexo | Edad del diagnóstico (años) | Valor de Ig al diagnóstico (mg/dl) | Peso (kg)a | Dosis GGIVb | Años con GGIV | Valor de IgG al inicio GGSCc (mg/dl) | Edad al inicio GGSC (años) | Dosis GGSC (g/semana) y mes cambio de dosisd | Valor de IgG (mg/dl) y dosis (mg/kg/semana) | Valor de IgG durante GGSCe (mg/dl) | Años con GGSC | ||||||
| IgG | IgA | IgM | (g/mes) | (mg/kg/semana) | Mes 1 | Mes 3 | Mes 6 | Mes 12 | |||||||||
| 1/M | 12 | 440 | 52 | 105 | 59,4 | 23,9 | 100,5 | 1,2 | 802 | 16 | 6→5 (mes 3)→4,5 (mes 12) | 1.222 (106,6) | 1.208 (89,3) | 964f (378,8) | 1.009 (75,8) | 1.101 | 1,4 |
| 2/V | 12 | 387 | 96 | 55 | 56,5 | 25,6 | 113,3 | 3,7 | 574 | 16 | 6,0 | 835 (104,9) | 814 (101) | 698f (101) | 706 (101) | 763 | 1,4 |
| 3/M | 5 | 530 | 28 | 39 | 53,5 | 14,7 | 68,5 | 6,8 | 756 | 12 | 5,4→5 (mes 3) | 1.089 (100,6) | 1.089 (87,7) | 1.023f (84,7) | 1.016 (85,5) | 1.054 | 1,4 |
| 4/M | 9 | 326 | 28 | 95 | 34 | 14 | 102,7 | 1,2 | 664 | 11 | 3,5→2,5 (mes 13) | 979 (98) | 1.223 (98,6) | 917f (352,1) | 822 (70,4) | 1.009 | 1,4 |
| 5/H | 0 | 210 | NC | NC | 56 | 42,6 | 190,1 | 16,3 | 511 | 16 | 5,6 | 685 (98,3) | 657 (98,3) | 718 (98,3) | – | 687 | 1,1 |
| 6/M | 14 | 141 | <10 | 27 | 60 | 27,3 | 113,2 | 3,4 | 885 | 17 | 5,6→4,2 (mes 7) | 1.108 (93,3) | 975 (93,3) | 742 (70,7) | 899 (70,7) | 931 | 1,1 |
| 7/V | 0 | 158 | NC | NC | 42,7 | 21,8 | 127,5 | 12,7 | 548 | 13 | 5,4 | 697 (126,2) | 733 (126,2) | 755 (126,2) | – | 710 | 1 |
| 8/V | 0 | 251 | NC | NC | 26,5 | 19,7 | 185,8 | 8,3 | 583 | 8 | 4,2 | 865 (155,6) | 720 (155,6) | 811 (155,6) | – | 784 | 1 |
| 9/V | 6 | 436 | 16 | 40 | 61,6 | 33,6 | 136,2 | 9,9 | 712 | 16 | 6,2 | 751 (101,5) | 804 (102,7) | 674 (103,3) | – | 743 | 0,9 |
| 10/V | 3 | 367 | NC | NC | 62,3 | 27,9 | 120 | 11 | 682 | 15 | 6,4 | 761 (101,6) | 847 (94) | 783 (94,4) | – | 797 | 0,8 |
| 11/V | 10 | 40 | <10 | 27 | 49,7 | 37,4 | 188,1 | 3,1 | 525 | 13 | 6,2→8 (mes 7) | 633 (125) | 541 (125,3) | 521 (161,6) | – | 565 | 0,6 |
GGIV: gammaglobulina intravenosa; GGSC: gammaglobulina subcutánea; M: mujer; NC: no consta; V: varón.
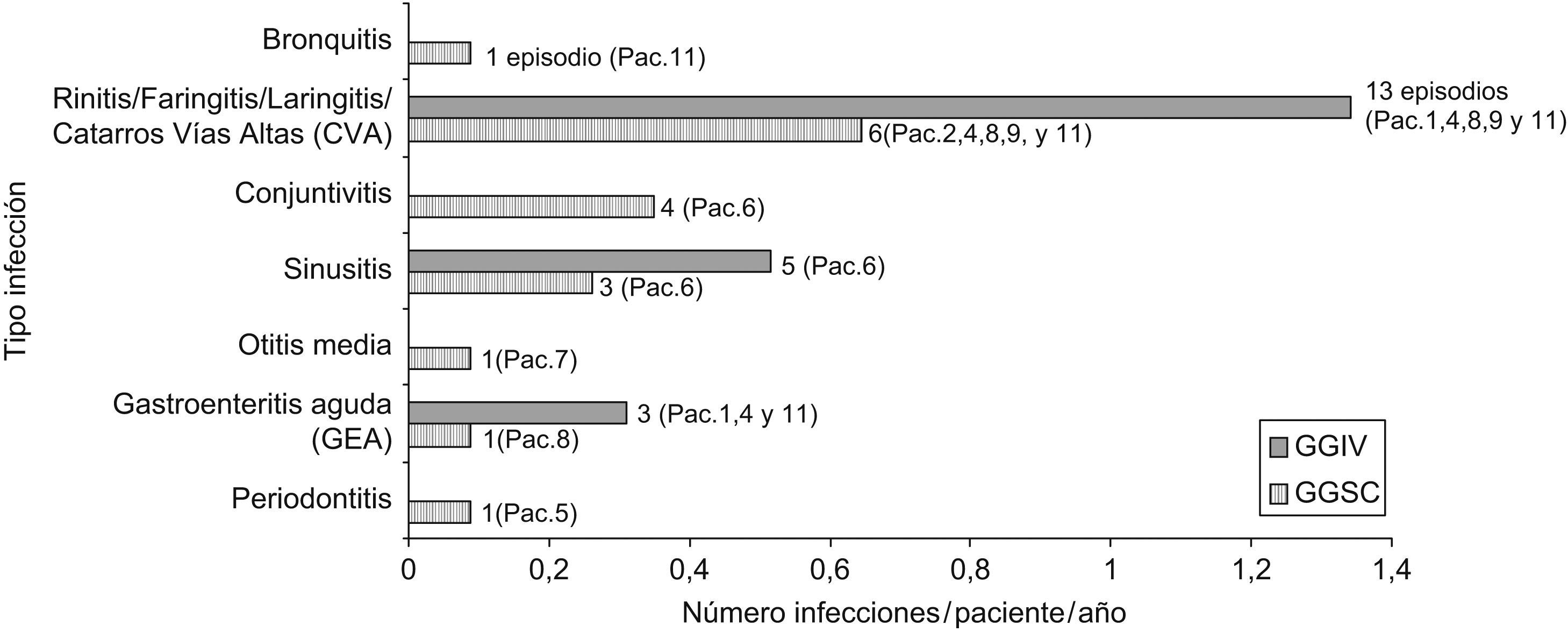
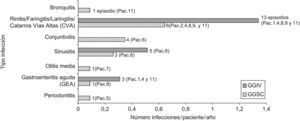
Durante el último año de tratamiento con GGIV (3.934 días observados) se registraron 21 episodios infecciosos (7/11 pacientes), con una tasa de 2,74 infecciones/paciente/año. Con GGSC (3.675 días observados) fueron 17 casos (8/11 pacientes) y la tasa fue 2,22. Las ITRS fueron las más frecuentes en ambos casos (2,62 infecciones/paciente/año con GGIV y 2,18 con GGSC). No se produjo ninguna infección grave con GGIV ni con GGSC (fig. 2).
Se registraron 15 episodios de fiebre con GGIV (8/11 pacientes) y 8 con GGSC (5/11 pacientes). Al tratarse de un estudio retrospectivo, no se pudo recoger de forma completa los episodios infecciosos que necesitaron tratamiento antibiótico ni los días de duración.
Reacciones adversasSe administró un total de 153 infusiones de GGIV (3.934 días observados) y 506 infusiones de GGSC (3.675 días observados).
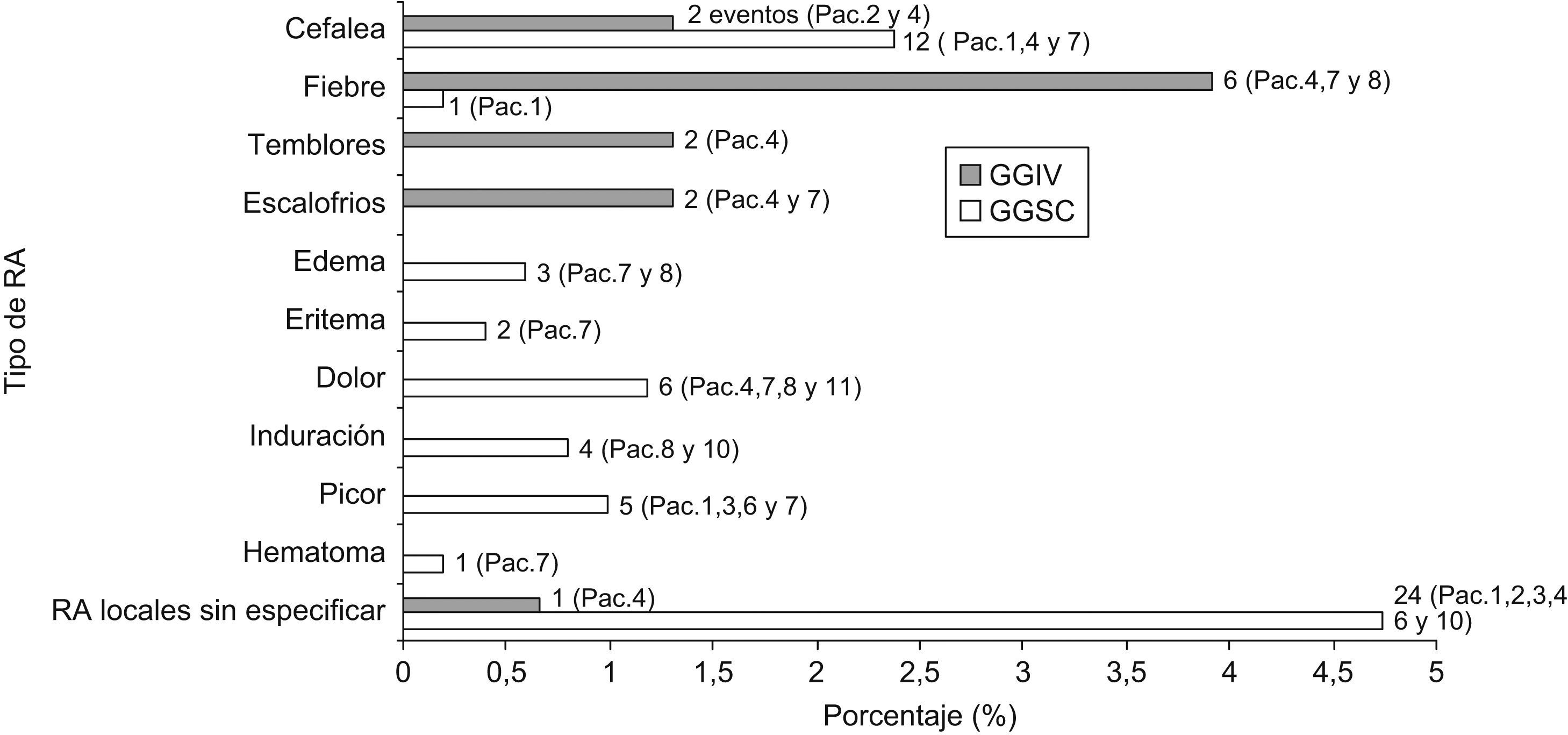
Con GGIV se registraron 13 RA en el 5,23% (8/153) de las infusiones evaluadas, 12 sistémicas (6 casos de fiebre, 2 cefaleas, 2 temblores y 2 escalofríos (fig. 3)) y 1 local. No hubo ninguna RA grave.
En 3 pacientes (4, 6 y 7) se administró premedicación (antihistamínicos, paracetamol) antes de cada infusión de GGIV por haber manifestado, anteriormente al periodo de estudio, alguna reacción sistémica grave. Aun así, los pacientes 4 y 7 presentaron RA sistémicas.
Con GGSC se produjeron un total de 58 RA en el 8,10% (41/506) de las infusiones evaluadas. Las RA locales fueron mucho más frecuentes que las sistémicas (45/58 eventos). Las más relevantes por orden decreciente fueron: RA locales sin especificar, dolor, picor, induración, edema y eritema en la zona de infusión (fig. 3).
De los 8 pacientes que presentaron RA locales, en 4 de ellos desaparecieron a las 4-6 semanas del inicio de GGSC. No se observó ningún caso de lipodistrofia del tejido subcutáneo. Las RA sistémicas fueron cefalea (12/13) y fiebre (1/13). Tampoco se produjo ninguna RA grave con GGSC.
La diferencia en las RA locales fue estadísticamente significativa (p=0,008). Por el contrario, la diferencia de RA sistémicas con ambos tratamientos no mostró significación (p=0,08).
Las pruebas analíticas para evaluar la seguridad viral de GGSC resultaron negativas en todos los pacientes.
Aceptación de la terapia domiciliaria con GGSCSe entrevistó a 7 de 11 pacientes al acabar el periodo de formación hospitalario. Todos ellos valoraron favorablemente los aspectos cuestionados. La percepción de los pacientes sobre la información recibida en cada sesión fue satisfactoria, indicando que fue comprensible y adecuada a las necesidades de cada paciente.
En la segunda entrevista, que evaluaba la satisfacción y las mejoras con la GGSC, los pacientes expresaron una mejor calidad de vida (escala 1-5), con una puntuación de 4-5 en 8 pacientes y 11 familiares; 7 pacientes manifestaron mayor comodidad con esta terapia (⩾8 puntos) (escala 1-10); 10 de los 11 pacientes percibieron mayores flexibilidad y libertad con GGSC, así como mayor independencia familiar y del personal sanitario.
Siete de los 11 pacientes y familiares refirieron una disminución del número de días perdidos en la escuela y el trabajo (3 pacientes no contestaron y 1 paciente recibía GGIV en domicilio).
Los pacientes y/o familiares expresaron cierta incomodidad con la necesidad de refrigeración de la GGSC y con la pauta semanal en periodos vacacionales.
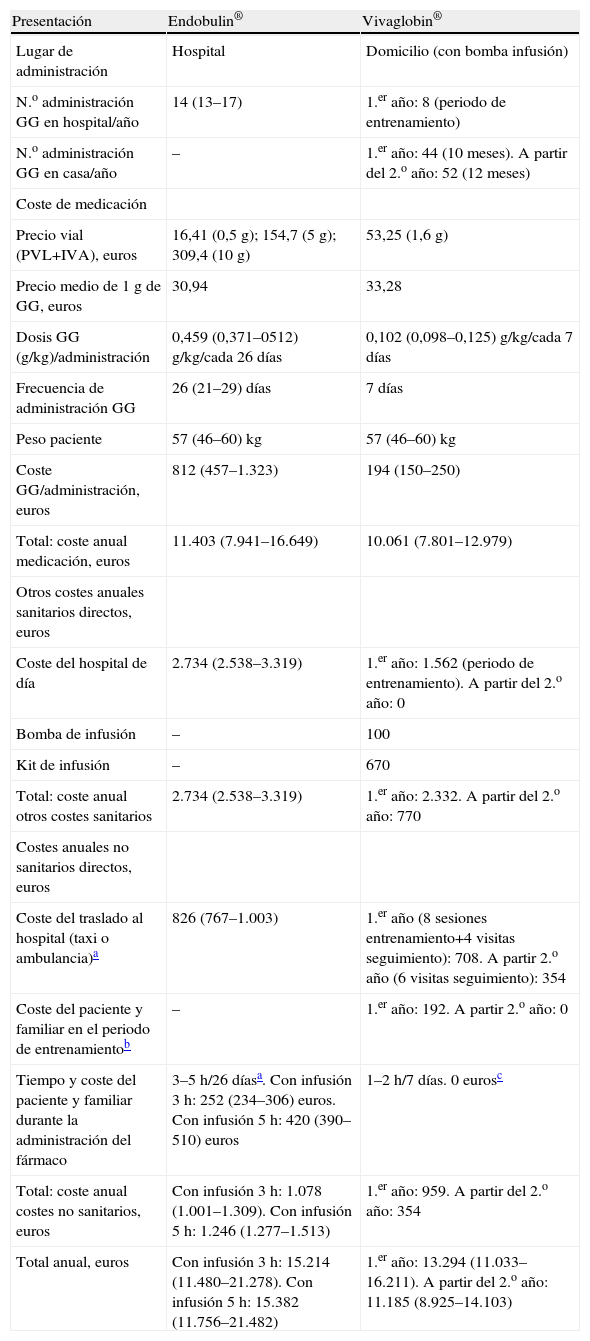
Evaluación económicaCon GGIV, la frecuencia de administración fue 26 días (mediana), y determinó unas 14 visitas al año. Con GGSC, la frecuencia de administración fue semanal y los pacientes durante el primer año de tratamiento acudieron a 8 sesiones de entrenamiento más 4 visitas de seguimiento en el hospital, que sumaron 12 visitas/año. A partir del segundo año, se realizaron 6 visitas de seguimiento.
El ahorro anual con el cambio de GGIV hospitalaria a GGSC en domicilio, incluidos gastos directos e indirectos, fue aproximadamente del 13% (1.921–2.089 euros) durante el primer año de tratamiento, y del 27% (4.029–4.197 euros) a partir del segundo año, en el que todas las administraciones de GGSC se realizan en el domicilio (tabla 3).
Comparación del coste anual con gammaglobulina intravenosa y gammaglobulina subcutánea en población pediátrica
| Presentación | Endobulin® | Vivaglobin® |
| Lugar de administración | Hospital | Domicilio (con bomba infusión) |
| N.o administración GG en hospital/año | 14 (13–17) | 1.er año: 8 (periodo de entrenamiento) |
| N.o administración GG en casa/año | – | 1.er año: 44 (10 meses). A partir del 2.o año: 52 (12 meses) |
| Coste de medicación | ||
| Precio vial (PVL+IVA), euros | 16,41 (0,5g); 154,7 (5g); 309,4 (10g) | 53,25 (1,6g) |
| Precio medio de 1g de GG, euros | 30,94 | 33,28 |
| Dosis GG (g/kg)/administración | 0,459 (0,371–0512) g/kg/cada 26 días | 0,102 (0,098–0,125) g/kg/cada 7 días |
| Frecuencia de administración GG | 26 (21–29) días | 7 días |
| Peso paciente | 57 (46–60) kg | 57 (46–60) kg |
| Coste GG/administración, euros | 812 (457–1.323) | 194 (150–250) |
| Total: coste anual medicación, euros | 11.403 (7.941–16.649) | 10.061 (7.801–12.979) |
| Otros costes anuales sanitarios directos, euros | ||
| Coste del hospital de día | 2.734 (2.538–3.319) | 1.er año: 1.562 (periodo de entrenamiento). A partir del 2.o año: 0 |
| Bomba de infusión | – | 100 |
| Kit de infusión | – | 670 |
| Total: coste anual otros costes sanitarios | 2.734 (2.538–3.319) | 1.er año: 2.332. A partir del 2.o año: 770 |
| Costes anuales no sanitarios directos, euros | ||
| Coste del traslado al hospital (taxi o ambulancia)a | 826 (767–1.003) | 1.er año (8 sesiones entrenamiento+4 visitas seguimiento): 708. A partir 2.o año (6 visitas seguimiento): 354 |
| Coste del paciente y familiar en el periodo de entrenamientob | – | 1.er año: 192. A partir 2.o año: 0 |
| Tiempo y coste del paciente y familiar durante la administración del fármaco | 3–5h/26 díasa. Con infusión 3 h: 252 (234–306) euros. Con infusión 5 h: 420 (390–510) euros | 1–2h/7 días. 0 eurosc |
| Total: coste anual costes no sanitarios, euros | Con infusión 3 h: 1.078 (1.001–1.309). Con infusión 5 h: 1.246 (1.277–1.513) | 1.er año: 959. A partir del 2.o año: 354 |
| Total anual, euros | Con infusión 3 h: 15.214 (11.480–21.278). Con infusión 5 h: 15.382 (11.756–21.482) | 1.er año: 13.294 (11.033–16.211). A partir del 2.o año: 11.185 (8.925–14.103) |
Se consideraron 4h para desplazamiento y visita de seguimiento clínico (6euros/h) y 35 euros del transporte por visita.
En nuestro estudio el tratamiento con GGSC supuso un incremento en la IgG valle del 37% (649 a 889mg/dl). El coeficiente de determinación (r2) 0,498 significó que un 49,8% de la variación de la IgG plasmática era explicado por la concentración basal plasmática de IgG y la vía de administración utilizada. Es importante destacar que, además, 6 pacientes recibieron una dosis mensual total de GGSC inicial inferior que la GGIV y que en 4 se redujo la dosis de GGSC durante el primer año de tratamiento.
El incremento de IgG obtenido en nuestro estudio fue mayor o similar al publicado hasta el momento, que oscila en el 5–49% en adultos y el 18% en niños5–8.
No hubo diferencias estadísticamente significativas en la tasa general de infección anual con GGIV (2,74) y GGSC (2,22) (p=0,212) ni en la tasa de ITRS por paciente, aunque sí fueron menores con GGSC. No se produjo ninguna infección grave durante la infusión de GGSC, por lo que resultó un buen indicador de la eficacia de la dosis de GGSC administrada. Estos datos son inferiores a los publicados5,7,13 con una tasa de infección anual de 0,04 episodios graves por paciente, una tasa anual general de infección de 4,43, y una tasa de ITRS de 3,6.
Las diferencias de RA sistémicas por paciente con GGIV y GGSC no tuvieron significación estadística (p=0,08). No hubo ninguna RA sistémica grave con GGIV, aunque es importante destacar que 3 pacientes recibían premedicación intravenosa antes de cada infusión de GGIV. Con la GGSC tampoco se produjo ninguna RA sistémica grave, resultados que coinciden con los publicados hasta el momento5,7,11,13,15,16.
El aumento de RA locales con GGSC fue estadísticamente significativo (p=0,008). El dolor, la induración y el picor constituyeron el 33% y fueron, en la mayoría de los casos, autolimitados, lo que reflejó una buena tolerancia del fármaco.
En el 8,1% de las infusiones con GGSC se manifestó algún tipo de RA. El resultado es similar a los publicados hasta el momento (2,1–10,4%)7,17.
La aceptación del cambio de tratamiento a GGSC domiciliaria fue unánime. La mayoría de los pacientes y familiares manifestaron una mejora de calidad de vida, comodidad, flexibilidad e independencia respecto al tratamiento intravenoso. Usar cuestionarios sin validar no permitió la comparación directa con los resultados publicados, que coinciden en un aumento de la satisfacción del paciente y de los índices de calidad de vida3,14,16,19,21.
El cambio de GGIV en el hospital a GGSC domiciliaria supuso un ahorro aproximado de 2.000 euros/paciente/año el primer año y de 4.000 euros los siguientes años de tratamiento con GGSC, incluidos los costes relacionados con absentismo laboral o escolar y transporte de los pacientes. La reducción del coste anual por paciente con GGSC domiciliaria fue del 13 al 27%. Nuestros resultados son bastante similares a los publicados hasta el momento, que reflejan un ahorro anual de 10.100 dólares por paciente8 o bien de 2.000–5.000 euros15, la reducción de costes a la mitad con GGSC22 o bien un ahorro anual de 17–77 millones de euros si el 60% de los pacientes con IDP recibieran tratamiento subcutáneo23.
Como conclusión, queremos señalar:
- •
La dosis de GGSC necesaria para obtener IgG plasmática valle de 600–800mg/dl fue igual o menor que la dosis de GGIV.
- •
No se manifestó ninguna infección grave durante el tratamiento con GGSC.
- •
Las RA sistémicas manifestadas con GGSC son poco frecuentes. Sin embargo, las RA locales son más frecuentes, pero de carácter leve y autolimitado. Este aspecto podría determinar el uso de la vía subcutánea en los pacientes en que la dependencia hospitalaria trastorna su escolarización u otros aspectos familiares.
- •
Los pacientes expresan mayores comodidad, calidad de vida y flexibilidad horaria con GGSC.
- •
El cambio de GGIV a GGSC es coste-efectivo para el sistema sanitario.
Debido al bajo número de pacientes incluidos en el estudio, es difícil establecer conclusiones con respecto a la población, por lo que es necesario aumentar el tamaño muestral para obtener una validez externa mayor. Para ello, sería útil crear un registro estatal centralizado donde recoger los datos de los pacientes en tratamiento con GGSC.
A la enfermera Ana Álvarez Roig por llevar a cabo todo el trabajo de educación sanitaria del proyecto y especialmente a todos los pacientes y sus familias.
Aclaración
Este estudio fue presentado en el 53 Congreso de la Sociedad Española de Farmacia Hospitalaria, Valencia, 21–24 de octubre de 2008.