las alteraciones hidrocarbonadas (AHC) en fibrosis quística (FQ) suelen ser asintomáticas pero conllevan gran morbilidad. Su diagnóstico precoz puede prevenir el deterioro del estado nutricional y de la función pulmonar (FP).
Objetivoscomparar los resultados de la monitorización continua de glucosa (CGMS) con los de la sobrecarga oral de glucosa (SOG) en pacientes con FQ. Evaluar la utilidad de la hemoglobina glicosilada (HbA1c) para el diagnóstico precoz de AHC. Analizar los cambios del estado nutritivo y función pulmonar al diagnóstico de AHC.
Pacientes y métodosen 13 pacientes púberes (7 varones) con FQ y AHC, diagnosticada por SOG, implantamos CGMS. Analizamos: edad, sexo, mutación relacionada con FQ, insuficiencia pancreática exocrina, HbA1c (%), glucemia en ayunas y 2h tras SOG. En el CGMS valoramos: glucosa global, en ayunas y posprandial, y excursiones de glucosa >140mg/dl. Además, comparamos el estado nutricional (índice de masa corporal) y la FP (capacidad vital forzada y volumen espiratorio forzado en el primer segundo) en ese momento y en el año previo.
Resultadosmedia de edad al diagnóstico de AHC de 16,4 años (11-22); 11 pacientes tenían mutación ΔF508. Todos tenían insuficiencia pancreática exocrina. Cumplían criterios de diabetes 1/13 con SOG y 7/13 (53,8%) con CGMS. Se evidenció una declinación del estado nutricional y/o de la FP en el 77%. Sólo 4 pacientes tenían HbA1c patológica.
Conclusionesel CGMS detecta mejor la diabetes relacionada con FQ que la SOG. La presencia de AHC tiende a relacionarse con un empeoramiento nutricional y/o de FP. La HbA1c no permite el diagnóstico precoz de AHC en FQ.
Diabetes mellitus (DM) is an increasing complication of cystic fibrosis (CF). It is associated with enhance morbidity. Continuous glucose monitoring system (CGMS) could detect glucose disorders earlier than other screening tests usually used.
AimsTo compare oral glucose tolerance test (OGTT), HbA1c and CGMS in patients with CF and recent disorders of glucose homeostasis and to analyse changes in nutritional status and/or pulmonary function.
Patients and methodsThirteen patients with CF (11–22 years, 7 males) were studied using OGTT, HbA1c and CGMS. All of them had newly diagnosed glucose disturbances. They were not receiving steroid therapy or had an underlying illness. In all subjects we compared: HbA1c levels (%), fasting and 2-hours glucose OGTT (mg/dl) and glucose CGMS values (overall, fasting, 2-hours post mean-meals and excursions >140mg/dl at any time). Furthermore, body mass index, forced expiratory volume in the first second (%) and forced vital capacity (%) were evaluated in the previous year and at the time of the study. We also analysed exocrine pancreatic function and CF-mutation.
ResultsMean age at diagnosis of glucose disturbance was 16.4 years. All patients had insufficient exocrine pancreatic function and 11/13 presented ΔF508 CF-mutation. Only one patient was diagnosed with DM using OGGT and 7/13 (53.8%) with CGMS. A total 77% of patients had poor nutritional status and/or pulmonary function at time of diagnosing the glucose disorder. Only 4 patients had abnormal HbA1c levels.
ConclusionsCGMS allows a better detection of glucose disorders than OGTT. Glucose homeostasis abnormalities are associated with a decrease in nutritional status and/or pulmonary function. HbA1c does not aid in the early diagnose of glucose disorders.
La alteración del metabolismo hidrocarbonado (AHC) es una complicación evolutiva en los pacientes con fibrosis quística (FQ), y su máxima expresión es la diabetes (DRFQ). Estas alteraciones conllevan una gran morbimortalidad y tienen una repercusión negativa en la calidad de vida de los pacientes1,2. En la actualidad, el mejor conocimiento de la FQ y el tratamiento multifactorial en unidades especializadas han aumentado su esperanza de vida y con ello la prevalencia de las AHC3,4, que suelen aparecer al final de la segunda década de la vida2. Se consideran factores de riesgo para su desarrollo: la edad, el sexo femenino, la presencia de insuficiencia pancreática exocrina y de la mutación ΔF5085,6. Es importante su diagnóstico y el tratamiento precoz, ya que su presencia se asocia con un empeoramiento del estado nutricional y/o de la función pulmonar (FP)6, así como una elevada morbimortalidad; todo ello es mejorable con un buen control metabólico7,8. No obstante, a pesar de las evidencias acerca de la influencia del control de las AHC en la evolución de la FQ, en el momento actual no hay consenso en cuanto a la actitud terapéutica a tomar en las fases precoces de estas AHC9,10.
Debido a que la AHC, inicialmente, suele ser asintomática9,11, es necesario realizar un cribado anual mediante el test de sobrecarga oral de glucosa (SOG) a partir de los 10 años de edad y/o cuando haya comenzado la pubertad9,10. Tanto la alteración de la glucemia en ayunas como de la hemoglobina glicosilada (HbA1c) son eventos tardíos9.
Hasta ahora, la realización de una SOG era el método más sensible para detectar la AHC12. Sin embargo, en la actualidad contamos con sistemas de monitorización continua de glucosa intersticial (CGMS, Medtronic Minimed, Northridge, CA) que son capaces de detectar un mayor número de fluctuaciones de glucosa en la vida diaria. Distintos estudios13–15 han demostrado una buena correlación entre las cifras de glucosa intersticial y la glucemia capilar y venosa, tanto en sujetos sanos como en personas con diabetes; esta correlación también se ha confirmado en pacientes con FQ16. Esta técnica de monitorización de glucosa puede permitir detectar más tempranamente las AHC con el objetivo de iniciar un tratamiento precoz. Aunque en la actualidad no hay mucha experiencia en la utilización del CGMS en FQ, algunos autores defienden su uso17–20.
El objetivo principal del estudio es evaluar la utilidad del CGMS para la detección precoz de las AHC, en especial la diabetes, en pacientes con FQ. Como objetivos secundarios nos planteamos analizar las modificaciones del estado nutricional y de la FP en el momento del diagnóstico de la AHC respecto al año previo y determinar si la HbA1c es un buen predictor de DRFQ.
Pacientes y métodosDurante los años 2004–2007 se realizaron, en la unidad de fibrosis quística, 50 SOG en 41 pacientes de edades comprendidas entre los 10 y los 22 años. Ninguno presentaba enfermedad intercurrente ni recibía tratamiento esteroideo sistémico. En 16 pacientes se evidenció una AHC no detectada previamente. De éstos, 13 aceptaron la CGMS. Los pacientes y/o sus padres dieron el consentimiento informado para participar en el estudio.
Definimos AHC según los criterios de la Asociación Americana de Diabetes21, también aplicables a los enfermos con FQ22. Según estos criterios, se considera alteración de la glucemia en ayunas cuando ésta está en 100–125mg/dl; alteración de la tolerancia a la glucosa cuando la glucemia a las 2h de la SOG es de 140–199mg/dl, y diabetes cuando la glucemia en ayunas es ⩾126mg/dl y/o la glucemia a las 2h de la SOG es ⩾200mg/dl.
En cada paciente se valoró: edad al diagnóstico de la FQ (en meses), edad al diagnóstico de la AHC (en años), sexo, alteración genética relacionada con FQ y función pancreática exocrina. En el momento del estudio y en el año anterior se analizó: el estado nutricional mediante el índice de masa corporal (IMC) en desviaciones estándar (IMC en DE)23 y la FP mediante la capacidad vital forzada (CVF, %) y el volumen espiratorio forzado en el primer segundo (FEV1, %); se utilizó el valor en porcentaje sobre el teórico. Entendemos por empeoramiento del estado nutricional y/o de la función pulmonar la caída de los valores de DE del IMC, de la CVF y/o del FEV1 (%), en cualquier cuantía, al comparar las cifras del momento del diagnóstico de la AHC con las del año previo. Para analizar estas variables cuantitativas, realizamos un análisis estadístico con el programa SPSS, versión 15.0. Asumiendo que nuestra muestra no era normal, utilizamos la prueba de la U de Mann-Whitney y la prueba de Wilcoxon para pruebas no paramétricas con nivel de significación estadística p<0,05. Para definir las variables usamos la mediana, con el rango intercuartílico (percentil 25-75) como medida de dispersión.
En cada paciente se hizo un test de SOG (1,75g/kg glucosa [máximo de 75g]) y una monitorización continua de glucosa intersticial (CGMS-Medtronic Minimed). Ésta se realizó de forma ambulatoria después de instruir correctamente en su manejo a los enfermos y sus familiares. La monitorización se realizó mediante un sensor que quedaba insertado en la zona glútea, durante un periodo mínimo de 4 días. Para el calibrado del sensor, se introdujeron cuatro determinaciones de glucemia capilar al día. Durante los días de monitorización, el paciente rellenó un diario especificando la ingesta de hidratos de carbono y el ejercicio realizado. Finalizada la monitorización, los datos se descargaron por medio del programa informático del sistema. De estos datos, analizamos la media y los intervalos de los valores de glucosa: global, en ayunas y posprandial (2h tras desayuno, comida y cena); además, las excursiones de glucosa >140mg/dl en cualquier momento del día (en número absoluto y en porcentaje respecto al tiempo total de la monitorización). Dichos valores los comparamos con las glucemias basales y a las 2h de la SOG. Además, los relacionamos con las concentraciones de HbA1c de cada paciente (valor normal, 5,3±0,3, HPLC Menarini).
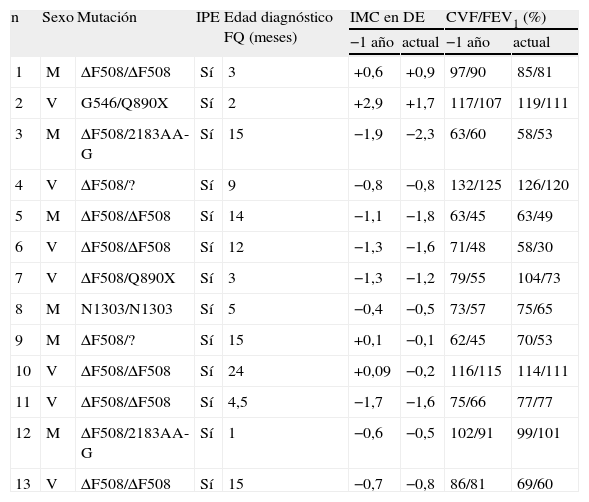
ResultadosLa mediana de edad al diagnóstico de FQ es 9 (intervalo, 3-15) meses y al diagnóstico de la AHC es de 15,2 (14–19,2) años; 7 (53,8%) de los 13 pacientes son varones. El 84,6% presentan la mutación ΔF508 (el 46,1% en homocigosis). Todos tienen insuficiencia pancreática exocrina. Ningún paciente refería clínica cardinal de diabetes. Las características clínicas de los pacientes se muestran en la tabla 1.
Características generales de los pacientes
| n | Sexo | Mutación | IPE | Edad diagnóstico FQ (meses) | IMC en DE | CVF/FEV1 (%) | ||
| −1 año | actual | −1 año | actual | |||||
| 1 | M | ΔF508/ΔF508 | Sí | 3 | +0,6 | +0,9 | 97/90 | 85/81 |
| 2 | V | G546/Q890X | Sí | 2 | +2,9 | +1,7 | 117/107 | 119/111 |
| 3 | M | ΔF508/2183AA-G | Sí | 15 | −1,9 | −2,3 | 63/60 | 58/53 |
| 4 | V | ΔF508/? | Sí | 9 | −0,8 | −0,8 | 132/125 | 126/120 |
| 5 | M | ΔF508/ΔF508 | Sí | 14 | −1,1 | −1,8 | 63/45 | 63/49 |
| 6 | V | ΔF508/ΔF508 | Sí | 12 | −1,3 | −1,6 | 71/48 | 58/30 |
| 7 | V | ΔF508/Q890X | Sí | 3 | −1,3 | −1,2 | 79/55 | 104/73 |
| 8 | M | N1303/N1303 | Sí | 5 | −0,4 | −0,5 | 73/57 | 75/65 |
| 9 | M | ΔF508/? | Sí | 15 | +0,1 | −0,1 | 62/45 | 70/53 |
| 10 | V | ΔF508/ΔF508 | Sí | 24 | +0,09 | −0,2 | 116/115 | 114/111 |
| 11 | V | ΔF508/ΔF508 | Sí | 4,5 | −1,7 | −1,6 | 75/66 | 77/77 |
| 12 | M | ΔF508/2183AA-G | Sí | 1 | −0,6 | −0,5 | 102/91 | 99/101 |
| 13 | V | ΔF508/ΔF508 | Sí | 15 | −0,7 | −0,8 | 86/81 | 69/60 |
CVF: capacidad vital forzada; FEV1: volumen espiratorio forzado en el primer segundo; FQ: fibrosis quística; IMC en DE: índice de masa corporal en desviaciones estándar; IPE: insuficiencia pancreática exocrina; M: mujer; V: varón; ?: mutación desconocida.
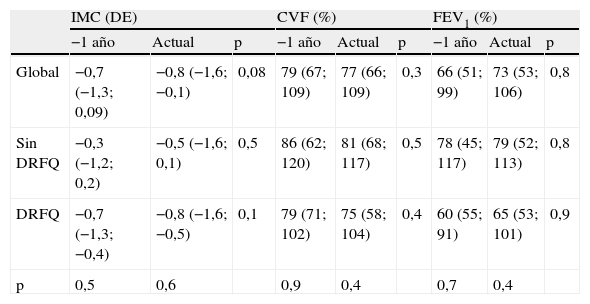
En el análisis retrospectivo, objetivamos un empeoramiento en el último año, aunque no estadísticamente significativo, del estado nutricional (IMC en DE) en el 66,6% de los pacientes, de la FP (CVF y/o FEV1) en el 58,3% y de ambos en el 20,7% (tabla 1). Cuando dividimos a la muestra en 2 subgrupos, según los resultados de la monitorización con CGMS, y comparamos la evolución de estas variables entre los subgrupos, apreciamos en aquellos pacientes en los que se detectó diabetes un mayor deterioro de los tres parámetros, pero sin significación estadística (tabla 2).
Evolución del estado nutricional y de la función pulmonar
| IMC (DE) | CVF (%) | FEV1 (%) | |||||||
| −1 año | Actual | p | −1 año | Actual | p | −1 año | Actual | p | |
| Global | −0,7 (−1,3; 0,09) | −0,8 (−1,6; −0,1) | 0,08 | 79 (67; 109) | 77 (66; 109) | 0,3 | 66 (51; 99) | 73 (53; 106) | 0,8 |
| Sin DRFQ | −0,3 (−1,2; 0,2) | −0,5 (−1,6; 0,1) | 0,5 | 86 (62; 120) | 81 (68; 117) | 0,5 | 78 (45; 117) | 79 (52; 113) | 0,8 |
| DRFQ | −0,7 (−1,3; −0,4) | −0,8 (−1,6; −0,5) | 0,1 | 79 (71; 102) | 75 (58; 104) | 0,4 | 60 (55; 91) | 65 (53; 101) | 0,9 |
| p | 0,5 | 0,6 | 0,9 | 0,4 | 0,7 | 0,4 | |||
DRFQ: diabetes relacionada con la fibrosis quística; CVF: capacidad vital forzada; FEV1: volumen espiratorio forzado en el primer segundo; IMC en DE: índice de masa corporal en desviaciones estándar.
Variables definidas con la mediana y el rango intercuartílico (percentiles 25 y 75).
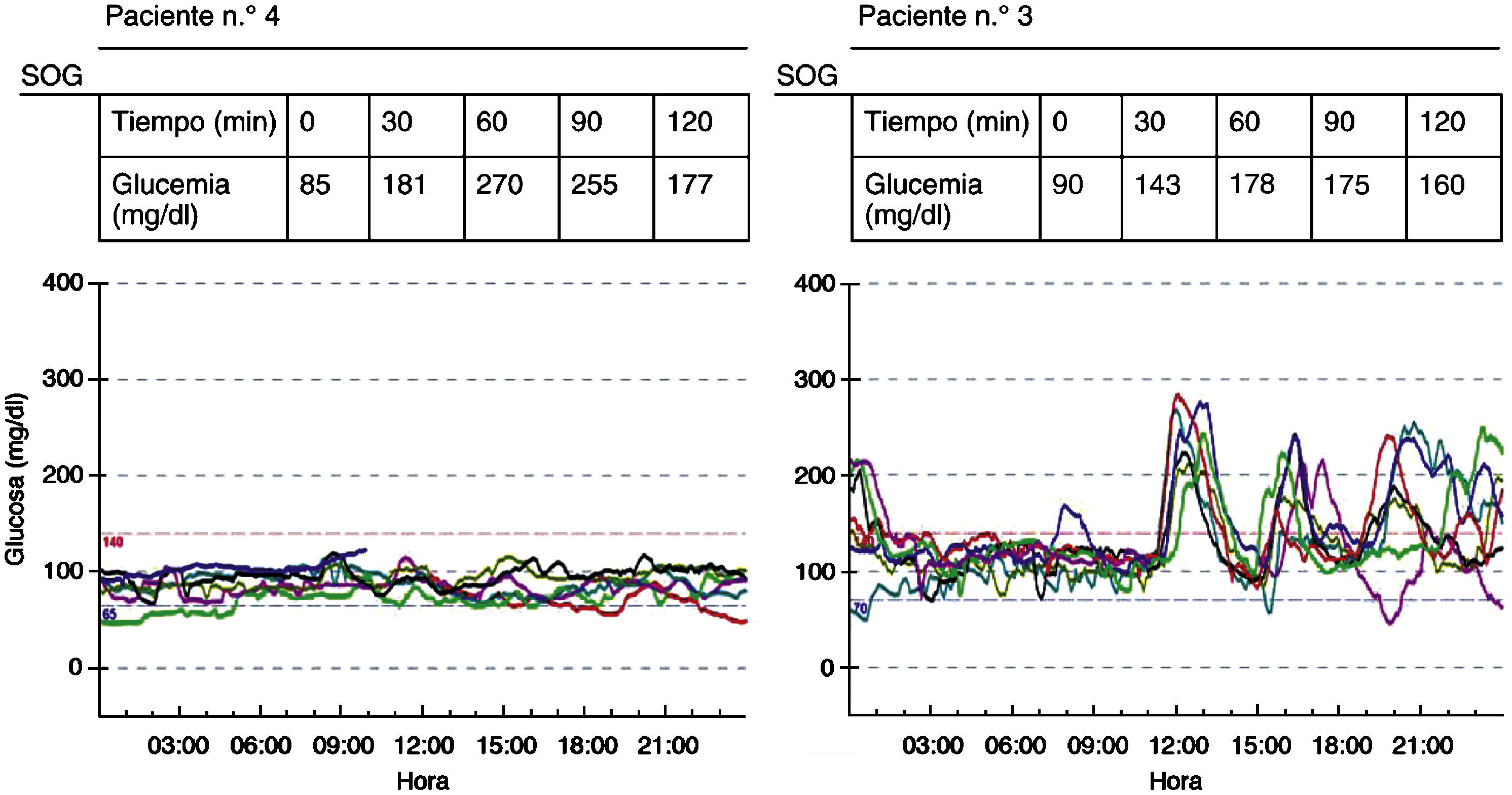
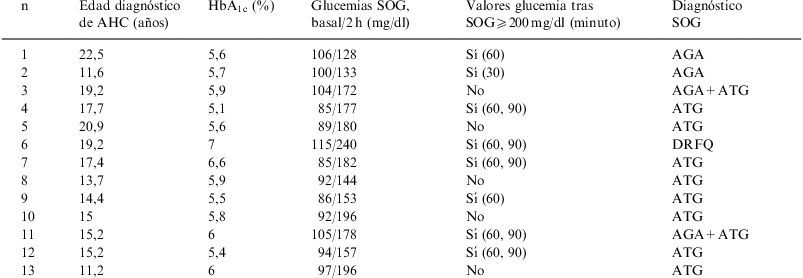
En la SOG (tabla 3) encontramos: alteración de la tolerancia a la glucosa (ATG) en el 76,9% de los pacientes, alteración de la glucemia en ayunas (AGA) en el 38,4% y diabetes en un único paciente (7,6%). Hay que señalar que en 8 de los 13 pacientes se evidencian glucemias ⩾200mg/dl en momentos intermedios de la curva de glucemia. Detectamos concentraciones de HbA1c patológicas en 4 (30,7%) pacientes.
Resultados de la hemoglobina glicosilada (HbA1c) y de la sobrecarga oral de glucosa (SOG)
| n | Edad diagnóstico de AHC (años) | HbA1c (%) | Glucemias SOG, basal/2h (mg/dl) | Valores glucemia tras SOG⩾200mg/dl (minuto) | Diagnóstico SOG |
| 1 | 22,5 | 5,6 | 106/128 | Sí (60) | AGA |
| 2 | 11,6 | 5,7 | 100/133 | Sí (30) | AGA |
| 3 | 19,2 | 5,9 | 104/172 | No | AGA+ATG |
| 4 | 17,7 | 5,1 | 85/177 | Sí (60, 90) | ATG |
| 5 | 20,9 | 5,6 | 89/180 | No | ATG |
| 6 | 19,2 | 7 | 115/240 | Sí (60, 90) | DRFQ |
| 7 | 17,4 | 6,6 | 85/182 | Sí (60, 90) | ATG |
| 8 | 13,7 | 5,9 | 92/144 | No | ATG |
| 9 | 14,4 | 5,5 | 86/153 | Sí (60) | ATG |
| 10 | 15 | 5,8 | 92/196 | No | ATG |
| 11 | 15,2 | 6 | 105/178 | Sí (60, 90) | AGA+ATG |
| 12 | 15,2 | 5,4 | 94/157 | Sí (60, 90) | ATG |
| 13 | 11,2 | 6 | 97/196 | No | ATG |
AGA: alteración de glucemia en ayunas; AHC: alteración hidrocarbonada; ATG: alteración de la tolerancia a la glucosa; DRFQ: diabetes relacionada con fibrosis quística.
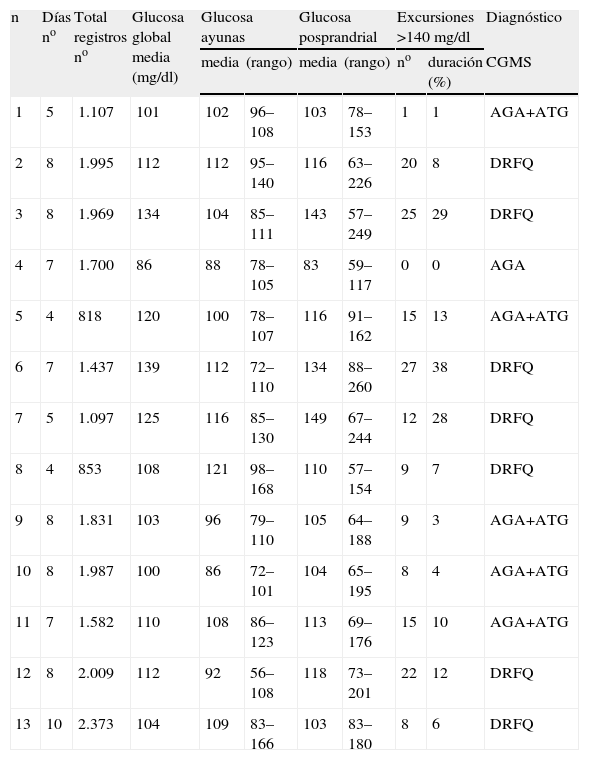
No hubo complicaciones durante la monitorización continua de glucosa. Ésta se mantuvo una media de 6,8 (4–10) días. Los resultados de CGMS quedan expuestos en la tabla 4. Encontramos una glucosa media global alterada en el 91,6% de los pacientes, en 2 de ellos en rango de diabetes.
Resultados de la monitorización continua de glucosa (CGMS)
| n | Días no | Total registros no | Glucosa global media (mg/dl) | Glucosa ayunas | Glucosa posprandrial | Excursiones >140mg/dl | Diagnóstico | |||
| media | (rango) | media | (rango) | no | duración (%) | CGMS | ||||
| 1 | 5 | 1.107 | 101 | 102 | 96–108 | 103 | 78–153 | 1 | 1 | AGA+ATG |
| 2 | 8 | 1.995 | 112 | 112 | 95–140 | 116 | 63–226 | 20 | 8 | DRFQ |
| 3 | 8 | 1.969 | 134 | 104 | 85–111 | 143 | 57–249 | 25 | 29 | DRFQ |
| 4 | 7 | 1.700 | 86 | 88 | 78–105 | 83 | 59–117 | 0 | 0 | AGA |
| 5 | 4 | 818 | 120 | 100 | 78–107 | 116 | 91–162 | 15 | 13 | AGA+ATG |
| 6 | 7 | 1.437 | 139 | 112 | 72–110 | 134 | 88–260 | 27 | 38 | DRFQ |
| 7 | 5 | 1.097 | 125 | 116 | 85–130 | 149 | 67–244 | 12 | 28 | DRFQ |
| 8 | 4 | 853 | 108 | 121 | 98–168 | 110 | 57–154 | 9 | 7 | DRFQ |
| 9 | 8 | 1.831 | 103 | 96 | 79–110 | 105 | 64–188 | 9 | 3 | AGA+ATG |
| 10 | 8 | 1.987 | 100 | 86 | 72–101 | 104 | 65–195 | 8 | 4 | AGA+ATG |
| 11 | 7 | 1.582 | 110 | 108 | 86–123 | 113 | 69–176 | 15 | 10 | AGA+ATG |
| 12 | 8 | 2.009 | 112 | 92 | 56–108 | 118 | 73–201 | 22 | 12 | DRFQ |
| 13 | 10 | 2.373 | 104 | 109 | 83–166 | 103 | 83–180 | 8 | 6 | DRFQ |
AGA: alteración de la glucemia en ayunas; ATG: alteración de la tolerancia a la glucosa; DRFQ: diabetes relacionada con fibrosis quística.
Valores de glucosa expresados en mg/dl.
Según el análisis de la glucosa posprandial en el CGMS: el 16,6% de los pacientes presentan cifras patológicas del valor de glucosa media; 12 de los 13 pacientes tienen valores patológicos teniendo en cuenta el valor máximo del rango (el 50% ATG, y el 41,6% diabetes).
En el análisis de la glucosa en ayunas durante el CGMS, al valorar el valor medio, el 65% de los sujetos cumplen criterios de AGA y ninguno presenta concentraciones de glucosa en el rango de diabetes. Sin embargo, teniendo en cuenta el valor máximo del rango, todos los pacientes, en algún momento de la monitorización, tienen cifras por encima de la normalidad; en el 30,7% de ellos está en el rango de diabetes.
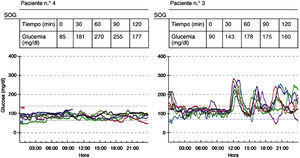
La figura 1 muestra los resultados del CGMS de 2 pacientes diagnosticados de ATG con la SOG, en los que se evidencia una diferencia clara en las fluctuaciones de glucosa durante la monitorización.
DiscusiónEn los consensos internacionales el diagnóstico de la AHC en los pacientes con FQ se basa en la glucemia en ayunas o en la SOG9,10,24. En la actualidad, los sistemas de monitorización continua de glucosa pueden permitir la búsqueda de un diagnóstico más precoz, con la ventaja de que la valoración se realiza en condiciones de la vida habitual de los pacientes17–19.
Con el estudio con CGMS hemos detectado un mayor número de valores patológicos de glucosa en comparación con los resultados del test de SOG y, sobre todo, nos ha permitido el diagnóstico más precoz de diabetes; hallazgos similares han sido obtenidos por otros autores17–20. Aún no hay consenso sobre su significación clínica y la actitud terapéutica a seguir9,10,12,25.
Sería importante conocer las fluctuaciones de glucosa durante las 24h en pacientes con FQ, tanto en el caso de normalidad como de alteración hidrocarbonada tras SOG. Hay pocos estudios mediante CGMS en pacientes con FQ y normalidad hidrocarbonada17,19. Los datos obtenidos mediante CGMS demuestran que las determinaciones convencionales del test de SOG subestiman las AHC en los pacientes con FQ17,19,20,25.
En nuestro estudio también hemos constatado que la HbA1c no es buen parámetro para el diagnóstico precoz de la AHC en la FQ20,26.
Además, en nuestros pacientes hemos evidenciado la existencia de insuficiencia pancreática exocrina y la presencia frecuente de la mutación ΔF508, conocidos ya como factores de riesgo de AHC en los pacientes con FQ5,6. Sin embargo, no hemos encontrado el predominio del sexo femenino descrito en dichos estudios.
El hecho de que la mayoría de nuestros pacientes con AHC tengan menos de 18 años apoya la necesidad de realizar el cribado de la AHC desde el inicio de la segunda década de la vida, como establecen los consensos existentes9,10.
En más de la mitad de los pacientes hemos evidenciado un deterioro del estado nutricional y/o de la FP, sin causa aparente, en el momento del diagnóstico de la AHC respecto al año previo. Este deterioro debe ser considerado como un signo de alerta para descartar activamente la AHC en la FQ7,11,27,28.
Como ya se ha descrito en pacientes con FQ antes del diagnóstico de la diabetes29, hemos detectado hipoglucemias bioquímicas, asintomáticas, durante la monitorización continua de glucosa. Éstas, posiblemente, son debidas a una secreción inadecuada de insulina, pero su etiología no está totalmente esclarecida.
En conclusión, en los pacientes con FQ la monitorización continua de glucosa es un método más sensible que la SOG para detectar precozmente las AHC, y especialmente la diabetes; pero todavía no está admitida su utilización como prueba de cribado. La determinación de la HbA1c no permite un diagnóstico precoz de las AHC en estos pacientes. Finalmente, ante un empeoramiento del estado nutricional y/o la función pulmonar sin causa aparente, se debe descartar la presencia de AHC.
Se precisan estudios con un mayor número de sujetos, y realizar la monitorización continua de glucosa a pacientes con FQ y normalidad de la SOG, para determinar si en la FQ se debe modificar el método de cribado y/o los criterios diagnósticos de alteración hidrocarbonada. Es importante, asimismo, evaluar la repercusión clínica de la detección y el tratamiento precoz de dichas alteraciones.