El Staphylococcus aureus resistente a la meticilina adquirido en la comunidad (SARM-AC) es actualmente un microorganismo emergente en todo el mundo, que puede producir infecciones cutáneas y de partes blandas, algunas de éstas graves, como la fascitis necrosante, además de neumonía y osteomielitis.
A continuación se presenta un caso de fascitis necrosante en un niño de 14 meses de edad, que se confirmó mediante resonancia magnética, producido por SARM-AC productor de leucocidina de Panton-Valentine. La evolución clínica fue buena después del tratamiento quirúrgico precoz y de la administración de clindamicina por vía intravenosa durante 2 semanas. En este trabajo se revisan los aspectos microbiológicos y las pautas de tratamiento de estas infecciones.
Community-Acquired Methicillin-Resistant Staphylococcus aureus (CA-MRSA) is a worldwide emerging pathogen that is able to produce serious skin and soft- tissue infections such as necrotizing fasciitis, as well as pneumonia and osteomyelitis. We present a 14 month child with necrotizing fasciitis, confirmed by magnetic resonance imaging, produced by CA-MRSA Panton-Valentine leukocidin producer. The clinical outcome was good after early surgical treatment and the administration of intravenous clindamycin for two weeks. We review microbiological aspects and treatment guidelines of these infections.
Los cambios epidemiológicos observados en los últimos años respecto a las infecciones producidas por Staphylococcus aureus son un hecho de importancia clínica y terapéutica, de gran trascendencia en la salud pública. Se observan con mayor frecuencia en la población pediátrica. En los últimos 10 años, se ha producido la emergencia de infecciones por S. aureus resistente a la meticilina adquirido en la comunidad (SARM-AC) en sujetos sin factores de riesgo conocidos y que no tienen relación con el sistema sanitario, en diferentes países (en especial en Estados Unidos). En 1998 Herold et al1, y un año después los Centers for Disease Control and Prevention2, publicaron las primeras descripciones en niños. Las infecciones más frecuentes se localizan en la piel y en las partes blandas, como en la primera serie pediátrica publicada en España en 20063.
La fascitis necrosante es una infección de partes blandas, rápidamente progresiva, que afecta a la piel, al tejido celular subcutáneo, a la fascia superficial y, ocasionalmente, a la fascia profunda; esta infección produce una necrosis hística con grave toxicidad sistémica. Se trata de una infección poco frecuente en los niños (de 10 a 12 casos al año en España) pero con una elevada mortalidad4. La etiología es generalmente polimicrobiana (del 70 al 80% de los casos por microorganismos aerobios y anaerobios); Streptococcus pyogenes es el más frecuente5. El S. aureus causa aproximadamente un 70% de las infecciones cutáneas y de partes blandas en el niño, y suele encontrarse asociado a S. pyogenes como causa de fascitis4, pero raramente es el único microorganismo.
A continuación se presenta el caso clínico de un niño de 14 meses con una fascitis necrosante por SARM-AC productor de leucocidina de Panton-Valentine, tratado con clindamicina por vía intravenosa y drenaje quirúrgico, con buena evolución clínica.
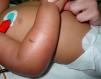
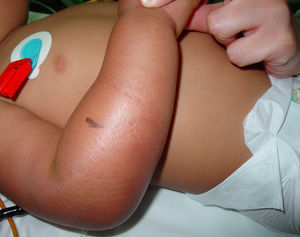
Observación clínicaVarón de 14 meses de edad, nacido en España, hijo de padres ecuatorianos, sin antecedentes patológicos de interés, que presenta tumefacción dolorosa del brazo derecho y fiebre de 48 h de evolución. Los padres refieren el antecedente de una picadura de insecto en el brazo 2 días antes. En la exploración clínica destaca la presencia de fiebre elevada (temperatura axilar de 39°C), irritabilidad y lesión en el antebrazo derecho caracterizada por edema circular, dolor, calor y escaso eritema que se extiende desde la mano hasta el pliegue antecubital, con una zona más eritematosa en la cara lateral (fig. 1). Se le diagnostica celulitis y se inicia antibioticoterapia intravenosa con dosis de 100mg/kg/día de amoxicilina con ácido clavulánico. Los resultados del análisis de sangre son hemoglobina de 12,3g/dl, hematocrito del 38,3%, recuento de leucocitos de 11,4×109/l (el 2% son metamielocitos, el 13% son bandas, el 58% son segmentados, el 13% son linfocitos, el 14% son monocitos), recuento de plaquetas de 315 × 109/l y proteína C reactiva (PCR) de 13mg/dl. Las pruebas de coagulación y de funcionalismo hepático y renal son normales. El hemocultivo es negativo.
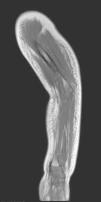
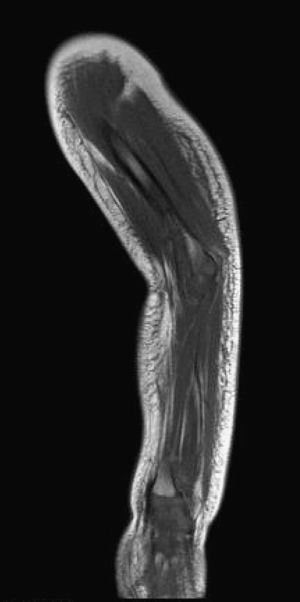
A las 12 h del ingreso el niño empeora y se aprecia mal estado general, extensión de la tumefacción cutánea hasta la región deltoidea, aumento del dolor al tacto y elevación de la PCR a 32mg/dl. Ante la sospecha clínica de fascitis necrosante, se amplía el espectro antibacteriano del tratamiento con clindamicina y se realiza una resonancia magnética; ésta muestra en el dorso del antebrazo una extensa colección subcutánea en relación con la fascia muscular, con hipercaptación y afectación entre los grupos musculares, que sugiere la presencia de fascitis (fig. 2). Se realiza intervención quirúrgica con abordaje dorsal del antebrazo, previa extracción de una muestra de pus del absceso para cultivo y tinción de Gram. Tras limpiar con suero fisiológico y raspar el tejido subcutáneo necrosado y la fascia, se dejan puntos de aproximación y un drenaje subcutáneo. En el cultivo se aísla S. aureus resistente a penicilina y oxacilina, y sensible a ciprofloxacino, clindamicina, cotrimoxazol, eritromicina, gentamicina, linezolid, rifampicina, teicoplanina, tobramicina y vancomicina. Se mantiene monoterapia con clindamicina intravenosa durante 14 días. Los estudios de frotis nasal y cutáneos son negativos; el estudio inmunitario (inmunoglobulinas, complemento y subpoblaciones linfocitarias) es normal.
La detección de la resistencia a la meticilina de esta cepa de S. aureus se realiza mediante el método de difusión en agar, con discos de oxacilina (5μg) y cefoxitina (30μg) (Neo-Sensitabs®; Rosco Diagnostica); la detección del gen mecA se realiza con las técnicas de aglutinación con látex (Slidex® MRSA Detection, bioMérieux) y la de reacción en cadena de la polimerasa se realiza con los cebadores de nitrógeno ureico corporal 1 y 2, mecA1 y mecA2. Mediante esta técnica se detecta que la cepa es productora de leucocidina de Panton-Valentine. La investigación de anaerobios, tanto en el hemocultivo como en el pus del absceso, es negativa.
La evolución del niño es favorable, con rápida disminución de la neutrofilia y los reactantes de fase aguda. Se realizan revisiones quirúrgicas y lavados diarios con suero fisiológico hasta que desaparece el tejido necrótico y se inicia la formación de tejido de granulación. En revisiones posteriores se observa una extensa cicatriz que se extiende desde la muñeca hasta el codo, sin que se aprecie déficits motores ni sensitivos.
DiscusiónLa definición epidemiológica de SARM-AC se refiere a una cepa de S. aureus resistente a la meticilina (SARM) que se aísla en un paciente ambulatorio o en las primeras 48h de ingreso en el hospital, sin historia en el año precedente de infección o colonización por SARM ni antecedentes de hospitalización o ingreso en un centro sociosanitario de larga estancia, de diálisis o cirugía, y que no es portador de un dispositivo intravascular o percutáneo6. Estudios recientes muestran un aumento del número de infecciones causadas por SARM-AC, sobre todo en Estados Unidos, localizadas preferentemente en la piel y las partes blandas; algunas de éstas son graves, como la fascitis necrosante, y también de otras infecciones, como la neumonía necrosante, la osteomielitis y el síndrome del shock tóxico6–9.
Las características microbiológicas de los SARM-AC incluyen la presencia del gen mecA, que forma parte de un islote genómico conocido como Staphylococcal Cassette Chromosome mec (SCCmec), que es el causante de la resistencia a la meticilina. Este gen codifica una nueva proteína ligada a la penicilina (PBP): la PBP-2a o PBP-2′, con actividad transpeptidasa y muy baja afinidad por los antibióticos betalactámicos, por lo que estas cepas deben considerarse resistentes a estos antiinfecciosos. Hay 5 tipos de SCCmec, el IV y el V en SARM-AC y el I, el II y el III en SARM hospitalario. Las cepas de SARM-AC son sensibles a los antibióticos no betalactámicos, como clindamicina, cotrimoxazol, tetraciclinas, fluoroquinolonas, aminoglucósidos y macrólidos; esta característica las diferencia de los SARM adquiridos en el hospital, que suelen ser multirresistentes6,10. Este hecho es importante ya que, al menos por ahora, permite establecer la sospecha de SARM-AC; sin embargo, también se han observado SARM-AC con resistencia adicional a la eritromicina. Otra característica de estas cepas es la de poseer distintos factores de virulencia, en especial la leucocidina de Panton-Valentine, una toxina que ocasiona necrosis hística así como formación de abscesos, y que contribuye a la gravedad de estas infecciones (sobre todo de las cutáneas y de la neumonía), aunque hay cierta controversia respecto a la confirmación de lo observado en el modelo animal. En el SARM nosocomial la producción de leucocidina de Panton-Valentine es menos frecuente (inferior al 5% de las cepas)6,10. Otros factores de virulencia se han identificado en el SARM-AC; los péptidos citolíticos de modulina soluble en fenol y el elemento móvil catabólico de arginina se han descrito recientemente como determinantes de gravedad en estas infecciones.
Las manifestaciones clínicas de la fascitis necrosante pueden ser inespecíficas en la fase inicial, lo que suele retrasar el diagnóstico y el tratamiento, y con esto empeorar el pronóstico. El diagnóstico debe considerarse ante cualquier infección de partes blandas acompañada de signos de toxicidad sistémica y de edema, incluso en ausencia de fiebre y leucocitosis. En la sintomatología local destacan la presencia de dolor desproporcionado a las manifestaciones cutáneas, edema y eritema con áreas de anestesia, así como una piel con «buen aspecto» al inicio, pero con aparición posterior de ampollas. El tejido subcutáneo se muestra pálido a la exploración quirúrgica y se despega con facilidad de la fascia, que es una característica indicativa de fascitis necrosante.
Los factores predisponentes en el niño son la varicela, la onfalitis, la comorbilidad o la inmunosupresión (diabetes mellitus, neoplasias, infección por el virus de la inmunodeficiencia humana) y las lesiones traumáticas o quirúrgicas de las extremidades y el abdomen. Sin embargo, puede aparecer también tras contusiones o quemaduras, y es frecuente el antecedente en la anamnesis de una picadura (de araña en Estados Unidos) por el aspecto rojo de la lesión, en la que se pueden desarrollar áreas necróticas que confunden a veces a enfermos y médicos11,12. El diagnóstico requiere un índice alto de sospecha y, al inicio de la enfermedad, es correcto sólo entre un 15 y un 30% de los casos. La celulitis es el diagnóstico erróneo inicial más frecuente (59%)5.
En las formas leves y moderadas de las infecciones cutáneas y de partes blandas por SARM-AC, el tratamiento de elección es cotrimoxazol o clindamicina por vía oral; en las formas graves, éstos se utilizan en tratamiento secuencial, de vía intravenosa a oral. La clindamicina sólo se debe utilizar si la cepa es sensible a la eritromicina; si es resistente, hay que descartar una resistencia inducible a la clindamicina, mediante el denominado D-test (zona D en la difusión en disco)10.
En las formas graves se utilizará clindamicina o vancomicina por vía intravenosa; si hay sepsis, afectación pulmonar o infecciones multifocales, hay que administrar vancomicina. Cuando el sujeto tiene insuficiencia renal o se observa fracaso terapéutico con la vancomicina, se recomienda daptomicina o linezolid; la primera si hay bacteriemia asociada y el segundo si también hay afectación pulmonar. El linezolid tiene la ventaja de su administración oral, pero no se recomienda si hay bacteriemia junto con la infección cutánea13–19. La clindamicina, el linezolid y el ácido fusídico inhiben la producción de leucocidina de Panton-Valentine y otros factores de virulencia de los SARM16.
Si se sospecha una fascitis necrosante debe iniciarse antibioticoterapia empírica para microorganismos aerobios y anaerobios. La pauta inicial es una cefalosporina de tercera generación asociada a otro antimicrobiano con actividad frente a anaerobios (clindamicina o metronidazol)5. En la fascitis por S. pyogenes se utiliza la asociación de penicilina G sódica y clindamicina. Si se sospecha una fascitis por SARM-AC, el tratamiento recomendado es clindamicina, vancomicina, linezolid, daptomicina o tigeciclina. Otros antiinfecciosos, todavía en investigación, podrán ser en un futuro alternativas en el tratamiento de las infecciones graves de piel y de partes blandas, incluidas las producidas por SARM y SARM-AC (tabla 1)13–19.
Antibioticoterapia en las infecciones por Staphylococcus aureus resistente a la meticilina adquirido en la comunidad
| Vía oral | Vía parenteral |
| Cotrimoxazol | Clindamicina |
| Clindamicina | Vancomicina |
| Tetraciclinas (doxiciclina, minociclina) | Teicoplanina |
| Ciprofloxacino | Linezolid |
| Linezolid | Daptomicina |
| Rifampicina con ácido fusídico | Tigeciclina |
| Quinupristina y dalfopristina | |
| Rifampicina con ácido fusídico | |
| Antiinfecciosos no comercializados* |
Además del tratamiento antibiótico, es fundamental realizar una exploración quirúrgica precoz, con una resección amplia de los tejidos necróticos. La tomografía computarizada y la resonancia magnética ayudan a delimitar la extensión lesional y también son de gran utilidad para el diagnóstico diferencial entre celulitis y fascitis.
Diversos estudios proponen el uso de dosis elevadas de inmunoglobulina polivalente por vía intravenosa como tratamiento coadyuvante de la fascitis debido a su poder neutralizante de los superantígenos bacterianos10,20. La cámara hiperbárica no suele usarse en niños10. El tratamiento quirúrgico precoz es el único medio que permite modificar el pronóstico de la enfermedad.
Las medidas de control para evitar la diseminación hospitalaria del SARM-AC son el aislamiento de contacto del enfermo hasta no disponer de 3 cultivos seriados negativos. En los sujetos con infecciones cutáneas leves que permanecen en su domicilio, se extremarán las medidas de higiene, en especial de manos, y se cubrirá la lesión con un apósito. El cribado de los contactos comunitarios para la identificación de portadores no se recomienda, excepto en situación de brote. La descolonización sólo está indicada en sujetos con infecciones recurrentes o en casos de brotes, y se realizará con mupirocina nasal y lavado de la piel con jabón de clorhexidina durante 5 días. En sujetos con recurrencias o si el S. aureus es resistente a la mupirocina, se utilizará ácido fusídico local y cotrimoxazol oral durante 7 días11,17.
Al doctor Ignasi Barber por su ayuda en el diagnóstico por la imagen del enfermo.