Introducción
La detección precoz de la infección por virus de la inmunodeficiencia humana (VIH) en niños es crucial para establecer un correcto seguimiento y tratamiento del paciente, así como para mejorar su pronóstico, evitando las infecciones oportunistas, la diseminación neurológica que produce alteraciones irreversibles y el deterioro inmunológico.
El diagnóstico de infección pediátrica por VIH, de acuerdo a los criterios del Center for Disease Control and Prevention (CDC) de 1994 1, requiere, en los niños menores de 18 meses, 2 resultados positivos, en 2 muestras de sangre diferentes separados una semana, de pruebas directas de virus, siendo la más utilizada la reacción en cadena de la polimerasa (PCR), ya sea de ARN o de ADN proviral. Sin embargo, en niños por encima de los 18 meses, el diagnóstico se basa en la serología, con la detección de anticuerpos anti-VIH por la técnica de análisis de inmunoabsorción ligada a enzimas (ELISA) y confirmados por Western blot. Se descarta de forma razonable la infección por VIH en el niño cuando se obtienen dos resultados negativos de PCR después del primer mes, y al menos uno de ellos es posterior al cuarto mes de vida 2, comprobando posteriormente la serorreversión.
Se habla de exposición perinatal al VIH en aquel niño menor de 18 meses seropositivo por ELISA y Western blot, hijo de madre infectada y no habiendo existido riesgo de otra vía de infección. La serorreversión se produce en el niño nacido de madre VIH positiva que presenta dos o más pruebas de anticuerpos negativas entre los 6 y 18 meses; basta una prueba si el niño es mayor de 18 meses.
Presentamos un paciente en el que el diagnóstico de infección por VIH-1 se realizó tardíamente por presentar dos resultados negativos de ADN proviral a los 2 y a los 4 meses de vida.
Paciente
Niña nacida en 2002, tras embarazo no controlado, de madre procedente de Camerún. Parto vaginal, a término. Se desconoce el tiempo de amniorrexis. En la sangre de cordón se detectó serología positiva para VIH, por lo que se inició profilaxis con zidovudina a las 48 h de vida de la niña, manteniéndose durante 6 semanas.
Por riesgo de infección, la paciente fue controlada a los 2, 4, 6, 12 y 18 meses. Las PCR de ADN proviral (Versant HIV-1 RNA 3.0 Assay Bayer) realizadas a los 2 y 4 meses fueron negativas. Por esta razón se clasificó a la niña como expuesta no infectada, según los criterios del CDC 1 comentados anteriormente.
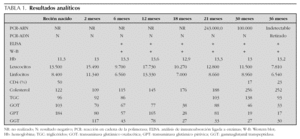
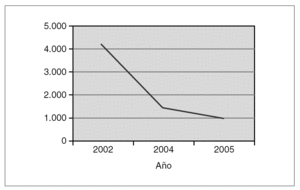
A los 2 meses de vida la paciente presentaba en el estudio inmunológico una proporción de linfocitos CD4 del 50 % (4.200 cél./μl).
Los anticuerpos anti-VIH-1 continuaron siendo positivos por encima de los 18 meses. Esto llevó a realizar una nueva PCR, esta vez de ARN (Amplicor HIV-1 Monitor Test 1.5 Roche), que resultó positiva, revelando una carga viral de 243.000 copias/ml. El diagnóstico de infección por VIH se realizó a los 21 meses de vida (tabla 1).
En los posteriores controles inmunológicos la proporción de linfocitos CD4 se encontraban alrededor del 17 % (1.000-1.500 cél./μl), con una carga viral de 100.000 copias/ml; por esta razón, a los 30 meses de vida de la niña, se inicia tratamiento con triple terapia antirretroviral, con dos análogos de los nucleósidos (zidovudina y lamivudina) y un inhibidor de la proteasa (lopinavir-ritonavir). Tras 20 meses de seguimiento la paciente se encuentra clínicamente asintomática, con situación inmunológica normal y carga viral indetectable, estando incluida en la clase A1 de la clasificación del CDC para el VIH pediátrico 1.
Se realizó estudio del subtipo viral, con el resultado de VIH-1, grupo M, forma recombinante A-G.
Discusión
En el caso presentado, se utiliza inicialmente la PCR del ADN proviral, que está basada en el proceso de transcripción inversa en el que se sintetiza ADN proviral complementario del ARN del VIH-1; este ADN se integra en el cromosoma de la célula mediante la integrasa viral. El ADN proviral persiste en las células mononucleares de sangre periférica y en los ganglios linfáticos a pesar del tratamiento antirretroviral 3. Se trata de un método cualitativo, utilizado para cribado y que en la actualidad no se encuentra disponible.
La PCR de ARN es una técnica cuantitativa, que se denomina carga viral. Existen en el mercado dos métodos para detectar el ARN del VIH-1. El aprobado por la Food and Drug Administration (FDA), VIH, ARN, PCR (Amplicor HIV-1 Monitor test 1.5) se basa en la RT-PCR, realizando una transcripción inversa del ARN del gen gag y posteriormente la PCR. Y el denominado branched DNA o ADNb (Versant HIV-1 RNA 3.0 Assay Bayer) que realiza una hibridación de 98 probes a diferentes regiones del gen de la polimerasa y su posterior amplificación. En un estudio comparativo se demostró mayor sensibilidad del ADNb para detectar subtipos no B 4.
El VIH es un virus de gran variabilidad genética. Existen 2 tipos: VIH-1 y VIH-2. El VIH-2 agrupa 5 subtipos (A-E) y se encuentra principalmente en el oeste de África. Es menos transmisible que el VIH-1 y raramente se contagia por transmisión vertical. Se asocia a una menor carga viral medida por PCR-ARN, y a un descenso de los linfocitos CD4 y una progresión clínica más lentos. Es frecuente que pacientes portadores del VIH-2 estén coinfectados con VIH-1. El VIH-2 no es sensible a los inhibidores no nucleósidos de la transcriptasa inversa y presenta mayores tasas de resistencias a los inhibidores de la proteasa que el VIH-1. La confirmación de la infección puede ser complicada ya que existen el 20-30 % de falsos negativos en la serología por ELISA.
El VIH-1 engloba 3 grupos: M (major), O (outlier) y N (non-M, non-O). El grupo M contiene 10 subtipos (A, B, C, D, E, F, G, H, J y K) según las secuencias de env, gag y pol; y 4 formas recombinantes (CRF01-AE, CRF02-AG, CRF03-AB y CRF04-cpx) 5,6.
El subtipo B del VIH-1 predomina en los países occidentales (América del Norte, Europa), así como en Oriente Medio, Este de Asia y Latinoamérica. El resto de subtipos se denominan como "no B" y son los responsables de la epidemia de sida en los países con recursos limitados; en concreto, en el continente africano se encuentran todos los subtipos no B, con una presencia mínima del subtipo B 7.
En los últimos años la prevalencia de subtipos no B está en aumento en los países occidentales, en clara relación con el fenómeno de la inmigración. Un tercio de los inmigrantes infectados lo están por subtipos no B, y esta proporción asciende al 70 % cuando se trata de personas africanas 5,7. En nuestro medio se ha demostrado alta prevalencia de cepas de subtipos G, gran parte de las cuales son formas recombinantes CRF02-AG, al igual que en el caso que presentamos 8.
Los factores asociados a la infección por subtipos no B son la transmisión heterosexual, origen africano, región geográfica donde se produce la infección y el año del diagnóstico, ya que el haber contraído la infección en los últimos años aumenta la probabilidad de subtipo no B 6.
En personas infectadas por estos subtipos se ha encontrado mayor frecuencia de pruebas diagnósticas con resultados falsos negativos, así como discrepancias de la carga viral esperada en relación con el recuento de linfocitos CD4 o el estadio clínico. Es decir, en pacientes con disminución en el recuento de linfocitos CD4 o estadio clínico avanzado se encuentran cargas virales inesperadamente bajas. Este fenómeno parece explicarse porque las técnicas diagnósticas utilizadas en nuestro medio están diseñadas basándose en secuencias de subtipos B, que no son lo suficientemente sensibles para detectar otros subtipos diferentes 9-13.
En general, no hay evidencia de que los subtipos no B se asocien con una peor respuesta virológica al tratamiento antirretroviral y responden a los análogos de los nucleósidos de la transcriptasa inversa. Sin embargo, muestran altas tasas de polimorfismo en el gen de la proteasa, con sustituciones en posiciones asociadas con resistencias a los inhibidores de la proteasa (IP). Una de estas mutaciones es la M36I, que está presente en el 96 % de los subtipos no B, frente al 12 % de los subtipos B. Esto condiciona un aumento de resistencias a los IP 7,14,15, lo que debe ser valorado al iniciar el tratamiento antirretroviral.
De la experiencia de este caso podemos concluir que es conveniente considerar la posibilidad de infección por subtipos no B en pacientes africanos, ante discrepancias entre carga viral y la situación clínica o el recuento de linfocitos CD4 y, en niños expuestos, con serología de VIH positiva más allá de los 18 meses de vida. En todos estos casos se recomienda el uso de técnicas diagnósticas sensibles para detectar subtipos no B y realizar estudios genotípicos de resistencias del VIH, para elegir la pauta de tratamiento antirretroviral más adecuada.
Correspondencia: Dra. M.ªI. de José Gómez.
Servicio de Enfermedades Infecciosas. Hospital Universitario La Paz.
P.º de la Castellana, 261. 28046 Madrid. España.
Correo electrónico: ijose.hulp@salud.madrid.org
Recibido en noviembre de 2005.
Aceptado para su publicación en marzo de 2006.
Figura 1.Evolución de los linfocitos CD4 (cél./ml).