La colestasis intrahepática familiar progresiva (CIFP) es un grupo heterogéneo de colestasis de herencia autosómica recesiva y se inicia en el período neonatal o en los primeros años de vida. Existen 3 formas de CIFP en relación con las distintas mutaciones a nivel de los genes del sistema de transporte hepatocelular causantes de la formación de la bilis. Suele afectar a los niños en edad escolar o a los adultos jóvenes. Las principales manifestaciones son colestasis, ictericia y prurito, con una evolución lenta de la enfermedad hepática hacia la fibrosis en los primeros años de vida adulta. El diagnóstico se basa en la sospecha clínica con hallazgos bioquímicos compatibles (la actividad gamma-glutamiltransferasa es normal en las CIFP tipo 1 y 2, pero es elevada en las tipo 3), pruebas de imagen que descarten otras causas de colestasis y anatomía patológica confirmatoria. El tratamiento inicial consiste en medidas sintomáticas como el ácido ursodesoxicólico. La derivación biliar parcial y el by-pass ileal representan opciones terapéuticas intermedias. En los casos que no respondan a los tratamientos anteriores, el transplante hepático sería la opción con mayores perspectivas curativas y buenos resultados de supervivencia.
A continuación presentamos el caso de un neonato con CIFP tipo 2 y una presentación clínica poco habitual en el período neonatal como es el fallo hepático.
Progressive familial intrahepatic cholestasis (PFIC) is a heterogeneous group of autosomic-recessive inherited cholestatic disorders that begin in the neonatal period or in the first years of life. There are three types of PFIC defined by different mutations located in the gene responsible for the bile flow through the intrahepatic canalicular transporter system. These disorders usually present in children or young adults and the main clinical manifestations are cholestasis, jaundice and pruritus, and they progress slowly towards liver fibrosis in adult life. PFIC diagnosis is based on clinical suspicion, biochemical findings (that include normal gamma-glutamyl transpeptidase in type 1 and 2, but increased levels in type 3), image techniques that rule-out other disorders, and histological confirmation. Initial treatment consists of symptomatic relief of cholestatic symptoms with choleretic agents (urso-deoxycholic acid). Partial biliary derivation and ileal bypass are intermediate therapeutic options. In case of no response to these treatments, liver transplantation is indicated.
We report the case of a neonate with PFIC type 2 presenting as a liver failure.
La colestasis representa una alteración en el flujo biliar que origina la retención de bilirrubina, ácidos biliares y otros componentes de la bilis. El mecanismo causal puede corresponder a una alteración en la formación o en la excreción de la bilis por el hepatocito o bien a una disfunción de la vía biliar intrahepática o extrahepática1,2.
Las causas de colestasis son múltiples; en el período neonatal y los primeros meses de vida es importante diferenciar las causas patológicas de las fisiológicas originadas por la inmadurez hepática. Toda ictericia presente más allá de los 15 días de vida deberá estudiarse para descartar colestasis a pesar de que la causa más frecuente será la lactancia materna. El diagnóstico diferencial es difícil, dada la superposición de los rasgos clínicos, bioquímicos e histológicos. Pueden clasificarse en 3 categorías: obstructivas, infecciosas y metabólicas/genéticas. Es imprescindible la búsqueda de aquellas causas tratables con un diagnóstico precoz (atresia de las vías biliares, tirosinemia, galactosemia, hipotiroidismo, infecciones, etc.) para evitar la hepatopatía crónica1,2.
El estudio diagnóstico de colestasis debe realizarse de forma sistematizada y escalonada con uso racional de los exámenes complementarios. En cuanto al tratamiento, es imprescindible el soporte nutricional con aporte de vitaminas liposolubles y un tratamiento específico según la etiología2.
Caso clínicoLactante de 40 días de vida que ingresó en la unidad neonatal derivado de su hospital de origen para un estudio de colestasis de inicio en la tercera semana de vida.
Corresponde a la segunda gestación de una madre sana de origen magrebí de 26 años. Tienen una hija sana de 2 años. El grupo sanguíneo materno es O Rh positivo. Los padres son consanguíneos (primos segundos). No existen antecedentes familiares de muertes neonatales ni enfermedades hepáticas. La gestación se había controlado sin incidencias hasta el tercer trimestre con diagnóstico ecográfico de polihidramnios, retraso de crecimiento intrauterino y cardiopatía no filiada. Se realizó amniocentesis con un cariotipo normal 46 XY. Las serologías maternas para virus de la hepatitis B y C, VIH, lúes, rubéola y toxoplasma fueron negativas en el primer y en el tercer trimestre. El parto tuvo lugar a las 37 semanas de gestación tras amniorexis espontánea. Fue eutócico, tras presentación cefálica y sin complicaciones. No existían factores de riesgo de infección. Se obtuvo un recién nacido de sexo masculino con peso al nacimiento de 2.370 g (DE de −1,21), longitud de 44,5cm (DE de −2,12) y perímetro craneal de 35cm (DE de +1,05). La puntuación de Apgar fue de 9/10 y no precisó de maniobras de reanimación.
Al ingreso en nuestra unidad el paciente se encontraba en tratamiento con ácido ursodesoxicólico y se alimentaba con lactancia materna a demanda.
En la exploración al ingreso destacaba aspecto polimalformativo, ictericia generalizada y aspecto madurativo acorde con la edad gestacional. Presentaba hipertelorismo, epicantus, micrognatia y pterigium colli. Los pabellones auriculares eran de implantación baja así como las areolas mamarias. Presentaba linfedema localizado en los pies y en la región torácica posterior. Destacaba hipoplasia del quinto dedo de ambas manos con agenesia/hipoplasia de uñas. A la auscultación cardiorrespiratoria se observaba soplo sistólico (1−2/6). Los pulsos periféricos estaban presentes y eran simétricos. En la exploración abdominal destacaba hepatomegalia de 3cm y esplenomegalia de 2cm. Los genitales eran masculinos y normoconfigurados. El examen neurológico y del aparato locomotor fue normal.
Debido a los hallazgos clínicos, se realizó cariotipo y estudio genético para descartar síndrome de Noonan (que resultó negativo). La ecocardiografía evidenció hipodesarrollo del arco aórtico transverso e istmo con patrón de hipertensión pulmonar.
El control analítico inicial mostró anemia normocítica normocrómica y alteración en las pruebas de coagulación con tiempo de protrombina del 42,4%, y tiempo de cefalina de 34,2 s. Las cifras de bilirrubina total fueron de 16,9mg/dl y conjugada de 10,9mg/dl. La función hepática estaba alterada con alaninoaminotransferasa de 240U/l, aspartatoaminotransferasa de 566U/l y fosfatasa alcalina de 622U/l. La gamma-glutamiltransferasa (GGT) inicial fue de 65U/l, el colesterol total de 142mg/dl y los triglicéridos de 141mg/dl. El resto del hemograma y la bioquímica fue normal. Se solicitaron serologías para virus hepatotropos que resultaron negativas.
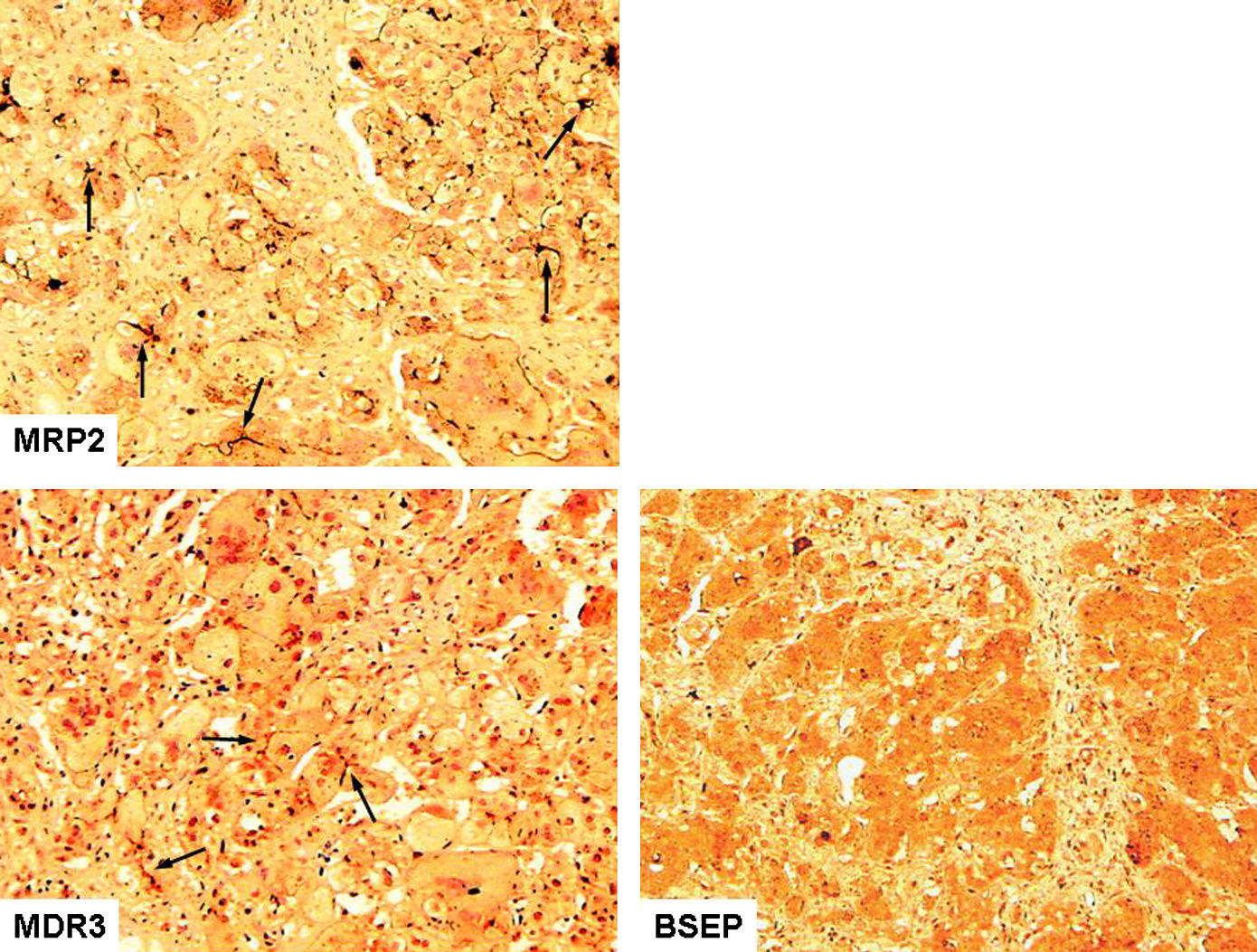
Se inició estudio con ecografía abdominal que no mostró alteraciones de la vía biliar. Se añadieron vitaminas liposolubles al tratamiento colerético y se solicitó gammagrafía de las vías biliares que tampoco evidenció alteraciones. Al tercer día de ingreso el paciente presentó aumento de las necesidades de oxígeno, por lo que se realizó una radiografía de tórax que mostró hiperclaridad del lóbulo inferior derecho. Durante los días posteriores el paciente permaneció estable, por lo que al octavo día de ingreso se le realizó una biopsia hepática a cielo abierto sin incidencias. A las 48h de la biopsia inició distrés respiratorio progresivo con control ecocardiográfico en el que se observó disminución del tamaño del arco aórtico y estenosis grave de la rama pulmonar izquierda sin flujo anterógrado y contractilidad miocárdica biventricular disminuida. Se realizaron estudios de fondo de ojo, cribado de metabolopatías en sangre y orina, ecografía y resonancia magnética craneales que resultaron normales. La biopsia hepática fue compatible con el síndrome de hepatitis neonatal de células gigantes. El paciente presentó mala evolución clínica con empeoramiento progresivo cardiorrespiratorio y sobreinfección respiratoria que requirió tratamiento antibiótico de amplio espectro, soporte ventilatorio e inotrópicos. La función hepática se mantuvo alterada con cifras máximas de bilirrubina de 32,2mg/dl (directa de 21,9mg/dl), fallo hepático progresivo (con normalidad mantenida de las cifras de GGT) y alteración de la coagulación refractaria al tratamiento; el paciente falleció a los 2 meses y medio de vida. Ante la sospecha clínica de colestasis intrahepática familiar progresiva (CIFP) sobre la base de la colestasis con disociación analítica (hiperbilirrubinemia y normalidad en las cifras de GGT) se remitió la muestra de la biopsia al laboratorio de referencia para un estudio inmunohistoquímico. Se realizaron técnicas con anticuerpos multidrug resistance protein 2 (MRP2) (transportador de bilirrubina, como marcador de tinción canalicular), multirresistente a fármacos tipo 3 (MDR3 [CIFP 3]) y BSEP (bile salt export pump [CIFP 2]), se apreció normalidad para MDR3 y ausencia de tinción con BSEP en la membrana canalicular (fig. 1) lo que confirmó el diagnóstico de CIFP 2.
Estudio inmunohistoquímico con tinción positiva para multidrug resistance protein 2 (MRP2) y para proteína multirresistente a fármacos tipo 3, donde se observa tinción de las membranas canaliculares de los hepatocitos (flechas) y falta de tinción para bile salt export pump, indicativo de déficit de ésta.
La CIFP es un grupo heterogéneo de colestasis que se transmite por herencia autosómica recesiva (AR) y se inicia en el período neonatal o en los primeros años de vida. Representa el 5–10% de las causas de colestasis neonatal1,3. Consiste en un defecto de los mecanismos de transporte hepatocelular de ácidos biliares que intervienen en la formación de la bilis4. La prevalencia de esta entidad se desconoce, pero su incidencia estimada varía entre 1/50.000 y 1/100.000 recién nacidos vivos, sin diferencias entre sexos3. Sin tratamiento, estos defectos evolucionan a fallo hepático progresivo con cirrosis y fallecimiento1–5.
Se conocen 3 formas. Los defectos en el gen ATP8B1, situado en el cromosoma 18q21-22 y que codifica para la proteína adenosíntrifosfato-asa (ATPasa) tipo-P, transportadora de aminofosfolípidos en el canalículo biliar e implicada también en la absorción intestinal de los ácidos biliares causan la CIFP 1 (denominada clásicamente enfermedad de Byler). La CIFP 2 consiste en un defecto en el principal transportador de ácidos biliares, el canal dependiente de la ATPasa llamado BSEP codificado por el gen ABCB11 situado en el cromosoma 2q24. Se han descrito más de 100 mutaciones diferentes para este gen3. Dada la falta de secreción de ácidos biliares por parte del hepatocito se producirá el acúmulo de ácidos biliares con lesión hepatocelular y enfermedad hepática progresiva4. Es la forma más grave de CIFP y presenta alto riesgo de malignización con elevada incidencia de carcinoma hepatocelular antes del año de vida3.
Las manifestaciones clínicas en las formas 1 y 2 suelen estar presentes en los primeros meses de vida, a diferencia del inicio tardío en la infancia o adolescencia de la CIFP 3 causada por un defecto en el transporte de fosfatidilcolina debido a la mutación del gen ABCB4, situado en el cromosoma 7q21 que codifica para la proteína MDR3 y causa un defecto en la secreción de fosfolípidos. Es la forma más benigna.
Las manifestaciones clínicas principales de las CIFP incluyen ictericia y prurito intenso; durante el curso de la enfermedad pueden presentar talla baja, hepatoesplenomegalia y diarrea crónica (variable según el tipo de CIFP). El patrón analítico característico consiste en un aumento de las cifras de bilirrubina a expensas de la fracción directa con actividad de la GGT normal en las clases de CIFP 1 y 2, y aumentada en CIFP 31–3,6. El estudio deberá completarse con ecografía abdominal, gammagrafía y biopsia hepática. Para el diagnóstico del subtipo de CIFP deberán realizarse estudios moleculares o de inmunofluorescencia específicos en centros especializados3,7.
El tratamiento inicial de estos pacientes se basa en el ácido ursodesoxicólico, que puede ser efectivo en algunos pacientes, sobre todo con CIFP 3. Algunos pacientes con CIFP 1 y 2 pueden beneficiarse de técnicas quirúrgicas de derivación biliar parcial y by-pass ileal. En los casos que no respondan a los tratamientos anteriores, en el prurito intratable y en fases avanzadas de la enfermedad el transplante hepático sería la opción con mayores perspectivas curativas y buenos resultados de supervivencia8,9. El consejo genético y diagnóstico prenatal debería recomendarse a las familias afectadas en las que se ha identificado la mutación genética causante.
El caso que presentamos es de especial interés, dado que el fallo hepático neonatal no es la presentación clásica en ninguno de estos síndromes, sino que la progresión de la enfermedad suele ser más lenta y con predominio de síntomas como prurito e ictericia con evolución a fallo hepático tardíamente. Se realizó una búsqueda bibliográfica para intentar hallar una asociación de la CIFP con algún síndrome polimalformativo. Se hallaron asociaciones entre el síndrome de Noonan (que se descartó en nuestro paciente) y el síndrome de Alagille10. También se buscó la posible asociación entre linfedema y colestasis neonatal presente en el síndrome de Aagenaes, una forma de colestasis con herencia AR descrita casi exclusivamente en la población noruega y causada por una hipoplasia en los vasos linfáticos con posible inicio en el período neonatal, pero con mejor pronóstico y episodios colestáticos recurrentes en la edad adulta11.