Existen datos que aseguran que la exposición al tratamiento antirretroviral (TAR) durante la gestación en la mujer infectada por VIH no afecta al posterior desarrollo ponderoestatural del lactante. El propósito de este estudio es realizar un análisis antropométrico de los niños no infectados de la cohorte de la Fundación para la Investigación y la Prevención del Sida en España (FIPSE) durante los primeros 18 meses de vida, así como analizar los posibles factores que influyen en el peso al nacimiento.
MétodosLa cohorte de la FIPSE incluye 8 hospitales públicos de Madrid y sigue prospectivamente a los niños de madre infectada por VIH que haya dado a luz en estos hospitales. Se recogieron los datos de 601 niños no infectados de los que se disponía el peso al nacimiento, según los protocolos estandarizados durante los 2 primeros años de vida. Se consideraron estadísticamente significativos los valores de p menores de 0,05. Se usaron las tablas de la Fundación Pablo Orbegozo para comparar las medidas antropométricas y hallar los valores z.
ResultadosLa media de peso fue de 2.766g (±590) y la media de peso con exclusión de los prematuros fue de 2.967g (±427). La proporción de los niños no prematuros con crecimiento retardado intrauterino fue del 19,8% (IC del 95%: 16,3–23,8). Los hijos de madre adicta a drogas pesaron menos: 2.752(±325) versus 3.002g (±435) (p<0,001), así como los hijos de madre fumadora: 2.842(±363) versus 3.018g (±444) (p<0,001). La anemia materna no influyó en el bajo peso en la población de los niños no prematuros. No se encontraron diferencias significativas en el peso al nacimiento, de acuerdo con el tipo de TAR. Los niños de madre que presentaba CD4>500cel/mm pesaron más (2.834g [±503]) que aquéllos de madre que presentaba CD4<200cel/mm (2.565g [±702]; p=0,008). Estas diferencias no se mantienen al excluir los prematuros. En la población general, los niños de madre con cargas virales indetectables pesaron más (2.866g [±532] versus 2.704g [±588]; p=0,005), pero estas diferencias tampoco se mantuvieron en la población al excluir a los prematuros. La media de peso, talla y perímetro craneal (PC) al nacimiento de la población estudiada (con exclusión de los prematuros) es ligeramente menor al de la población española (peso z=−0,83; talla z=−1,02; PC z=−1,00), pero estas diferencias no son significativas y estas medidas son equiparables entre sí a los 18 meses de vida (peso z=−0,08; talla z=−0,32; PC z=−0,31). El tipo de tratamiento no influyó de manera significativa.
DiscusiónExiste una diferencia muy significativa entre el peso de los recién nacidos hijos de madre adicta a drogas y el resto, diferencia que se mantiene al excluir a los prematuros: los niños hijos de madre adicta a drogas presentan un menor peso. De igual manera ocurre con los hijos de fumadoras, con un peso claramente menor. La anemia materna no influyó significativamente. El tipo de TAR tampoco influyó de manera significativa. Los niños de esta población pesan y miden menos al nacimiento que la población española, pero se cree que este dato está influenciado por el alto número de cesáreas programadas a las 38 semanas. Los niños de esta población presentan un catch-up durante el primer y el segundo año de vida, de manera que las medidas antropométricas se equiparan a las de la media española a los 18 meses de vida.
Recent reports show that Antiretroviral Treatment (ART) during pregnancy does not affect somatic growth of children born to HIV-infected mothers, are reassuring. The aim of this study is to perform an anthropometric analysis of the uninfected children followed in the Spanish FIPSE cohort during their first 18 months of life, and to describe the possible risk factors during pregnancy that may influence low birth weight.
MethodsThe FIPSE cohort includes 8 public hospitals in Madrid, and prospectively follows children born to HIV-infected women at these hospitals. We collected data on 601 uninfected children, following standardised protocols, during their first 2 years of life. A P value<0.05 was considered statistically significant. Data from the Pablo Orbegozo Foundation were used to compare the means of our population with the standard weight, longitude an occipitofrontal circumference (OFC) of the Spanish population during the first 18 months of life.
ResultsThe mean weight was 2766g (+/−590), and 2967g (+/−427) when premature neonates were excluded. The proportion of Intrauterine Growth Restriction among non- premature neonates was 19.8% (95% CI: 16.3–23.8). Children born to mothers that used illicit drugs weighed less: 2752g (+/−325) vs. 3002g (+/ 435), P<0.001, as did children born to mothers who smoked during pregnancy: 2842g (+/−363) vs. 3018g (+/−444), P>0.001. Maternal anaemia did not influence the low birth weight of the children when premature neonates were excluded. We found no statistically significant differences depending on the ART received during pregnancy. Children born to mothers who had CD4 > 500 cell /mm were heavier (2834g +/−503) than those whose mothers had CD4 of less than 200 cell/mm (2565g +/−702), P=0.008. These differences disappeared when premature neonates were excluded. Children born to mothers with undetectable viral load were heavier (2866g +/−532 vs. 2704g +/−588, P=0.005), but these differences also disappeared when the prematures were excluded from the analysis. Mean weight, length, and OFC of our population at birth (excluding premature neonates) were lower than the Spanish standards. (z for weight=−0.83; z for length =−1.02; z for OFC=−1.00), but these differences are not statistically significant and disappear at 18 months of age (z for weight=−0.08; z for height=−0.32; z for OFC=−0.31). The type of ART did not have any significant influence.
DiscussionThere is a very significant difference between the weight of the children born to mothers addicted to illicit drugs and the rest of the children. Similarly, the weight of the children born to smoking mothers is significantly lower. There was no association between maternal anaemia and the type of ART. The children of our population have lower weights, length and OFC at birth, but this may due to the high number of scheduled caesarean births, practised at 38 weeks of pregnancy (54.5%). Our children catch-up with anthropometric measurements during the first and second year of life, and these are similar to Spanish standards at 18 months old.
Desde finales de la década de 1990 se observó que la combinación de 3 o más fármacos antirretrovirales (AR), el tratamiento antirretroviral de gran actividad (TARGA) de la mujer gestante infectada por VIH, junto con otras medidas terapéuticas, disminuía el riesgo de transmisión vertical por debajo del 2%1,2. Existe ya información sobre el efecto que estos AR recibidos intraútero tienen en el desarrollo ponderoestatural del niño no infectado3. Asimismo, se conocen ya los efectos perjudiciales sobre el crecimiento producidos por el virus y el efecto beneficioso del TARGA sobre las medidas antropométricas4, y también cómo el tratamiento correcto durante la gestación evita un alto número de partos prematuros y bajo peso al nacimiento5, aunque por otra parte, hay cierta evidencia de que el empleo del TARGA por parte de la madre gestante se asocie, en pequeña medida, al parto prematuro6,7. En la década pasada se presentaron informes sobre el crecimiento de los lactantes expuestos a zidovudina (AZT), donde no se observaron efectos perjudiciales relativos a la somatometría8,9, pero aún se estudian los efectos del TARGA, que a menudo se emplea durante toda la gestación, sobre el peso del recién nacido (PRN) expuesto y sobre su crecimiento posterior. En la actualidad, existen datos derivados de estudios amplios que asocian el TARGA con la prematuridad, aunque no se ha observado hasta ahora un efecto negativo sobre el crecimiento fetal ni posteriormente sobre el crecimiento del lactante10–14.
El propósito de este estudio es realizar un análisis antropométrico de los niños no infectados de la cohorte de la Fundación para la investigación y la prevención del sida en España (FIPSE) que agrupa a 8 hospitales públicos de la Comunidad de Madrid, con el objetivo de observar y describir la curva de crecimiento de estos niños, así como de investigar las variables que puedan condicionar una disminución del peso al nacimiento en el recién nacido (RN).
MétodosPoblación de estudio. La base de la Fundación para la Investigación y la Prevención del Sida en EspañaLa cohorte de la Fundación para la Investigación y la Prevención del SIDA en España (FIPSE), proyecto 36531/05, se inició en el año 2000 con el objetivo de seguir prospectivamente a las gestantes infectadas por VIH y a sus hijos hasta la edad de 3 años, para determinar la tasa de transmisión vertical dentro de la cohorte y para evaluar los efectos adversos y malformaciones congénitas del tratamiento antirretroviral (TAR) tanto en la madre como en el feto, el RN y el lactante. La base constaba, cuando se realizó el análisis, de datos de 623 niños no infectados desde el inicio de la base en mayo de 2000 hasta diciembre de 2005, recogidos en 8 hospitales de la Comunidad de Madrid (Hospital 12 de Octubre, Hospital La Paz, Hospital Gregorio Marañón, Hospital Universitario de Getafe, Hospital Severo Ochoa, Hospital de Móstoles, Hospital Príncipe de Asturias y Hospital Fundación Alcorcón). Se incluyeron en la base a las gestantes con VIH positivo identificadas antes de la gestación, durante ésta o en las 48h posteriores al parto. Para el análisis de la base en este trabajo se seleccionaron los 601 niños no infectados nacidos vivos, de los cuales se disponía de datos antropométricos. Los pares de madres y niños se incluyeron y se siguieron prospectivamente, de manera activa, desde que se detectó la gestación (si era una paciente seropositiva seguida previamente) o desde que se detectó en una gestante la seropositividad para el VIH, por un equipo de infectólogos, ginecólogos y pediatras. Ningún lactante tomó leche materna.
VariablesEn el seguimiento de las madres se recogieron los datos sobre el control de la gestación, los datos demográficos personalizados de cada gestante, enfermedad concomitante, ingesta de fármacos o drogas, TAR recibido, datos físicos, analíticos y carga viral (CV) correspondientes a cada visita programada, los efectos adversos observados y las características del parto. En el seguimiento de los niños se realiza una exploración física detallada, se registran las características antropométricas, el tratamiento recibido, y los datos clínicos y analíticos correspondientes a cada visita (que comprende hemograma, bioquímica con perfil hepatorrenal y ácido láctico) que se efectúa al nacimiento, a las 2–3 semanas, a las 6 semanas, a los 3, 6, 12, 18, 24 y 36 meses. Se realizó, asimismo, una reacción en cadena de la polimerasa (PCR) para el VIH en las visitas del nacimiento, a las 2–3 semanas, a las 6 semanas y al tercer mes, y anticuerpos anti-VIH en las visitas al año y a los 18 y 24 meses. Se consideró “no infectado” al niño que presentó al menos 2 PCR negativas, una de éstas por encima de los 3 meses de edad. Se consideró parto prematuro si presentaba <37 semanas de gestación. Se consideró bajo peso al nacimiento a los nacidos con un peso ≤2.500g. La anemia materna se definió siempre según las tablas de toxicidad de los grupos de ensayos clínicos sobre VIH (ACTG, AIDS Clinical Trial Groups) (URL: www.rcc.tech-res.com/tox_tables) como una cifra de hemoglobulina en el tercer trimestre igual o inferior a 9,5g/dl. La CV materna de definió como indetectable si presentaba <200copias/ml. Se consideró madre adicta a drogas a las consumidoras de cocaína, heroína o metadona. El TAR en la embarazada se clasificó en no tratamiento, monoterapia AZT [zidovudina], biterapia (AZT más lamivudina [3TC] o nevirapina [NVP]), TARGA con inhibidores de la proteasa (IP) y tratamiento antirretroviral de gran actividad (TARGA) sin IP.
Para el análisis del desarrollo ponderoestatural se analizaron 439 niños no prematuros (de los cuales se disponía de datos antropométricos) y se establecieron como modelo las curvas de peso, talla y perímetro craneal (PC) hasta los 2 años de edad propuestas por la Fundación Pablo Orbegozo para la población española. Se realizó el análisis hasta los 18 meses de vida en peso y talla, y hasta los 12 meses con respecto al perímetro cefálico (PC), por disponer de escasos datos sobre la medida del PC en la visita de los 18 meses.
Análisis estadísticoLas variables categóricas se expresaron como frecuencias y porcentajes, mientras que las variables numéricas se presentaron como medias, medianas, desviación típica y rango intercuartílico. Se compararon las variables categóricas usando el test de la χ2 y χ2 de tendencia lineal o el test exacto de Fischer cuando fue apropiado. Todos los valores de p fueron bilaterales y se consideró estadísticamente significativa una p<0,05. Los intervalos de confianza (IC) se fijaron al 95%. Para el análisis de los datos se empleó el programa SPSS (Chicago, Illinois) para Windows, versión 15.0.
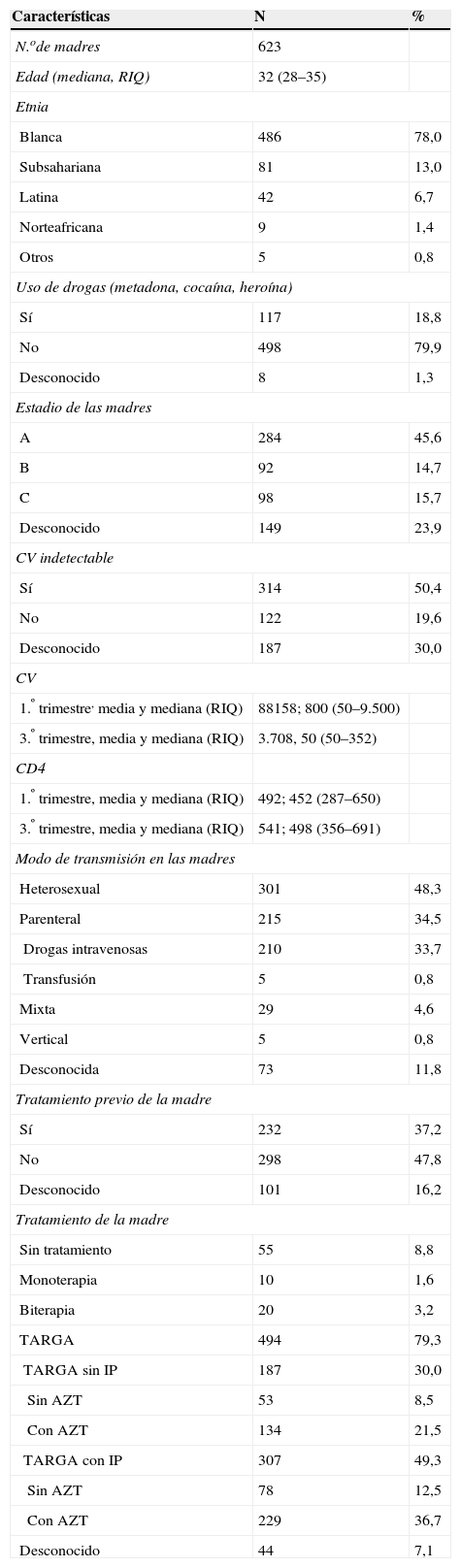
ResultadosCaracterísticas generalesLas características globales de la base, tanto las características basales de las madres como de los niños se indican en las tablas 1 y 2. La tasa de transmisión vertical fue de 1,42 (IC del 95%: 0,71–2,68). La tasa de prematuridad fue del 22,5% (IC del 95%: 19,3–25,9). La tasa de los niños con crecimiento intrauterino retardado (CIR) fue del 26,8% (IC del 95%: 23,4–30,5). La tasa entre la población de los niños no prematuros fue del 19,8% (IC del 95%: 16,3–23,8).
Características de las madres de la población estudiada
| Características | N | % |
| N.ode madres | 623 | |
| Edad (mediana, RIQ) | 32 (28–35) | |
| Etnia | ||
| Blanca | 486 | 78,0 |
| Subsahariana | 81 | 13,0 |
| Latina | 42 | 6,7 |
| Norteafricana | 9 | 1,4 |
| Otros | 5 | 0,8 |
| Uso de drogas (metadona, cocaína, heroína) | ||
| Sí | 117 | 18,8 |
| No | 498 | 79,9 |
| Desconocido | 8 | 1,3 |
| Estadio de las madres | ||
| A | 284 | 45,6 |
| B | 92 | 14,7 |
| C | 98 | 15,7 |
| Desconocido | 149 | 23,9 |
| CV indetectable | ||
| Sí | 314 | 50,4 |
| No | 122 | 19,6 |
| Desconocido | 187 | 30,0 |
| CV | ||
| 1.º trimestre, media y mediana (RIQ) | 88158; 800 (50–9.500) | |
| 3.º trimestre, media y mediana (RIQ) | 3.708, 50 (50–352) | |
| CD4 | ||
| 1.º trimestre, media y mediana (RIQ) | 492; 452 (287–650) | |
| 3.º trimestre, media y mediana (RIQ) | 541; 498 (356–691) | |
| Modo de transmisión en las madres | ||
| Heterosexual | 301 | 48,3 |
| Parenteral | 215 | 34,5 |
| Drogas intravenosas | 210 | 33,7 |
| Transfusión | 5 | 0,8 |
| Mixta | 29 | 4,6 |
| Vertical | 5 | 0,8 |
| Desconocida | 73 | 11,8 |
| Tratamiento previo de la madre | ||
| Sí | 232 | 37,2 |
| No | 298 | 47,8 |
| Desconocido | 101 | 16,2 |
| Tratamiento de la madre | ||
| Sin tratamiento | 55 | 8,8 |
| Monoterapia | 10 | 1,6 |
| Biterapia | 20 | 3,2 |
| TARGA | 494 | 79,3 |
| TARGA sin IP | 187 | 30,0 |
| Sin AZT | 53 | 8,5 |
| Con AZT | 134 | 21,5 |
| TARGA con IP | 307 | 49,3 |
| Sin AZT | 78 | 12,5 |
| Con AZT | 229 | 36,7 |
| Desconocido | 44 | 7,1 |
AZT: zidovudina; CV: carga viral; DE: desviación estándar; RIQ: rango intercuartílico; TARGA: tratamiento antirretroviral de gran actividad.
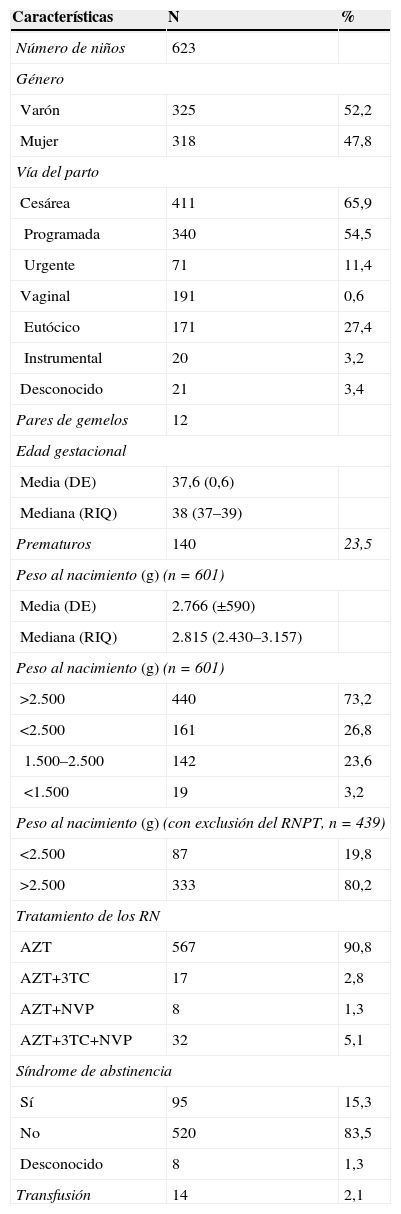
Características basales de los niños del estudio
| Características | N | % |
| Número de niños | 623 | |
| Género | ||
| Varón | 325 | 52,2 |
| Mujer | 318 | 47,8 |
| Vía del parto | ||
| Cesárea | 411 | 65,9 |
| Programada | 340 | 54,5 |
| Urgente | 71 | 11,4 |
| Vaginal | 191 | 0,6 |
| Eutócico | 171 | 27,4 |
| Instrumental | 20 | 3,2 |
| Desconocido | 21 | 3,4 |
| Pares de gemelos | 12 | |
| Edad gestacional | ||
| Media (DE) | 37,6 (0,6) | |
| Mediana (RIQ) | 38 (37–39) | |
| Prematuros | 140 | 23,5 |
| Peso al nacimiento (g) (n = 601) | ||
| Media (DE) | 2.766 (±590) | |
| Mediana (RIQ) | 2.815 (2.430–3.157) | |
| Peso al nacimiento (g) (n = 601) | ||
| >2.500 | 440 | 73,2 |
| <2.500 | 161 | 26,8 |
| 1.500–2.500 | 142 | 23,6 |
| <1.500 | 19 | 3,2 |
| Peso al nacimiento (g) (con exclusión del RNPT, n = 439) | ||
| <2.500 | 87 | 19,8 |
| >2.500 | 333 | 80,2 |
| Tratamiento de los RN | ||
| AZT | 567 | 90,8 |
| AZT+3TC | 17 | 2,8 |
| AZT+NVP | 8 | 1,3 |
| AZT+3TC+NVP | 32 | 5,1 |
| Síndrome de abstinencia | ||
| Sí | 95 | 15,3 |
| No | 520 | 83,5 |
| Desconocido | 8 | 1,3 |
| Transfusión | 14 | 2,1 |
3TC: lamivudina; AZT: zidovudina; NVP: nevirapina; RN: recién nacido; RNPT: recién nacido pretérmino.
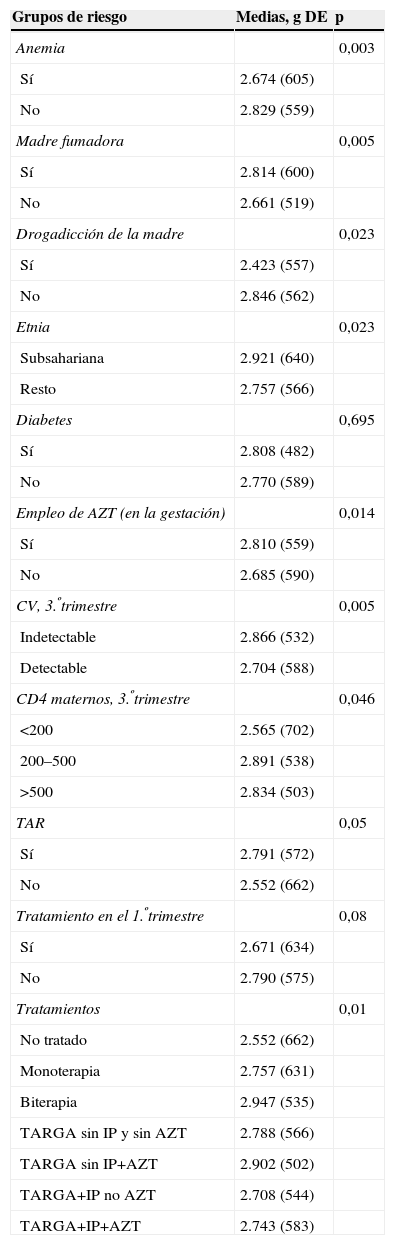
Población general: la media global del PRN fue de 2.766 g (±590). Al valorar por grupos, según las características maternas, las diferencias en el PRN fueron significativas entre los hijos de madre con anemia en el tercer trimestre y los hijos de madre sin anemia: 2.674g (±605) versus 2.829g (±559) (p=0,003). Fue también significativa la diferencia entre el PRN de los niños de las gestantes adictas a drogas frente al resto del grupo: 2.423g (±557) frente a 2.846g (±562) (p<0,001). De igual manera ocurrió con el grupo de fumadoras, en donde la diferencia también fue significativa (tabla 3). Sin embargo, se encontraron mínimas diferencias (no significativas) entre el PRN de los hijos de madre diabética (pregestacional o posgestacional) y los hijos de madre no diabética (tabla 3). La raza de las madres influyó de manera importante en el PRN: se han observado diferencias al comparar los grupos étnicos entre sí, por lo que fue mayor el PRN de origen subsahariano frente al resto (tabla 3).
Grupos de peso en la muestra general (n=601)
| Grupos de riesgo | Medias, g DE | p |
| Anemia | 0,003 | |
| Sí | 2.674 (605) | |
| No | 2.829 (559) | |
| Madre fumadora | 0,005 | |
| Sí | 2.814 (600) | |
| No | 2.661 (519) | |
| Drogadicción de la madre | 0,023 | |
| Sí | 2.423 (557) | |
| No | 2.846 (562) | |
| Etnia | 0,023 | |
| Subsahariana | 2.921 (640) | |
| Resto | 2.757 (566) | |
| Diabetes | 0,695 | |
| Sí | 2.808 (482) | |
| No | 2.770 (589) | |
| Empleo de AZT (en la gestación) | 0,014 | |
| Sí | 2.810 (559) | |
| No | 2.685 (590) | |
| CV, 3.ºtrimestre | 0,005 | |
| Indetectable | 2.866 (532) | |
| Detectable | 2.704 (588) | |
| CD4 maternos, 3.ºtrimestre | 0,046 | |
| <200 | 2.565 (702) | |
| 200–500 | 2.891 (538) | |
| >500 | 2.834 (503) | |
| TAR | 0,05 | |
| Sí | 2.791 (572) | |
| No | 2.552 (662) | |
| Tratamiento en el 1.ºtrimestre | 0,08 | |
| Sí | 2.671 (634) | |
| No | 2.790 (575) | |
| Tratamientos | 0,01 | |
| No tratado | 2.552 (662) | |
| Monoterapia | 2.757 (631) | |
| Biterapia | 2.947 (535) | |
| TARGA sin IP y sin AZT | 2.788 (566) | |
| TARGA sin IP+AZT | 2.902 (502) | |
| TARGA+IP no AZT | 2.708 (544) | |
| TARGA+IP+AZT | 2.743 (583) |
AZT: zidovudina; CV: carga viral; IP: inhibidores de la proteasa; TAR: tratamiento antirretroviral; TARGA: tratamiento antirretroviral de gran actividad.
Respecto a las características inmunovirológicas de las madres, se observó que el PRN hijos de madre con CV indetectable anterior al parto era mayor que el del grupo de madres con CV detectable (tabla 3) y que la situación inmunológica también influía en el PRN: los hijos de madre con CD4 mayores de 500 cel/mm en el tercer trimestre de la gestación pesaban más, y de manera estadísticamente significativa, que los niños de madre inmunodeprimida (2.834g [±538g] versus 2.565g [±702]; p=0,026). El empleo o no del TAR durante el primer trimestre no tuvo influencia en el PRN.
El tipo de tratamiento ha influido también en el PRN, aunque las diferencias más significativas se observan entre el grupo de los niños de madre que no recibió ningún tratamiento y el resto de las madres (2.552g [±662] versus 2.791g [±572]; p=0,05). Los hijos de madres que recibieron biterapia fueron los que más pesaron (x=2.947 g [±535]), aunque no se encontró diferencia significativa al comparar este dato con el resto de las medias. El grupo que más pesó, después del grupo de los que recibieron biterapia intraútero, fue aquel que recibió TARGA sin IP con AZT (x=2.902g [±502]) y se hallaron también diferencias significativas al comparar esta media con la del grupo de los niños sin tratamiento intraútero (2.522g versus 2.902g; p=0,008) (tabla 3). Se estudió el empleo de la AZT, independientemente del empleo o no de otros fármacos, y se observó que los niños de madres que tomaban AZT tuvieron un mayor PRN que el resto: 2.810g (±559) versus 2.685g (±590) (p=0,014).
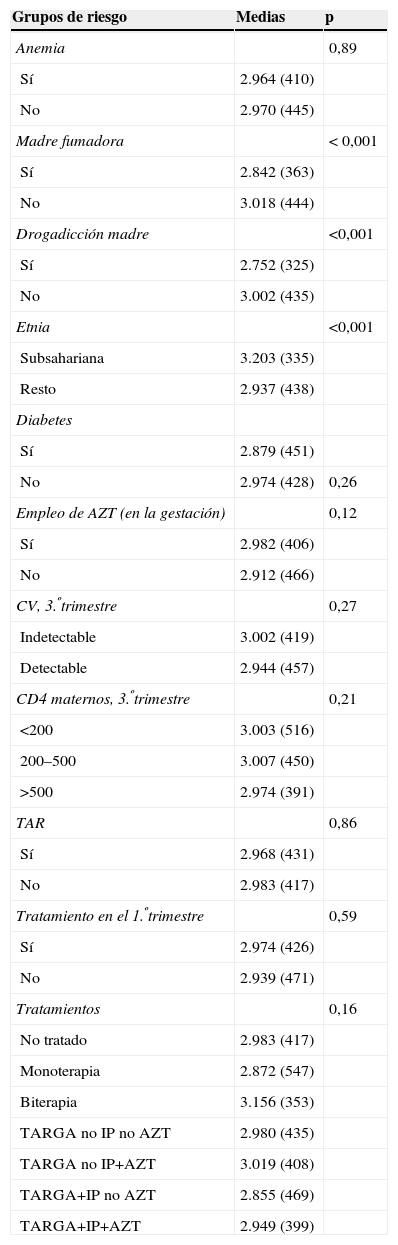
Población que excluye a los RN prematuros: la media de este grupo es de 2.967g (±427) (tabla 4). El PRN de madres que empleaban drogas durante la gestación fue menor al resto del grupo: 2.752g (±325) versus 3.002g (±435) (p< 0,001); así como los hijos de madre fumadora también pesaron menos al nacimiento que el resto del grupo: 2.842g (±363) versus 3.018g (±444) (p<0,001) (tabla 4). Los niños de origen subsahariano pesaron más que los niños de otro origen étnico: 3.203g (±335) versus 2.937g (±438) (p<0,001). En este grupo de RN no prematuros, la anemia materna y las caracerísticas inmunovirológicas maternas no influyeron de manera significativa en el peso al nacimiento. Tampoco lo hizo el empleo del TAR en el primer trimestre (tabla 4).
Grupos de peso en gramos (se excluyen los prematuros) (n=439)
| Grupos de riesgo | Medias | p |
| Anemia | 0,89 | |
| Sí | 2.964 (410) | |
| No | 2.970 (445) | |
| Madre fumadora | < 0,001 | |
| Sí | 2.842 (363) | |
| No | 3.018 (444) | |
| Drogadicción madre | <0,001 | |
| Sí | 2.752 (325) | |
| No | 3.002 (435) | |
| Etnia | <0,001 | |
| Subsahariana | 3.203 (335) | |
| Resto | 2.937 (438) | |
| Diabetes | ||
| Sí | 2.879 (451) | |
| No | 2.974 (428) | 0,26 |
| Empleo de AZT (en la gestación) | 0,12 | |
| Sí | 2.982 (406) | |
| No | 2.912 (466) | |
| CV, 3.ºtrimestre | 0,27 | |
| Indetectable | 3.002 (419) | |
| Detectable | 2.944 (457) | |
| CD4 maternos, 3.ºtrimestre | 0,21 | |
| <200 | 3.003 (516) | |
| 200–500 | 3.007 (450) | |
| >500 | 2.974 (391) | |
| TAR | 0,86 | |
| Sí | 2.968 (431) | |
| No | 2.983 (417) | |
| Tratamiento en el 1.ºtrimestre | 0,59 | |
| Sí | 2.974 (426) | |
| No | 2.939 (471) | |
| Tratamientos | 0,16 | |
| No tratado | 2.983 (417) | |
| Monoterapia | 2.872 (547) | |
| Biterapia | 3.156 (353) | |
| TARGA no IP no AZT | 2.980 (435) | |
| TARGA no IP+AZT | 3.019 (408) | |
| TARGA+IP no AZT | 2.855 (469) | |
| TARGA+IP+AZT | 2.949 (399) |
AZT: zidovudina; CV: carga viral; IP: inhibidores de la proteasa; TAR: tratamiento antirretroviral; TARGA: tratamiento antirretroviral de gran actividad.
Respecto al tratamiento, en este grupo de RN no prematuros, el de mayor peso fue de nuevo el de los que recibieron biterapia intraútero (3.156g [±353]), sin diferencias significativas al realizar la comparación por grupos de tratamiento. El siguiente grupo más pesado fue también (al igual que en las comparaciones realizadas sin excluir los prematuros) el de los RN con TARGA sin IP con AZT intraútero: 3.019g (±408); sin embargo, no se encontraron diferencias significativas en ninguna de las comparaciones de pesos entre los grupos de tratamiento. Se estudió el empleo de la AZT, independientemente del empleo o no de otros fármacos combinados, y no se encontraron diferencias significativas, aunque existe una tendencia a presentar mayor PRN de madres que tomaban AZT que en las que no: 2.982g (±466) versus 2.902g (±466) (p=0,09) (tabla 4).
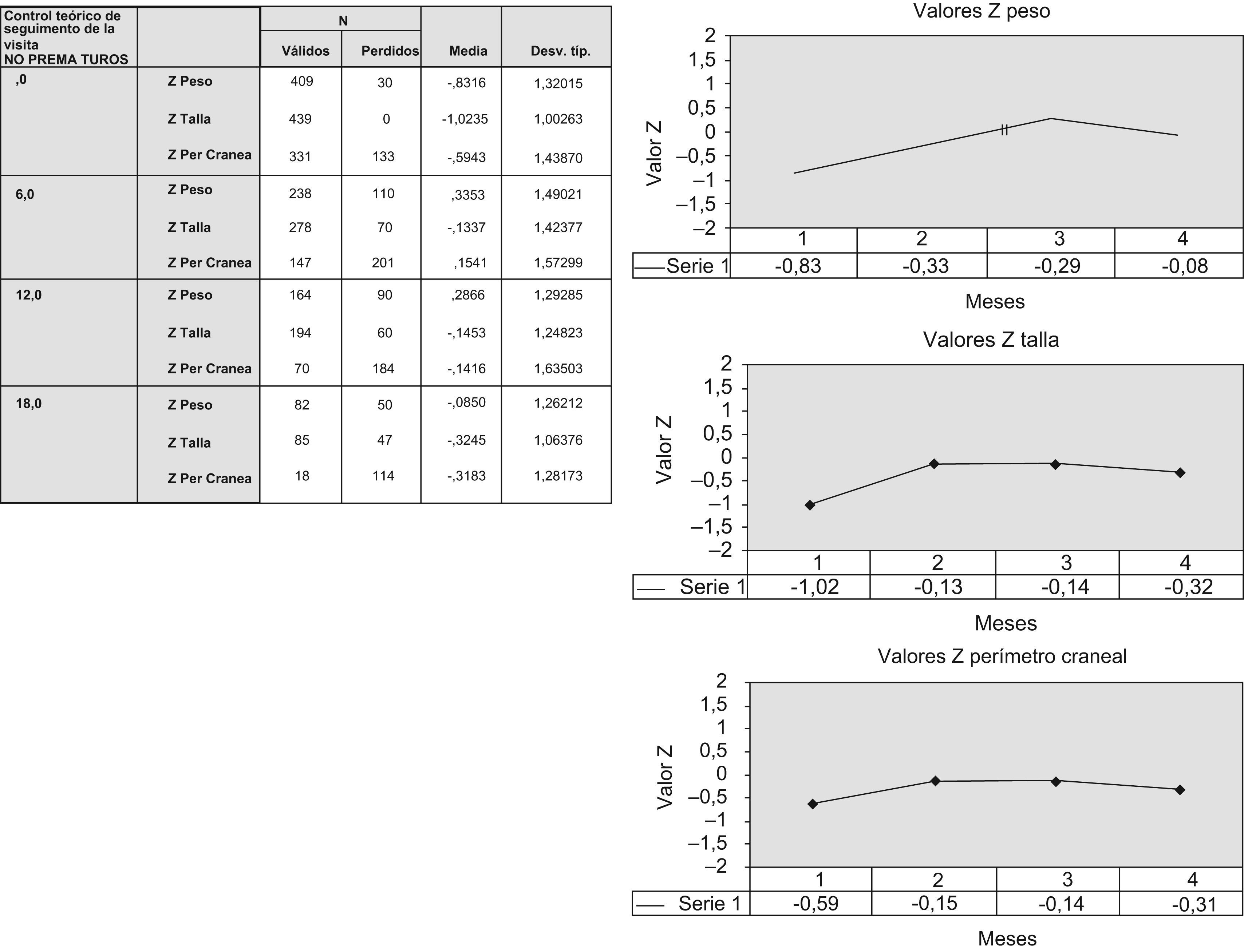
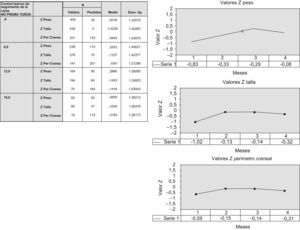
Crecimiento antropométricoRespecto al peso, las mayores diferencias ocurren al nacimiento. Este grupo de niños presentó menos PRN que la población general (z=−0,83) (±1,32) (fig. 1). Estas mínimas diferencias desaparecen desde el sexto mes de vida en adelante. Respecto a la talla, las diferencias son mayores. Los lactantes de esta población presentan longitudes algo menores durante los primeros 18 meses de vida (valor z: al nacimiento=−1,02 [±1,0]; a los 18 meses=−0,32 [±1,06]). De la misma manera ocurre con las medidas del PC (fig. 1).
Figura 1.1. Desarrollo ponderoestatural y PC de los niños no prematuros. Figura 1.2. Gráfica de valores z respecto al peso en los lactantes no prematuros hasta los 18 meses de edad. Figura 1.3. Gráfica de valores z respecto a la talla en los lactantes no prematuros hasta los 18 meses de edad. Figura 1.4. Gráfica de valores z respecto al perímetro cefálico en los lactantes no prematuros hasta los 12 meses de edad. Los valores correspondientes a los epígrafes 1, 2, 3 y 4 corresponden a los valores a los 0, 6, 12 y 18 meses de edad respectivamente.
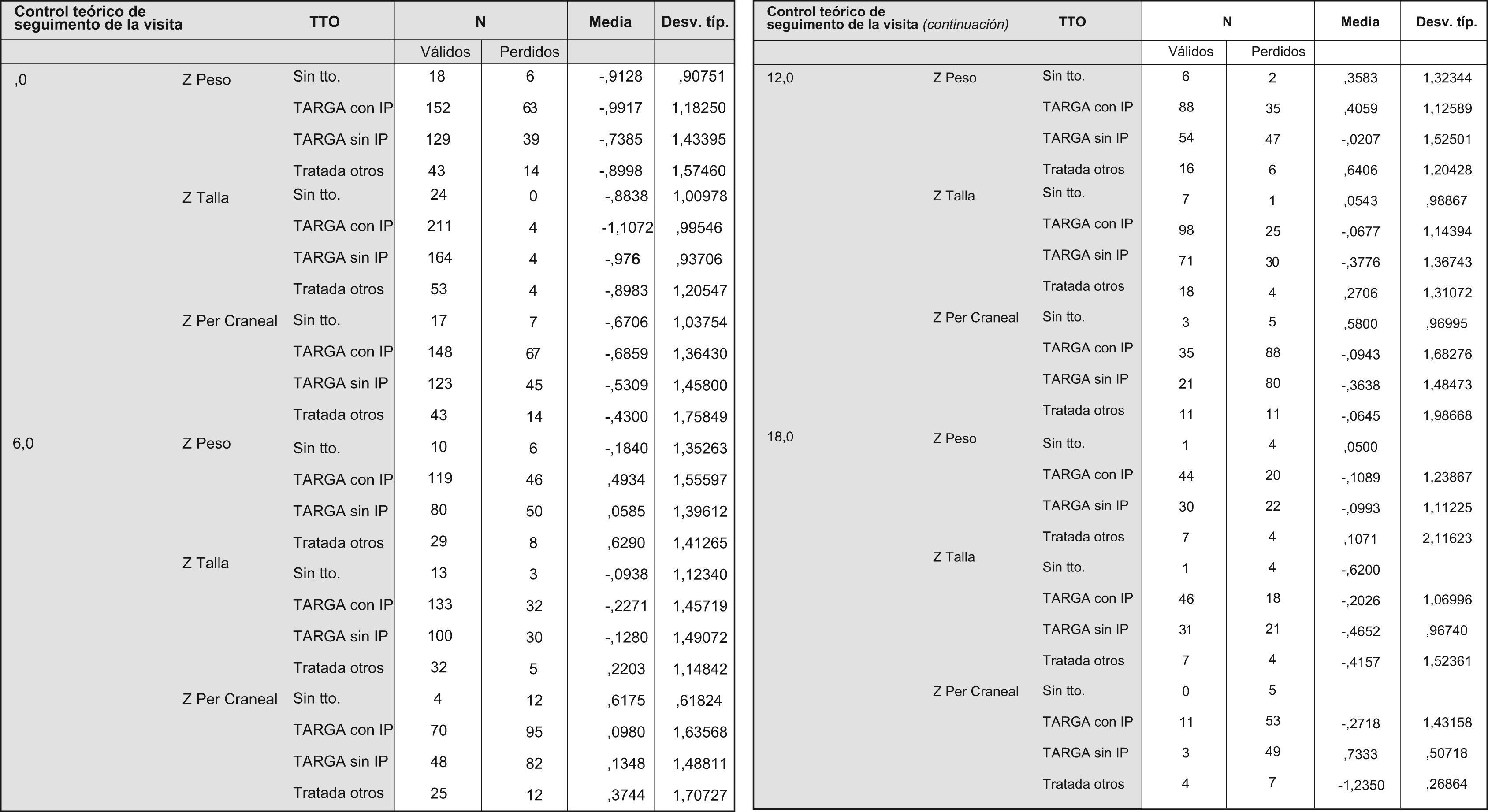
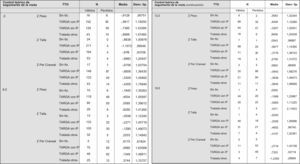
Se han analizado los datos antropométricos según el tratamiento recibido intraútero y, de manera global, no hubo tampoco diferencias significativas al comparar cada grupo de tratamiento con la población general (fig. 2). Respecto al peso, las mayores diferencias ocurrieron al nacimiento en el grupo de los hijos de madre no tratada (z=−0,93 [±0,90]). Posteriormente, los niños que recibieron TARGA intraútero ganaron más peso incluso que la población general, (valor z a los 6 meses para el grupo de TARGA con IP=0,49 [±1,55]; valor z a los 6 meses para el grupo de TARGA sin IP=0,06 [±1,39]), si bien estas mínimas diferencias desaparecen a los 18 meses. Se ha observado también, al estratificar por grupos de tratamiento, pequeñas diferencias no significativas respecto a la talla desde el nacimiento y que se mantuvieron a los 18 meses de vida, con valores de z=−0,21 (±1,06) para el grupo de los hijos de madre tratada con TARGA con IP y con valores z=−0,47 (±0,96) para el grupo de lactantes hijos de madre tratada con TARGA sin IP. No existen datos suficientes para analizar las diferencias entre los niños tratados y los niños no tratados. Por último, y respecto al PC, a los 12 meses de vida no se observaron diferencias significativas respecto a la población general en los niños tratados con TARGA, bien con IP (z=−0,09 [±1,68]) o sin IP (z=−0,36 [±1,48]), aunque no se han obtenido datos suficientes para comparar el PC de los niños no tratados respecto a la población general a los 18 meses de vida (tabla 6).
Figura 2.1. Desarrollo ponderoestatural de los niños no prematuros según el TAR recibido intraútero. Figura 2.2. Valores de p para las comparaciones de medias ponderoestaturales según el tratamiento recibido intraútero. Figura 2.3. Gráfica de valores z respecto al peso en lactantes no prematuros hasta los 18 meses de edad; se compara según el tratamiento recibido intraútero. Figura 2.4. Gráfica de valores z respecto a la talla en los lactantes no prematuros hasta los 18 meses de edad; se compara según el tratamiento recibido intraútero. Figura 2.5. Gráfica de valores z respecto al perímetro cefálico en los lactantes no prematuros hasta los 12 meses de edad; se compara según el tratamiento recibido intraútero.
En esta base de datos, similar a otras europeas en cuanto a las características maternas, del parto, la tasa de prematuridad y el empleo de AR1,2 se han descrito las características antropométricas de una cohorte de 601 niños no infectados, hijos de madre con VIH positivo, desde el nacimiento hasta los 18 meses de edad. Desde la década de 1990 se conoce el efecto negativo que el VIH presenta en el desarrollo ponderoestatural3 y cómo el TARGA acompaña una aceleración del crecimiento4. También se ha descrito cómo el control de la gestación y el empleo del TAR en la gestante influye en la ganancia de peso fetal: en un artículo del CDC de 2006 se observa la disminución del porcentaje de los niños con CIR del 35 (en 1989) al 21% (en 2004) y de los niños prematuros del 35 (en 1989) al 22% (en 2004)5. De todas formas, el TARGA se ha asociado en las cohortes europeas a un aumento de la tasa de prematuridad6,7, si bien en este trabajo sólo se han analizado la antropometría y el desarrollo ponderoestatural.
Peso al nacimientoCon respecto al peso al nacimiento, se ha encontrado un peso claramente menor al de la población general según las tablas de la Fundación Pablo Orbegozo, incluso al retirar del análisis a los niños prematuros. Se sitúan a casi una desviación estándar de los promedios de la media poblacional (z=−0,83). Creemos que esta diferencia está artefactada por el alto número de cesáreas realizadas de manera programada a la edad de 37–38 semanas (54, 5%) con lo que no resulta una diferencia fehaciente. Esta disminución de peso al nacimiento se observaba ya en la era pre-TARGA (hasta el empleo habitual del TARGA en la gestación, a partir de 1997–1998)8,9, con el empleo exclusivo de la AZT durante la gestación, y se ha mantenido en los resultados de las cohortes europeas, donde se emplean tratamientos combinados10–15, y en cohortes africanas16–19 con variedad de tratamientos con monoterapia más AZT o combinados pero de corta duración. La tasa del CIR entre los niños no prematuros (19,8%) es equivalente a la de otras cohortes.
Se ha observado un menor PRN al analizar la muestra general en los hijos de madre que presentaba anemia en el tercer trimestre, aunque las diferencias no son significativas cuando se excluye del análisis a los niños prematuros. También existe una diferencia muy significativa, entre el PRN hijos de madre adicta a drogas y el resto, diferencia que se mantiene al excluir a los prematuros: los niños hijos de madre adicta a drogas presentan un menor peso, del orden de 300–400g (tablas 3 y 4). De igual manera ocurre con los hijos de fumadoras, con un peso claramente menor. Todas estas características son factores de riesgo para presentar el CIR, por lo que resulta lógico que las medias de peso sean menores en este grupo.
En la muestra general se demostró que hubo diferencias significativas entre el menor peso de los niños hijos de madre con mala situación inmunovirológica y el peso del resto de los niños. Estas diferencias no se mantuvieron al retirar del análisis a los prematuros.
También se encontraron diferencias significativas en los lactantes de origen subsahariano, que resultaron más pesados que el resto.
El grupo de niños de madres que no recibieron tratamiento durante la gestación presentó menor peso que el resto de los grupos (x=2.552g [±662]). Al excluir a los prematuros, esto no sucede así, debido a que en el grupo de los no tratados, el 50% (23 niños) son prematuros, factor que evidentemente influye en el peso. Se encontró que el grupo de mayor peso al nacimiento fue el de los tratados con biterapia y seguidamente el de los que recibieron TARGA sin IP con AZT, aunque las diferencias no son significativas en ninguna de las comparaciones entre los grupos de tratamiento si se excluyen a los niños prematuros. El empleo de la AZT (combinado o exclusivo) resultó ser, en la muestra general, un factor asociado al aumento del PRN, ya que los RN de madres que la usaron durante la gestación pesaron más que el resto, y de manera significativa. Pero de nuevo no existen diferencias al excluir al grupo de prematuros.
Desarrollo ponderoestaturalSe observaron, durante el desarrollo, mínimas diferencias no significativas frente a los datos de la Fundación Pablo Orbegozo. Respecto al peso, la mayor diferencia corresponde con el nacimiento, como se ha comentado, para luego disminuir y situarse en torno al valor z=0 o percentil 50 a los 18 meses. Es decir, existe un fenómeno de catch-up en los primeros 18 meses de vida (fig. 1). De la misma manera ocurre con la talla y el PC, aunque en estos 2 casos, las diferencias son algo mayores, sobre todo para la talla, donde se encuentra una diferencia de una desviación estándar al nacimiento respecto a la media de la población muestral, que disminuye también durante los siguientes meses (fig. 2). Las cohortes comparativas empleadas habitualmente en la literatura médica corresponden a cohortes de niños infectados, comparados con los niños no infectados3,16–23, hasta los 2–4 años de edad, por lo que el grupo control es el de los no infectados. En 2 estudios similares realizados en 1998 y 1999, se compara al grupo de los no infectados que habían recibido AZT intraútero con los no infectados que habían recibido placebo, y no se encontraron diferencias8,9 en la evolución del desarrollo ponderoestatural. Un trabajo de Glasgow14 compara los niños no infectados, hijos de madre con VIH, con una muestra poblacional hospitalaria, en donde no se encontraron diferencias significativas en el desarrollo ponderoestatural de estos niños, aunque sí se observó el efecto negativo que produce el uso de drogas i.v. durante la gestación, por lo que el grupo de niños que recibieron drogas intraútero fue el de menor peso, dato que los autores también han definido. En un estudio italiano de 1998, se compara una población de niños no infectados con valores antropométricos extraídos de los datos de la Organización Mundial de la Salud12. Estos autores concluyen, de manera similar a los de este estudio, que si bien hay un crecimiento ponderal y un fenómeno de catch-up, no ocurre lo mismo con la talla. En este trabajo se compara directamente una cohorte de niños no infectados con una muestra representativa de la población general española (los datos de la Fundación Pablo Orbegozo) y se encontró una disminución clara de peso, talla y PC al nacimiento y una aceleración ponderal durante el segundo año de vida, por lo que la ganancia de talla y PC fue algo más lenta.
Se ha estudiado el posible efecto que uno u otro TAR pudiera tener sobre el crecimiento de estos niños y no se encontraron diferencias significativas en el crecimiento, pero se observó una más rápida ganancia de peso en los primeros 6–12 meses, predominantemente en el grupo en que las madres recibieron TARGA con IP. Estas mínimas diferencias desaparecen a los 18 meses de edad. Algo similar ocurre en la talla y en el PC: los niños que recibieron TARGA con IP tendrían una velocidad de crecimiento mayor al resto de los grupos. No hay muchos estudios que analicen el efecto del TAR en la gestante en el desarrollo ponderoestatural de los hijos de madre infectada. En un artículo de 2006 se observó menor peso al nacimiento en los niños que recibieron AZT intraútero de manera prolongada, respecto a los que lo recibieron en pautas cortas, pero esta diferencia desaparecía a los 18 meses13. Otro estudio reciente, derivado del estudio colaborativo europeo, encontraba una menor velocidad de crecimiento en los niños expuestos al TARGA intraútero, datos que contrastan con los de este estudio. De todas formas, en ese estudio, la diferencia encontrada es mínima y desaparece a los 3 años de edad.
En definitiva, se encontraron datos que describen una población, los hijos de gestantes infectadas por VIH, con un peso, talla y PC por debajo de la media al nacimiento y que presenta una velocidad de crecimiento superior a la media poblacional en los primeros 12 meses de vida, lo que hace que a los 18 meses de vida estos niños tengan parámetros antropométricos equiparables a la población española. La talla es la medida que “tarda” más en equipararse. Respecto a los grupos de tratamiento, se encontró un mínimo efecto favorecedor de ganancia ponderoestatural, si bien no significativo, en el tratamiento con TARGA más IP.
Entre las limitaciones de este estudio figuran, en primer lugar, las propias de los estudios de cohortes. En las cohortes prospectivas, como es la cohorte FIPSE, los factores de confusión no están suficientemente controlados y pueden derivar en sesgos debido a la interpretación de los resultados, pero es indudable que proporcionan la base para realizar estudios aleatorizados. Por otro lado, la frecuente pérdida de pacientes durante el seguimiento hace que las conclusiones sobre las medias de las medidas antropométricas sean menos rigurosas. Una limitación importante de este estudio es la ausencia de un grupo control, que proporcionaría la base comparativa. Es por esto que se prefirieron recoger los datos que proporciona la Fundación Pablo Orbegozo, por tratarse de medidas de lactantes nacidos en España en los últimos 10 años, y realizar la comparación con esta muestra poblacional. Otra limitación en el seguimiento de la base es el hecho de que muchos de los datos, sobre todo aquéllos relacionados con la duración y el cumplimiento del tratamiento, son derivados de encuestas realizadas a las madres durante las visitas sucesivas. Por otro lado, en el presente análisis no se ha tenido en cuenta la duración del tratamiento, lo que sí podría ser un factor importante para el desarrollo ponderoestatural.