Describir la evolución 4.944 niños que completaron el seguimiento a los 2 años de edad corregida de un total de 10.456 nacidos entre los años 2002-2007 con peso ≤1.500g y dados de alta en los hospitales pertenecientes a la red SEN1500, de los cuales 522 fueron excluidos por presentar algún tipo de malformación. El número de niños evaluados supone un 49,76% del total de niños dados de alta sin malformaciones en el conjunto de hospitales integrantes de la red.
MétodosEstudio retrospectivo de los datos recogidos prospectivamente en la base de datos SEN1500. Se compararon los datos de crecimiento somatométrico a los 2 años de edad corregida en los grupos según el peso al nacimiento y el sexo. Se analizaron entre estos grupos las alteraciones motoras, la incidencia de parálisis cerebral, las alteraciones visuales y auditivas y el desarrollo neuromadurativo anormal para la edad de gestación. Se estudió la asociación de parálisis cerebral con factores perinatales.
ResultadosEl 44,2% de los niños seguidos a los 2 años tuvieron un peso <2 desviaciones estándar; presentaron peor evolución en todos los parámetros somatométricos los niños con peso al nacimiento ≤1.000g. El 6,96% de los niños tuvo algún tipo de dificultad motora, estando el 4,56% de ellos diagnosticados de parálisis cerebral. Su incidencia fue mayor entre los varones con peso ≤1.000g. Hubo una incidencia de alteraciones visuales del 5,21%, siendo ciegos de uno o ambos ojos el 0,5% de los niños. La parálisis cerebral se asoció con retinopatía del prematuro grave, hemorragia intraventricular grave y leucomalacia periventricular, en especial la leucomalacia periventricular quística
To describe growth and neurodevelopmental status of 4,944 children who completed a follow-up at two years of corrected age out of the 10,456 newborns with weight ≤1500g born between the years 2002-2007 and discharged from hospitals within the network SEN1500. A total of 522 newborns were excluded as they had some type of malformation. The total number of children assessed represents the 49.76% of children discharged alive and without malformations.
MethodsA retrospective review was conducted using prospectively collected data in the SEN1500 database. We compared growth data at two years of corrected age according to birth weight and sex. Motor impairment, incidence of cerebral palsy, visual and hearing disabilities, and abnormal neurodevelopment for gestational age were analysed between groups. We studied the associations between cerebral palsy (CP) and perinatal factors.
ResultsAt 2 years of age 44.2% of children had a weight <2 SD for corrected age. Children with birth weight ≤1000g showed worse outcomes in growth. Some type of motor impairment was observed in 6.96% of the infants, and 4.56% of them were diagnosed with CP. The incidence was higher among males with birth weight ≤1000g. There was an incidence of 5.21% of visual disability, with 0.5% of children being blind in one or both eyes. Cerebral palsy was associated with retinopathy of prematurity, severe intraventricular haemorrhage, and periventricular leukomalacia, in particular cystic periventricular leukomalacia.
Los avances tecnológicos y terapéuticos en los cuidados perinatales y neonatales en estos últimos años han disminuido la mortalidad de los recién nacidos (RN) <1.500g1 y han hecho que la morbilidad haya cambiado. Estudios recientes del grupo EPICURE2 refieren una disminución de la mortalidad en niños extremadamente prematuros, con una disminución de su discapacidad. Dado que el indicador principal de la asistencia neonatal es la supervivencia con ausencia de discapacidad, es importante conocer la evolución de estos niños a corto y a largo plazo. Por este motivo la Sociedad Española de Neonatología (SEN) creó una red neonatal española (SEN1500) con un programa diseñado para recoger datos de morbimortalidad de los niños nacidos con un peso ≤1.500g en los hospitales pertenecientes a la red, que son seguidos hasta los 2 años de edad corregida. Disponemos de datos de seguimiento de otras redes neonatales europeas en las que se detectan diferencias en los resultados según el género y el peso al nacimiento; así, el grupo EPICURE3 estudia la evolución de niños nacidos por debajo de 26 semanas y comprueba cómo un 23% de estos niños tiene una discapacidad severa, siendo más frecuente en el grupo de varones con respecto a las mujeres a la edad de 2,5 años; el grupo EPIPAGE4 estudia la evolución de una cohorte de niños nacidos con menos de 33 semanas encontrando una mejor evolución de las mujeres con respecto a los varones en el coeficiente de desarrollo. En el metaaálisis realizado por Escobar et al.5 no hubo diferencias notables en la incidencia de parálisis cerebral ni de discapacidad entre los <1.000g, y los niños con peso al nacer entre 1.000-1.500g, sin embargo estudios multicéntricos posteriores comprueban que la parálisis cerebral bilateral espástica ha disminuido en los últimos años en el grupo de peso 1.000-1.499g6. En otros estudios donde valoran los niños nacidos con un peso <1.000g entre los 18-24 meses de edad corregida, encuentran tasas más elevadas de alteraciones motoras y neurosensoriales, a medida que disminuye el peso al nacer7,8.
El objetivo de este estudio es analizar la frecuencia de discapacidad a los 2 años de edad corregida de RN con peso al nacimiento ≤1.500g, atendidos entre los años 2002-2007 en los hospitales pertenecientes a la red SEN1500, comprobar si hay diferencias de morbilidad entre los RN con peso al nacer ≤1000g y 1.001-1.500g estratificados según el sexo y analizar la asociación de parálisis cerebral (PC) con factores neonatales.
Población y métodosPoblaciónCohorte de 4.944 RN entre 400g y 1.500g, sin malformaciones, dados de alta en 38 hospitales pertenecientes a la red neonatal SEN1500 entre los años 2002-2007 y valorados a los 2 años de edad corregida en dichos hospitales. En total hubo 10.456 niños vivos al alta, en un total de 64 hospitales, de los cuales se excluyeron 522 por presentar algún tipo de malformación congénita; los 9.934 restantes tuvieron datos de seguimiento, si bien valorados entre los 18 y 30 meses de edad corregida hubo un total de 4.944 (49,76% del total) que se consideraron válidos para el estudio. La población de los evaluados se dividió en 2 grupos: según el peso al nacimiento: ≤1000g (1.430) y de 1.001-1.500g (3.514) y diferenciando las mujeres (2.551) de los varones (2.393).
MétodoSe ha realizado el estudio retrospectivo de los datos recogidos prospectivamente en la base de datos SEN1500, previa petición de consentimiento informado a los padres, que se basa en un registro informatizado y protocolizado con reuniones periódicas de los investigadores para dar calidad a los datos y con monitorización anual de los datos aportados. Inicialmente se compararon las características perinatales de los niños evaluados con los perdidos en el seguimiento. Se consideraron bajo peso al nacimiento los niños cuyo peso estaba por debajo de 2 desviaciones estándar según las tablas de Olsen9.
En la población evaluada se compararon los datos de crecimiento somatométrico (peso, talla y perímetro cefálico) a los 2 años de edad corregida en los grupos según el peso al nacimiento y el sexo. Se consideró bajo peso, talla baja y perímetro cefálico bajo cuando eran inferiores a 2 desviaciones estándar según las tablas de Hernández et al.10 y en función de la edad corregida.
Se analizaron entre estos grupos las alteraciones de la función neuromotora, la incidencia de parálisis cerebral mediante exploración neurológica, la función visual, auditiva y la comunicación valorada según las definiciones especificadas en el manual de la Web SEN 150011, semejantes a las referidas por otros grupos3,12, y el desarrollo neuromadurativo anormal para la edad de gestación valorado por test de desarrollo, o en su defecto por impresión clínica y encuesta de los padres. Se estudió la asociación de parálisis cerebral con factores perinatales y la morbilidad neonatal.
Se analizó el porcentaje de niños que a los 2 años presentaron una secuela leve, moderada o grave, definida como discapacidad leve cuando presentaban parálisis cerebral pero habían conseguido la marcha, alteraciones visuales corregidas con lentes, hipoacusia <40dB o coeficiente de desarrollo (CD) entre 71-84; discapacidad moderada aquellos con parálisis cerebral que habían conseguido la sedestación, alteraciones visuales no corregidas con lentes o ceguera unilateral, hipoacusia entre 41-90dB o CD entre 55-70; y discapacidad grave cuando tenían dificultad para sentarse, dificultad para el uso de las 2 manos, dificultad visual (ciego de los dos ojos), sordera o CD <55.
Finalmente se analiza la incidencia de reingresos hospitalarios y su principal causa mediante anamnesis a sus cuidadores.
Análisis estadísticoSe realizó un análisis univariable para la descripción de la muestra. Según la distribución que presentaban las variables del estudio, se utilizaron pruebas paramétricas o no paramétricas. Las variables continuas con distribución normal fueron descritas a través de sus medias y desviaciones estándar, mientras que las que no presentaron distribución normal se expresaron con su mediana y rango intercuartílico. Se calcularon frecuencias y porcentajes para las variables categóricas. Se utilizó la prueba Chi-cuadrado de Pearson (o la prueba exacta de Fisher en su caso) para el análisis de datos categóricos. Se estima el efecto con odds ratio junto a su IC 95% (odds ratio brutas). Se analizaron las medias según distintos grupos, mediante el test «t» de Student o el test no paramétrico de la U de Mann-Whitney, según correspondía. Finalmente, se ajustó un modelo de regresión logística con el fin de determinar los posibles factores predictivos asociados a la parálisis cerebral. Los contrastes de hipótesis fueron bilaterales, con una significación de 0,05. Todos los análisis estadísticos se realizaron utilizando el programa SPSS versión 19.0.
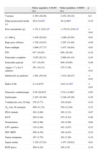
ResultadosEn la tabla 1 se muestran las características perinatales y la morbilidad de los niños que completaron su seguimiento con los que no lo hicieron. En la valoración del crecimiento el 44,2% de los niños tuvieron un peso <2DS, en el 24,3% la longitud estaba <2DS y en el 22,48% el perímetro cefálico estaba <2DS, presentaron peor evolución los ≤1.000g al nacer, tanto en varones como en mujeres. Peso: OR 2,41 (IC 95% 0,85-1,07). Longitud: OR 1,82 (IC 95% 1,58-2,11). Perímetro cefálico: OR 2,18 (IC 95% 1,188-2,54). Al comparar ambos sexos no hubo diferencias significativas en cuanto a la longitud ni al peso, pero sí existieron en el perímetro cefálico, con mayor frecuencia de percentil <2DS entre los varones: OR 1,34 (IC 95% 1,16-1,54).
Características perinatales de los niños con seguimiento a los 2 años y niños perdidos
| Niños seguidos: 4.944N (%) | Niños perdidos: 4.990N (%) | p | |
| Varones | 2.393 (48,40) | 2.452 (49,10) | 0,4 |
| Edad gestacional media (s) | 29,9 (2,62)a | 30 (2,66)a | 0,19 |
| Peso nacimiento (g) | 1.151,5 (242,3)a | 1.170,35 (239,1)a | <0,01 |
| ≤1.000g | 1.430 (28,92) | 1.296 (25,95) | 0,01 |
| Bajo peso (Olsen) | 1.728 (34,97) | 1.597 (31,89) | 0,50 |
| Parto múltiple | 1.866 (37,77) | 1.837 (36,84) | 0,63 |
| FIV | 917 (18,95) | 858 (18,36) | 0,18 |
| Esteroides completo | 3.025 (62,51) | 2.966 (61,43) | 0,45 |
| Esteroides parcial | 917 (18,95) | 949 (19,66) | 0,46 |
| Apgar <7 a los 5 minutos | 501 (10,13) | 375 (7,58) | <0,01 |
| Intubación en paritorio | 1.482 (30,10) | 1.412 (28,47) | <0,01 |
| Índice Crib | 2,3 (2,67)a | 2,03 (2,35)a | <0,01 |
| Duración ventiloterapia | 5,56 (20,65)a | 5,54 (13,66)a | 0,95 |
| Surfactante | 2.245 (45,46) | 2.248 (45,20) | 0,30 |
| Ventilación a los 28 días | 276 (5,77) | 316 (6,84) | 0,10 |
| O2 a las 36 semanas | 499 (11,32) | 530 (12,49) | 0,33 |
| PDA tratada | 182 (3,68) | 165 (3,31) | 0,07 |
| ECN | 259 (5,24) | 275 (5,53) | 0,26 |
| Neumotórax | 146 (2,96) | 154 (3,09) | 0,64 |
| LPV quística | 119 (2,44) | 101 (2,07) | 0,22 |
| HIV III/IV | 206 (4,30) | 194 (4,03) | 0,54 |
| Sepsis temprana | 187 (3,79) | 162 (3,26) | 0,18 |
| Sepsis tardía | 1.329 (27,03) | 1.457 (29,62) | 0,01 |
| ROP grave | 206 (4,16) | 194 (3,9) | 0,34 |
La tabla 2 refleja la incidencia de secuelas incluyendo cualquier espectro de gravedad y el riesgo de padecerlas según grupos de peso y sexos.
Riesgo de complicaciones detectadas en el seguimiento a los 2 años de edad
| Total | Mujeres ≤1.000g | Mujeres >1.000g | Varones ≤1.000g | Varones >1.000g | Peso | Sexo | |
| % | |||||||
| Parálisis cerebral | 4,56 | 4,81 | 3,43 | 8,62 | 4,06 | OR 1,8 (IC 95%: 1,36-2,4) | OR 1,4 (IC 95%: 1,06-1,86) |
| Dificultad motora | 6,96 | 7,59 | 4,96 | 12,60 | 6,57 | OR 1,8 (IC 95%: 1,43-2,26) | OR 1,47 (IC 95%: 1,17-1,84) |
| Dificultad visual | 5,21 | 7,15 | 3,48 | 9,65 | 4,48 | OR 2,2 (IC 95%: 1,68-2,85) | OR 1,3 (IC 95%: 1,00-1,69) |
| Dificultad audición | 2,41 | 3 | 1,26 | 6,89 | 1,61 | OR 3,4 (IC 95%: 2,36-5,07) | OR 1,74 (IC 95%: 1,18-2,55) |
| Dificultad comunicación | 5,23 | 5,53 | 3,03 | 12,52 | 4,55 | OR 2,4 (IC 95%: 1,88-3,15) | OR 1,8 (IC 95%: 1,41-2,39) |
| Dificultad expresión | 17,34 | 18,38 | 10,01 | 34,49 | 18,38 | OR 2,16 (IC 95%: 1,85-2,52) | OR 2,01 (IC 95%: 1,72-2,35) |
| Desarrollo patológico | 12,37 | 13,70 | 9,16% | 22,69 | 11,21 | OR 1,9 IC 95% (01,59-2,3) | OR 1,42 IC 95% (1,18-1,70) |
Presentaron parálisis cerebral el 4,56% de los niños, con mayor incidencia en los ≤1.000g, en especial los varones. En las alteraciones de la función neuromotora hubo más varones que mujeres con dificultades motoras, siendo más frecuentes entre los ≤1.000g para los 2 sexos. Hubo mayor incidencia de déficit visual, auditivo y de la comunicación entre los ≤1.000g, en especial en los varones.
El tipo de parálisis cerebral más frecuente en todos los grupos fue el espástico, con un discreto predominio de la diplejía; la hemiplejía fue más frecuente en los grupos de mayor peso, tanto en varones como en mujeres. Sin embargo, en los grupos de menor peso la cuadriplejía fue más frecuente que en los de mayor peso (tabla 3).
Casos de parálisis cerebral por grupos de sexo y según peso al nacimiento. Valores expresado en n (%)
| Total | Mujeres ≤1.000g | Mujeres >1.000g | Varones ≤1.000g | Varones >1.000g | |
| N (%) | N (%) | ||||
| Parálisis cerebral | 208 (4,56) | 34 (4,81) | 56 (3,43) | 53 (8,62) | 65 (4,06) |
| Diplejía | 73 (37,24) | 11 (33) | 21 (39,62) | 18 (36) | 23 (38,33) |
| Hemiplejía | 55 (28,06) | 7 (21,21) | 18 (33,96) | 10 (20) | 20 (33,03) |
| Cuadriplejía | 39 (19,90) | 9 (27,27) | 7 (13,21) | 12 (24) | 11 (18,33) |
| Atetoide | 2 (1,02) | 0 | 2 (3,77) | 0 | 0 |
| Incierta | 27 (13,78) | 6 (18,18) | 5 (9,43) | 10 (20) | 6 (10) |
En La tabla 4 queda reflejada la gravedad de las alteraciones motoras.
Gravedad de las alteraciones motoras para los distintos grupos. Riesgo de alteraciones
| Total | Mujeres ≤1.000g | Mujeres >1.000g | Varones ≤1.000g | Varones >1.000g | Peso | Sexo | |
| N (%) | N (%) | ||||||
| Dificultad para caminar | 298 (6,02) | 46 (5,99) | 77 (4,3) | 72 (10,85) | 103 (5,9) | OR (1,65 IC 95%: 1,3-2,11) | OR 1,55 (IC 95%: 1,22-1,96) |
| No deambulación estable | 146 (48,99) | 21 (45,65) | 38 (49,35) | 35 (48,61) | 52 (50,48) | ||
| Marcha anormal | 42 (14,09) | 2 (4,34) | 14 (18,18) | 13 (18,05) | 13 (12,62) | ||
| Imposibilidad para marcha sin apoyo | 97 (32,55) | 19 (41,30) | 22 (28,57) | 21 (29,16) | 35 (33,98) | ||
| Dificultad para sentarse | 81 (1,63) | 20 (2,60) | 15 (0,84) | 19 (2,86) | 27 (1,56) | OR 2,30 (IC 95%: 1,48-3,57) | OR 1,45 (IC 95%: 0,9-2,18) |
| Sedestación inestable | 21 (25,92) | 3 (15) | 5 (33,33) | 4 (21) | 9 (33,33) | ||
| Sedestación con apoyo | 25 (30,86) | 5 (25) | 3 (20) | 8 (53,33) | 9 (33,33) | ||
| Imposibilidad para sentarse | 27 (33,33) | 10 (50) | 6 (40) | 5 (33,33) | 6 (22,22) | ||
| Dificultad en el uso de manos | 166 (3,35) | 30 (3,91) | 39 (2,18) | 44 (6,63) | 53 (3,06) | OR 2,01 (IC 95%: 1,47-2,76) | OR 1,51 (IC 95%: 1,10-2,07) |
| Una mano | 64 (38,55) | 11 (36,66) | 14 (35,89) | 13 (29,54) | 26 (49) | ||
| Dos manos | 24 (14,45) | 3 (10) | 8 (20,51) | 10 (22,72) | 3 (5,66) | ||
| Dificultad para comer solo | 69 (41,56) | 14 (46,66) | 13 (33,33) | 19 (43,18) | 23 (43,39) | ||
| Dificultad en el control de la cabeza | 29 (0,58) | 10 (1,30) | 7 (0,39) | 3 (0,45) | 9 (0,52) | OR 1,99 (IC 95%: 0,95-4,15) | OR 0,75 (IC 95%: 0,35-1,57) |
| Sostén cefálico inestable | 13 (44,82) | 5 (50) | 3 (42,85) | 1 (33,33) | 4 (44,44) | ||
| Necesidad soporte cefálico | 10 (34,48) | 3 (30) | 2 (28,57) | 1 (33,33) | 4 (44,44) | ||
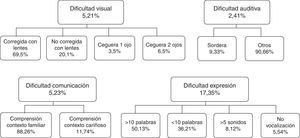
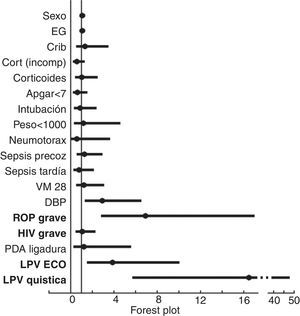
La mayoría de los déficits visuales fueron leves, siendo ciegos de uno o ambos ojos el 0,5% de los niños. La incidencia de sordera fue de 0,22% de todos los niños. En cuanto a la comunicación la dificultad en la expresión fue la más frecuente (17,35% de todos los niños), presentando ausencia de vocalización el 0,95% (fig. 1). En la regresión logística la parálisis cerebral se asoció con retinopatía del prematuro (ROP) grave, hemorragia intraventricular (HIV) grave y leucomalacia periventricular (LPV), en especial la LPV quística (fig. 2). Las variables que se incluyeron están representadas en la figura 2. La impresión global de cada niño mostró que el 88,9% no presentó ningún tipo de discapacidad, mientras que el 11,1% sí la tuvo. De ellos, el 50% presentaba una discapacidad leve, el 21% moderada y el 29% grave.
Precisaron reingreso 1.279 niños (25,87%). La necesidad de reingreso fue significativamente mayor en los varones, con mayor frecuencia en los ≤1.000g. Los problemas respiratorios fueron su causa más común (31,7% del total).
DiscusiónLa mortalidad de los RN prematuros ha descendido en la última década, existiendo controversia acerca de si ello ocasiona un aumento en la morbilidad en esta población13,14. En el año 2002 se inició la recogida de una base de datos elaborada por la Sociedad Española de Neonatología llamada SEN1500, en la que se registran datos de morbimortalidad al nacimiento y del seguimiento de estos niños a los 2 años15. Al ser niños pertenecientes a distintos hospitales españoles existen problemas en la unificación de criterios de todos los observadores, por lo que se han realizado monitorizaciones y reuniones periódicas para perfilar las definiciones y aumentar la fiabilidad de los datos.
A los 2 años de edad pueden detectarse la mayoría de los trastornos sensoriales y psicomotores graves, aunque es posible que a esta edad no se detecten otras alteraciones menos graves, como problemas de aprendizaje y de conducta que no se han manifestado todavía16,17. En nuestra serie la pérdida de niños seguidos a los 2 años fue elevada, lo que hace que los resultados no reflejen la totalidad de los niños atendidos en los hospitales pertenecientes a SEN1500. No obstante, la recogida y el análisis de estos datos en 4.944 menores de 1.500g españoles aporta una información muy útil y supone una buena base para futuros estudios.
Una de las secuelas más frecuentemente observadas durante el seguimiento de los recién nacidos de bajo peso (<1.500g) es el retraso del crecimiento posnatal, especialmente en los de extremado bajo peso (<1.000g)18,19. Nuestros resultados apoyan los hallazgos de otros autores al encontrar un retraso del crecimiento posnatal en los recién nacidos de bajo peso al nacimiento20,21, siendo estos hallazgos significativamente más manifiestos en los recién nacidos que tuvieron un peso al nacimiento ≤1.000g, tanto en el grupo de varones como en el de mujeres. El peso fue el parámetro más afectado y el perímetro cefálico el que menos se alteró en todos los grupos, como ya ha sido referido con anterioridad22.
En cuanto a la influencia del sexo en el crecimiento posnatal hay autores que describen una discreta mejor evolución en las niñas23 y otros no encuentran diferencias24. En nuestro estudio solo se encontraron diferencias significativas en el crecimiento del perímetro cefálico, peor en los varones, dato que debe ser valorado, ya que el escaso crecimiento cerebral se asocia con deterioro cognitivo, como refiere el grupo Epicure25. En nuestra serie las alteraciones en la función neuromotora tuvieron mayor incidencia en los niños con peso ≤1.000g, datos concordantes con otras redes neonatales3,8; así mismo, hubo mayor incidencia de este tipo de discapacidad en varones que en mujeres, como ya se ha referido otros grupos26,27. Fueron diagnosticados de parálisis cerebral el 4,56% de los niños, cifra algo inferior de lo encontrado por otros grupos; la Vermont Oxford Network (VON) refiere un porcentaje de PC en una población similar a la nuestra de 8,5%28, pero esta cifra puede aumentar en etapas posteriores, como demuestran los estudios del grupo EPICURE27 y el grupo EPIPAGE29. En un estudio publicado recientemente que valora una población de niños <1.500g al nacer, valorados entre los 8-18 meses, encuentra una incidencia de PC del 3,7%, algo inferior a la nuestra30, probablemente debido a la precocidad de la valoración. La incidencia de la PC es mucho mayor en los extremadamente prematuros, que alcanza hasta un 19% en el estudio del grupo EPICURE31 en niños nacidos con <26 semanas de gestación y hasta un 17% en el gupo National Institute of Child Health and Human Development (NICHD) en poblaciones de extremado bajo peso7. Según la experiencia internacional, aunque la tasa de PC permanece estable, el número absoluto de niños ha aumentado debido al incremento de la supervivencia32,33. Si bien estudios multicéntricos concluyen que la prevalencia de la PC entre los niños <1.500g parece estar disminuyendo en Europa14,34, esta disminución es solo en el grupo de niños >1.000g14,35, y esta incidencia es menor a medida que se incrementa la edad de gestación36. En nuestro estudio también hubo mayor incidencia de PC en niños de menor peso, y fue mayor en el grupo de los varones frente a las mujeres, sobre todo en los ≤1.000g. En los niños con parálisis cerebral se encuentra una asociación con la LPV y HIV grados iii-iv en el periodo neonatal, afirmando una vez más el valor predictivo que tiene la presencia de lesión parenquimatosa detectada por ecografía28,32,37,38. En nuestro estudio el tipo de parálisis cerebral que predominó fue la espástica, y dentro de esta la diplejía. Sin embargo, actualmente se refiere una tendencia a la disminución de la diplejía por la reducción de la LPV, permaneciendo la hemiplejía estable14.
El retraso del desarrollo neuromadurativo para la edad corregida se evaluó mediante distintos test de desarrollo, y en su defecto por la impresión clínica y encuesta a los padres, por lo que es un dato a valorar con reservas.
Las alteraciones neurosensoriales suponen otra de las secuelas más comprometedoras en el pronóstico a largo plazo de los prematuros. El estudio del grupo EPIPAGE refiere defecto visual >3 dioptrías en el 2,7% de los niños <33 semanas a los 5 años29. En nuestro estudio se detectó déficit visual de un 5,21%, incluyendo defectos leves que precisaban lentes para su corrección, siendo mayor en la población de menor peso al nacimiento, dato que coincide con las observaciones de otros autores en las que las alteraciones oftálmicas disminuyen con el aumento del peso y la edad de gestación8. La incidencia de sordera fue inferior a la referida por la VON: 1,9%28, aunque varía en los distintos estudios; así en el grupo EPIPAGE29 la incidencia de hipoacusia grave a los 5 años de edad fue del 0,4% en la población entre 24-32 semanas de gestación, y en un estudio del grupo EPICURE39 refieren un 3% de hipoacusia profunda en<26 semanas valorados a los 6 años, cifra que coincide con el estudio multicéntrico de Vohr7.
Las alteraciones en el lenguaje fueron predominantemente del lenguaje expresivo, y hubo mayor predominio de este retraso en los varones y en los grupos de menor peso, lo que coincide con lo referido por otros autores26,37.
En el momento de la evaluación el 88,9% de los niños no tenía ningún tipo de discapacidad y en el 50% de los niños que la presentaban se trataba de una discapacidad leve no invalidante, resultados concordantes con otros estudios38.
La causa predominante de reingresos fueron los problemas respiratorios, tal como ya había sido descrito39.
En conclusión, este estudio recoge el seguimiento a los 2 años de edad de 4.944 recién nacidos prematuros ≤1.500g al nacer procedentes de diferentes hospitales en España. Sus resultados reflejan la situación de estos niños de forma parcial, lo cual implica la necesidad de mejorar la recogida de los datos. Sin embargo, puede servir de base para optimizar y comparar futuros estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el equipo de investigadores y coordinadores de la Red Neonatal SEN1500, a los presidentes, vicepresidentes y vocales de la Comisión SEN1500.
Complejo Hospitalario Albacete (A. Martínez Gutiérrez); Hospital Basurto (G. Saitua Iturriaga); Hospital Bierzo (M.T González Martínez); Hospital Cabueñes (A. Rodríguez Fernández); Hospital Cantabria (J. Gómez-Ullate Vergara, R. Galván); Hospital Carlos Haya (T. Sánchez Tamayo, M. García del Río); Hospital Central Asturias (C. Moro Bayón, J. López Sastre); Hospital Clínic Barcelona (J. Figuera Aloy, F. Botet Mussons); Hospital Clínico San Carlos (T. Carrizosa Molina, E. Mariscal Ramos); Hospital Cruces (C. de Castro Laíz, A. Valls-I-Soler); Hospital de Granollers (I. Anquela Sanz); Hospital de la Santa Creu i Sant Pau (G. Ginovart Galiana, E. Moliner Calderon); Hospital Universitario Donostia (M.D. Elorza Fernández); Hospital Germans Trias i Pujol (Coroleu, A. Natal Pujol); Hospital Getafe (M. Muro Brussi, L. Cabanillas Vilaplana); Hospital Jerez (J. Ortiz Tardío, E. Valls Sánchez Puerta); Hospital León (E.A. Iglesias, F. Fernández Calvo); Hospital Montepríncipe (M. García San Miguel); Hospital Mutua de Terrassa (A. Moral García); Hospital San Juan de Deu (M. Iriondo Sanz); Hospital San Pedro (F. Cucalón Manzanos, M. Yolanda Ruiz del Prado); Hospital San Pedro de Alcántara (A. Barrio Sacristán, M.J. López Cuesta); Hospital Severo Ochoa (M.J. Santos Muñoz); Hospital Txagorritxu (M.M. Martínez Ayucar); Hospital Virgen de la Concha (V. Marugán Isabel, T. Casanueva Pascual); Hospital Virgen de la Luz (E. Cueto Calvo); Hospital Virgen de la Salud (A. de Ureta Huertas, A. Arroyos Plana); Hospital Virgen de las Nieves (L.F. Moltó Ripio, J.A. Hurtado Suazo); Hospital Universitario Santiago (J.M. Fraga, M.I. Martínez Soto); Hospital General Yagüe (B.A. Álvarez, J.M. Montero Macarro); Hospital General Universitario Alicante (M. López Azorín, M. González Santacruz); Hospital Universitario La Paz (J. Pérez Rodríguez, S. Salas); Hospital Universitario Canarias (P.A. Fuster Jorge); Hospital Universitario La Fe (V. Roqués, F. Morcillo); Hospital Universitario Reina Sofía (J.M. Guzmán Cabañas, M.D. Huertas Muñoz); Hospital Universitario Río Hortega (C. González Armengol, M.F. Omaña); Hospital Universitario Salamanca (P. García González, R. García Sánchez); Institut Dexeus (R. Porta, E. Capdevila Cogul); Hospital Juan Canalejo (J.L. Fernández Trisac); Hospital Elche (M. González Santa Cruz); Hospital Universitario San Juan (J. Pastor Peydrol, J. González de Dios); Hospital Nuestra Señora de Sonsoles (A. Martín Sanz, M. García); Hospital Son Dureta (P.-R. Balliu Badía); Corporación Parc Taulí (J. Badía, C. Figaró); Scias-Hospital Barcelona (X. Sagrera Felip) Hospital Vall Hebrón (A.F. Martí, J. Perapoch López); Hospital General de Castellón (R. Aguilera Olmos); Hospital Infanta Margarita (J.M. Barcía Ruiz); Complejo Hospitalario A. Marcide (J. Luaces González); Hospital J. Trueta (A. Trujillo); Hospital Universitario San Cecilio (E. Narbona, A. Ruiz); Hospital M.I. de Canarias (G.E. González-Luis, F. García-Muñoz); Hospital Universitario Arnau de Vilanova (E. Solé Mir, J. García Martí); Fundación Hospital Alarcón (A. Martín Ancel); Hospital General Universitario Gregorio Marañón (A. Fuster Jorge); Hospital General de Segovia (A. Urbón Artero); Hospital Universitario I. Virgen del Rocío (C. Macías Díaz); Hospital Virgen de la Macarena (M. Granero Asensio, A. López); Hospital Juan XXIII (J.M. Carretero Bellón); Hospital Cínico Universitario de Valencia (J. Estañ Capell); Hospital Universitario Valladolid (J. Luis Fernández Calvo); Hospital Xeral Vigo (S. Ocampo Cardalda); Hospital Clínico Universitario Zaragoza (P. Ventura Faci); Hospital Miguel Servet (J.J. Beltrán Crouset).