Describir los aspectos epidemiológicos, clínicos y microbiológicos del serotipo 19A como principal productor de enfermedad neumocócica invasiva (ENI) en un hospital terciario de la Comunidad de Madrid (CAM).
MétodosEstudio retrospectivo (1998-2004) y prospectivo (2005-2009) del serotipo 19A como agente productor de ENI en pediatría entre 1998-2009. Se analizaron 3 periodos de estudio: P1 (1998-2001), previo a la comercialización de la VNC7; P2 (2002-2005), con una cobertura vacunal de 40%, y P3 (2006-2009), cuando la vacuna fue incorporada al calendario vacunal de la CAM.
ResultadosSe analizaron un total de 155 muestras de Streptococcus pneumoniae (S. pneumoniae) productoras de ENI; 21 casos producidos por el serotipo 19A (14%). Se detectó un aumento de la prevalencia del serotipo 19A: 2 casos de un total de 45 en P1 (4,4%), 3 de 41 casos en P2 (7,3%) y 16 de 69 casos en P3 (23,2%). Afectó, principalmente, a niños menores de 2 años (16/21; 76%), siendo, globalmente, el principal productor de meningitis (5/20; 25%), así como de empiema pleural (3/22; 14%) y mastoiditis bacteriémica (2/4; 50%). Trece aislamientos (61,5%) presentaron una CMI ≥ 0,12μ/ml para penicilina en infecciones extrameníngeas y 3 de los 5 casos de meningitis (60%) presentaron una CMI ≥ 1μ/ml para cefotaxima.
ConclusionesEl serotipo 19A se convirtió en el principal agente etiológico productor de ENI en la era de la VNC7 (P3), asociando altas tasas de resistencia antibiótica. Este serotipo produjo todas las formas clínicas de ENI, siendo el principal causante de meningitis.
To describe the epidemiology, clinical syndromes and microbiological characteristics of serotype 19A as the main cause of invasive pneumococcal disease (IPD) in children admitted to a tertiary hospital in Spain.
MethodsA retrospective (1998-2004) and prospective (2005-2009) study was conducted on children with IPD produced by serotype 19A. The study was divided into three periods (P): P1 (1998-2001) when PCV7 had not been commercialized; P2 (2002-2005) with 40% vaccine coverage among children; and P3 (2006-2009) when the vaccine was added to the Childhood Immunization Schedule in Madrid.
ResultsA total of 155 isolates of Streptococcus pneumoniae (SP) producing IPD were analysed, with 21 of them being serotype 19A (14%). An increased prevalence of serotype 19A was found: 2/45 cases (4.4%) in P1, 3/41 cases (7.3%) in P2 and 16/69 cases (23.2%) in P3. It occurred mostly in children younger than 2 years (16/21; 76%). This serotype was the main cause of meningitis (5/20; 25%), pleural empyema (3/22; 14%) and bacteraemic mastoiditis (2/4; 50%). Thirteen isolates (61.5%) had an MIC ≥ 0.12μ/ml for penicillin in extra-meningeal infections, and 3 of the 5 isolates causing meningitis (60%) had an MIC ≥ 1μ/ml for cefotaxime.
ConclusionsSerotype 19A was the main causal agent of IPD in the PCV7 era (P3), with high antibiotic resistance rates. This serotype was responsible for all types of IPD, being the main cause of meningitis.
La epidemiología de la enfermedad neumocócica invasiva (ENI) ha variado sustancialmente en la última década de forma concomitante a la introducción de la vacuna neumocócica heptavalente (VNC7; Prevenar®). La introducción de la VNC7 en el año 2000 se asoció con la práctica desaparición de los serotipos vacunales (SV) y su reemplazo por otros serotipos emergentes o serotipos no vacunales (SNV)1,2. Así, se ha observado un aumento muy significativo de la incidencia de ENI producida por el serotipo 19A, siendo, en la actualidad, el principal serotipo productor de ENI, y uno de los principales agentes etiológicos de algunas formas clínicas como empiema pleural y meningitis3,4. Igualmente, este serotipo es el serotipo emergente que asocia con más frecuencia resistencia a penicilina y cefalosporinas de tercera generación5,6.
Por todo ello, este serotipo ha suscitado numerosas publicaciones nacionales e internacionales analizando su repercusión epidemiológica, clínica y microbiológica. Debido a que es un serotipo incluido en algunas vacunas neumocócicas ampliadas (VNC13; Prevenar 13®), es importante que el pediatra conozca al máximo sus características para poder indicar con precisión científica la administración de la vacuna.
Material y métodosEstudio observacional, descriptivo, de niños menores de 16 años diagnosticados de ENI producida por el serotipo 19A en el Hospital General Universitario Gregorio Marañón, en Madrid, durante un periodo de 12 años (enero de 1998 a diciembre de 2009). Este hospital es el centro de referencia del Área 1 de la Comunidad Autónoma de Madrid (CAM) que atiende a un número de urgencias pediátricas que oscila entre 30.000 y 60.000 anuales.
Se incluyeron todos los pacientes con diagnóstico de ENI, realizándose un análisis detallado de los casos en los que se aisló el serotipo 19A de Streptococcus pneumoniae (S. pneumoniae) de cualquier muestra estéril (sangre, líquido cefalorraquídeo, pleural, articular o peritoneal). El estudio consta de una fase retrospectiva durante el periodo 1998-2004, donde se revisaron las historias clínicas de los pacientes que habían presentado un síndrome clínico compatible con ENI, con especial énfasis en aquellos en los que se aisló el serotipo 19A, a partir de una base de datos de S. pneumoniae, y una segunda fase durante el periodo 2005-2009, donde el análisis se realizó de manera prospectiva. Se recogieron variables epidemiológicas, clínicas y microbiológicas incluyendo edad, sexo, antecedentes personales y familiares, antecedente de vacunación antineumocócica, forma clínica de presentación y evolución, muestra en la que se realizó el aislamiento o procedimientos microbiológicos (cultivo y antibiograma, técnicas de biología molecular, detección antigénica).
La identificación de S. pneumoniae se realizó según los protocolos de identificación fenotípica bacteriana basados en las características «observables» de las bacterias (morfología, hemólisis, propiedades bioquímicas y metabólicas). La serotipificación se realizó a través de la aglutinación en látex con antisueros específicos (Pneumotest, Statens Serum Institut, Glostrup, Dinamarca) en el laboratorio de referencia de neumococo (Instituto de Salud Carlos III), donde se determinaron los aislamientos producidos por el serotipo 19A. Para realizar el análisis de la resistencia antibiótica, el estudio de la concentración mínima inhibitoria (CMI) se basó en las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) por medio del método de microdilución en caldo, utilizando distintos paneles antibióticos comercializados (penicilina, eritromicina, cefotaxima, fluoroquinolonas, rifampicina y vancomicina). Se definió multirresistencia a la resistencia a 3 o más antibióticos.
La VNC7 fue comercializada en España en junio de 2001 e incorporada en la CAM dentro del calendario sistemático de vacunación en el año 2006. Por esta razón, se ha dividido el estudio en 3 periodos: P1 (enero de 1998 a junio de 2001) en el que todavía no se encontraba comercializada la VNC7; P2 (julio de 2001 a diciembre de 2005) en el que la vacuna no estaba incluida dentro del calendario sistemático de vacunación de la CAM, con una cobertura vacunal aproximada de un 40-50%, y P3 (2006 a 2009) en el que la vacuna fue incorporada al calendario sistemático de vacunación de la CAM (cobertura superior al 90%).
El análisis estadístico se realizó mediante el programa SPSS 18.0. Se utilizó la prueba de χ2 y el test exacto de Fisher para la comparación de proporciones. Las proporciones se expresaron en forma de porcentajes. La incidencia se calculó en función de las urgencias pediátricas atendidas en el hospital, y posteriormente se compararon las tasas de incidencia. Se consideraron significativos valores de p<0,05. Se solicitó el consentimiento informado de todos los pacientes en la fase prospectiva y se garantizó la confidencialidad de los resultados en todo momento.
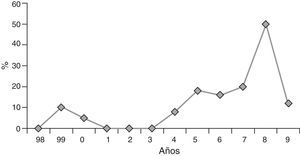
ResultadosEl serotipo 19A fue el más emergente tras la introducción de la VNC7. Así, de los 155 aislamientos de SP de los niños con ENI, el serotipo 19A produjo 21 casos (14% del total), siendo en el último periodo (P3) el serotipo aislado con más frecuencia, causando 16 casos de ENI (23,2%). Se produjo un incremento exponencial significativo de los aislamientos de este serotipo, con 2 casos de un total de 45 en P1 (4,4%), 3 casos de un total de 41 en P2 (7,3%) y 16 casos de un total de 69 en P3 (23,2%) (P1 vs P3, p=0,007). Este aumento se traduce en un incremento significativo de la incidencia fundamentalmente de P2 a P3 de 1,41 a 7,11 casos por 100.000 urgencias pediátricas (urgencias en P2 = 212.685; urgencias en P3 = 224.971) (P2 vs P3; p=0,06), lo que supone un incremento de un 504% (fig. 1).
El serotipo 19A produjo ENI fundamentalmente en niños menores de 2 años (16 casos, 76%), aunque de forma similar al resto de serotipos productores de ENI (62%), asociándose a todas las formas clínicas de presentación como se indica en la tabla 1. Fue, globalmente, el principal productor de meningitis (5/20 casos; 25%), siendo un agente causal de empiema pleural (3/22 casos, 14%). Destaca como un serotipo causante de mastoiditis bacteriémica, con 2 casos (9,5%) de ENI producidos por este serotipo y 50% (2/4) de casos de mastoiditis bacteriémicas totales. Ocho de los 21 síndromes clínicos producidos por el serotipo 19A se consideraron complicados (38%), y 7 niños (33%) precisaron ingreso en la unidad de cuidados intensivos pediátricos (UCIP), fundamentalmente debido a meningitis y empiema pleural.
Características epidemiológicas, clínicas y microbiológicas del serotipo 19A
| Serotipo 19A (n=21) | Resto de serotipos (n=134) | p | |
| Edad<24 meses | 16 (76,1%) | 83 (61,9%) | 0,20 |
| Formas clínicas | |||
| Meningitis | 5 (23,8%) | 15 (11,1%) | 0,10 |
| Respiratorias | 7 (33,3%) | 63 (47%) | 0,24 |
| NB | 4 (19%) | 44 (32,8%) | 0,20 |
| EP | 3 (14,2%) | 19 (14,1%) | 0,98 |
| Bacteriemia | 7 (33,3%) | 46 (34,3%) | 0,92 |
| Mastoiditis bacteriémica | 2 (9,5%) | 2 (1,4%) | 0,03 |
| Otras (artritis, peritonitis) | 0 (0%) | 8 (5,9%) | 0,25 |
| Ingreso | 14 (66,6%) | 109 (81,3%) | 0,12 |
| UCIP | 7 (33,3%) | 32 (23,8%) | 0,35 |
| Complicaciones | 8 (38%) | 37 (27,6%) | 0,32 |
| R penicilina | (61,5%) | 40 (29,8%) | 0,004 |
| CMI ≤ 0,06 | 8 (38%) | 94 (70,1%) | 0,004 |
| CMI 0,12-1 | 11 (52,3%) | 24 (17,9%) | < 0,001 |
| CMI ≥ 2 | 2 (9,5%) | 16 (11,9%) | 0,74 |
| R eritromicina | 16 (76,1%) | 30 (22,3%) | < 0,001 |
| R cefotaxima | 2 (9,5%) | 10 (7,4%) | 0,74 |
| Multirresistencia | 2 (9,5%) | 3 (2,2%) | 0,07 |
CMI: concentración mínima inhibitoria (μ/l); EP: empiema pleural; NB: neumonía bacteriémica; R: resistencia antibiótica.
Respecto a la resistencia antibiótica, 13 aislamientos (61,5%) presentaron una CMI ≥ 0,12μ/l para penicilina, uno de ellos con una CMI ≥ 4μ/l (4,7%). Dos casos (9,5%) presentaron una CMI ≥ 2μ/l para cefotaxima en infecciones extrameníngeas. Asimismo, 16 aislamientos (76%) presentaron una CMI ≥ 0,5μ/l para eritromicina. Se aislaron 2 casos con multirresistencia antibiótica (9,5%). Respecto a la resistencia a cefotaxima en la meningitis, hubo 3 aislamientos (60%) que presentaron una CMI ≥ 1μ/l para cefotaxima, presentando uno de ellos (20%) una CMI ≥ 2μ/l. Estos datos lo convierten en un serotipo con elevadas tasas de resistencia a penicilina (CMI ≥ 0,12μ/l) si lo comparamos con el resto de serotipos productores de ENI analizados (resistencia serotipo 19A= 13/21 casos (61,5%) vs. resistencia resto de serotipos = 40/134 casos (29,8%); p=0,004).
DiscusiónEl serotipo 19A se ha convertido en el principal serotipo emergente productor de ENI en niños en la era de la VNC7, tanto en nuestro estudio, como en diversos estudios nacionales e internacionales. Así, en nuestro trabajo se observó que, tras la comercialización de la VNC7, se produjo un incremento exponencial de este serotipo, fundamentalmente entre P2 y P3 (desde un 7,3 a un 23,2% de los casos), periodo en el que se introdujo la vacuna en el calendario sistemático de vacunación de la CAM. El serotipo 19A produjo un gran espectro clínico de enfermedad en los niños evaluados en este estudio, desde bacteriemia primaria y neumonía bacteriémica no complicada hasta formas clínicas de importante gravedad como empiema pleural y meningitis. Este serotipo fue también el principal causante de mastoiditis aguda, produciendo en ocasiones mastoiditis bacteriémica probablemente debido a su gran invasividad. Además, se encontró una tasa de resistencia a penicilina muy elevada en este serotipo, lo que complica en mayor medida el tratamiento antibiótico de las ENI producidas por él, fundamentalmente las infecciones meníngeas.
Otras series españolas también destacan un importante incremento de este serotipo en los últimos años. Así, en un área de Barcelona detectaron un incremento de la incidencia de ENI producida por el serotipo 19A en pacientes menores de 5 años, desde 4,8 casos por 100.000 de población en época prevacunal (1997-2001) hasta 11,9 casos en época posvacunal (2005-2007), lo que supuso un incremento de la incidencia del 147%5,7, detectándose algunos aislamientos del clon ST320, que asociaba altas tasas de multirresistencia. Otros trabajos de la CAM, como el estudio Heracles, lo han descrito como el más emergente y prevalente en los últimos años, con elevadas tasas de multirresistencia8,9. En Navarra también se ha detectado un incremento en este serotipo10.
Algunos estudios de Estados Unidos demuestran un incremento de un 1,5 a un 35,4% en el aislamiento del serotipo 19A en niños con ENI entre los años 2000 y 200511. Otros trabajos describen un incremento de la incidencia del serotipo 19A de 0,8 a 2,5 por 100.000 entre 1998 y 2005, aunque sin gran repercusión en la tasa de incidencia global de ENI en algunos de ellos3. Muchos de estos trabajos realizados durante la última década enfatizan este incremento progresivo del serotipo 19A de forma significativa, siendo causante de hasta el 46% de los aislamientos producidos por SNV en época posvacunal, convirtiéndole en un verdadero problema de salud4,6,11–18.
La tasa de resistencia a penicilina del 19A en época posvacunal asciende en algunos trabajos hasta el 74%, con una resistencia a macrólidos del 47%, siendo hasta un 30% de los aislamientos multirresistentes13. Además, se observa que en algunas series, más de un tercio de los clones pertenecen a los denominados clones de multirresistencia. Aunque el clon más frecuente en algunos estudios de Estados Unidos es el MLST 199, se han aislado otros clones pertenecientes a un determinado clon del serotipo 19A multirresistente, fundamentalmente el clon MLST 320. Este clon representa un verdadero problema epidemiológico emergente en algunos países como Estados Unidos, ya que supone un incremento de resistencias totales de un 303%, y de multirresistencia de hasta un 160%15.
Existen autores que intentan explicar este predominio del serotipo 19A dentro del incremento de los SNV, argumentando que, dentro de este serotipo existen diversos clones con diferentes tasas de resistencia e invasividad, lo que todavía hace más complejo su estudio3. Postulan que tiene más capacidad que otros SNV para ocupar el nicho ecológico, ya que, aparte de presentar gran capacidad para originar enfermedad invasiva, también la tiene para producir colonización nasofaríngea y otitis media. Indican que la vacunación probablemente no sea el único factor que ha convertido a este serotipo en el más importante dentro de los SNV, ya que era uno de los serotipos más frecuentes dentro de los SNV antes de la comercialización de la VNC7 en Estados Unidos. El hecho de ser uno de los serotipos con mayor grado de resistencia a antibióticos probablemente también le haya permitido predominar sobre otros SNV. Algunos autores atribuyen este grado de resistencia a diversos factores como pueden ser la utilización excesiva de antibióticos de amplio especto o los fenómenos de intercambio de ADN capsular, entre otros3,13. De esta manera, algunos expertos piensan que el aumento del aislamiento del serotipo 19A en niños con ENI y su alto nivel de resistencia antibiótica se debe más a la presión antibiótica que a la propia VNC7, afirmando que la introducción de las vacunas conjugadas ampliadas produciría una menor utilización de antibióticos, lo que supondría una disminución de la incidencia de estos serotipos multirresistentes19. Así, estos mismos autores argumentan que no se puede asegurar categóricamente que el aumento de este serotipo sea debido únicamente a la vacunación con la VNC7 ya que se ha observado también en países donde no se introdujo la vacunación, como en Israel y Corea del Sur. Asimismo, existen otras series, como la publicada en Sudáfrica20, en las que no se observa un incremento del serotipo 19A tras la introducción de la VNC7, existiendo la misma proporción de casos en las épocas pre y posvacunal, lo que determina que puedan existir otros factores más que la propia vacunación relacionados con la expansión de este serotipo.
El serotipo 19A es, por lo tanto, un serotipo que produce una enorme variedad de infecciones invasivas, probablemente por su facilidad de colonización y su invasividad, pudiendo dar lugar a cuadros de importante gravedad como empiema pleural y meningitis. El verdadero problema de este serotipo son sus altos niveles de resistencia y multirresistencia, lo que dificulta, en muchas ocasiones, la actuación terapéutica en estas infecciones. La comercialización de la VNC13, que incluye el serotipo 19A, ha demostrado en ensayos clínicos eficacia para evitar la infección por este patógeno, por lo que probablemente sirva para controlar su expansión y, de este modo, evitar infecciones de gravedad21,22.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al servicio de microbiología, ya que su ayuda y sus datos microbiológicos han sido la base para la realización de este trabajo.