El Programa de cribado o detección precoz del hipotiroidismo congénito es uno de los mayores avances logrados en Pediatría. Las hormonas tiroideas son imprescindibles para el desarrollo y la maduración cerebral, que continúan en la etapa neonatal. Las alteraciones de la función tiroidea en niños prematuros y con bajo peso en los primeros meses de vida origina lesiones irreversibles en el sistema nervioso central y es una de las causas más frecuentes y evitables de retraso mental. El diagnóstico en el periodo neonatal es difícil, por lo que requiere estudio analítico para poder efectuar el tratamiento adecuado.
La relevancia de este problema justifica su difusión a todas las áreas de Pediatría. El objetivo principal, evitar el daño cerebral en estos pacientes. Otros aspectos para optimizar el desarrollo adecuado de estos niños con todos los controles periódicos necesarios y lograr la inclusión del diagnóstico de las alteraciones tiroideas durante la estancia en unidades neonatales y en los primeros meses de vida precisan implementar los recursos de los centros sanitarios y continuar avanzando según los conocimientos actuales.
En el presente documento nos centraremos en el cribado de los recién nacidos pretérmino (< 32 semanas de gestación) o con muy bajo peso para la edad gestacional (1.500-1.000 g muy bajo peso al nacer, o<1.000 g peso extremadamente bajo al nacer) y la protocolización de evaluación de función tiroidea en prematuros.
Actualizamos los procedimientos diagnósticos, las pruebas imprescindibles y complementarias requeridas, la etiología y los diagnósticos diferenciales en esta patología.
The screening program or early detection of congenital hypothyroidism is one of the greatest advances achieved in Pediatrics. Thyroid hormones are essential for brain development and maturation, which continue into the neonatal stage. Alterations in thyroid function in premature and underweight children in the first months of life causes irreversible damage to the central nervous system and is one of the most frequent and avoidable causes of mental retardation. Diagnosis in the neonatal period is difficult, so it requires an analytical study to be able to carry out the appropriate treatment.
The relevance of this problem justifies its communication to all areas of pediatrics. The main objective is to avoid brain damage in these patients. Other aspects to optimize the adequate development of these children with all the necessary periodic controls and to achieve the inclusion of the diagnosis of thyroid alterations during the stay in neonatal units and in the first months of life, need to implement the resources of the health centers and continue advancing according to current knowledge.
In this document, we will focus on the screening of preterm newborns VLBW (<32 weeks of gestation) and/or very low weight for gestational age (1500-1000g VLBW or <1000g) and the function evaluation protocol thyroid in premature babies.
We update the diagnostic procedures, the essential and complementary tests required, the etiology and the differential diagnoses in this pathology.
La incidencia del hipotiroidismo congénito (HC) ha aumentado en el mundo y se sitúa en torno a 1:1.400-1:1.700 recién nacidos (RN) vivos1. Entre las causas de dicho incremento se encuentran la disminución2 en los niveles de corte de tirotropina (TSH) en el cribado neonatal, la mayor supervivencia de prematuros2 y la implementación de estrategias para la detección de HC en los RN pretérmino (RNPT).
El HC es una de las causas prevenibles del retraso mental. El cribado neonatal del HC se desarrolló para evitar dichos efectos en el neurodesarrollo. Existen diversos métodos de cribado; en la mayoría de los programas en España se incluye la TSH en papel de filtro, otros programas determinan la T4 (total) en papel de filtro, y según su valor determinan la TSH, y hay programas que miden ambas de forma simultánea (TSH y T4).
En el presente documento nos centramos en el cribado de los RNPT (≤ 32 semanas de gestación [SG]) o con muy bajo peso para la edad gestacional (EG) (1.500-1.000g muy bajo peso al nacer [MBPN], o<1.000g peso extemadamente bajo al nacer [PEBN]) y en la protocolización de evaluación de su función tiroidea.
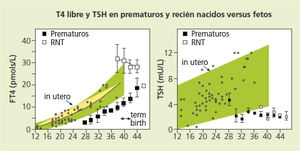
Fisiología del tiroides en el fetoLa glándula tiroidea se desarrolla a lo largo de la vida fetal3,4 (fig. 1).
Las concentraciones séricas de T4 libre (FT4) de los prematuros de 27 a 36 semanas de gestación en los diferentes momentos después del nacimiento no solo son más bajas que las de los recién nacidos a término de igual edad posmenstrual, sino que son claramente inferiores a las concentraciones que hubiesen tenido de seguir desarrollándose in utero. La TSH sérica de los prematuros es igual que la de los recién nacidos a término, pero notablemente inferior a la que hubiesen tenido in utero.
Fuente: datos de Ares et al.27 superpuestos a los datos obtenidos por cordocentesis por Thorpe-Beeston et al.4.
Durante el primer trimestre, la T4 circulante en el feto procede de la madre, ya que el feto no produce una cantidad suficiente de T4 hasta la 2.ª mitad de la gestación. A partir de entonces se produce un aumento de T4 por la producción hepática de tiroxina-binding globulin (TBG) y por la del tiroides fetal estimulado por la TSH. Las concentraciones de T4 van aumentando de 2 μg/dl a las 12 semanas a 10 μg/dl en el RN a término (RNT); la concentración de T4 libre aumenta de 0,1 ng/dl a las 12 semanas a 2 ng/dl a término, y las concentraciones de T3 y FT3 no aumentan en el feto debido a la deiodinación en placenta, excepto al final de la gestación5 (tabla 1).
Desarrollo del tiroides durante la vida fetal
| Desarrollo fetal | Semanas de gestación |
|---|---|
| La glándula tiroides es la primera glándula endocrina en aparecer | 7 |
| Hipotálamo (secreción TRH) | 6-8 |
| Capacidad de concentrar yoduro in vivo (coincidiendo con la aparición de la estructura folicular y los espacios centrales que contienen coloide) | 10-12 |
| Sistema portal hipofisario | 8-12 |
| La hipófisis empieza a desarrollarse (secreción TSH) | 12 |
| Inicio del eje hipotálamo-hipófisis-tiroides | 20 |
| Inicio secreción T4 | Desde 22-24 |
| Inicio secreción T3 | Desde 26-28 |
| Sistemas de las enzimas deiodinasas | Desde 30 |
Asimismo, el yodo que necesita el feto para la síntesis de hormonas procede de la madre y se transfiere por la placenta, siendo dichas necesidades en torno a 250-300 μg/día6.
La glándula tiroidea en niños pretérmino es más pequeña, lo que condiciona una menor síntesis de hormonas tiroideas y unido a la baja capacidad de almacenamiento de yodo, producen una disfunción tiroidea en un tiempo en el que los requerimientos de hormonas cambian rápidamente.
Función tiroidea en el RNTAl nacer, en los primeros 30-60 min tras el parto, por el frío y el pinzamiento del cordón umbilical, se produce un aumento de la TSH fetal hasta alcanzar valores de 60-80 mUI/l, que descienden a una media de 20 mUI/l a las 24 h de vida y a 6-8 mUI/l alrededor de la semana de vida7. Además, se detecta una elevación de T4 (10-22 μg/dl) y FT4 (2-5 ng/dl), respectivamente, a las 24-36 h de vida. La T3 también aumenta por el incremento de la producción y la conversión de T4 a T3 en tejidos.
La T4, la FT4 y la T3 van disminuyendo a lo largo de las 4 primeras semanas de vida, hasta cifras de 7-16 μg/dl de T4, 0,8-2 ng/dl FT4 y TSH entre 0,5-6 mUI/l.
Función tiroidea en el RNPTTras el nacimiento, en el RNPT se produce también un aumento de TSH y de hormonas tiroideas cualitativamente similar pero cuantitativamente menor que en el RNT. Los valores son proporcionales a la EG y al peso5,8,9 (fig. 1).
En el trabajo de Murphy et al.8 se estudian los cambios que se producen en el eje HHT en las primeras 24 h de vida en RNPT entre 24 y 34 SG y los analizan por grupos según SG. Observan que el pico de TSH que se produce al nacer está atenuado en el grupo de 24-27 SG; la T4 en este grupo también declina a lo largo de las primeras 24h, mientras que en el grupo más maduro se incrementa. Igual que sucede en los RNT, los valores de T4 caen en la primera semana de vida, pero este descenso es mayor en los RNPT y MBPN, ya que el aclaramiento de T4 es más rápido. Las causas de la disfunción tiroidea en el RNPT pueden ser múltiples y se detallan en la tabla 2.
Causas de disfunción tiroidea en niños prematuros
| Pérdida de la transferencia de T4 materna a través de la placentaInmadurez del eje HHTReserva limitada de la glándula tiroidea por su pequeño tamañoPersistencia del metabolismo fetal de las hormonas tiroideas¿Predisposición a enfermedades no tiroideas?: medicamentos y eventos adversos perinatales. Propuesta: alteración debida a medicamentos y enfermedades graves perinatales¿Falta, deficiencia o exceso de yodo? |
Los valores de normalidad en RNPT en relación con la EG y la edad posnatal son un tema no resuelto todavía10, lo que puede provocar sobre o infradiagnósticos de hipotiroidismo en estos niños.
Carrascosa et al.11 analizan la FT en 75 RNPT sanos de 30-35 SG durante el primer año de vida y los comparan con niños sanos nacidos a término, de la misma edad posnatal. El valor medio de TSH a las 24 h de vida en el RNPT fue significativamente menor. La T4 y T3 fueron significativamente menores en RNPT a la hora y a las 24 h, y la rT3 a las 24 h fue significativamente más alta en RNPT. A partir de la primera semana de vida, todos los valores de FT estuvieron en el mismo rango en ambos grupos.
La función tiroidea puede afectarse en RNPT con enfermedad de la membrana hialina o distrés respiratorio y se asocian con el síndrome eutiroideo enfermo12. El aumento en TSH, T4 y T3 no se produce tras el nacimiento y puede no aumentar hasta que se haya recuperado el niño, elevándose entonces poco a poco. Asimismo, en estos RNPT se detecta correlación inversa entre los niveles de FT4 y la gravedad de la enfermedad.
Los niños nacidos pretérmino PEG tienen también unas características específicas en su función tiroidea. Presentan niveles más elevados de TSH al nacer, pero dentro del rango de normalidad, y mayores requerimientos de hormonas tiroideas a largo plazo, asemejándose a los niños prematuros, por lo que deberían ser monitorizados regularmente13.
En definitiva, la maduración del eje HHT en los RNPT y de bajo peso con el incremento de TSH ocurre entre la 2.a y la 6.a semana de vida. A pesar de estas diferencias demostradas y los factores que modifican la función tiroidea de los RNPT, los valores de referencia para el punto de corte (cutoff) del diagnóstico de HC son los mismos que en los RNT, por lo que la probabilidad de falsos negativos en el cribado, como hemos comentado, se incrementa.
Problemas específicos en el niño prematuro de muy bajo o extremadamente bajo pesoEn estos pacientes podemos encontrar con frecuencia alteraciones tiroideas, como la elevación tardía de la TSH, la elevación transitoria de la TSH o la hipotiroxinema. Estas alteraciones pueden ser transitorias o permanentes.
En los últimos años se ha descrito un aumento de la incidencia de HC1 en RNPT, que podría ser incluso superior a los RNT, llegando a 1/400 RNPT. Es difícil afirmar si este aumento es real o se debe a una mayor detección de casos de formas moderadas o transitorias.
Elevación tardía de la TSHLos pacientes prematuros (RNPT) pueden presentar una elevación tardía de la TSH y escapar al cribado neonatal. Se conoce que hasta un 5-10% de los RN con bajo peso (MBPN) o muy bajo peso (PEBN) con HC podrían tener un cribado inicial normal14.
Sobre la elevación tardía de la TSH en los prematuros existe desconocimiento y se debate sobre si se trata de una forma transitoria por inmadurez del eje o bien son formas moderadas de HC permanentes.
Al respecto, existen recomendaciones internacionales para la detección de HC entre las que destacan:
- –
El documento conjunto de American Academy of Pediatrics/American Thyroid Association/ Lawson Wilkins Pediatric Endocrine Society en 200615 reconoce una mayor incidencia de elevación tardía de la TSH en los prematuros pero también se recogen las dificultades de implementar un programa de cribado universal con realización sistemática de una segunda muestra, así como la necesidad de estudios a largo plazo que describan los resultados de la implementación de estas medidas. Una estrategia alternativa podría ser restringir esta evaluación a pacientes de muy alto riesgo como MBPN (incidencia HC 1:250 casos), PEBN (incidencia HC 1:1589) o neonatos ingresados en cuidados intensivos neonatales o con enfermedad cardiovascular, realizando controles a las 2 y 6 semanas. En dicha guía se propone, en caso de hipertirotropinemia persistente a las 6 semanas, la valorar el inicio del tratamiento y revaluar a los 3 años.
- –
El Consenso de la European Society of Paediatric Endocrinology en 201416 realiza la recomendación de realizar un recribado en pacientes de riesgo:<37 SG; neonatos MBPN y PEBN; RN enfermos o prematuros ingresados en la Unidad de Cuidados Intensivos neonatal; muestras recogidas en las primeras 24 h de vida y partos gemelares, especialmente en los del mismo sexo. Se aconseja recoger una segunda muestra a las 2 semanas de vida o tras 2 semanas del cribado. Sin embargo, se reconoce que esta política no está implementada en todas las unidades neonatales, aunque sí subraya la dificultad de realizar una recomendación de un recribado en sangre venosa versus en papel de filtro.
Se han publicado datos tras la implementación de programas específicos de revaluación de función tiroidea en RNPT17. Describen que la incidencia de HC en prematuros es mayor que en los RNT, siendo 1/579 en RNPT 32-36 SG, 1/1.488 en RNT ≥ 37 SG. En RN ≤ 32 SG la incidencia aumenta: el 1,56% en los que tienen BPN, el 1,9% en MBPN y el 3,7% en PEBN.
El grupo de McGrath et al.18 recogen muestras de sangre total semanalmente hasta las 37 semanas de edad corregida o alta hospitalaria. Los autores destacan que 27 (50,9%) pacientes de los RNPT<33 SG diagnosticados de HC tienen una elevación tardía de la TSH detectada entre los 8-48 días de vida (media de 13 días), que no se hubiera detectado en el primer cribado. De estos, 12 pacientes (40,7%) presentan hipotiroidismo descompensado (FT4<10pmol/l) y 4 pacientes un hipotiroidismo grave (FT4 < 5,5pmol/l). Este trabajo describe también la revaluación, encontrando 6 casos (22%) de HTC permanente y 8 (29%) transitorios. En 13 RN (48%) su elevación fue posterior a los 15 días y 7/13 tenían FT4<10pmol/l. Así mismo, el 25% de los RN con hipertirotropinemia tardía presentaban como antecedente exposición a yodo, por lo recomiendan que su cribado se prolongase hasta el mes de vida.
Kaluarachchi et al.19 realizan un programa de cribado en sangre de talón a las 2, 4 semanas y al alta, con reconfirmación venosa. Diagnostican a 49 pacientes prematuros con HC y el 92% de ellos tenían elevación tardía de la TSH. La muestra a las 2 semanas identifica el mayor número de pacientes (n = 18), destacando que 15 casos presentan TSH>100 mU/l y que un paciente con elevación precoz y 19 con elevación tardía de TSH tienen T4 libre<0,8 ng/dl, por lo que justifican el seguimiento con múltiples controles.
En resumen, dada la alta incidencia de alteraciones en estos pacientes y la posible repercusión en su evolución, parece razonable recomendar realizar una revaluación de la función tiroidea y hacer seguimiento, dado que actualmente se desconoce la repercusión a largo plazo de la detección o tratamiento en estos casos.
Elevación transitoria de TSHLa hipertirotropinemia transitoria puede deberse a diferentes factores: enfermedad tiroidea materna (fármacos antitiroideos en madre, traspaso de anticuerpos-TRAB maternos), mutaciones (mutación heterocigota en DUOX-2, o en el receptor TSH-R), exposición prenatal/posnatal a un exceso de yodo (povidona yodada, contrastes yodados), zonas con déficit de yodo o relacionados con la situación de gravedad o utilización de fármacos descritos en la tabla 3.
Medicamentos que influyen en la función tiroidea
| Disminuyen o aumentan la secreción de hormona tiroidea | DopaminaGlucocorticoidesOctreótido |
| Disminuyen la secreción de TSH | YodoAmiodarona |
| Aumentan la concentración de TBG | Estrógenos |
| Disminuyen la concentración de TBG | Glucocorticoides |
| Desplazan del sitio de unión a proteínas | FurosemidaSalicilato |
| Aumentan el metabolismo hepático | FenobarbitalFenitoínaCarbamazepina |
| Disminuyen la T4 5’-deiodinasa | PropiltiouraciloAmiodaronaAntagonista β-adrenérgicoGlucocorticoides |
TBG: globulina fijadora de tiroxina; TSH: tirotropina.
En los últimos años, la mejora en los tratamientos y el manejo de la enfermedad perinatal (esteroides prenatales, ventilación no invasiva, menor uso de medicamentos, etc.) ha disminuido la incidencia de la hipotiroxinemia del prematuro e hipertirotropinemia tardía en los prematuros extremos20.
La elevación persistente, pasadas las 2primeras semanas de vida, de TSH>10 mU/l o T4 libre<0,8 ng/dl es un criterio para su tratamiento, reconocido en la mayoría de los consensos. Los valores intermedios de TSH entre 6-10 mU/l son más controvertidos y dependen de diversos factores; por tanto, el tratamiento será consensuado entre el médico y los padres. En el RN la persistencia de TSH>10 mU/l tras el mes de vida, según el consenso publicado por la European Thyroid Association20, sería subsidiario de tratamiento hasta los 3 años, con revaluación posterior. Se recomienda realizar pruebas de imagen (ecografía o gammagrafía 131I o 99Tc), para definir si existe una anomalía estructural que apoyaría el diagnóstico de HC permanente. La identificación de alteraciones genéticas asociadas a esta hipertirotropinemia también ayuda a tomar la decisión de tratamiento y a prever la historia natural de la enfermedad.
Hipotiroxinemia del prematuroLos RN prematuros presentan con mayor frecuencia hipotiroxinemia (niveles de T4/FT 4 bajas, TSH normal); durante las primeras semanas de vida se observa hasta en el 50% de<28 SG y es más marcada cuanto más inmaduro o grave esté el niño (tabla 4)21.
Patología neonatal asociada a alteraciones de las concentraciones de tiroxina
| Síndrome de distrés respiratorio agudoDisplasia broncopulmonarSepsis precoz y tardíaSíndrome de aspiración meconialNeumotóraxAsfixiaHipertensión pulmonar persistenteEnterocolitis necrosanteDuctus arterioso persistente |
La mayoría de los casos son transitorios, pero en la fase inicial puede ser difícil para el clínico distinguir si se trata de una forma de hipotiroidismo secundario o terciario (hipotálamo-hipofisario) o un déficit de TBG. Así mismo, no existe evidencia científica suficiente que confirme que el tratamiento con L-tiroxina de la hipotiroxinemia del prematuro mejore el desarrollo cognitivo a largo plazo. Los estudios aleatorizados son escasos, con población pequeña (entre 10-100 prematuros), con variabilidad en la muestra y en los protocolos utilizados (dosis de L-tiroxina 4-20 μg/kg/día, duración 2-6 semanas), lo que dificulta su interpretación22. En un trabajo reciente23 se analizaron 20 artículos sobre el impacto de la hipotiroxinemia en el neurodesarrollo y 7 ensayos aleatorizados sobre tratamiento sustitutivo con L-tiroxina entre 1981 y 2016. Algunos datos sugieren que la sustitución podría ayudar a los prematuros extremos. Otros trabajos han encontrado relación entre los niveles de T4/T3 y la evolución clínica (mortalidad, complicaciones cardiovasculares, etc.), aunque la relación causal es difícil de demostrar24,25.
El tratamiento con tiroxina sigue siendo controvertido26-30 y los estudios actuales no permiten recomendar el tratamiento de forma sistemática en los prematuros con hipotiroxinemia transitoria. Se necesitan más datos para identificar cuando el tratamiento puede ser beneficioso30, el momento óptimo para comenzarlo y la duración, basado en el óptimo umbral de las hormonas tiroideas circulantes.
La recomendación sería iniciar tratamiento ante hipotiroxinemia que se asocie a elevación de TSH>10 mU/l o bien sea persistente (T4 libre<0,8 ng/dl en 2determinaciones separadas 1-2 semanas) e individualizar en los pacientes de más riesgo como los prematuros<28 semanas o<1.000g, sobre todo en aquellos con enfermedad grave (tabla 5).
Recomendación sobre el tratamiento de la hipotiroxinemia en RNPT
| Los estudios actuales no permiten recomendar el tratamiento de forma sistemática en los prematuros con hipotiroxinemia transitoriaLa recomendación sería iniciar tratamiento en los casos en que la hipotiroxinemia se asocie a elevación de la TSH e individualizar con los factores asociados como enfermedad grave |
Hemos de distinguir la hipotiroxinemia transitoria de los casos que sugieran alteración hipotálamo-hipofisaria. Pensaremos en un HC central cuando nos encontremos una FT4 baja persistentemente y una TSH baja o inadecuadamente normal. La forma más frecuente suele estar asociada a otros déficits hipofisarios (panhipopituitarismo congénito), en los que pueden observarse hipoglucemias neonatales prolongadas, micropene o criptorquidia bilateral, e ictericia prolongada, además de presentar alteraciones en la morfología de la hipófisis (neurohipófisis ectópica/ ausencia o hipoplasia de adenohipófisis/alteraciones del tallo hipofisario/anomalías de línea media, como displasia septo-óptica). También podríamos estar ante el diagnóstico de hipotiroidismo central aislado, cuya incidencia es baja, 1/30.000 RN, y no cubierto en el cribado neonatal realizado con TSH.
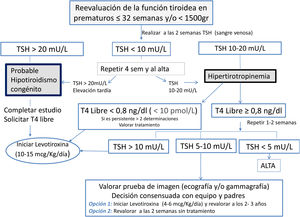
Protocolización de evaluación de función tiroidea en RNPTUna vez analizadas las peculiaridades de la función tiroidea en los niños pretérmino, se intuye la necesidad de realizar el cribado del hipotiroidismo de una manera diferente de la que se hace en el RNT (fig. 2).
Por ello, el protocolo que sugerimos para la detección de disfunción tiroidea en pacientes RNPT ≤ 32 semanas o<1.500g sería31-33:
- 1.
Se recomienda realizar determinación de hormonas tiroideas en sangre venosa (TSH/T4 libre) a las 2 semanas, 4 semanas, al alcanzar 1.500g o al alta, o en su defecto en las comunidades que lo contemplen en su programa de cribado pueden plantearse realizarlo por prueba de talón (TSH) (tabla 6).
Tabla 6.Recomendación sobre la revaluación de la función tiroidea en prematuros ≤ 32 SG o < 1.500g
Recomendamos la evaluación en todos los recién nacidos ≤ 32 SG o < 1.500gSe propone hacerlo a las 2 semanas de vida, o 2 semanas del primer cribado, repetir a las 4 y 10 semanas, y posteriormente al alta, o cuando alcancen 1.500g32,33Además, en ≥ 1.500g se aconseja repetirla si permanecen críticamente enfermosSe realizará idealmente con TSH y T4 libre en sangre venosa, o TSH en papel de filtro en aquellos centros que pudieran realizarloLa decisión de seguimiento o tratamiento se hará según el algoritmo propuesto (fig. 2) Se deben evaluar los factores de riesgo, por lo que resulta importante conocer el uso de medicación que pueda interferir con la función tiroidea, la utilización de povidona yodada o contrastes yodados.
- 2.
Los pacientes con alteraciones a las 2 semanas:
- –
Requieren tratamientos si: TSH venosa>20 mU/l, se completa estudio con valor de T4 libre, pero de forma independiente, el paciente debe iniciar tratamiento, y se recomienda realizar pruebas de imagen con gamagrafía (con o sin test de perclorato) o ecografía tiroidea o bien ambas.
- –
Requieren revaluación si la TSH venosa está entre 10-20 mU/l; dado que algunas formas son transitorias, se aconseja repetición del control en 1-2 semanas y, ante la persistencia, valorar tratamiento.
- –
Ante la persistencia de alteraciones tiroideas, TSH 5-10 mU/l a las 3- 4 semanas de vida o antes del alta, se recomienda ampliar estudios (pruebas de imagen, tiroglobulina) y valorar la realización de tratamiento con levotiroxina, con revaluación a los 2-3 años de vida, o bien antes en casos que la dosis requeridas de levotiroxina sean tan bajas como<3 μg/kg/día, teniendo en cuenta que muchas de estas formas van a ser alteraciones transitorias34 (tabla 7).
Tabla 7.Recomendación sobre hipertirotropinemia (elevación de TSH con T4 libre normal)
Elevación de TSH a las 2 semanas de vida, deber repetirse otro control entre 2-4 semanas y ante la persistencia de TSH > 10 mU/l se recomienda realizar tratamiento (fig. 2); con valores entre 5-10 mU/l se recomienda realizar nuevo controlHipertirotropinemia (TSH >10 mU/l) + hipotiroxinemia (T4 libre < 0,8 ng/dl/< 10pmol/l) se recomienda siempre iniciar tratamiento y realizar revaluaciónSi persiste elevación de TSH > 10 mU/l, pasado el mes de vida se recomienda plantear tratamiento con levotiroxina y realizar una revaluación a los 2-3 años de vida21. En algunos casos, en RNPT, si se confirma la presencia de tiroides in situ (tiroides eutópico), y se ha precisado durante su seguimiento dosis bajas de levotiroxina (< 3 μg/kg/día) se puede plantear la revaluación antes de ese tiempo, dado que entre el 38 y el 55% pueden normalizar la función tiroidea24
- 1.
Los RNPT ≤ 32 semanas o muy bajo peso<1.500g son un grupo de pacientes de riesgo de presentar disfunción tiroidea. Las concentraciones normales de TSH en la prueba de cribado durante los primeros días de vida en prematuros no descartan la presencia de HC.
- 2.
Dado el riesgo de falsos negativos en el cribado de HC y la probabilidad de disfunción tiroidea, sugerimos repetir la determinación analítica a las 2 semanas de vida, 4 semanas, cuando alcance los 1.500 g o al alta32,33.
- 3.
Las concentraciones de T4 total y libre deberían volver a los niveles normales después de 2-8 semanas en niños de bajo peso (28-32 SG o 1.000-1.500g) y 4-12 semanas en niños con extremado bajo peso (< 28 semanas o<1.000g).
- 4.
Los estudios actuales no permiten recomendar el tratamiento de forma sistemática en los prematuros con hipotiroxinemia transitoria. La recomendación sería iniciar tratamiento en los casos que la hipotiroxinemia se asocie a elevación de la TSH>10 UI/l o sea persistente, e individualizar en aquellos prematuros de mayor riesgo con enfermedad grave.
- 5.
Un nivel de TSH ≥ 20 mU/l junto con cualquier nivel de T4 libre se considera HC y precisa tratamiento a dosis de 10-15 μg/kg/día.
- 6.
Valores de TSH entre 10-20 mU/l con FT4 normal precisan revaloración, ampliar estudio por endocrinólogo (con pruebas de imagen) y valorar tratamiento ante su persistencia.
Los autores declaran no tener ningún conflicto de intereses.