Las agencias reguladoras son responsables de enmarcar la prescripción de fármacos en condiciones off-label (OL) y unlicensed (UL) en los cuidados intensivos neonatales. No obstante, los criterios de aprobación establecidos pueden variar entre las agencias de distintos países. El objetivo del estudio fue determinar la frecuencia de la prescripción de fármacos OL y UL en una muestra de pacientes en cuidados intensivos neonatales según los criterios establecidos por la Food and Drug Administration (FDA) de Estados Unidos y la Agência Nacional de Vigilância Sanitária (ANVISA) de Brasil, analizando las diferencias en los resultados obtenidos con los criterios de cada agencia.
MétodosEstudio prospectivo de cohortes en neonatos ingresados más de 24horas en la unidad de cuidados intensivos neonatales (UCIN) de un hospital universitario materno infantil entre agosto de 2017 y julio de 2018. Se obtuvo información sobre los fármacos incluidos en el análisis de prescripción OL y UL de las bases de datos DrugDex-Micromedex® y de la información oficial sobre fármacos de Brasil. La concordancia entre los criterios de la FDA y de la ANVISA se evaluó por medio del índice kappa. Los valores de kappa <0,200 se consideraron indicativos de discordancia.
ResultadosSe evaluó a 220 neonatos ingresados en la UCIN y 17.421 prescripciones de fármacos individuales en el período de estudio. No hubo diferencias en la proporción de pacientes que recibieron al menos una prescripción OL según se aplicasen los criterios de la FDA o los de la ANVISA (96,4% vs. 98,6%). En cambio, se encontraron diferencias en el motivo de clasificación como OL en base a la edad o a la indicación entre las dos agencias reguladoras, principalmente en la prescripción de antiinfecciosos sistémicos y agentes cardiovasculares. Al comparar las condiciones de prescripción aprobadas por la FDA y la ANVISA, se observó que los criterios de la ANVISA eran menos específicos.
ConclusionesLa prescripción de fármacos OL y UL es frecuente en los cuidados intensivos neonatales aplicando los criterios de cualquiera de las dos agencias, aunque los criterios de la FDA son más específicos en cuanto a los grupos de edad y las indicaciones para los que se autoriza el uso de los fármacos.
Regulatory agencies are responsible for defining the use of off-label (OL) and unlicensed (UL) drug prescription in neonatal intensive care. However, these regulatory criteria may differ between agencies in different countries. The aim of this study was to establish the frequency of OL and UL drug prescription in a sample of patients in a neonatal intensive care unit applying the criteria of the Food and Drug Administration (FDA) of the United States and the Agência Nacional de Vigilância Sanitária (ANVISA) of Brazil, analysing the differences observed in the results based on the applied criteria.
MethodsProspective cohort study in neonates admitted for more than 24hours to the neonatal intensive care unit (NICU) of a teaching maternity hospital between August 2017 and July 2018. We obtained information concerning the drugs included in the analysis of OL and UL prescriptions from the DrugDex-Micromedex® and official information on pharmaceutical products in Brazil. We used the kappa correlation coefficient to assess the agreement between the FDA and ANVISA criteria. We defined disagreement as a kappa value of less than 0.200.
ResultsWe evaluated 220 neonates admitted to the NICU and 17,421 items prescribed during the study period. We did not find a difference in the proportion of neonates in which at least 1 drug was prescribed under OL conditions applying the FDA versus the ANVISA criteria (96.4% vs. 98.6%). We found differences between the FDA and ANVISA in the OL classification based on the authorised age of use and indications for prescription, mainly in systemic antimicrobials and cardiovascular drugs. When we compared the prescribing information provided by the FDA and the ANVISA, we found that the criteria of the ANVISA were less specific.
ConclusionsOL and UL drug prescription are frequent in neonatal intensive care applying the criteria of either agency, although the FDA has established more detailed criteria in terms of the ages and indications for which prescription is authorised.
El uso de fármacos es esencial en las unidades de cuidados intensivos neonatales (UCIN) para el manejo de neonatos, especialmente de los prematuros1–4. La administración de múltiples fármacos es común en los cuidados intensivos neonatales a pesar del riesgo de eventos adversos en neonatos1,4,5. Además de la polifarmacia, otra característica de la farmacoterapia en neonatos es la carencia de ensayos clínicos y formas farmacéuticas específicos para esta población3,5. Por lo tanto, existen varias deficiencias en la seguridad y eficacia de la farmacoterapia en neonatos, y las opciones de tratamiento disponibles son relativamente escasas.
Como resultado, medicamentos aprobados para niños mayores y adultos se usan comúnmente en neonatos, y se modifican formas farmacéuticas existentes para tratar situaciones específicas5,6. En este contexto, se define el uso off-label (OL) como cualquier uso de un fármaco comercializado no detallado en su ficha técnica, incluyendo la indicación, dosis, frecuencia o vía de administración aprobadas por las agencias reguladoras; y el uso unlicensed (UL) como la utilización de un medicamento no comercializado, importado, contraindicado en neonatos o que requiere modificación de la forma farmacéutica previa a su uso7,8.
Las agencias reguladoras, como la Agência Nacional de Vigilância Sanitária en Brasil (ANVISA) y la Food and Drug Administration (FDA) en Estados Unidos, son responsables de enmarcar el uso OL y UL de medicamentos en neonatos9,10. No obstante, puede haber variaciones en los criterios establecidos por las agencias de distintos países, dando lugar a prevalencias de prescripción OL y UL que oscilan entre el 5 y el 90%11–15. Criterios excesivamente rígidos pueden restringir el acceso a medicamentos, pero por otro lado, el uso excesivo de medicamentos OL o UL se asocia a un aumento en la incidencia de eventos adversos y errores de medicación1,4,5.
La FDA destaca entre las agencias reguladoras internacionales como referente global por el rigor de sus procesos de aprobación de fármacos y vigilancia poscomercialización9,10,16. En Brasil se han realizado pocos estudios observacionales y longitudinales para evaluar el perfil de utilización OL y UL de medicamentos en los cuidados intensivos neonatales17–20. A nuestro conocer, ningún estudio hasta la fecha ha comparado el uso OL y UL en neonatos en base a los criterios de la ANVISA y la FDA. Dicha comparación es relevante dadas las diferencias entre agencias y el impacto de los distintos criterios en el tratamiento farmacológico en neonatos.
El objetivo principal del estudio fue determinar la frecuencia de la prescripción OL y UL en una muestra de pacientes de la UCIN aplicando los criterios de la FDA y los criterios de la ANVISA y comparando los resultados obtenidos en base a los criterios empleados. El objetivo secundario fue identificar el grupo de la Clasificación Anatómico-Terapéutico-Química (ATC por sus siglas en inglés) correspondiente a la mayor frecuencia de prescripción OL de medicamentos.
MétodosDiseño del estudioEl estudio fue aprobado por el Comité de Revisión Institucional con el número de registro 580.201/2014, y se obtuvo el consentimiento informado firmado de los tutores legales de los neonatos incluidos en la muestra autorizando su participación en el estudio. Se realizó un estudio de cohortes prospectivo durante un período de un año (agosto 2017-julio 2018) en la UCIN de un hospital universitario materno infantil que es el centro de referencia regional para los embarazos de alto riesgo, la salud de la mujer, la cirugía ginecológica y las malformaciones cardíacas pediátricas. Se consideró a todos los neonatos ingresados en la UCIN durante el período de estudio para su posible inclusión. Los criterios de inclusión fueron: estancia en la UCIN de más de 24horas, prescripción de al menos un medicamento durante la estancia en la UCIN, y obtención del consentimiento informado firmado de los padres. Se excluyó a neonatos mayores de 28 días, neonatos readmitidos durante el período de estudio y neonatos en los que solo se prescribió nutrición parenteral, fluidoterapia intravenosa por perfusión continua, oxigenoterapia, hemoderivados o electrólitos.
Recogida de datosPara cada paciente se recogieron datos sobre el sexo, edad gestacional (EG), peso al nacer, diagnóstico al ingreso, duración de la estancia y medicamentos administrados en la UCIN (nombre genérico, indicación, dosis, frecuencia y vía de administración).
Los medicamentos prescritos se clasificaron de acuerdo con el sistema ATC y la condición de la prescripción como aprobada, OL o UL según los criterios de autorización establecidos por la FDA y la ANVISA. Para los criterios de la FDA se consultó la base de datos DrugDex-Micromedex®14. Para los de la ANVISA, se consultó la ficha técnica provista por el fabricante, del que se recogió el nombre, así como el sitio web de la ANVISA21. Se consideró que el uso era UL en caso de (1) contraindicación del medicamento en neonatos, (2) fórmula magistral o modificación de la forma farmacéutica por personal de enfermería antes de su administración, o (3) medicamento importado. Se consideró que el uso era OL en caso de haber diferencias entre las condiciones de prescripción y las condiciones autorizadas en la ficha técnica en cuanto a la edad, indicación, dosis, frecuencia o vía de administración.
Análisis estadísticoEn base al promedio de ingresos en la UCIN, se estimó que durante el período de estudio ingresarían 220 neonatos, lo que correspondería a aproximadamente 12.000 prescripciones individuales de fármacos. Se calculó que este tamaño muestral permitiría estimar la proporción real de prescripciones UL con una precisión del 0,9% y la de prescripciones OL con una precisión del 0,8% con un nivel de confianza del 95%. En base a los resultados de un estudio piloto anterior, se esperaba que en una muestra de prescripciones de 12.000 fármacos individuales, 6.600 (55%) serían UL y 3.840 (32%) OL. Así, el error máximo de las estimaciones obtenidas sería inferior al 1,2% en el caso de los medicamentos UL e inferior al 1,6% en el caso de los medicamentos OL con un nivel de confianza del 95%. Estos niveles de precisión se consideraron adecuados para los propósitos del estudio.
Los datos demográficos y clínicos se expresan como frecuencias absolutas y porcentajes o como media±desviación estándar. Se calcularon intervalos de confianza del 95% por distribución binomial para las proporciones de fármacos OL y UL obtenidas al aplicar los criterios de la FDA y de la ANVISA, la proporción de pacientes expuestos a estos fármacos y el número de fármacos prescrito por paciente. El análisis estadístico se realizó con el software Stata versión 11 (Stata Corporation, College Station, EE.UU.). Se utilizó la prueba chi cuadrado para comparar las variables cualitativas según los criterios de la FDA y de la ANVISA. El nivel de significación estadística se estableció en p<0,05.
La concordancia entre los criterios de la FDA y la ANVISA (edad, indicación, dosis, frecuencia y vía de administración) para la identificación de prescripciones OL y UL se evaluó mediante el índice kappa. Los valores de kappa <0,200 se consideraron indicativos de discordancia. Se documentaron las frecuencias absolutas y relativas de cada fármaco prescrito en el que la clasificación como OL o UL varió dependiendo de los criterios aplicados (FDA o ANVISA).
ResultadosSe analizaron 3.965 prescripciones correspondientes a un total de 17.421 fármacos en 220 neonatos durante el año bajo estudio. Hubo una predominancia de neonatos varones y de prematuros con una EG media de 32,4±4,4 semanas (rango: 23,4-42,4 semanas). El motivo más frecuente de ingreso en la UCIN fueron los problemas respiratorios, seguidos de la prematuridad, y la estancia media en la unidad fue de 18,3±19,4 días (mediana, 12 días; rango: 1-106 días). Los grupos de fármacos prescritos con mayor frecuencia fueron los antiinfecciosos para uso sistémico y los fármacos que actúan sobre el tracto alimentario y el metabolismo, seguidos de los fármacos que actúan sobre los sistemas nervioso, cardiovascular y respiratorio (1.369; 7,9%). La tabla 1 resume las características de los pacientes incluidos en el estudio.
Resumen de las características de los pacientes y las prescripciones
| Variable | Valor | |
|---|---|---|
| Sexo masculino (n, %) | 118 | 53,7% |
| Semanas de edad gestacional (media±DE) | 32,4±4,4 | |
| Peso al nacer en g (media±DE) | 1.932,7±1.127,6 | |
| Días de estancia en la UCIN (media±DE) | 18,3±19,4 | |
| Motivo de ingreso en la UCIN (n, %) | ||
| Problemas respiratorios | 127 | 57,7% |
| Prematuridad | 31 | 14,1% |
| Problemas neurológicos | 16 | 7,3% |
| Patología infecciosa | 14 | 6,4% |
| Otros | 32 | 14,6% |
| Total | 220 | 100,0% |
| Mortalidad (n, %) | 15 | 6,8% |
| Fármacos (media±DE) | 8,2±6,2 | |
| Prescripciones (media±DE) | 17,9±19,2 | |
| Prescripciones por clase de la ATC (n, %) | ||
| Antiinfecciosos para uso sistémico | 4.868 | 27,9% |
| Tracto alimentario y metabolismo | 4.245 | 24,4% |
| Sistema nervioso | 3.536 | 20,3% |
| Sistema cardiovascular | 2.324 | 13,3% |
| Sistema respiratorio | 1.369 | 7,9% |
| Otros | 1.079 | 6,2% |
| Total | 17.421 | 100,0% |
ANVISA: Agência Nacional de Vigilância Sanitária (Brasil); ATC: Clasificación Anatómico-Terapéutico-Química; DE: desviación estándar; FDA: Food and Drug Administration (Estados Unidos).
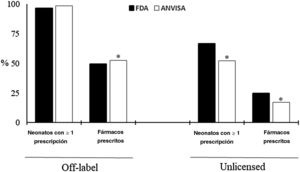
En la muestra total de 220 neonatos, la proporción de pacientes que recibieron al menos un medicamento OL no varió según se aplicaran los criterios de la FDA o de la ANVISA (96,4% vs. 98,6%; p=0,13) Sin embargo, al considerarse la muestra total de fármacos individuales prescritos (17.421), se observó una proporción menor de medicamentos OL al aplicar los criterios de la FDA (49,3% vs. 52,6%; p<0,01) (fig. 1). En cuanto a la prescripción UL, la aplicación de los criterios de la FDA resultó en una proporción mayor de neonatos tratados con al menos un medicamento clasificado como UL (66,8% vs. 52,3%; p<0,01) y una proporción mayor de medicamentos UL sobre el total de medicamentos prescritos (24,6% vs. 17,2%; p<0,01).
En el análisis de la prescripción OL, al comparar los detalles de la autorización por la FDA y por la ANVISA para cada fármaco, se encontraron diferencias principalmente con respecto a la edad y las indicaciones para las que se había aprobado el medicamento (fig. 2). Se encontraron diferencias entre estas agencias en el grupo de edad en el que se autorizaba el uso en medicamentos de los grupos J (antiinfecciosos para uso sistémico; k=0,003), C (sistema cardiovascular; k=0,000) y R (sistema respiratorio; k=0,067). No obstante, las mayores discrepancias entre la FDA y la ANVISA correspondieron a las indicaciones aprobadas para los grupos C (sistema cardiovascular; k=0,004), N (sistema nervioso; k=0,000) y A (tracto alimentario y metabolismo).
Análisis de la correlación entre los criterios de la Food and Drug Administration (FDA) y de la Agência Nacional de Vigilância Sanitária (ANVISA) para la clasificación de la prescripción como off-label (OL) y unlicensed (UL) en cuidados intensivos neonatales. Se analizó la clasificación OL en términos de los grupos de edad, indicaciones, dosis, frecuencia y vía de administración aprobados. Los valores de kappa <0,200 se consideraron indicativos de discordancia entre los criterios de aprobación en Estados Unidos y en Brasil.
Los fármacos en los que se detectó el mayor número de diferencias respecto a la clasificación OL según los criterios aplicados fueron la anfotericina B, la milrinona, el paracetamol, la beclometasona, la penicilina G, la dobutamina, la furosemida y la cefazolina (tabla 2). El motivo más frecuente de clasificación como UL fue la contraindicación.
Fármacos en los que la categorización de la condición de prescripción fue diferente según se aplicaran los criterios de la FDA o de la ANVISA
| Fármaco | Discordancia en la categoría de prescripción | Motivo | Descripción | |
|---|---|---|---|---|
| n | % | |||
| Anfotericina B | 128 | 100% | Edad | Uso pediátrico no aprobado por la FDA y aprobado por la ANVISA |
| Milrinona | 45 | 100% | Edad | Uso pediátrico no aprobado por la FDA y aprobado por la ANVISA |
| Paracetamol | 118 | 100% | Edad y vía de administración | La FDA solo autoriza la vía parenteral en neonatos. La ANVISA aprueba las vías oral y parenteral en niños <12 años |
| Beclometasona | 115 | 91,3% | Edad e indicación | La FDA no aprueba su uso en neonatos, mientras que la ANVISA aprueba el uso pediátrico. La FDA no aprueba su indicación para la displasia broncopulmonar. La ANVISA aprueba su indicación para «procesos inflamatorios de la vía aérea» |
| Penicilina G | 91 | 40,4% | IndicaciónFrecuencia | Uso en neonatos aprobado por ambas agencias. La FDA no aprueba su uso para la sepsis neonatal, y la ANVISA sí. La FDA especifica la dosis en neonatos, mientras que la ANVISA no especifica la frecuencia de dosificación |
| Dobutamina | 120 | 27,6% | Indicación | La FDA no aprueba su indicación para el fallo cardíaco en neonatos. La ANVISA aprueba su uso en niños<12 años |
| Furosemida | 166 | 21,9% | Indicación | La FDA no aprueba la indicación de edema en neonatos, y la ANVISA sí |
| Cefazolina | 35 | 9,3% | Edad | Aprobada por la FDA en niños >1mes. La ANVISA aprueba el uso en neonatos |
No se incluyen datos de fármacos con menos de 15 casos de divergencia en la categorización como off-label (epinefrina=10, gentamicina=12) o unlicensed (ambroxol=7, norepinefrina=1, furosemida=12).
ANVISA: Agência Nacional de Vigilância Sanitária (Brasil); FDA: Food and Drug Administration (Estados Unidos).
La ANVISA resultó ser más flexible en los términos de aprobación para uso pediátrico en comparación con la FDA. Fármacos como la anfotericina o la milrinona no están autorizados para uso en niños por la FDA, mientras que la beclometasona y la cefazolina están aprobados para uso en niños mayores de 1año. En cambio, la ANVISA no restringe el uso de estos fármacos en niños menores de 12años. La FDA no ha aprobado el uso de algunos fármacos bajo condiciones especiales, tales como la beclometasona en la displasia broncopulmonar (DBP), la penicilina G en la sepsis neonatal o la furosemida en el edema en neonatos. Por el contrario, la ANVISA ha aprobado un abanico más amplio de indicaciones para estos fármacos (tabla 2).
DiscusiónSe llevó a cabo un estudio de cohortes prospectivo para analizar la condición de prescripción de los medicamentos empleados en el manejo de neonatos en la UCIN de un hospital universitario brasileño en un período de un año según los criterios de agencias reguladoras de los Estados Unidos y de Brasil. Se observó que casi todos los neonatos en cuidados intensivos recibieron al menos un medicamento en condiciones OL independientemente de la aplicación de los criterios de una u otra agencia. Sin embargo, al analizar el total de prescripciones de fármacos individuales, se observó una prevalencia menor de prescripción OL al aplicar los criterios de la FDA. En cuanto a los criterios resultantes en la clasificación como OL en estos dos países, las discrepancias implicaron mayoritariamente a la edad y las indicaciones aprobadas para el uso en neonatos. Las mayores diferencias en la clasificación como OL en base a la aplicación de los criterios de la FDA o de la ANVISA se observaron en los antiinfecciosos para uso sistémico y los agentes que actúan sobre el sistema cardiovascular, el sistema nervioso, el tracto alimentario y metabolismo y el sistema respiratorio. En cuanto a las prescripciones UL, se encontró una mayor proporción sobre el total de prescripciones con la aplicación de los criterios de la FDA en comparación con los de la ANVISA.
En lo respectivo a la utilización de al menos un fármaco en condiciones OL o UL durante la estancia en la UCIN, la literatura médica revela una variabilidad considerable en relación con los criterios de distintas agencias reguladoras. Así, estudios en España (Agencia Española de Medicamentos y Productos Sanitarios [AEMPS] y Agencia Europea del Medicamento [EMA]), Italia (Agenzia Italiana del Farmaco) y Francia (Agence Nationale de Sécurité du Médicament et des Produits de Santé [ASNM]) han descrito prevalencias de prescripción OL que oscilan entre el 22,5 y el 73,4% y de prescripción UL, oscilantes entre el 5,0 y el 53,0%1,7,13,14,21–24. En el Oriente Próximo, países como Líbano, Israel y Palestina también han reportado frecuencias heterogéneas de prescripción OL (del 35,3 al 64,8%) y UL (del 5,9 al 16,0%)25–27. Estos estudios demuestran que la situación varía de un país a otro como resultado de diferencias en el proceso de aprobación de medicamentos y en la práctica clínica. En consecuencia, los resultados obtenidos no se pueden comparar directamente, aunque sí ofrecen una perspectiva general de la cuestión.
No obstante, contrastando con estos estudios, nuestros datos mostraron que los criterios de aprobación en Brasil y Estados Unidos tuvieron un efecto similar en la clasificación como prescripción OL en la UCIN. Estudios previos que aplicaron los criterios de la FDA han reportado prevalencias altas superiores al 90%12,27–29. De manera similar, un estudio de cohortes en 201 neonatos que incluyó 3.290 prescripciones y aplicó los criterios de la ANVISA encontró una prevalencia de prescripción OL del 95,6%12. Otro estudio brasileño encontró un porcentaje menor (23,4%), pero era un estudio transversal en una muestra de neonatos más reducida (n=73)15. Por lo tanto, si solo se tienen en cuenta estudios de cohortes en Brasil, la prevalencia de la prescripción OL en base a los criterios de cada una de estas agencias es similar, de lo que cabe concluir que sus criterios son similares.
Al considerar el total de prescripciones de fármacos individuales, encontramos una proporción mayor de medicamentos OL al aplicar los criterios de la ANVISA (52,6% vs. 49,3%; p<0,05). La FDA es un referente global en regulación sanitaria, y su proceso para la aprobación de fármacos nuevos se complementa con una rigurosa vigilancia poscomercialización. En lo concerniente a la prescripción OL en particular, la legislación estadounidense limita la aprobación de fármacos a situaciones en las que hay un determinado nivel de evidencia concluyente9. Dicho lo cual, los ensayos clínicos en neonatos son escasos, y una regulación excesivamente restrictiva podría dificultar el uso de medicamentos en la UCIN30. Por consiguiente, la menor frecuencia de la prescripción OL observada en nuestra muestra al aplicarse los criterios de la FDA podría atribuirse a que estos son más estrictos en comparación con los de la ANVISA.
En cuanto a la prescripción UL, su prevalencia es inferior al aplicarse los criterios de la agencia reguladora del país en cuestión en comparación con los de agencias de otros países, lo que no debe sorprendernos teniendo en cuenta el uso predominante de medicamentos comercializados en el propio país que no requieren modificaciones.
En nuestra muestra, las principales discrepancias entre la FDA y la ANVISA en la clasificación de prescripciones como OL implicaron la edad del paciente y las indicaciones de uso. Los antiinfecciosos para uso sistémico son el grupo de la ATC utilizado con mayor frecuencia en neonatos8,31,32. Para este grupo de fármacos, la FDA ha establecido grupos etarios específicos en los que autoriza su uso. Por ejemplo, la anfotericina B está contraindicada en neonatos según la FDA, mientras que la ANVISA aprueba su uso en la población pediátrica en general (tabla 2). De modo similar, la ANVISA aprueba el uso pediátrico de fármacos como la milrinona y el paracetamol, sin especificaciones particulares respecto al uso en neonatos.
En el caso de la penicilina G, ambas agencias han aprobado su utilización en neonatos. No obstante, la FDA contraindica su uso en monoterapia en la sepsis neonatal, mientras que la ANVISA la considera indicada para «procesos infecciosos» en general en este grupo etario. De manera global, las indicaciones de la ANVISA son más amplias que las de la FDA. Por ejemplo, la beclometasona inhalada para tratamiento de la DBP en neonatos está contraindicada según los criterios de la FDA, mientras que la ANVISA indica este fármaco para el tratamiento de «procesos inflamatorios de la vía aérea».
Las contraindicaciones mencionadas implican situaciones en las que la evidencia disponible es escasa y que comportan riesgos considerables para el neonato. Se sabe que la anfotericina B es nefrotóxica y hepatotóxica y que su toxicidad es mayor en neonatos debido a su inmadurez fisiológica, que afecta a la eliminación del fármaco33. La penicilina G en monoterapia no está indicada debido a la alta prevalencia de bacterias multirresistentes en la sepsis neonatal34. En el caso de la DBP, la evidencia sobre la eficacia de los corticoides inhalados en neonatos de más de 7 días sigue siendo contradictoria, y el uso de corticoides de alta potencia, como la beclometasona, se asocia a un mayor riesgo de secuelas en el neurodesarrollo a largo plazo35. Aunque la prescripción OL y UL aumenta el riesgo de efectos adversos en neonatos36, ambas son esenciales en los cuidados intensivos neonatales. El número limitado de fármacos aprobados para uso neonatal se debe a la escasez de estudios realizados en esta población. Los estudios en neonatos no alcanzan a representar el 3% de los ensayos clínicos registrados a nivel mundial37. En este contexto, cabe resaltar la necesidad de debatir medidas legales que ofrezcan más opciones seguras para el tratamiento farmacológico.
Nuestro estudio tiene algunas limitaciones. En primer lugar, se realizó en una única UCIN, lo que limita la generalización de los resultados. No obstante, la amplia mayoría de los estudios sobre este tema o temas relacionados publicados hasta la fecha son unicéntricos. En segundo lugar, los datos se recogieron de fuentes secundarias, tales como notas clínicas, notas de enfermería y órdenes médicas, lo que podría mermar la calidad de los datos, aunque probablemente afectó poco a los resultados, pues los datos se recogieron y evaluaron de manera prospectiva según fueron registrados.
En resumen, aunque la prevalencia de la prescripción OL en la UCIN fue similar independientemente de la aplicación de los criterios de la FDA o de la ANVISA, los criterios estadounidenses eran más específicos en lo concerniente a la edad y las indicaciones aprobadas para la utilización de fármacos. En cuanto a la prescripción UL, se observó una prevalencia menor con la aplicación de los criterios de la ANVISA. Las mayores diferencias entre las dos agencias implicaron el criterio de edad en la prescripción de antiinfecciosos para uso sistémico, los agentes cardiovasculares y los agentes que actúan sobre el sistema respiratorio. En cuanto a las diferencias relacionadas con las indicaciones, las mayores discrepancias correspondieron a la prescripción de agentes cardiovasculares, agentes que actúan sobre el sistema nervioso y agentes que actúan sobre el tracto alimentario y el metabolismo.
También cabe concluir que, con independencia de las particularidades de cada país, es esencial que la aprobación de fármacos se base en la evidencia científica de mayor calidad disponible en cada momento. No obstante, esto implica que las agencias reguladoras tienen que mantenerse actualizadas con respecto a los avances en la investigación y aplicar la información emergente a los protocolos clínicos lo antes posible. Desafortunadamente, incluso en el caso ejemplar de la FDA, este proceso suele ser lento y no está estandarizado, lo que podría explicar la variabilidad existente entre países. En cuanto a la investigación futura, proponemos evaluar si la aplicación de distintos criterios para la clasificación OL o UL de medicamentos se asocia a diferencias en la evolución clínica de pacientes neonatales.
FinanciaciónNinguna.
Conflicto de interesesNo se declaró ninguno.