Se han realizado muchos estudios acerca de las controversias en el manejo de la bronquiolitis aguda (BA). El objetivo de este estudio multicéntrico nacional en España es conocer la variabilidad en el manejo de la BA en los distintos ámbitos de atención clínica (atención primaria, urgencias y hospitalización) y analizar el impacto de la edad del paciente en su manejo diagnóstico-terapéutico.
Material y métodosEstudio transversal descriptivo (de octubre de 2007 a marzo de 2008) de todos los casos de BA (criterios de McConnochie) tratados en una muestra de 31 hospitales y 60 centros de salud pertenecientes a 12 comunidades autónomas de España. Se diseñó un cuestionario para la recogida de las variables de estudio (datos generales, síntomas, factores de riesgo, pruebas diagnósticas y tratamientos) y se realizó una comparación de las variables por grupos de edad (recién nacidos, 1–3 meses, 3–12 meses y >12 meses).
ResultadosHubo 5.647 casos de BA (el 51,2% procedentes de urgencias, el 28,9% de hospitalización, el 18,3% de centros de salud y el 1,6% de UCI) con una media de edad de 0,34 (intervalo, 0,32–0,35) años, de los que el 6,6% tenía menos de 1 mes; el 23,5%, 1–3 meses; el 60,6%, 3–12 meses, y el 9,3%, más de 12 meses. Se observa un importante uso de procedimientos diagnósticos y terapéuticos no recomendados en las guías práctica clínica. Encontramos asimismo diferencias relacionadas con la edad: los lactantes más pequeños presentaban mayor riesgo de ingreso, diferencias clínicas (mayor incidencia de rinitis, vómitos, rechazo de tomas, apnea y aspecto séptico y menor de fiebre y tos nocturna; más taquipnea, retracciones, hipoventilación y alteración de la conciencia, y menor presencia de sibilancias), mayor número de pruebas diagnósticas (saturación de oxígeno, radiografía de tórax, identificación del VRS, hemograma, etc.) y diferencias en las pautas de tratamiento en las distintas fases (menor uso de todas las medicaciones utilizadas antes del diagnóstico y en la fase de mantenimiento; en la fase aguda, mayor uso de adrenalina y corticoides parenterales y menor de broncodilatadores y corticoides orales, así como mayor uso de oxigenoterapia, fluidoterapia intravenosa, antibioterapia intravenosa, lavados nasales, aspiración respiratoria, fisioterapia respiratoria, ventilación mecánica y heliox).
ConclusionesEn España hay discrepancias entre la práctica clínica habitual y el manejo de la BA basado en la evidencia (tanto en pacientes hospitalizados como en los ambulatorios). En un elevado porcentaje de casos de BA, se realizan pruebas diagnósticas e intervenciones terapéuticas de eficacia y utilidad no demostradas en la BA, y su uso es mayor en los lactantes más pequeños.
There are many studies on the controversial issues involved in the management of acute bronchiolitis (AB). The aim of this multicenter nationwide study in Spain was to find out the variability in the management of AB in various areas of clinical care (primary care, emergency and hospitalization) and to analyze the impact of patient age on diagnostic and therapeutic management.
Material and methodsA cross-sectional observational study (from October 2007 to March 2008) of all cases of BA (McConnochie criteria) treated in a sample of 31 hospitals and 60 health or primary care centers in 12 autonomous regions in Spain. A questionnaire was designed to collect study variables (general information, symptoms, risk factors, diagnostic tests and treatments) and to make a comparison of variables by age groups (newborns, 1–3 months, 3–12 months and >12 months).
ResultsA total of 5647 cases of AB (51.2% from emergency services, 28.9% from hospitalization, 18.3% from primary care and 1.6% from ICU), whose average age was 0.34 years (95%CI 0.32 to 0.35), with 6.6% under 1 month, 23.5% between 1 and 3 months, 60.6% from 3 to 12 months and 522 over 12 months. There is an important use of diagnostic and therapeutic procedures not recommended in clinical practice guidelines. We also found differences related to age: younger infants showed an increased risk of admission, clinical differences (greater presence of rhinitis, vomiting, refusal of feedings, apnea and septic appearance and less fever and night cough; more tachypnea, retractions, hypoventilation and impaired consciousness, and lower presence of wheezing), increased number of diagnostic tests (oxygen saturation, chest x-ray, RSV test, CBC, etc.) and differences in patterns of treatment (less use of all medications before diagnosis and the maintenance phase; in the acute phase, increased use of epinephrine and parenteral corticosteroids and lower use of bronchodilators and oral corticosteroids, and more frequent use of supplemental oxygen, intravenous fluids, intravenous antibiotics, nasal washings, respiratory aspiration, chest physiotherapy, assisted ventilation and heliox).
ConclusionsThere are discrepancies between routine practice and evidence-based management of AB in Spain (both inpatient and outpatient). There is a high percentage of cases in which diagnostic tests and therapeutic interventions (of unproven effectiveness and usefulness in the BA) are performed, where the use is higher in younger infants.
La bronquiolitis aguda (BA) es la principal causa de ingreso por infección respiratoria aguda de vías bajas en el niño menor de 2 años. La carga clínica de la BA es importante por su frecuencia y su repercusión en todos los niveles asistenciales (atención primaria, urgencias y hospitalización), especialmente en las épocas epidémicas de finales de otoño e invierno. No obstante, la mayoría de los casos de BA son autolimitados y pueden ser manejados en el domicilio con medidas sintomáticas; sólo un pequeño porcentaje de pacientes requiere ingreso hospitalario. Sin embargo, la mayor parte de la evidencia disponible sobre el manejo diagnóstico-terapéutico de la BA procede de pacientes hospitalizados, lo que resulta una estrategia incompleta y probablemente sesgada, ya que el criterio de ingreso hospitalario presenta una gran variabilidad entre áreas y sistemas sanitarios.
La BA es una entidad de diagnóstico clínico. Los criterios clásicos más aceptados son los propuestos por McConnochie1, que considera BA como el primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con o sin fiebre), que afecta a niños menores de 2 años, aunque preferentemente se da en el primer año de vida. Lamentablemente, la información sobre validez y precisión de los distintos signos o síntomas de BA procede exclusivamente de estudios descriptivos y sobre todo de la opinión de expertos2. Por ello no sorprende que el espectro clínico de los pacientes catalogados como BA en los distintos trabajos pueda ser tan heterogéneo.
La literatura publicada en relación con el manejo de la BA es muy abundante, tanto en los aspectos diagnósticos como, especialmente, en los aspectos terapéuticos. La información publicada incluye múltiples ensayos clínicos aleatorizados en las distintas intervenciones analizadas, así como la síntesis de la información de estos estudios primarios, fundamentada en guías de práctica clínica (GPC) y revisiones sistemáticas (con o sin metanálisis). Destacamos tres GPC sobre BA, actuales y con rigurosa metodología: las de la American Academy of Pediatrics3, la Scottish Intercollegiate Guideline Network2 y el Cincinnati Children's Hospital Medical Center4. Las GPC clasifican como alta la fuerza de las recomendaciones de muchas intervenciones, dado que están basadas en revisiones sistemáticas de la Colaboración Cochrane: adrenalina5, antibióticos6, β2-adrenérgicos7,8, bromuro de ipratropio9,10, corticoides11–14, fisioterapia15,16, inmunoglobulinas17–19, ribavirina20,21, suero salino hipertónico22 y surfactante23. En España la literatura al respecto también es recurrente: destacamos la publicación en Anales Españoles de Pediatría de dos artículos de revisión sobre BA fundamentados en los principios de la medicina basada en pruebas y un editorial24–26, de indudable interés. En dicho editorial ya se concluía que sería muy útil elaborar y consensuar en nuestro país recomendaciones sobre intervenciones basadas en la mayor evidencia disponible, con el objetivo de poder trabajar con el máximo rigor científico, adecuar nuestra actuación clínica a la gravedad de la BA y disminuir nuestra variabilidad asistencial (especialmente la innecesaria).
Toda esta ingente literatura ha permitido que se desarrollen cada vez más protocolos y guías de actuación clínica diagnóstico-terapéutica que tratan de racionalizar la utilización de estos recursos. La mayoría coincide en los siguientes puntos clave:
- •
Habitualmente no se requiere el empleo de pruebas complementarias en el manejo de la BA. Tan sólo en un pequeño porcentaje de pacientes será necesario recurrir a ellas para descartar diagnósticos alternativos, clasificar la gravedad de la afección respiratoria o indicar algún procedimiento diagnóstico o terapéutico suplementario.
- •
Sólo un pequeño porcentaje de pacientes requiere ingreso hospitalario, que suele estar motivado por la necesidad de cuidados como la administración de oxígeno suplementario, la aspiración de secreciones o la alimentación enteral o parenteral. Pese a la existencia de múltiples ensayos clínicos aleatorizados en los últimos 25 años sobre las potenciales intervenciones farmacológicas en la BA (principalmente broncodilatadores, antiinflamatorios y antivirales), hay escaso avance en el manejo de los casos de BA, con estudios reiterados (ocasionalmente contradictorios) y con escasas novedades (heliox, suero salino hipertónico, etc.). En BA se mantiene la cuestión de definir el medicamento correcto para el paciente adecuado, en la dosis apropiada y en el momento oportuno27.
Son numerosos, sin embargo, los estudios publicados en los últimos 15 años que muestran las grandes diferencias entre la práctica real y la recomendada, con una marcada inadecuación de la práctica clínica a la evidencia científica. Para comprobar la adecuación de la práctica clínica a la evidencia científica se utilizan estudios con distintos tipos de diseño: estudios descriptivos transversales (facilitan información de cómo es el proceso asistencial en un momento dado), auditorías clínicas (se somete a comprobación el cumplimiento de determinados criterios previamente fijados, que llevan implícitos unos estándares de calidad) y estudios de intervención (valoración de los cambios producidos por la implantación de una guía clínica o programa de calidad en relación con controles históricos o concurrentes). Al menos hemos detectado 18 publicaciones que han estudiado la variabilidad del manejo diagnóstico y terapéutico de la BA, distribuidos en los siguientes países: Australia28–30, Canadá31–33, España34–36, Estados Unidos37–39, Francia40, Países Bajos41, Irlanda42, Israel43, Nueva Zelanda44 y Suiza45.
El objetivo de nuestro trabajo tiene una doble vertiente: en general, realizar un estudio epidemiológico y de la variabilidad en el manejo de la BA en los distintos ámbitos de atención clínica (atención primaria, urgencias y hospitalización) en toda España (con una muestra amplia y representativa de las diferentes comunidades autónomas) y, específicamente, analizar la repercusión de la edad del paciente en los aspectos epidemiológicos y de manejo diagnóstico-terapéutico.
Material y métodosDiseño: estudio transversal descriptivo de los casos de BA atendidos en una muestra de hospitales, servicios de urgencias, centros y consultas de atención primaria españoles. Los centros participantes pertenecían a 12 comunidades autónomas (25 provincias) y correspondían a 31 centros hospitalarios (18 hospitales completos, 7 servicios de hospitalización y 6 servicios de urgencias) y 60 centros o consultas de atención primaria (al final del artículo se refieren los centros participantes). La información de este estudio descriptivo forma parte de un estudio de variabilidad e idoneidad de la práctica clínica en el que se emplean como patrón de referencia las recomendaciones elaboradas en una conferencia de consenso, actualmente en proceso de análisis.
Período de estudio: los meses de octubre de 2007 a marzo de 2008, ambos inclusive.
Criterios de inclusión: todos los casos de BA diagnosticados en el periodo de estudio según los criterios de McConnochie1: primer episodio agudo de dificultad respiratoria con sibilancias, precedido por un cuadro catarral de vías altas (rinitis, tos, con o sin fiebre), que afecta a niños menores de 2 años. En cada centro participante se definió a priori el ámbito de recogida de casos: consultas, urgencias, hospitalización y/o cuidados intensivos. En cuatro servicios de urgencias en los que se estimó que el número de casos iba a ser >150, se realizó la recogida de todas las BA diagnosticadas en una muestra de 30 días seleccionados aleatoriamente (muestreo aleatorio por conglomerados).
Criterios de exclusión: pacientes con antecedentes de episodios previos de sibilantes (sólo se aceptaba el primer episodio). A efectos operativos, se consideró episodio previo de sibilantes aquel cuyos síntomas hubieran desaparecido al menos 15 días antes del episodio actual.
Sistema de recogida de casos: incluía el registro consecutivo de casos diagnosticados por los médicos colaboradores en el estudio, así como la revisión periódica de bases de datos informatizadas, listados o copias de informes para el registro de casos diagnosticados por otros médicos. En las búsquedas automáticas se consideraron los siguientes códigos de la clasificación internacional de enfermedades (CIE-9 Modificación Clínica) tanto en posición principal como secundaria: 466.1, bronquiolitis; 079.6, infección por VRS; 466.11, bronquiolitis por VRS; 466.19, bronquiolitis, otras, y 493, asma. Asimismo se realizaron búsquedas textuales del término “bronquiolitis”. Los resultados de las búsquedas se comprobaron manualmente, considerando los criterios de BA de McConnochie. Se diseñó un cuestionario para la recogida de las variables de estudio que comprendían datos generales, síntomas y signos, factores de riesgo, pruebas diagnósticas y tratamiento. Se definió con objetividad cada una de las variables de recogida en un manual operativo. Las hojas de recogida de casos se volcaron a una base de datos Access para cada centro participante.
Variables de estudiosDatos generales: tipo de centro, procedencia del caso (UCI, ingreso, urgencias o consulta), días de ingreso, edad, sexo y fecha de nacimiento.
Síntomas o signos: temperatura al diagnóstico (previa a antitérmicos), tos diurna y nocturna, signos de rinitis, signos de deshidratación, vómitos, rechazo de tomas, pausas de apnea, aspecto séptico, escala de gravedad al diagnóstico y máxima (de 0 a 10 puntos, 0 a 2 para cada componente: frecuencia respiratoria, ventilación pulmonar, sibilancias, tiraje y conciencia, medidos tras adecuada aspiración de secreciones).
Factores de riesgo: prematuridad, semanas de gestación, peso al nacimiento, displasia broncopulmonar (necesidad de oxígeno suplementario a las 36 semanas de edad posmenstrual), otras neumopatías crónicas, cardiopatías congénitas, cardiopatías hemodinámicamente significativas (cardiopatías congénitas cianóticas o acianóticas, no intervenidos o con cardiopatías complejas parcialmente corregidas que presentan hipertensión pulmonar moderada-grave, insuficiencia cardiaca, hipoxemia, hipertensión pulmonar moderada-grave; pacientes corregidos quirúrgicamente con lesiones residuales hemodinámicamente significativas y/o antecedentes de complicaciones pulmonares graves con necesidad de ventilación mecánica prolongada; miocardiopatías en tratamiento médico; cardiopatías que ingresan para cateterismo), inmunodeficiencias congénitas o adquiridas, enfermedad neuromuscular, tratamiento previo con palivizumab (número de dosis), uso previo de broncodilatadores, atopia familiar (asma, rinitis alérgica o dermatitis atópica) o del paciente, exposición a tabaco en el entorno familiar, madre fumadora en embarazo, asistencia a guardería y número de hermanos.
Pruebas diagnósticas: se registró si se había medido la saturación de oxígeno y, en su caso, el valor al diagnóstico (tras aspiración y cuando era posible sin suplemento de oxígeno) y la peor medición; si se había realizado radiografía de tórax y los principales hallazgos (hiperinsuflación, atelectasia, infiltrados y fuga aérea); si se había solicitado alguna prueba de identificación de VRS en secreciones respiratorias y sus resultados; si se había realizado gasometría, el tipo (arterial, venosa o capilar) y sus resultados (pH, CO3H+, pO2 y pCO2), así como si se disponía de alguna determinación de recuento leucocitario, proteína C reactiva, procalcitonina y hemocultivo y sus resultados.
Tratamientos: se recogieron los tratamientos que el paciente había recibido antes del diagnóstico, en la fase aguda y en la fase de mantenimientos.
- •
Antes del diagnóstico: antitusígenos, descongestivos y/o mucolíticos, estimulantes β2 por vía oral o inhalada (mediante nebulización o dispositivos presurizados), antibióticos, corticoides por vía oral o inhalada y bromuro de ipratropio inhalado.
- •
Fase aguda de la enfermedad (en pacientes ingresados, tratamientos recibidos durante el ingreso; en pacientes ambulatorios, tratamientos administrados en el lugar del diagnóstico y los recomendados para su administración en las 24h inmediatas a éste): oxígeno, suero intravenoso, estimulantes β2 (por vía oral o inhalada), antibiótico (por vía oral, intravenosa o intramuscular), fisioterapia respiratoria, adrenalina por vía inhalada, corticoides (por vía oral, inhalada, intravenosa o intramuscular), bromuro de ipratropio inhalado, CPAP nasal, heliox, ribavirina inhalada, ventilación asistida (mediante tubo endotraqueal), antitérmicos, humidificación, lavados nasales y aspiración de vías respiratorias (excluidos lavados nasales).
- •
Fase de mantenimiento (en pacientes ingresados, tratamientos recomendados al alta hospitalaria; en pacientes ambulatorios, tratamientos recomendados para seguir más allá del tercer día después del diagnóstico): antitusígenos, descongestivos y/o mucolíticos, estimulantes β2 por vía oral o inhalada, antibióticos, corticoides por vía oral o inhalada, bromuro de ipratropio inhalado, montelukast por vía oral y otros.
Aspectos éticos: el protocolo del estudio fue aprobado por el Comité Ético de Investigación del centro coordinador (versión del protocolo de 12 de abril de 2007, con informe del Comité Ético de Investigación Clínica del Hospital General Universitario de Alicante de fecha 26 de julio de 2007). Se recomendó expresamente no realizar ninguna modificación en el manejo habitual de los pacientes con BA. La información se recogió de forma anonimizada, sin registrar los datos de identificación de los pacientes.
Aspectos estadísticos: el procesamiento estadístico se realizó en con SPSS versión 11.5.1 (número de serie 9036057). No se realizó una estimación del tamaño muestral necesario por ámbitos o grupos de edad, dado que en casi todos los centros se recogía a todos los pacientes diagnosticados de BA. No obstante, hemos considerado que submuestras de 300 pacientes permitirían estimar porcentajes con una precisión de±5% y discriminar diferencias de porcentajes de al menos el 12% (para porcentajes teóricos del 50%, valor más desfavorable, error α del 5% y β del 20%). Se calcularon medidas de centralización y de tendencia de las variables cuantitativas y análisis de frecuencias de las variables cualitativas, del total y por grupos de edad. Se estimaron intervalos de confianza para las principales medidas. Se realizó una comparación de variables por grupos de edad (neonatos, 1–3 meses, 3–12 meses y >12 meses) mediante prueba de la χ2 para variables cualitativas y análisis de la varianza para variables cuantitativas.
ResultadosEn los meses de octubre de 2007 a marzo de 2008, se recogieron 5.647 bronquiolitis atendidas en los 31 centros hospitalarios y 60 centros o consultas de atención primaria.
Datos generalesLa máxima incidencia de casos se produjo en los meses de diciembre (35,7%), noviembre (21%) y enero (18,3%), que comprendieron el 75% de los casos.
El diagnóstico se realizó predominantemente en los servicios de urgencias (2.765; 51,2%) y hospitalización (1.562; 28,9%); en 986 (18,3%) se realizó en consultas y en 85 (1,6%), en UCI. En 249 casos no se especificó el lugar. Precisaron ingreso 1.866 niños (34,6%); de los 1.241 casos recogidos por seis servicios de urgencias de hospitales terciarios, el 30,5% correspondía a ingresos, mientras que, de los 1.142 casos recogidos en centros o consultas de atención primaria, el 9,1% precisó ingreso. La estancia hospitalaria media fue de 5,73 (5,54–5,92) días.
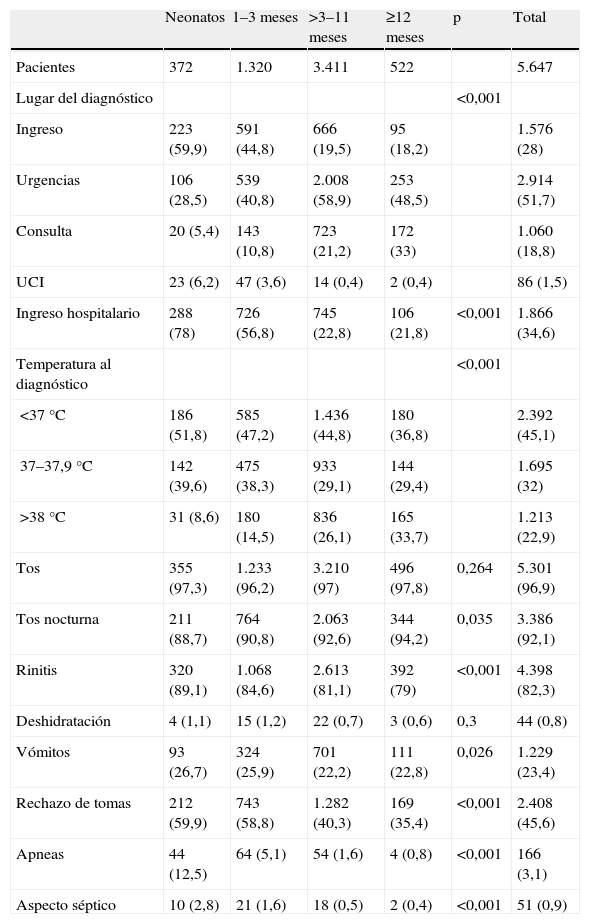
El 58,1% de los casos eran varones, sin diferencias en cuanto al sexo por grupos de edad. La media de edad fue de 0,34 (0,32–0,35) años; 372 (6,6%) eran tenían menos de 1 mes; 1.320 (23,5%), 1–3 meses; 3.411 (60,6%), 3 meses–1 año, y 522 (9,3%), más de 1 año. El riesgo de ingreso fue significativamente superior en los niños más pequeños, con una tendencia decreciente con la edad (tabla 1).
Distribución de frecuencias por grupos de edad para las principales variables
| Neonatos | 1–3 meses | >3–11 meses | ≥12 meses | p | Total | |
| Pacientes | 372 | 1.320 | 3.411 | 522 | 5.647 | |
| Lugar del diagnóstico | <0,001 | |||||
| Ingreso | 223 (59,9) | 591 (44,8) | 666 (19,5) | 95 (18,2) | 1.576 (28) | |
| Urgencias | 106 (28,5) | 539 (40,8) | 2.008 (58,9) | 253 (48,5) | 2.914 (51,7) | |
| Consulta | 20 (5,4) | 143 (10,8) | 723 (21,2) | 172 (33) | 1.060 (18,8) | |
| UCI | 23 (6,2) | 47 (3,6) | 14 (0,4) | 2 (0,4) | 86 (1,5) | |
| Ingreso hospitalario | 288 (78) | 726 (56,8) | 745 (22,8) | 106 (21,8) | <0,001 | 1.866 (34,6) |
| Temperatura al diagnóstico | <0,001 | |||||
| <37°C | 186 (51,8) | 585 (47,2) | 1.436 (44,8) | 180 (36,8) | 2.392 (45,1) | |
| 37–37,9°C | 142 (39,6) | 475 (38,3) | 933 (29,1) | 144 (29,4) | 1.695 (32) | |
| >38°C | 31 (8,6) | 180 (14,5) | 836 (26,1) | 165 (33,7) | 1.213 (22,9) | |
| Tos | 355 (97,3) | 1.233 (96,2) | 3.210 (97) | 496 (97,8) | 0,264 | 5.301 (96,9) |
| Tos nocturna | 211 (88,7) | 764 (90,8) | 2.063 (92,6) | 344 (94,2) | 0,035 | 3.386 (92,1) |
| Rinitis | 320 (89,1) | 1.068 (84,6) | 2.613 (81,1) | 392 (79) | <0,001 | 4.398 (82,3) |
| Deshidratación | 4 (1,1) | 15 (1,2) | 22 (0,7) | 3 (0,6) | 0,3 | 44 (0,8) |
| Vómitos | 93 (26,7) | 324 (25,9) | 701 (22,2) | 111 (22,8) | 0,026 | 1.229 (23,4) |
| Rechazo de tomas | 212 (59,9) | 743 (58,8) | 1.282 (40,3) | 169 (35,4) | <0,001 | 2.408 (45,6) |
| Apneas | 44 (12,5) | 64 (5,1) | 54 (1,6) | 4 (0,8) | <0,001 | 166 (3,1) |
| Aspecto séptico | 10 (2,8) | 21 (1,6) | 18 (0,5) | 2 (0,4) | <0,001 | 51 (0,9) |
En algunas variables hay casos con datos no especificados, por lo que los recuentos no suman el total. Los datos expresan n (%).
Los principales datos clínicos constatados son, por orden de frecuencia: tos (96,9%), rinitis (82,3%), rechazo de las tomas (45,6%), vómitos (23,4%) y fiebre (22,9%). Son infrecuentes las apneas (3,1%), la deshidratación (0,8%) y el aspecto séptico (0,9%). La clínica varió por grupos de edad, con mayor presencia de rinitis, vómitos, rechazo de tomas, apneas y aspecto séptico entre los más pequeños y de fiebre y tos nocturna entre los mayores (tabla 1).
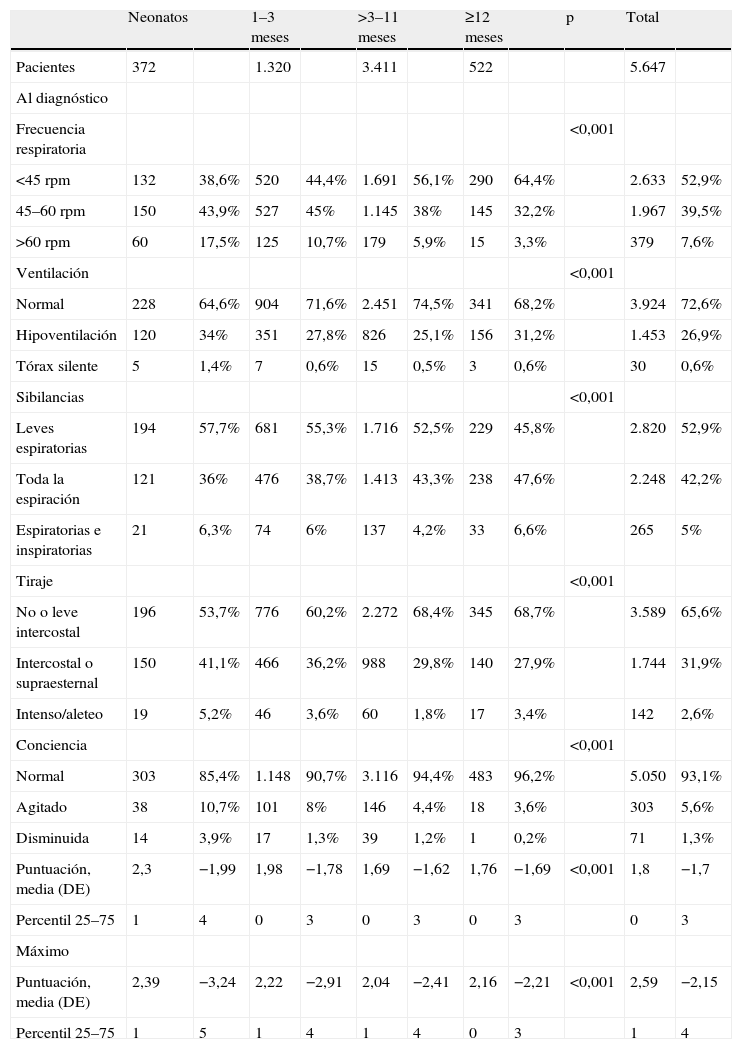
En la tabla 2 se detalla el grado de afección respiratoria de los pacientes distribuidos por grupos de edad. Los niños más pequeños presentan significativamente más taquipnea, tiraje, hipoventilación y alteración de la conciencia, mientras que en los lactantes mayores encontramos significativamente más sibilantes. Tomando en consideración la puntuación de la escala de gravedad, predominaban los pacientes con escasa afección respiratoria: al diagnóstico, la media era 1,8±1,7 puntos; la puntuación máxima media era 2,5±2,1; las puntuaciones medias eran significativamente superiores en los pacientes más pequeños. Sólo presentaron una puntuación >5 en la escala de gravedad al diagnóstico el 2,9% de los pacientes, con una significativa tendencia decreciente con la edad (neonatos, 5,1%; 1–3 meses, 4,5%; 3–11 meses, 2,2%, y 12 o más meses, 2,5%; p<0,001).
Afección respiratoria al diagnóstico y máxima por grupos de edad
| Neonatos | 1–3 meses | >3–11 meses | ≥12 meses | p | Total | ||||||
| Pacientes | 372 | 1.320 | 3.411 | 522 | 5.647 | ||||||
| Al diagnóstico | |||||||||||
| Frecuencia respiratoria | <0,001 | ||||||||||
| <45rpm | 132 | 38,6% | 520 | 44,4% | 1.691 | 56,1% | 290 | 64,4% | 2.633 | 52,9% | |
| 45–60rpm | 150 | 43,9% | 527 | 45% | 1.145 | 38% | 145 | 32,2% | 1.967 | 39,5% | |
| >60rpm | 60 | 17,5% | 125 | 10,7% | 179 | 5,9% | 15 | 3,3% | 379 | 7,6% | |
| Ventilación | <0,001 | ||||||||||
| Normal | 228 | 64,6% | 904 | 71,6% | 2.451 | 74,5% | 341 | 68,2% | 3.924 | 72,6% | |
| Hipoventilación | 120 | 34% | 351 | 27,8% | 826 | 25,1% | 156 | 31,2% | 1.453 | 26,9% | |
| Tórax silente | 5 | 1,4% | 7 | 0,6% | 15 | 0,5% | 3 | 0,6% | 30 | 0,6% | |
| Sibilancias | <0,001 | ||||||||||
| Leves espiratorias | 194 | 57,7% | 681 | 55,3% | 1.716 | 52,5% | 229 | 45,8% | 2.820 | 52,9% | |
| Toda la espiración | 121 | 36% | 476 | 38,7% | 1.413 | 43,3% | 238 | 47,6% | 2.248 | 42,2% | |
| Espiratorias e inspiratorias | 21 | 6,3% | 74 | 6% | 137 | 4,2% | 33 | 6,6% | 265 | 5% | |
| Tiraje | <0,001 | ||||||||||
| No o leve intercostal | 196 | 53,7% | 776 | 60,2% | 2.272 | 68,4% | 345 | 68,7% | 3.589 | 65,6% | |
| Intercostal o supraesternal | 150 | 41,1% | 466 | 36,2% | 988 | 29,8% | 140 | 27,9% | 1.744 | 31,9% | |
| Intenso/aleteo | 19 | 5,2% | 46 | 3,6% | 60 | 1,8% | 17 | 3,4% | 142 | 2,6% | |
| Conciencia | <0,001 | ||||||||||
| Normal | 303 | 85,4% | 1.148 | 90,7% | 3.116 | 94,4% | 483 | 96,2% | 5.050 | 93,1% | |
| Agitado | 38 | 10,7% | 101 | 8% | 146 | 4,4% | 18 | 3,6% | 303 | 5,6% | |
| Disminuida | 14 | 3,9% | 17 | 1,3% | 39 | 1,2% | 1 | 0,2% | 71 | 1,3% | |
| Puntuación, media (DE) | 2,3 | −1,99 | 1,98 | −1,78 | 1,69 | −1,62 | 1,76 | −1,69 | <0,001 | 1,8 | −1,7 |
| Percentil 25–75 | 1 | 4 | 0 | 3 | 0 | 3 | 0 | 3 | 0 | 3 | |
| Máximo | |||||||||||
| Puntuación, media (DE) | 2,39 | −3,24 | 2,22 | −2,91 | 2,04 | −2,41 | 2,16 | −2,21 | <0,001 | 2,59 | −2,15 |
| Percentil 25–75 | 1 | 5 | 1 | 4 | 1 | 4 | 0 | 3 | 1 | 4 |
En algunas variables hay casos con datos no especificados por lo que los recuentos no suman el total.
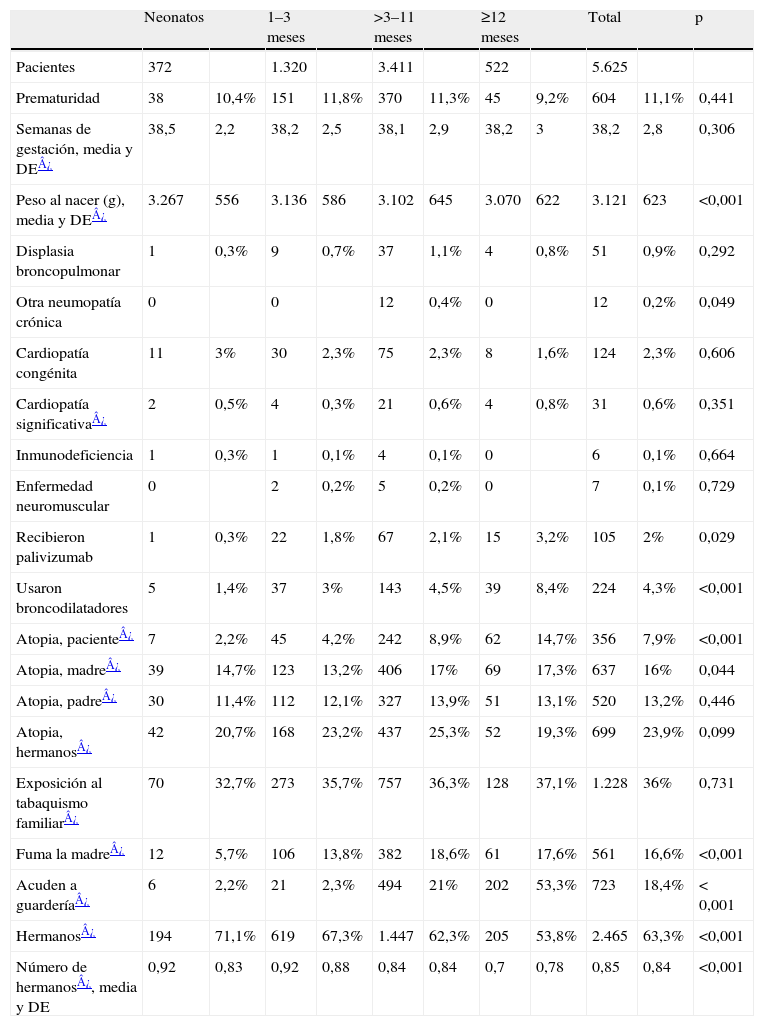
En la tabla 3 se recogen los factores de riesgo de los pacientes. Un 11% de los casos tenían antecedente de prematuridad (el 2,6% con ≤32 semanas de gestación) y un 2,3%, de cardiopatía congénita (en el 0,6%, hemodinámicamente significativa). Otros factores de riesgo son infrecuentes: displasia broncopulmonar (0,9%), otras neumopatías crónicas (0,2%), inmunodeficiencia (0,1%) y enfermedad neuromuscular (0,1%). Entre los lactantes mayores era significativamente más frecuente el antecedente de atopia personal o familiar, la exposición a tabaquismo materno o guardería, mientras que entre los más pequeños lo era tener hermanos. Sólo un 2% había recibido con anterioridad palivizumab y un 4,3%, broncodilatadores, discretamente más frecuente entre los niños mayores.
Factores de riesgo. Distribución por grupos de edad y total (recuentos y porcentajes o medias y DE de los casos con datos disponibles)
| Neonatos | 1–3 meses | >3–11 meses | ≥12 meses | Total | p | ||||||
| Pacientes | 372 | 1.320 | 3.411 | 522 | 5.625 | ||||||
| Prematuridad | 38 | 10,4% | 151 | 11,8% | 370 | 11,3% | 45 | 9,2% | 604 | 11,1% | 0,441 |
| Semanas de gestación, media y DE¿ | 38,5 | 2,2 | 38,2 | 2,5 | 38,1 | 2,9 | 38,2 | 3 | 38,2 | 2,8 | 0,306 |
| Peso al nacer (g), media y DE¿ | 3.267 | 556 | 3.136 | 586 | 3.102 | 645 | 3.070 | 622 | 3.121 | 623 | <0,001 |
| Displasia broncopulmonar | 1 | 0,3% | 9 | 0,7% | 37 | 1,1% | 4 | 0,8% | 51 | 0,9% | 0,292 |
| Otra neumopatía crónica | 0 | 0 | 12 | 0,4% | 0 | 12 | 0,2% | 0,049 | |||
| Cardiopatía congénita | 11 | 3% | 30 | 2,3% | 75 | 2,3% | 8 | 1,6% | 124 | 2,3% | 0,606 |
| Cardiopatía significativa¿ | 2 | 0,5% | 4 | 0,3% | 21 | 0,6% | 4 | 0,8% | 31 | 0,6% | 0,351 |
| Inmunodeficiencia | 1 | 0,3% | 1 | 0,1% | 4 | 0,1% | 0 | 6 | 0,1% | 0,664 | |
| Enfermedad neuromuscular | 0 | 2 | 0,2% | 5 | 0,2% | 0 | 7 | 0,1% | 0,729 | ||
| Recibieron palivizumab | 1 | 0,3% | 22 | 1,8% | 67 | 2,1% | 15 | 3,2% | 105 | 2% | 0,029 |
| Usaron broncodilatadores | 5 | 1,4% | 37 | 3% | 143 | 4,5% | 39 | 8,4% | 224 | 4,3% | <0,001 |
| Atopia, paciente¿ | 7 | 2,2% | 45 | 4,2% | 242 | 8,9% | 62 | 14,7% | 356 | 7,9% | <0,001 |
| Atopia, madre¿ | 39 | 14,7% | 123 | 13,2% | 406 | 17% | 69 | 17,3% | 637 | 16% | 0,044 |
| Atopia, padre¿ | 30 | 11,4% | 112 | 12,1% | 327 | 13,9% | 51 | 13,1% | 520 | 13,2% | 0,446 |
| Atopia, hermanos¿ | 42 | 20,7% | 168 | 23,2% | 437 | 25,3% | 52 | 19,3% | 699 | 23,9% | 0,099 |
| Exposición al tabaquismo familiar¿ | 70 | 32,7% | 273 | 35,7% | 757 | 36,3% | 128 | 37,1% | 1.228 | 36% | 0,731 |
| Fuma la madre¿ | 12 | 5,7% | 106 | 13,8% | 382 | 18,6% | 61 | 17,6% | 561 | 16,6% | <0,001 |
| Acuden a guardería¿ | 6 | 2,2% | 21 | 2,3% | 494 | 21% | 202 | 53,3% | 723 | 18,4% | < 0,001 |
| Hermanos¿ | 194 | 71,1% | 619 | 67,3% | 1.447 | 62,3% | 205 | 53,8% | 2.465 | 63,3% | <0,001 |
| Número de hermanos¿, media y DE | 0,92 | 0,83 | 0,92 | 0,88 | 0,84 | 0,84 | 0,7 | 0,78 | 0,85 | 0,84 | <0,001 |
En algunas variables hay casos con datos no especificados, por lo que los recuentos no suman el total.
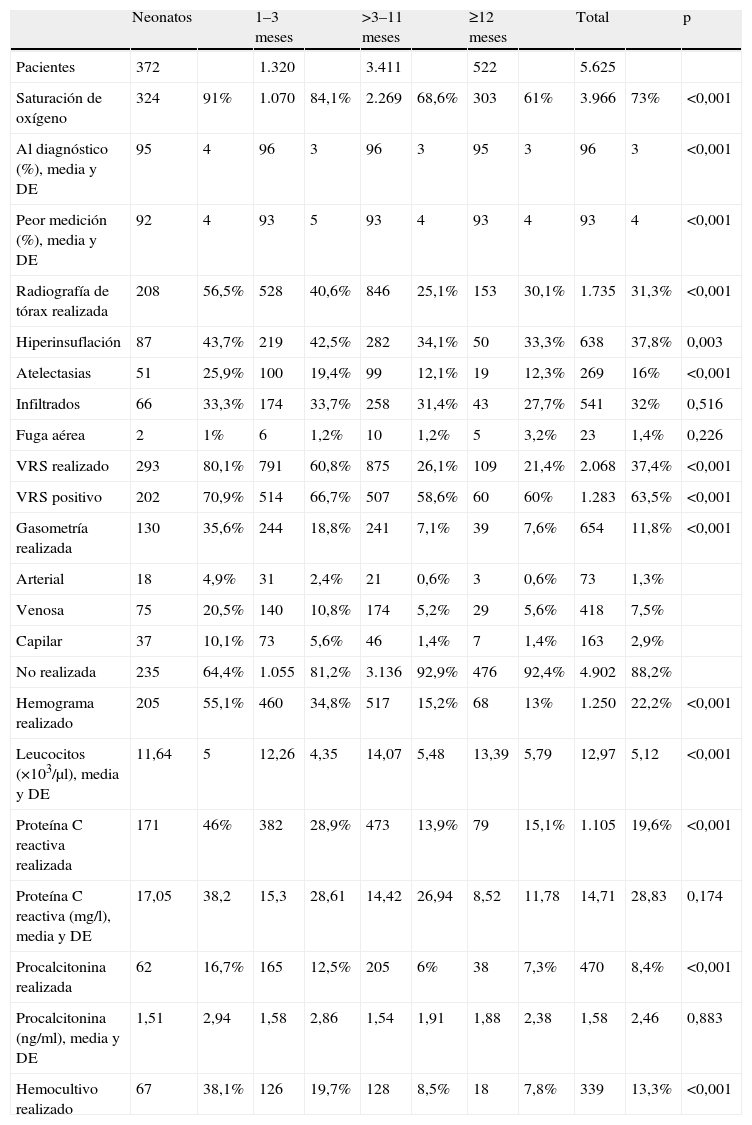
En la tabla 4 se presentan las pruebas diagnósticas realizadas y los principales resultados. Todos los procedimientos fueron más frecuentes entre los niños más pequeños. La saturación de oxígeno se midió en el 73% de los casos, se realizaron pruebas de identificación del VRS en el 37,4% (positivas en el 63,5%), radiografía de tórax en el 31,3%, hemograma en el 22,2%, proteína C reactiva en el 19,6%, hemocultivo en el 13,3%, gasometría en el 11,8% y procalcitonina en el 8,4%. Los principales hallazgos radiológicos fueron hiperinsuflación (37,8%), infiltrados (32%) y atelectasias (16%).
Pruebas diagnósticas realizadas y resultados principales. Distribución por grupos de edad y total (recuentos y porcentajes, salvo que se indique otra cosa)
| Neonatos | 1–3 meses | >3–11 meses | ≥12 meses | Total | p | ||||||
| Pacientes | 372 | 1.320 | 3.411 | 522 | 5.625 | ||||||
| Saturación de oxígeno | 324 | 91% | 1.070 | 84,1% | 2.269 | 68,6% | 303 | 61% | 3.966 | 73% | <0,001 |
| Al diagnóstico (%), media y DE | 95 | 4 | 96 | 3 | 96 | 3 | 95 | 3 | 96 | 3 | <0,001 |
| Peor medición (%), media y DE | 92 | 4 | 93 | 5 | 93 | 4 | 93 | 4 | 93 | 4 | <0,001 |
| Radiografía de tórax realizada | 208 | 56,5% | 528 | 40,6% | 846 | 25,1% | 153 | 30,1% | 1.735 | 31,3% | <0,001 |
| Hiperinsuflación | 87 | 43,7% | 219 | 42,5% | 282 | 34,1% | 50 | 33,3% | 638 | 37,8% | 0,003 |
| Atelectasias | 51 | 25,9% | 100 | 19,4% | 99 | 12,1% | 19 | 12,3% | 269 | 16% | <0,001 |
| Infiltrados | 66 | 33,3% | 174 | 33,7% | 258 | 31,4% | 43 | 27,7% | 541 | 32% | 0,516 |
| Fuga aérea | 2 | 1% | 6 | 1,2% | 10 | 1,2% | 5 | 3,2% | 23 | 1,4% | 0,226 |
| VRS realizado | 293 | 80,1% | 791 | 60,8% | 875 | 26,1% | 109 | 21,4% | 2.068 | 37,4% | <0,001 |
| VRS positivo | 202 | 70,9% | 514 | 66,7% | 507 | 58,6% | 60 | 60% | 1.283 | 63,5% | <0,001 |
| Gasometría realizada | 130 | 35,6% | 244 | 18,8% | 241 | 7,1% | 39 | 7,6% | 654 | 11,8% | <0,001 |
| Arterial | 18 | 4,9% | 31 | 2,4% | 21 | 0,6% | 3 | 0,6% | 73 | 1,3% | |
| Venosa | 75 | 20,5% | 140 | 10,8% | 174 | 5,2% | 29 | 5,6% | 418 | 7,5% | |
| Capilar | 37 | 10,1% | 73 | 5,6% | 46 | 1,4% | 7 | 1,4% | 163 | 2,9% | |
| No realizada | 235 | 64,4% | 1.055 | 81,2% | 3.136 | 92,9% | 476 | 92,4% | 4.902 | 88,2% | |
| Hemograma realizado | 205 | 55,1% | 460 | 34,8% | 517 | 15,2% | 68 | 13% | 1.250 | 22,2% | <0,001 |
| Leucocitos (×103/μl), media y DE | 11,64 | 5 | 12,26 | 4,35 | 14,07 | 5,48 | 13,39 | 5,79 | 12,97 | 5,12 | <0,001 |
| Proteína C reactiva realizada | 171 | 46% | 382 | 28,9% | 473 | 13,9% | 79 | 15,1% | 1.105 | 19,6% | <0,001 |
| Proteína C reactiva (mg/l), media y DE | 17,05 | 38,2 | 15,3 | 28,61 | 14,42 | 26,94 | 8,52 | 11,78 | 14,71 | 28,83 | 0,174 |
| Procalcitonina realizada | 62 | 16,7% | 165 | 12,5% | 205 | 6% | 38 | 7,3% | 470 | 8,4% | <0,001 |
| Procalcitonina (ng/ml), media y DE | 1,51 | 2,94 | 1,58 | 2,86 | 1,54 | 1,91 | 1,88 | 2,38 | 1,58 | 2,46 | 0,883 |
| Hemocultivo realizado | 67 | 38,1% | 126 | 19,7% | 128 | 8,5% | 18 | 7,8% | 339 | 13,3% | <0,001 |
En algunas variables hay casos con datos no especificados, por lo que los recuentos no suman el total.
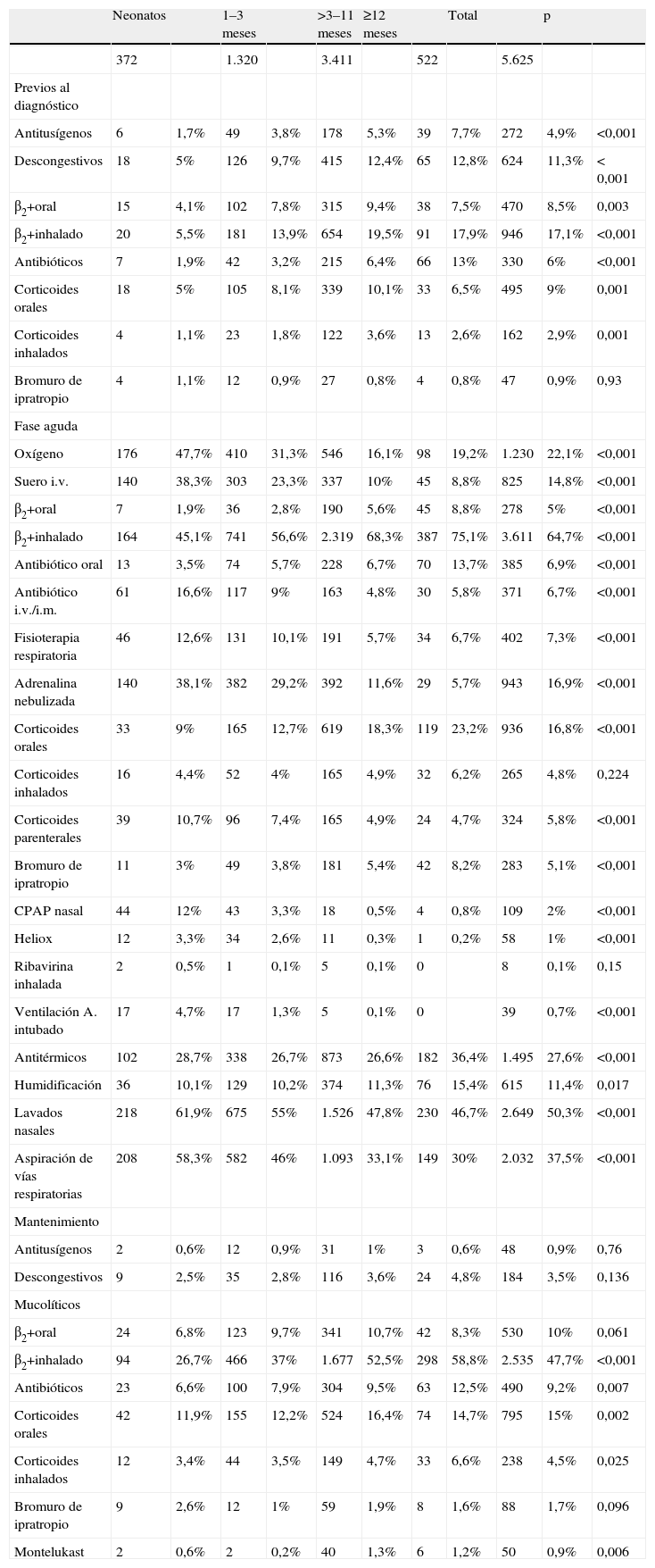
En la tabla 5 se presentan los tratamientos utilizados antes del diagnóstico, durante la fase aguda y de mantenimiento de la BA:
- •
Antes del diagnóstico los pacientes habían recibido los siguientes tratamientos: estimulantes β2 inhalados, el 17,1%; descongestivos, el 11,3%; corticoides orales, el 9%; estimulantes β2 orales, el 8,5%; antibióticos, el 6%; antitusígenos, el 4,9%; corticoides inhalados, el 2,9%, y bromuro de ipratropio, el 0,9%. El uso de todos estos tratamientos fue mayor a medida que aumentaba la edad del paciente, con diferencia significativa en todos los casos (salvo el bromuro de ipratropio).
- •
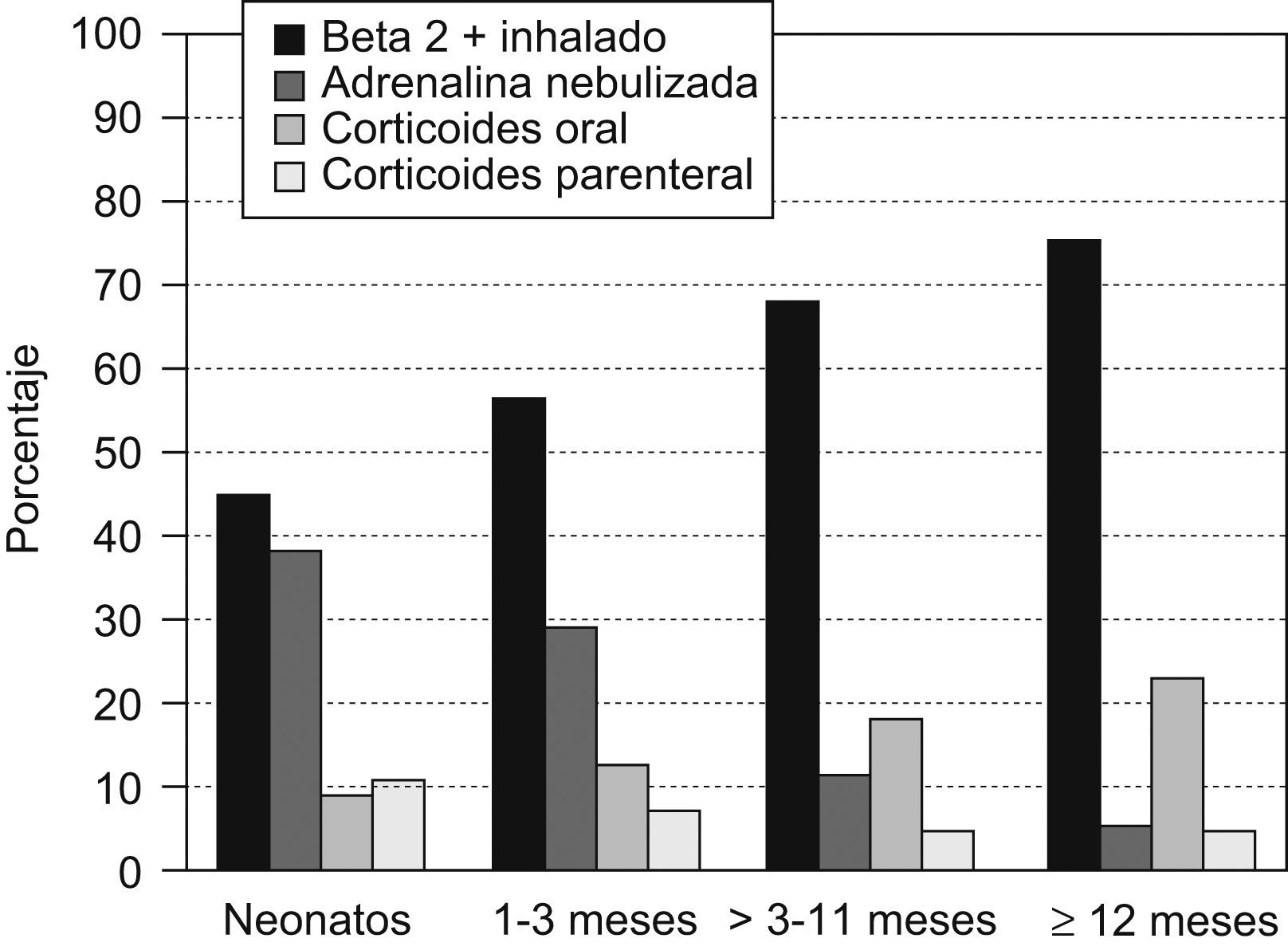
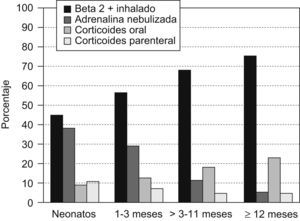
Los principales tratamientos empleados en la fase aguda fueron los broncodilatadores inhalados (64,7%), la adrenalina nebulizada (16,9%) y los corticoides orales (16,8%) y parenterales (5,8%). El uso de adrenalina y corticoides parenterales predominó en los niños más pequeños, mientras que el de broncodilatadores y corticoides orales en los mayores (fig. 1). La oxigenoterapia y la fluidoterapia intravenosa fueron necesarias en el 22,1 y el 14,8% de los casos, con uso más frecuente entre los niños más pequeños. Esa misma tendencia se observó con otras medidas como lavados nasales, aspiración de vías respiratorias o fisioterapia respiratoria, y con el empleo de ventilación asistida o heliox. El 6,9% de los pacientes recibieron antibioticoterapia oral y el 6,7%, parenteral, con una tendencia invertida, disminuyendo la parenteral y aumentando la oral con la edad.
- •
En la fase de mantenimiento, los tratamientos más empleados fueron los broncodilatadores inhalados (47,7%), los corticoides orales (15%), los broncodilatadores orales (10%) y los corticoides inhalados (4,5%). El uso de todos estos tratamientos fue mayor a medida que aumentaba la edad del paciente.
Principales tratamientos antes del diagnóstico, en fase aguda y de mantenimiento. Distribución por grupos de edad y total (recuentos y porcentajes)
| Neonatos | 1–3 meses | >3–11 meses | ≥12 meses | Total | p | ||||||
| 372 | 1.320 | 3.411 | 522 | 5.625 | |||||||
| Previos al diagnóstico | |||||||||||
| Antitusígenos | 6 | 1,7% | 49 | 3,8% | 178 | 5,3% | 39 | 7,7% | 272 | 4,9% | <0,001 |
| Descongestivos | 18 | 5% | 126 | 9,7% | 415 | 12,4% | 65 | 12,8% | 624 | 11,3% | < 0,001 |
| β2+oral | 15 | 4,1% | 102 | 7,8% | 315 | 9,4% | 38 | 7,5% | 470 | 8,5% | 0,003 |
| β2+inhalado | 20 | 5,5% | 181 | 13,9% | 654 | 19,5% | 91 | 17,9% | 946 | 17,1% | <0,001 |
| Antibióticos | 7 | 1,9% | 42 | 3,2% | 215 | 6,4% | 66 | 13% | 330 | 6% | <0,001 |
| Corticoides orales | 18 | 5% | 105 | 8,1% | 339 | 10,1% | 33 | 6,5% | 495 | 9% | 0,001 |
| Corticoides inhalados | 4 | 1,1% | 23 | 1,8% | 122 | 3,6% | 13 | 2,6% | 162 | 2,9% | 0,001 |
| Bromuro de ipratropio | 4 | 1,1% | 12 | 0,9% | 27 | 0,8% | 4 | 0,8% | 47 | 0,9% | 0,93 |
| Fase aguda | |||||||||||
| Oxígeno | 176 | 47,7% | 410 | 31,3% | 546 | 16,1% | 98 | 19,2% | 1.230 | 22,1% | <0,001 |
| Suero i.v. | 140 | 38,3% | 303 | 23,3% | 337 | 10% | 45 | 8,8% | 825 | 14,8% | <0,001 |
| β2+oral | 7 | 1,9% | 36 | 2,8% | 190 | 5,6% | 45 | 8,8% | 278 | 5% | <0,001 |
| β2+inhalado | 164 | 45,1% | 741 | 56,6% | 2.319 | 68,3% | 387 | 75,1% | 3.611 | 64,7% | <0,001 |
| Antibiótico oral | 13 | 3,5% | 74 | 5,7% | 228 | 6,7% | 70 | 13,7% | 385 | 6,9% | <0,001 |
| Antibiótico i.v./i.m. | 61 | 16,6% | 117 | 9% | 163 | 4,8% | 30 | 5,8% | 371 | 6,7% | <0,001 |
| Fisioterapia respiratoria | 46 | 12,6% | 131 | 10,1% | 191 | 5,7% | 34 | 6,7% | 402 | 7,3% | <0,001 |
| Adrenalina nebulizada | 140 | 38,1% | 382 | 29,2% | 392 | 11,6% | 29 | 5,7% | 943 | 16,9% | <0,001 |
| Corticoides orales | 33 | 9% | 165 | 12,7% | 619 | 18,3% | 119 | 23,2% | 936 | 16,8% | <0,001 |
| Corticoides inhalados | 16 | 4,4% | 52 | 4% | 165 | 4,9% | 32 | 6,2% | 265 | 4,8% | 0,224 |
| Corticoides parenterales | 39 | 10,7% | 96 | 7,4% | 165 | 4,9% | 24 | 4,7% | 324 | 5,8% | <0,001 |
| Bromuro de ipratropio | 11 | 3% | 49 | 3,8% | 181 | 5,4% | 42 | 8,2% | 283 | 5,1% | <0,001 |
| CPAP nasal | 44 | 12% | 43 | 3,3% | 18 | 0,5% | 4 | 0,8% | 109 | 2% | <0,001 |
| Heliox | 12 | 3,3% | 34 | 2,6% | 11 | 0,3% | 1 | 0,2% | 58 | 1% | <0,001 |
| Ribavirina inhalada | 2 | 0,5% | 1 | 0,1% | 5 | 0,1% | 0 | 8 | 0,1% | 0,15 | |
| Ventilación A. intubado | 17 | 4,7% | 17 | 1,3% | 5 | 0,1% | 0 | 39 | 0,7% | <0,001 | |
| Antitérmicos | 102 | 28,7% | 338 | 26,7% | 873 | 26,6% | 182 | 36,4% | 1.495 | 27,6% | <0,001 |
| Humidificación | 36 | 10,1% | 129 | 10,2% | 374 | 11,3% | 76 | 15,4% | 615 | 11,4% | 0,017 |
| Lavados nasales | 218 | 61,9% | 675 | 55% | 1.526 | 47,8% | 230 | 46,7% | 2.649 | 50,3% | <0,001 |
| Aspiración de vías respiratorias | 208 | 58,3% | 582 | 46% | 1.093 | 33,1% | 149 | 30% | 2.032 | 37,5% | <0,001 |
| Mantenimiento | |||||||||||
| Antitusígenos | 2 | 0,6% | 12 | 0,9% | 31 | 1% | 3 | 0,6% | 48 | 0,9% | 0,76 |
| Descongestivos | 9 | 2,5% | 35 | 2,8% | 116 | 3,6% | 24 | 4,8% | 184 | 3,5% | 0,136 |
| Mucolíticos | |||||||||||
| β2+oral | 24 | 6,8% | 123 | 9,7% | 341 | 10,7% | 42 | 8,3% | 530 | 10% | 0,061 |
| β2+inhalado | 94 | 26,7% | 466 | 37% | 1.677 | 52,5% | 298 | 58,8% | 2.535 | 47,7% | <0,001 |
| Antibióticos | 23 | 6,6% | 100 | 7,9% | 304 | 9,5% | 63 | 12,5% | 490 | 9,2% | 0,007 |
| Corticoides orales | 42 | 11,9% | 155 | 12,2% | 524 | 16,4% | 74 | 14,7% | 795 | 15% | 0,002 |
| Corticoides inhalados | 12 | 3,4% | 44 | 3,5% | 149 | 4,7% | 33 | 6,6% | 238 | 4,5% | 0,025 |
| Bromuro de ipratropio | 9 | 2,6% | 12 | 1% | 59 | 1,9% | 8 | 1,6% | 88 | 1,7% | 0,096 |
| Montelukast | 2 | 0,6% | 2 | 0,2% | 40 | 1,3% | 6 | 1,2% | 50 | 0,9% | 0,006 |
En algunas variables hay casos con datos no especificados por lo que los recuentos no suman el total.
Las características de nuestro estudio, por número de casos (5.647 lactantes menores de 2 años con primer episodio de BA recogidos de 91 centros sanitarios distribuidos de 25 provincias de 12 comunidades autónomas) y emplazamiento del estudio (BA atendidas en los diferentes niveles asistenciales: atención primaria, urgencias, hospitalización y UCI), permiten obtener datos representativos de las características epidemiológicas y de manejo diagnóstico-terapéutico de esta entidad en España, dado que los diferentes investigadores recogían prospectivamente en un cuestionario sistematizado los casos consecutivos de BA durante el periodo epidémico 2007–2008 y reflejaban el manejo en la práctica clínica de acuerdo con su criterio.
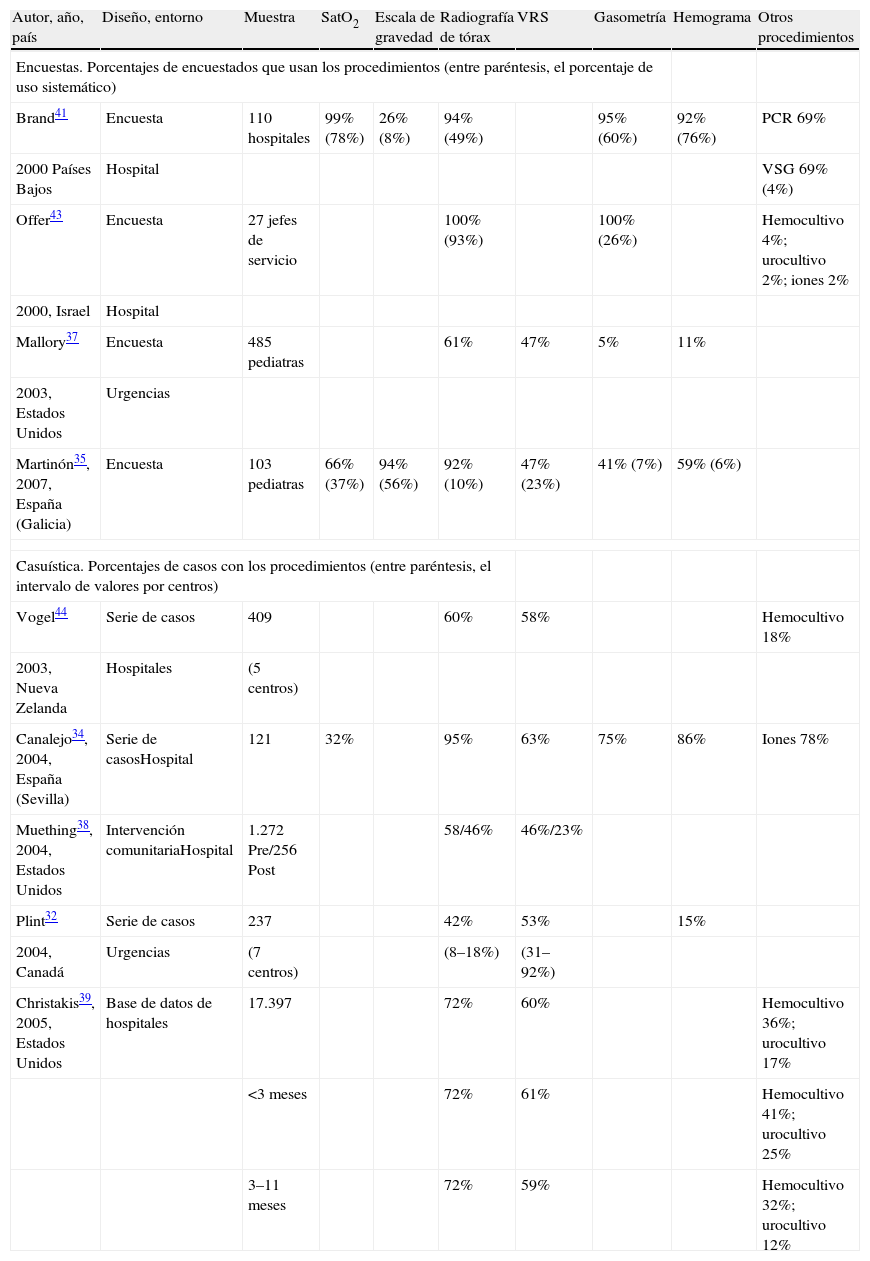
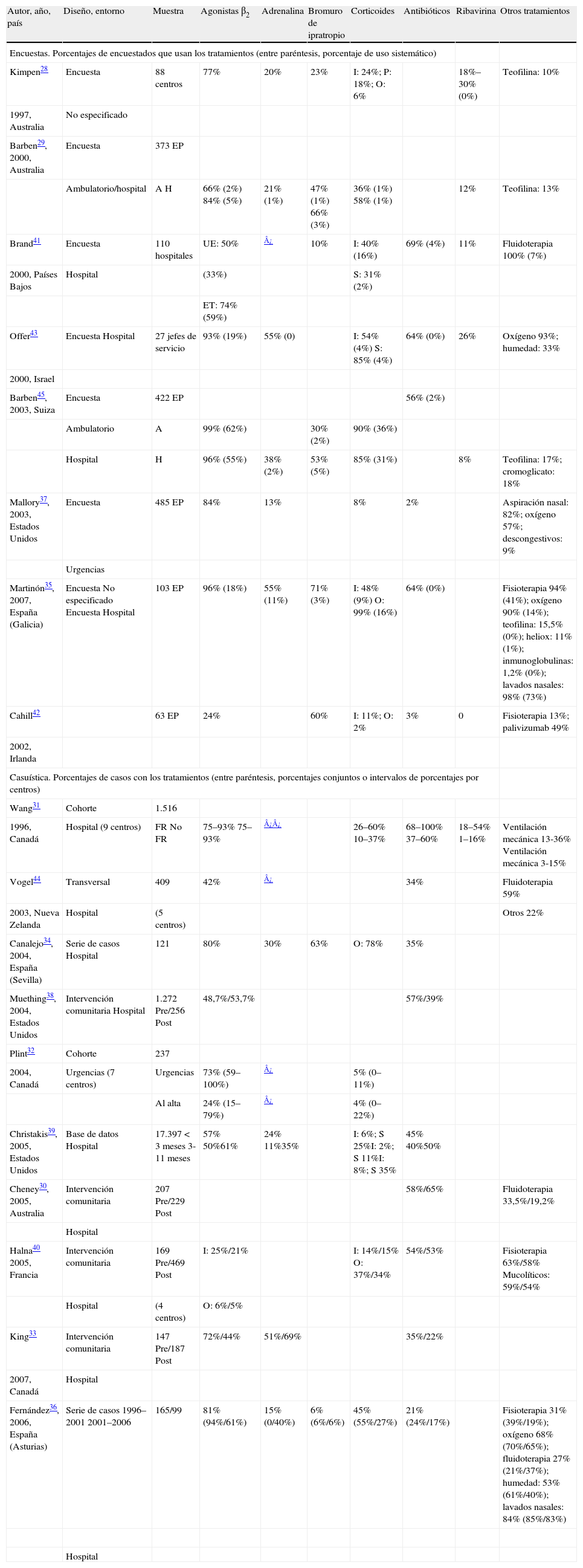
En las tablas 6 y 7 se resumen los datos de los principales estudios de variabilidad en el manejo diagnóstico y terapéutico, respectivamente, de la BA. Al comparar con estos estudios publicados, la fortaleza de nuestro estudio procede tanto del tamaño muestral (bien casos de BA, bien pediatras que responden al manejo de un caso tipo de BA) como del emplazamiento de los casos registrados:
- •
Nuestro estudio presenta el mayor tamaño muestral, a excepción del estudio de Christakis et al39, quienes recogen retrospectivamente los datos de 17.397 casos de BA por medio de la base de datos del Pediatric Health Information System en los años 2001–2003.
- •
No conocemos ningún trabajo que recoja datos simultáneos de todos los ámbitos de emplazamiento (atención primaria, urgencias y hospitalización). La mayoría de los estudios se han centrado en pacientes hospitalizados29–31,33,34,36,38–45 (dos de ellos consideraban también pacientes ambulatorios29,45), y sólo dos se plantearon en urgencias32,37; en dos estudios no se define con claridad el emplazamiento del estudio, aunque se intuye que pueden corresponder a pacientes hospitalizados y ambulatorios28,35. Los estudios realizados en España se circunscriben al estudio de 121 pacientes hospitalizados en un centro de Sevilla34 y de 264 pacientes hospitalizados en un centro de Asturias36, así como en un cuestionario remitido a 103 pediatras de la Comunidad de Galicia35.
Estudios de variabilidad en el manejo diagnóstico de la bronquiolitis aguda
| Autor, año, país | Diseño, entorno | Muestra | SatO2 | Escala de gravedad | Radiografía de tórax | VRS | Gasometría | Hemograma | Otros procedimientos |
| Encuestas. Porcentajes de encuestados que usan los procedimientos (entre paréntesis, el porcentaje de uso sistemático) | |||||||||
| Brand41 | Encuesta | 110 hospitales | 99% (78%) | 26% (8%) | 94% (49%) | 95% (60%) | 92% (76%) | PCR 69% | |
| 2000 Países Bajos | Hospital | VSG 69% (4%) | |||||||
| Offer43 | Encuesta | 27 jefes de servicio | 100% (93%) | 100% (26%) | Hemocultivo 4%; urocultivo 2%; iones 2% | ||||
| 2000, Israel | Hospital | ||||||||
| Mallory37 | Encuesta | 485 pediatras | 61% | 47% | 5% | 11% | |||
| 2003, Estados Unidos | Urgencias | ||||||||
| Martinón35, 2007, España (Galicia) | Encuesta | 103 pediatras | 66% (37%) | 94% (56%) | 92% (10%) | 47% (23%) | 41% (7%) | 59% (6%) | |
| Casuística. Porcentajes de casos con los procedimientos (entre paréntesis, el intervalo de valores por centros) | |||||||||
| Vogel44 | Serie de casos | 409 | 60% | 58% | Hemocultivo 18% | ||||
| 2003, Nueva Zelanda | Hospitales | (5 centros) | |||||||
| Canalejo34, 2004, España (Sevilla) | Serie de casosHospital | 121 | 32% | 95% | 63% | 75% | 86% | Iones 78% | |
| Muething38, 2004, Estados Unidos | Intervención comunitariaHospital | 1.272 Pre/256 Post | 58/46% | 46%/23% | |||||
| Plint32 | Serie de casos | 237 | 42% | 53% | 15% | ||||
| 2004, Canadá | Urgencias | (7 centros) | (8–18%) | (31–92%) | |||||
| Christakis39, 2005, Estados Unidos | Base de datos de hospitales | 17.397 | 72% | 60% | Hemocultivo 36%; urocultivo 17% | ||||
| <3 meses | 72% | 61% | Hemocultivo 41%; urocultivo 25% | ||||||
| 3–11 meses | 72% | 59% | Hemocultivo 32%; urocultivo 12% | ||||||
Estudios de variabilidad en el manejo terapéutico de la bronquiolitis aguda
| Autor, año, país | Diseño, entorno | Muestra | Agonistas β2 | Adrenalina | Bromuro de ipratropio | Corticoides | Antibióticos | Ribavirina | Otros tratamientos |
| Encuestas. Porcentajes de encuestados que usan los tratamientos (entre paréntesis, porcentaje de uso sistemático) | |||||||||
| Kimpen28 | Encuesta | 88 centros | 77% | 20% | 23% | I: 24%; P: 18%; O: 6% | 18%–30% (0%) | Teofilina: 10% | |
| 1997, Australia | No especificado | ||||||||
| Barben29, 2000, Australia | Encuesta | 373 EP | |||||||
| Ambulatorio/hospital | A H | 66% (2%) 84% (5%) | 21% (1%) | 47% (1%) 66% (3%) | 36% (1%) 58% (1%) | 12% | Teofilina: 13% | ||
| Brand41 | Encuesta | 110 hospitales | UE: 50% | ¿ | 10% | I: 40% (16%) | 69% (4%) | 11% | Fluidoterapia 100% (7%) |
| 2000, Países Bajos | Hospital | (33%) | S: 31% (2%) | ||||||
| ET: 74% (59%) | |||||||||
| Offer43 | Encuesta Hospital | 27 jefes de servicio | 93% (19%) | 55% (0) | I: 54% (4%) S: 85% (4%) | 64% (0%) | 26% | Oxígeno 93%; humedad: 33% | |
| 2000, Israel | |||||||||
| Barben45, 2003, Suiza | Encuesta | 422 EP | 56% (2%) | ||||||
| Ambulatorio | A | 99% (62%) | 30% (2%) | 90% (36%) | |||||
| Hospital | H | 96% (55%) | 38% (2%) | 53% (5%) | 85% (31%) | 8% | Teofilina: 17%; cromoglicato: 18% | ||
| Mallory37, 2003, Estados Unidos | Encuesta | 485 EP | 84% | 13% | 8% | 2% | Aspiración nasal: 82%; oxígeno 57%; descongestivos: 9% | ||
| Urgencias | |||||||||
| Martinón35, 2007, España (Galicia) | Encuesta No especificado Encuesta Hospital | 103 EP | 96% (18%) | 55% (11%) | 71% (3%) | I: 48% (9%) O: 99% (16%) | 64% (0%) | Fisioterapia 94% (41%); oxígeno 90% (14%); teofilina: 15,5% (0%); heliox: 11% (1%); inmunoglobulinas: 1,2% (0%); lavados nasales: 98% (73%) | |
| Cahill42 | 63 EP | 24% | 60% | I: 11%; O: 2% | 3% | 0 | Fisioterapia 13%; palivizumab 49% | ||
| 2002, Irlanda | |||||||||
| Casuística. Porcentajes de casos con los tratamientos (entre paréntesis, porcentajes conjuntos o intervalos de porcentajes por centros) | |||||||||
| Wang31 | Cohorte | 1.516 | |||||||
| 1996, Canadá | Hospital (9 centros) | FR No FR | 75–93% 75–93% | ¿¿ | 26–60% 10–37% | 68–100% 37–60% | 18–54% 1–16% | Ventilación mecánica 13-36% Ventilación mecánica 3-15% | |
| Vogel44 | Transversal | 409 | 42% | ¿ | 34% | Fluidoterapia 59% | |||
| 2003, Nueva Zelanda | Hospital | (5 centros) | Otros 22% | ||||||
| Canalejo34, 2004, España (Sevilla) | Serie de casos Hospital | 121 | 80% | 30% | 63% | O: 78% | 35% | ||
| Muething38, 2004, Estados Unidos | Intervención comunitaria Hospital | 1.272 Pre/256 Post | 48,7%/53,7% | 57%/39% | |||||
| Plint32 | Cohorte | 237 | |||||||
| 2004, Canadá | Urgencias (7 centros) | Urgencias | 73% (59–100%) | ¿ | 5% (0–11%) | ||||
| Al alta | 24% (15–79%) | ¿ | 4% (0–22%) | ||||||
| Christakis39, 2005, Estados Unidos | Base de datos Hospital | 17.397 < 3 meses 3-11 meses | 57% 50%61% | 24% 11%35% | I: 6%; S 25%I: 2%; S 11%I: 8%; S 35% | 45% 40%50% | |||
| Cheney30, 2005, Australia | Intervención comunitaria | 207 Pre/229 Post | 58%/65% | Fluidoterapia 33,5%/19,2% | |||||
| Hospital | |||||||||
| Halna40 2005, Francia | Intervención comunitaria | 169 Pre/469 Post | I: 25%/21% | I: 14%/15% O: 37%/34% | 54%/53% | Fisioterapia 63%/58% Mucolíticos: 59%/54% | |||
| Hospital | (4 centros) | O: 6%/5% | |||||||
| King33 | Intervención comunitaria | 147 Pre/187 Post | 72%/44% | 51%/69% | 35%/22% | ||||
| 2007, Canadá | Hospital | ||||||||
| Fernández36, 2006, España (Asturias) | Serie de casos 1996–2001 2001–2006 | 165/99 | 81% (94%/61%) | 15% (0/40%) | 6% (6%/6%) | 45% (55%/27%) | 21% (24%/17%) | Fisioterapia 31% (39%/19%); oxígeno 68% (70%/65%); fluidoterapia 27% (21%/37%); humedad: 53% (61%/40%); lavados nasales: 84% (85%/83%) | |
| Hospital | |||||||||
A: ambulatorio; EP especialistas en pediatría; ET: ensayo terapéutico; FR: pacientes con factores de riego; H: hospital; I: uso inhalado; O: uso oral; P: uso parenteral; Post: período posterior a la intervención; Pre: período previo a la intervención; S: uso sistémico; UE: uso estándar.
Los diferentes estudios (tablas 6 y 7) tienen mayoritariamente diseño de estudios descriptivos transversales (preferentemente mediante cuestionarios), si bien también cabe destacar algunos estudios de intervención (con el análisis previo y posterior a la implementación de una GPC o consenso)30,33,38,40. Sólo en el estudio de Chistakis et al39 se considera el factor edad en el análisis del estudio de variabilidad en el manejo de la BA, que es también un valor añadido en el análisis de nuestros datos.
Datos generalesLa distribución de casos de BA por sexo (predominio de varones, 58,1%), edad (media de 4 meses, con un 60,6% de casos en el intervalo de 3 a 12 meses) y mes de presentación (distribución gaussiana con el 75% de los casos entre noviembre y enero, con pico de incidencia en diciembre) se corresponden con lo conocido de esta enfermedad.
La mayoría de los casos recogidos se distribuye entre urgencias (51,2%) y hospitalización (28,9%). La estancia media de ingreso osciló entre 5,5 y 6 días.
La edad de presentación de la BA influye en el emplazamiento en el que se recogieron los casos (más de la mitad de neonatos y lactantes de 1–3 meses corresponde a hospitalización y más de la mitad de los casos de lactantes de más de 3 meses corresponde a urgencias) y riesgo de ingreso hospitalario (diferencia estadística significativa con tendencia decreciente: se ingresó al 78% de los neonatos, frente al 21,8% de los lactantes de 12 o más meses) (tabla 1).
Datos clínicosLa frecuencia de presentación de los datos clínicos se corresponde con lo publicado. Hay una evidente relación, con diferencias significativas en todos los apartados, entre la edad y la clínica: los neonatos y lactantes de 1–3 meses presentan más rinitis y vómitos, pero las diferencias de riesgo son más patentes en relación con rechazo de las tomas, aspecto séptico y, especialmente, presencia de apneas (el 12,5% de los neonatos frente al 0,8% de los lactantes de 12 o más meses); los lactantes de más de 3 meses presentaron significativamente más fiebre y tos nocturna (tabla 1).
Aunque existen diversas escalas de gravedad de la BA, que incorporan diferentes signos y síntomas, ninguna se ha demostrado más válida o precisa para recomendar su aplicación preferente en la práctica clínica. Por ello confeccionamos una escala de gravedad ad-hoc (tabla 2), que recogía las principales variables de las que se ha demostrado una adecuada concordancia del observador de forma independiente o integradas en otras escalas46–52. Aunque nuestra escala no está validada, permite intuir la gravedad de los casos y ver las diferencias por intervalos de edad:
- •
Predominio de pacientes con escasa afección respiratoria: al diagnóstico la media era 1,8±1,7 puntos, y la puntuación máxima media, 2,5±2,1, sobre una escala de 10 puntos; las puntuaciones medias eran significativamente superiores en los pacientes más pequeños (tabla 2). Sólo el 2,9% de los pacientes presentaban una afección moderada al diagnóstico (puntuación >5).
- •
Los neonatos y lactantes de 1–3 meses presentan significativamente más taquipnea, tiraje, hipoventilación y alteración de la conciencia, mientras que en los lactantes de más de 3 meses encontramos significativamente más sibilantes.
Los factores de riesgo más constatados en los pacientes son el antecedente de prematuridad (el 11%, pero sólo en el 2,6% 32 o menos semanas de gestación) y la presencia de cardiopatía congénita (el 2,3%, pero sólo en un 0,6% considerada hemodinámicamente significativa). El resto de los antecedentes personales de riesgo son anecdóticos, pero destaca la displasia broncopulmonar (el 0,9%, correspondiendo a los casos con menor edad gestacional) (tabla 3).
Las diferencias constatadas en relación con la edad de los pacientes se refleja en una mayor presencia, estadísticamente significativa, de atopia (personal o familiar), exposición a tabaquismo materno y guardería en los lactantes de más de 3 meses, así como mayor convivencia con hermanos en los neonatos y lactantes de 1–3 meses (tabla 3). Cabe constatar que estos ítems fueron los peor recogidos del cuestionario, en algunos de los cuales no estaban especificados los datos en más del 20% de los casos.
Pruebas diagnósticasEn la tabla 4 se exponen las pruebas diagnósticas realizadas a los pacientes con BA, que en orden decreciente fueron: medición de SatO2 (73%), identificación del VRS (37,4%), radiografía de tórax (31,3%), hemograma (22,2%), proteína C reactiva (19,6%), hemocultivo (13,3%), gasometría (11,8%) y procalcitonina (8,4%). Todas las pruebas se realizaron más frecuentemente en los neonatos y lactantes de 1–3 meses, con diferencia estadísticamente significativa en todos los casos (p<0,001) respecto a los lactantes de más de 3 meses.
Tal como se expone en la tabla 6, el porcentaje de realización de pruebas complementarias en nuestro estudio se sitúa, en general, entre el amplio intervalo descrito en los nueve estudios en que se analizan estos datos, salvo en el caso de la radiografía de tórax y la proteína C reactiva, cuya realización es menor en nuestro estudio (posiblemente por incluir a pacientes de distintos ámbitos, no sólo hospitalizados): la SatO2 se valora en tres estudios, cuya medición se realiza entre el 3234 y el 99%41; la identificación del VRS se valora en siete estudios, y oscila entre el 2338 y el 65%34; la radiografía de tórax se valora en los nueve estudios, y oscila entre 4232 y el 100%43; el hemograma se valora en cinco estudios, y oscila entre el 1137 y el 92%41; la proteína C reactiva se valora dos estudios, y oscila entre el 4835 y el 69%41, si bien en general no sistemáticamente, sino cuando hay algún indicio de posible infección; el hemocultivo se valora en tres estudios, y oscila entre el 437 y el 36%39; la gasometría se valora en cinco estudios, y oscila entre el 537 y el 100%43, si bien en general no sistemáticamente, sino cuando hay algún indicio de afección respiratoria.
Es muy llamativo el alto porcentaje de pruebas complementarias solicitadas, cuando habitualmente no se recomienda el empleo de pruebas complementarias en el abordaje de la BA.
Intervenciones terapéuticasEn la tabla 5 se exponen los principales tratamientos recibidos por los pacientes antes del diagnóstico y durante las fases aguda y de mantenimiento. Hay amplia información y, por lo tanto, es bien reconocido en el tratamiento de la BA que: a) lo fundamental es realizar las medidas de soporte sintomáticas frente al manejo de la fiebre, las secreciones respiratorias, la hiporexia y la dificultad respiratoria y la hipoxemia; b) se puede valorar el uso alternativo de la prueba terapéutica con salbutamol o adrenalina nebulizada (mejor con suero salino hipertónico) en casos moderados-graves seleccionados y mantenerlos sólo si se documenta respuesta positiva por medios objetivos (escala de gravedad clínica); c) cabe plantear la posible utilización de ciertos fármacos (heliox, surfactante y/o ribavirina) en casos graves de BA bien seleccionados, y d) se considera inapropiado el uso de la mayoría de los demás fármacos (corticoides, salbutamol oral, adrenalina subcutánea, bromuro de ipratropio, antibióticos, inmunoglobulinas, etc.).
Pese a estos datos fundamentados, sigue sorprendiendo el elevado uso de ciertos fármacos:
- •
En todas las fases de tratamiento de la BA: estimulantes β2 inhalados (el 17,1% antes del diagnóstico, el 64,7% en la fase aguda y el 47,7% en la fase de mantenimiento), estimulantes β2 orales (el 8,5% antes del diagnóstico, el 5% en la fase aguda y el 10% en la fase de mantenimiento), corticoides orales (el 9% antes del diagnóstico, el 16,8% en la fase aguda y el 15% en la fase de mantenimiento), bromuro de ipratropio (el 0,9% antes del diagnóstico, el 5,1% en la fase aguda y el 1,7% en la fase de mantenimiento), antibióticos (el 6% antes del diagnóstico, el 6,7% en la fase aguda y el 9,2% en la fase de mantenimiento).
- •
En alguna de las fases: corticoides inhalados (el 2,9% antes del diagnóstico y el 4,5% en la fase de mantenimiento), corticoides parenterales (el 5,8% en la fase aguda), adrenalina nebulizada (el 16,9% en la fase aguda).
Tal como se aprecia en la tabla 5, la mayoría de los tratamientos empleados antes del diagnóstico y en la fase de mantenimiento fueron más frecuentes a medida que aumentaba la edad del paciente, con diferencias significativas en la mayoría de ellos. En la fase aguda, el uso de adrenalina y corticoides parenterales predominó en los niños más pequeños, mientras que el de broncodilatadores y corticoides orales predominó en los mayores (fig. 1). En los neonatos y lactantes de 1–3 meses fue más frecuente el uso de oxigenoterapia, fluidoterapia intravenosa, antibioterapia intravenosa, lavados nasales, aspiración de vías respiratorias, fisioterapia respiratoria, ventilación asistida y heliox.
El manejo de los casos de BA es uno de los ejemplos de la medicina actual en que la práctica diaria (“lo que hacemos”) se separa con más frecuencia de la deseable de la evidencia científica (“lo que sabemos”). Esto da lugar a prácticas clínicas muy dispares, más relacionadas con las preferencias individuales de los médicos que atienden a niños con BA o con las “modas” temporales que con la gravedad de los episodios y su ajuste a criterios probados53.
Centros participantes (e investigadores) en la recogida de casos de bronquiolitis aguda durante el periodo epidémico 2007-2008Andalucía: Hospital de Torrecárdenas, Almería (M.D. Gámez Gómez, J. Batlles Garrido, J.E. Cabrera Servilla, I. García Escobar, F. Giménez Sánchez, L. Ruiz Tudela); C.S. Candelaria, Sevilla (A. Fernández Valverde, M.G. Bueno Rodríguez, I. Ramón Faba, M. Praena Crespo).
Aragón: C.S. Fuentes del Ebro, Zaragoza (J.A. Castillo Laita, R. Macipe Costa); Hospital Infantil Universitario Miguel Servet, Zaragoza (C. Campos Calleja, M.C. García Jiménez, R. Pérez Delgado, Y. Romero Salas).
Asturias: C.S. Contrueces (M. López Benito), C.S. El Llano (V. Martínez Suárez, M. García Balbuena), C.S. Infesto (I. Mora Gandarillas), C.S. La Magdalena (J.I. Pérez Candás), C.S. Laviada (A. Cobo Ruisánchez, B. Yáñez Meana), C.S. Natahoyo (A. Hernández Encinas), C.S. Otero (B. Domínguez Aurrecoechea), C.S. Pravia (M. García Adaro, R. Buznego Sánchez), C.S. Tineo (M. Fernández Francés), C.S. Puerta La Villa (I. Franco, S. Ballesteros), C.S. Sama (M. Benito Martín, A.J. Mira López, M. Fernández López); Hospital de Cabueñes, Gijón (C. Molinos Norniella, C. Pérez Méndez, E. Fernández Fernández, J. Fernández Antuña); Hospital Central de Asturias, Oviedo (J. Rodríguez Suárez, S. Jiménez Treviño, F. Álvarez Caro).
Canarias: Hospital Universitario Materno Infantil, Las Palmas de Gran Canaria (S. Todorcevic, M.R. García Luzardo).
Cantabria: C.S. Buelna (A. Bercedo Sanz); Hospital Marqués de Valdecilla, Santader (M.J. Cabero Pérez, L. Álvarez Granda, E. Pérez Belmonte).
Castilla y León: Hospital Complejo Asistencial de León, León (S. Lapeña López de Armentia, R. Morales Sánchez, L. Fernández Pérez); C.S. Jardinillos, Palencia (S. Alberola López, I. Pérez García); C.S. Pintor Oliva, Palencia (A.B. Camina Gutiérrez, J.G. Santos García), C.S. Venta de Baños, Palencia (I. Casares Alonso); C.S. Villamuriel, Palencia (A. Cano Garcinuño); Hospital Río Carrión, Palencia (C. Urueña Leal, J.M. Andrés de Llano, J.E. Fernández Alonso, J.M. Bartolomé Porro); C.S. Ciudad Rodrigo, Salamanca (M.C. Sánchez Jiménez, M.J. Estévez Amores); C.S. Ledesma, Salamanca (M. Mendoza Sánchez); C.S. Miguel Armijo, Salamanca (J. López Ávila); C.S. San Bernardo, Salamanca (A. Martín Ruano); C.S. Santa Marta, Salamanca (J. Martín Ruano, B. de Dios Martín); Hospital Complejo Hospitalario de Salamanca, Salamanca (S. Fernández de Miguel, J.M. Sánchez Granados, O. Serrano Ayestaran); Hospital Clínico Universitario, Valladolid (F. Conde Redondo, A. del Río López, V. Matías del Pozo); Hospital del Rio Hortega, Valladolid (F. Centeno Malfaz, C. Alcalde Martín, B. Bello Martínez, L. Crespo Valderrábano, C. Gutiérrez Abad); C.S. Benavente Sur, Zamora (M.E. Vázquez Fernández); C.S. Parada de Molino, Zamora (A. Cortés Gabaudán); C.S. Puerta Nueva, Zamora (M.M. Miguélez Vara, P. Pérez García); C.S. Santa Elena, Zamora (S. García Vicente); C.S. Virgen de la Concha, Zamora (M.A. Prieto Figuero, M.J. Piorno Hernández, M.J. Moro Pérez); Hospital Virgen de la Concha, Zamora (C. Ochoa Sangrador, A.F. Bajo Delgado, A. Fernández Testa); Hospital General de Segovia, Segovia (C. Ortega Casanueva).
Cataluña: ABS Llefiá, Barcelona (G. Ruiz Aragón); ABS-7 La Salut, Barcelona (P. Aizpurua Galdeano); Hospital Sant Joan de Déu, Barcelona (G. Claret Teruel, S. Fernández Ureña); Hospital Universitari Germans Trias i Pujol, Barcelona (M. Méndez Hernández, F. Brossa Guerra, J. Fàbrega Sabaté); ABS Girona-3, Girona (R.B. Cortés Marina, E. Fortea Gimeno); ABS Girona-4, Girona (J.C. Buñuel Alvarez, C. Vila Pablos); Hospital Josep Trueta, Girona (S. Uriel Prat, L. Mayol i Canals).
Comunidad Valenciana: C.S. Acequión, Alicante (C. Buhedo Gordillo, G. Rinero de Campos); C.S. El Cabo, Alicante (M.J. Mateo Moraleda, T. Pérez Martín, A. Redondo, A. Sanguino, B. Sepulcre, B. Serra, A. Tosao); C.S. El Campello, Alicante (J. Galiano Olivares); C.S. Guardamar del Segura, Alicante (C.P. Rico Uriós); C.S. Hospital Provincial, Alicante (M.C. Sirvent Mayor, M.J. Fernández Tarí); C.S. La Mata, Alicante (M.S. Fuggini); C.S. Mutxamel, Alicante (L. Comino Almenara); C.S. Rojales i Benijofar, Alicante (A. Bernabé Gutiérrez, I. Degtyareva); Hospital de Orihuela, Alicante (V. Cañadas Olmo, F. Goberna Burguera); Hospital de San Juan, Alicante (J.L. Mestre Ricote); Hospital de Torrevieja, Alicante (J. González de Dios, C. Rivas Juesas); C.S. Gran Vía, Castellón (E. Fabregat Ferrer, M.J. Palomares Gimeno); Hospital de La Plana, Castellón (J. Colomer Pellicer); C.S. La Eliana, Valencia (I. Úbeda Sansano, M. Romero García); C.S. de Meliana, Valencia (A. Plaza Miranda); Consultorio Auxiliar Albalat de la Ribera, Valencia (C. Sánchez Medina); Consultorio Auxiliar Barrio de la Luz, Valencia (T. Álvarez de Laviada Mulero); C.S. Padre Jofré, Valencia (P. Barona Zamora); C.S. Serrería I, Valencia (M. Asensi Monzó).
Extremadura: C.S. Talavera la Real, Badajoz (C.M. Gómez Málaga); C.S. Urbano-I, Badajoz (J.J. Cuervo Valdés); C.S. Villanueva de la Serena Sur, Badajoz (D. Barroso Espadero).
Galicia: C.S. Santa Comba, A Coruña (M.E. Amigo Ferreiro); Hospital Arquitecto Marcide, A Coruña (E. García Fernández, A.I. García Villar, R.M. Romaris Barca, M. Santos Tapia); Hospital Clínico de Santiago, A Coruña (A. Miras Veiga, F. Martinón Torres, N. Martinón Torres, L. Redondo Collazo); Hospital Virxe da Xunqueira, A Coruña (M.I. Quintela Fernández); Hospital Monforte, Lugo (S.A. Fernández Cebrián, M.J. Pita Pérez, F.J. Vadillo González); Hospital da Costa, Lugo (A.G. Andrés Andrés, P. Lago Manchado); Hospital Complejo Hospitalario de Ourense, Ourense (C. Lorenzo Legerén, M. Berrocal Castañeda, J.M. Iglesias Meleiro); Complejo Hospitalario Universitario de Vigo, Pontevedra (E. González Colmenero, J. Antelo Cortizas, E. García Martínez, A. Ruiz Conde).
Madrid: C.S. Barrio del Pilar (P. González Rodríguez); C.S. Canillejas (O. Cortés Rico); C.S. Entrevías-Área 1 (M. Aparicio Rodrigo); C.S. General Ricardos (G. Orejón de Luna, M.M. Martín Mate); C.S. Guayaba (M. Duelo Marcos, C. Indaberea Iguaran, A. Nuñez Giralda, F. Muñoz Velasco); C.S. Juncal (L. Perdikidis Oliveri); C.S. Mar Báltico-Área 4 (J.L. Montón Álvarez, V. Orbe León); C.S. Potes, Área 11 (M. Fernández Rodríguez); Hospital Gregorio Marañón (M.M. Guerrero, R. Marañón Pardillo, A. Peñalba Cítores).
Páis Vasco: C.S. Bidebieta, Guipúzcoa (M. Callén Blecua); Hospital Donostia, Guipúzcoa (J. Korta Murua, F.J. Mintegui Aramburu, I. Olaciregui Echenique, E. Rezola Arcelus); Hospital de Basurto, Vizcaya (C. González Díaz); Hospital de Cruces, Vizcaya (J. Sánchez Echaniz).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónProyecto financiado con una beca de la Fundación Hospital Torrevieja para el periodo de junio de 2007 a junio de 2009 (código de protocolo: BECA0001).
AgradecimientosA María García-Puente Sánchez, documentalista del Hospital de Torrevieja, y a Pilar Montesinos Butrón, enfermera de Control de Infecciones del Hospital de Torrevieja, por su colaboración en la confección de la base de datos del estudio.