El tratamiento antibiótico clásico de la faringoamigdalitis aguda estreptocócica es una pauta de 10 días; sin embargo, la aparición de resistencias antibióticas induce a explorar pautas más cortas.
Material y métodosSeleccionamos a aquellos pacientes diagnosticados de faringoamigdalitis aguda estreptocócica en 2 cupos de pediatría de un centro de salud entre junio de 2016 y abril de 2020. Se compararon los resultados de aquellos que recibieron tratamiento 8-10 días con el de aquellos que lo recibieron 5-7 días.
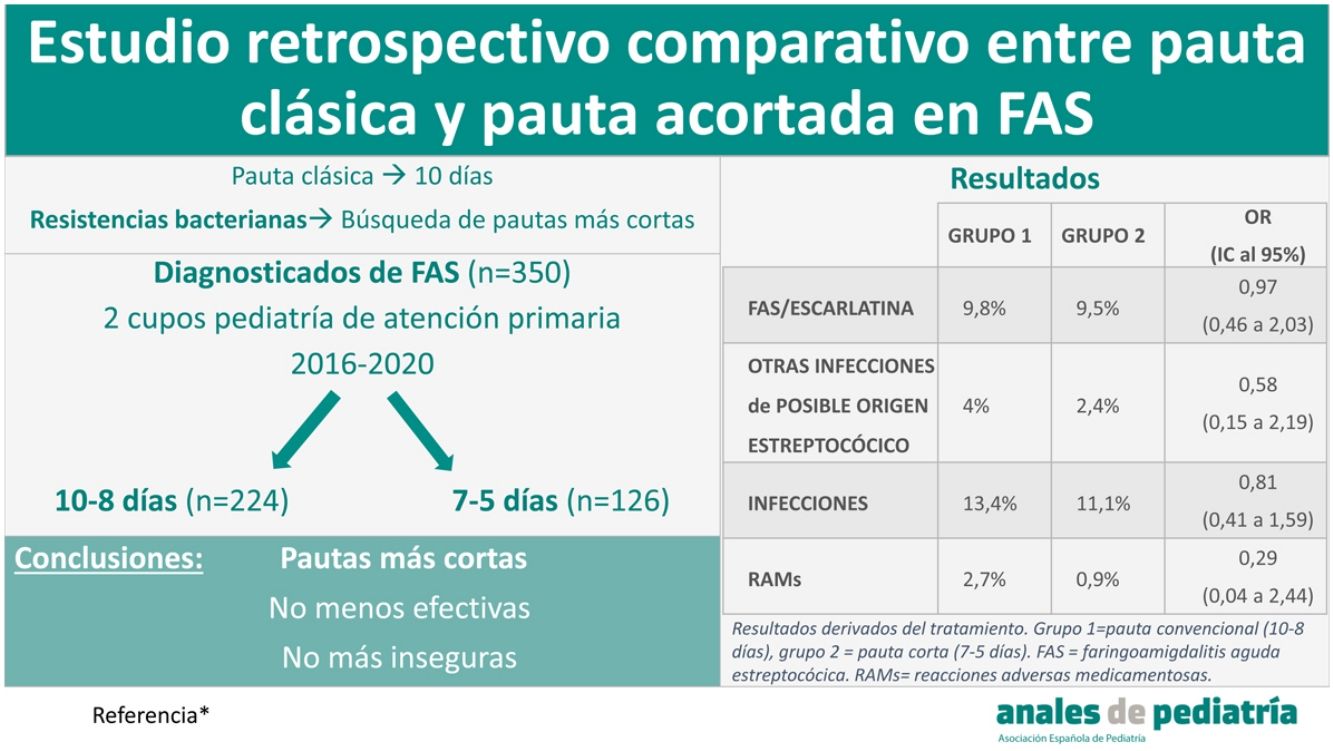
ResultadosSe analizaron 350 episodios (252 pacientes). El 64% recibieron tratamiento durante 8-10 días (grupo 1) y el 36% durante 5-7 días (grupo 2). No se observaron diferencias significativas en la aparición de faringoamigdalitis aguda estreptocócica o escarlatina los 3 meses posteriores (OR 0,97; IC 95%: 0,46-2,03), con una proporción similar en ambos grupos (9,8 vs. 9,5%). Sin diferenciar el tipo de infección (faringoamigdalitis aguda estreptocócica, escarlatina u otro tipo de infección streptocócica), se observaron resultados similares (OR 0,81; IC 95%: 0,41-1,59) con el 13,4% en el grupo 1 y el 11,1% en el 2. Respecto a la aparición de reacciones adversas medicamentosas recogidas en la historia clínica, fue de 2,7% en el grupo 1 y 0,8% en el 2 (OR 0,29; IC 95%: 0,04-2,44).
ConclusionesSegún nuestra experiencia, la pauta antibiótica corta (5-7 días) en faringoamigdalitis aguda estreptocócica no es menos efectiva ni más insegura que la clásica pauta de 10 días.
Antibiotherapy regimens for management of acute streptococcal pharyngitis traditionally last 10 days, but the development of resistance to different antimicrobials has motivated the exploration of shorter courses.
Material and methodsWe selected patients given a diagnosis of streptococcal pharyngitis in 2 paediatric caseloads of one primary care centre between June 2016 and April 2020. We compared outcomes in patients treated with 8- to 10-day courses versus 5- to 7-day courses.
ResultsThe analysis included 350 care episodes (252 patients). Sixty-four percent were managed with 8- to 10-day courses of antibiotherapy (group 1) and 36% with 5- to 7-day courses (group 2). There were no significant differences in the incidence of streptococcal pharyngitis or scarlet fever in the 3 months that followed (OR, 0.98; 95% CI: 0.46-2.03), with similar percentages in both groups (9.8 vs. 9.5%). Overall, without differentiating based on the type of infection (streptococcal pharyngitis, scarlet fever or other streptococcal infections), we found similar outcomes (OR, 0.81; 95% CI: 0.41-1.59): 13.4% in group 1 and 11.1% in group 2. We also found no differences in the frequency of adverse events documented in the health records (OR, 0.29; 95% CI: 0.04-2.44): 2.7% in group 1 and 0.8% in group 2.
ConclusionsIn our experience, a shorter antibiotic course (5-7 days) is not less effective or more unsafe for management of acute streptococcal pharyngitis than the traditional 10-day course.
La faringoamigdalitis aguda (FAS) es una enfermedad muy frecuente en la infancia, tanto que es uno de los motivos de consulta más comunes en Pediatría de Atención Primaria. Su etiología es vírica en un 75-80% de los casos; dentro de la etiología bacteriana, la estreptocócica es la más frecuente (30-40%).
El tratamiento antibiótico de elección de la FAS es la fenoximetilpenicilina por vía oral, aunque la amoxicilina supone una alternativa preferida en muchas ocasiones por su sabor y por no interferir con la alimentación, lo que facilita la administración en niños. El objetivo del tratamiento es acelerar la recuperación y evitar la aparición de complicaciones supurativas de tipo absceso periamigdalino, o no supurativas, como la clásica fiebre reumática aguda. Además, se pretende evitar la transmisión y aparición de brotes. Pese a estar indicado el tratamiento antibiótico, cabe destacar que en los casos no tratados la recuperación se suele producir a los 5 días sin complicaciones y que la fiebre reumática tiene una prevalencia mínima en nuestro medio.
La pauta de 10 días se estableció en el año 1958 con los primeros estudios llevados a cabo en Estados Unidos y su objetivo principal era la erradicación bacteriana, ya que se creía que esto disminuía el riesgo de fiebre reumática aguda, lo que siempre fue la principal indicación de tratamiento1. Pese a ello, se desconoce la infectividad de los portadores faríngeos y, con ello, la necesidad real de lograr la erradicación; actualmente se postula que estos portadores rara vez transmiten el microorganismo, lo que plantearía pocos riesgos a sus contactos2.
Existen pocos estudios en la literatura que comparen la pauta de 10 días en la FAS con pautas más cortas. Aquellos en los que el objetivo es clínico (aparición de complicaciones o tasa de curación) han mostrado que no existen diferencias significativas3-5. Sin embargo, aquellos en los que se mantiene como objetivo la erradicación bacteriológica se observa un menor éxito con la pauta corta6. Por ello, se comienza a proponer que, salvo en los casos en los que interese especialmente la erradicación bacteriológica, se emplee la pauta corta7.
La necesidad de buscar pautas más cortas proviene, principalmente, del emergente problema de las resistencias a los antibióticos. Si bien no se han descrito resistencias de S. pyogenes a los antibióticos betalactámicos, conviene recordar que, al llevar a cabo un tratamiento antibiótico, estamos sometiendo a todas las bacterias de ese organismo a una presión que permitirá que se seleccionen las bacterias resistentes. Un ejemplo en la práctica clínica lo vemos en el tratamiento de Escherichia coli, uno de los microorganimos más frecuentes en las infecciones de orina en niños y que muestra un 56% de resistencia a amoxicilina en nuestro medio (datos facilitados por el laboratorio de microbiología de referencia del centro de salud, correspondientes al año 2019).
Además, existen otros beneficios, ya que pautas más cortas de antibioterapia han demostrado menos complicaciones, mayor adherencia al tratamiento y menor coste económico8.
Buscando detectar si existen diferencias en cuanto a reinfecciones, aparición de otras infecciones de posible origen estreptocócico o efectos secundarios medicamentosos en relación con pautas cortas o largas de antibioterapia en la FAS, se planteó esta investigación
Material y métodosDiseño del estudioSe trata de un estudio retrospectivo observacional descriptivo y analítico a partir de la revisión de historias de pacientes diagnosticados de FAS en 2 cupos de pediatría del Centro de Salud José Ramón Muñoz Fernández de Zaragoza (España), entre junio de 2016 y abril de 2020.
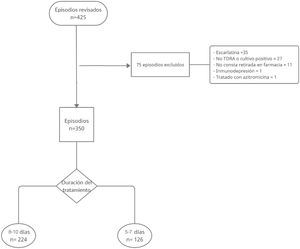
Se seleccionó a aquellos pacientes diagnosticados de FAS mediante test de detección rápida de antígeno estreptocócico o cultivo faríngeo. Los criterios de exclusión fueron: pacientes diagnosticados de FAS sin prueba diagnóstica, pacientes en los que no constara en el programa de receta electrónica la retirada en farmacia del antibiótico pautado, pacientes afectos de escarlatina y pacientes con inmunodepresión por enfermedad o medicamentosa. Se excluyeron 75 episodios (n=75), por lo que el tamaño muestral final fue de 350 (n=350) (fig. 1).
Este proyecto cuenta con la aprobación del Comité de Ética de la Investigación de Aragón (CEICA; PI20/519; fecha 02/12/2020), al cumplir los requisitos establecidos. Los datos fueron recogidos en una base de datos y anonimizados. Al tratarse de un estudio retrospectivo y contar con los permisos necesarios, no fue necesaria la solicitud del consentimiento informado.
Recogida de datosSobre esta muestra se realizó una revisión a partir de la historia clínica electrónica para Atención Primaria y de la historia electrónica global individual del Servicio Aragonés de Salud. Se registraron: datos epidemiológicos (sexo, edad y fecha del diagnóstico) y los tratamientos pautados (antibiótico, días de tratamiento y, si precisó cambio de tratamiento, el 2.° antibiótico pautado). Como resultados derivados del tratamiento se recabaron: la aparición de FAS o escarlatina en los 3 meses siguientes al episodio, aparición de otras infecciones probablemente estreptocócicas (neumonías, otitis medias agudas, sinusitis, escarlatina, enfermedad perineal estreptocócica y artritis séptica) en los 3 meses siguientes, además del tipo de infección y las reacciones adversas medicamentosas registradas en la historia clínica.
Análisis estadísticoEn el estudio comparativo se calculó la odds ratio (OR) y la diferencia de medias (DM) con sus respectivos intervalos de confianza (IC) al 95%. Además, para valorar si existieron o no diferencias significativas, y según cumplieran o no las condiciones de aplicación, se emplearon los test estadísticos de χ2 y t de Student mediante el paquete estadístico SPSS versión 25.0, estableciendo como nivel de significación p<0,05.
ResultadosLa muestra de este estudio incluye 350 episodios de FAS, que corresponden a 252 pacientes, ya que 98 pacientes (38%) presentaron más de un episodio de FAS en el tiempo analizado.
La muestra se dividió en 2 grupos según la duración del tratamiento que se prescribió. La duración media fue de 8,85 días (rango 5-10 días). Los miembros del denominado grupo 1 (largo) recibieron una propuesta de tratamiento durante 10-8 días y suponían el 64% de la muestra (n=224); el 36% restante (n=126) recibieron una propuesta de pauta antibiótica de 7-5 días y conformaron el grupo 2 (corto).
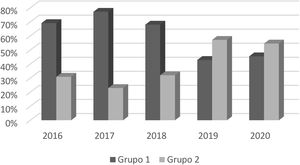
El estudio comprendió desde junio del año 2016 hasta abril del año 2020, siguiendo la distribución observada en la figura 2.
Respecto a las características demográficas (sexo y edad), no se observaron diferencias significativas (tabla 1).
Características demográficas y antibioterapia
| Grupo 1 | Grupo 2 | p | ||||
|---|---|---|---|---|---|---|
| n | %/ x̄± DE | n | %/ x̄±DE | |||
| Sexo | Femenino | 117 | 52 | 58 | 46 | 0,265 |
| Masculino | 107 | 48 | 68 | 54 | ||
| Edad | 7,26±2,7 | 7,22±2,8 | 0,9 | |||
| Antibioterapia | Amoxicilina | 178 | 79 | 98 | 78 | 0,26 |
| Penicilina | 35 | 16 | 27 | 21 | 0,08 | |
| Otros | 11 | 5 | 1 | 0,8 | 0,055 | |
Grupo 1: pauta convencional (10-8 días); grupo 2: pauta corta (7-5 días).
Otros antibióticos: josamicina, clindamicina, cefadroxilo y cefuroxima.
La distribución estacional, sin diferenciar entre pauta de tratamiento recibida, fue: 40% de los episodios (n=139) sucedieron en primavera, 9% (n=32) en verano, 27% (n=96) en otoño y 24% (n=83) en invierno. Cabe destacar que se observaron diferencias significativas en la incidencia en primavera (p=0,02) e invierno (p=0,006) entre ambos grupos.
El antibiótico más prescrito en ambos grupos fue la amoxicilina, seguida de la penicilina. Otros antibióticos, entre los que se incluyen josamicina, clindamicina, cefadroxilo y cefuroxima, fueron minoritarios (tabla 1). En el antibiótico prescrito no se observaron diferencias significativas entre ambos grupos. En el 2% (n=5) de los pacientes del grupo 1 se cambió a un 2.° antibiótico; esto no sucedió en ningún caso en el grupo corto.
Respecto a los resultados derivados del tratamiento (tabla 2), el 9,8% (n=22) del grupo 1 frente al 9,5% (n=12) del grupo 2 presentaron una FAS o escarlatina con confirmación microbiológica en los 3 meses posteriores (OR: 0,97; IC 95%: 0,46-2,03). Se estudió separadamente a aquellos pacientes que habían desarrollado escarlatina y tampoco se observaron diferencias significativas (OR: 0,7; IC 95%: 0,14-3,4). En lo relativo a otras infecciones de posible origen estreptocócico, tampoco se observaron diferencias estadísticamente significativas: 4% (n=9) en el grupo 1 y 2,4% en el grupo 2 (n=3) (OR: 0,58; IC 95%: 0,15-2,19). En el grupo 2 la única infección descrita fue la otitis media aguda; en el grupo 1 se describieron: otitis media aguda (n=6), sinusitis (n=1), neumonía (n=1) y adenitis (n=1). Por último, se analizaron los resultados independientemente del tipo de infección (FAS, escarlatina u otras), sin apreciarse diferencias significativas: 13,4% del grupo 1 (n=30) frente al 11,1% del grupo 2 (n=14), (OR: 0,81; IC 95%: 0,41-1,59).
Resultados derivados del tratamiento
| Grupo 1 | Grupo 2 | OR (IC95%) | |||
|---|---|---|---|---|---|
| n | % | n | % | ||
| FAS/escarlatina | 22 | 9,8 | 12 | 9,5 | 0,97 (0,46 a 2,03) |
| Otras infecciones de posible origen estreptocócico | 9 | 4 | 3 | 2,4 | 0,58 (0,15 a 2,19) |
| Infecciones (FAS/escarlatina/otras) | 30 | 13,4 | 14 | 11,1 | 0,81 (0,41 a 1,59) |
| RAM | 6 | 2,7 | 1 | 0,9 | 0,29 (0,04 a 2,44) |
FAS: faringoamigdalitis aguda estreptocócica; grupo 1: pauta convencional (10-8 días); grupo 2: pauta corta (7-5 días); RAM: reacciones adversas medicamentosas.
Para finalizar, se analizó la aparición de posibles reacciones adversas medicamentosas registradas en la historia clínica, que presentaron el 2,7% (n=6) del grupo 1 frente al 0,8% (n=1) del grupo 2. Las RAM descritas fueron: exantemas (n=4) y alteraciones gastrointestinales (n=3) (OR: 0,29; IC 95%: 0,04-2,44). Cabe destacar que se observaron estas reacciones adversas en los 2 pacientes tratados con clindamicina.
DiscusiónLas características demográficas (edad y sexo) de nuestra serie fueron similares a las descritas en la bibliografía. Respecto a la estacionalidad, las diferencias observadas en la incidencia en primavera e invierno pueden deberse a que la mayoría de los pacientes incluidos en el grupo 2 (pauta corta) fueron diagnosticados a partir de la primavera de 2018, lo que incluye el periodo de tiempo del confinamiento por SARS-CoV-2 (marzo y abril de 2020), cuando se observó una reducción de todas las infecciones respiratorias.
Los antibióticos más prescritos en nuestra muestra son amoxicilina y penicilina, conforme a las recomendaciones de las más recientes guías internacionales7,9. La pauta elegida en la mayoría de los episodios fue de 10 días, según la recomendación clásica; a partir de 2018 (lo que supone aproximadamente la mitad del tiempo de estudio) y coincidiendo con la publicación de la guía NICE7, se comenzaron a prescribir pautas más cortas en el centro de salud.
Existen pocos estudios que comparen la efectividad y seguridad de pautas cortas y largas en el tratamiento de la FAS desde que la pauta larga se instauró en 1958.
En nuestro estudio, en lo relativo a aparición de reacciones adversas medicamentosas o reinfecciones de posible origen estreptocócico en los 3 meses posteriores al diagnóstico, no hemos observado diferencias significativas entre ambas pautas. Sin embargo, en todas las variables analizadas la proporción fue mayor en el grupo 1.
En 2018, Oliveira publicó un estudio sobre efectividad con pauta corta realizado en un servicio de urgencias de pediatría. Obtuvo resultados similares a los nuestros, ya que no se observaron diferencias significativas en la aparición de complicaciones3. Skoog desarrolló un ensayo clínico aleatorizado en el que constató que el 66% de su muestra prefería la pauta de 5 días; también analizó la efectividad y seguridad, en las que también se observaron resultados similares a los nuestros4.
En la mayoría de los estudios que comparan ambas pautas, el objetivo principal es la erradicación microbiológica. En estos sí se observa una superioridad de la pauta de 10 días. Por ejemplo, en el mismo ensayo de Skoog, se observó que la erradicación fue menor con la pauta corta (80,4 vs. 90,7%). También Falagas realizó un metaánalisis en el que también constató una menor erradicación (OR: 0,49; IC 95%: 0,32-0,74) y también mayor fracaso clínico de esta pauta (OR: 0,49; IC 95%: 0,25-0,96), aunque este estudio no es únicamente pediátrico y las pautas comparadas no son homogéneas6.
En 1997, Gunnarson analizó la presencia de S. pyogenes en niños sanos y observó una prevalencia entre un 2% y un 20% según la edad10. Posteriormente se han desarrollado más estudios en diversas partes del mundo con prevalencias similares11,12. Pese a que la erradicación microbiológica es el objetivo principal en la mayoría de las publicaciones que comparan las 2pautas, no existen estudios que analicen la función de estos portadores y su infectividad.
El objetivo de la pauta de 10 días es, principalmente, evitar las complicaciones supurativas y la fiebre reumática. También la resolución del cuadro y la mejoría clínica, aunque esto último ya se ha visto que no requiere una pauta larga, ya que estos pacientes suelen mejorar en las primeras 24-48 h del tratamiento.
En nuestra experiencia clínica, las complicaciones supurativas en la mayoría de las ocasiones, si se instauran, lo hacen desde el diagnóstico o en los días siguientes, por lo que una pauta de 10 días no aporta más beneficios en ese sentido13. Respecto a infecciones supurativas posteriores, en nuestro estudio no se han observado diferencias significativas entre las 2pautas.
Evitar la fiebre reumática fue una de las razones que dieron soporte a la pauta de 10 días, basado en estudios de mediados del siglo xx14. En la actualidad, en Europa esta enfermedad está prácticamente desaparecida: solo se presentan casos esporádicos en la población inmigrante15. Tras los estudios iniciales, no existe ningún estudio que compare la pauta antibiótica corta y la larga en el tratamiento de la FAS que tenga como variable principal la aparición de fiebre reumática aguda. En la mayoría se asume la relación entre la erradicación microbiológica y la no aparición de esta fiebre. En 2013 Noonan, en un análisis de 151 casos de fiebre reumática aguda en Australia, solo el 33% la habían presentado de forma previa16. Por lo que se propone que el pilar principal en la prevención de dicha fiebre reumática no debería ser solo el tratamiento antibiótico de la FAS.
Desde mediados del siglo xx el uso de antibióticos se ha extendido en el mundo. Al mismo tiempo que se ha convertido en una de las herramientas vitales en la medicina, ha creado el que es y será uno de los problemas principales en la salud: las resistencias bacterianas a los antibióticos. Por ello, se ha comenzado a replantear las indicaciones, las dosis y la duración de los tratamientos17. El Plan Nacional para Disminuir la Selección y Diseminación de las Resistencias Antibióticas incluye como una de sus líneas estratégicas la actualización de la posología de aquellos tratamientos que están desactualizados18. Otras guías internacionales también recomiendan la duración efectiva más corta posible, lo que minimizaría la exposición del patógeno y del resto de la microbiota a dicho antibiótico y reduciría la selección de cepas resistentes7,9,19.
Además de minimizar la exposición, las pautas más cortas tienen otros beneficios añadidos como: menor aparición de reacciones adversas medicamentosas, una mayor adherencia al tratamiento5,20 y un menor coste económico.
Teniendo en cuenta lo expuesto, las guías más recientes han comenzado a introducir la recomendación de pautas de 5-7 días, excepto en población considerada de riesgo o en situaciones en las que la erradicación sea una prioridad5,7,9.
Como limitaciones de nuestro estudio, además de las inherentes a un estudio retrospectivo a partir de registros clínicos, destaca el hecho de que se recoge la duración propuesta del tratamiento, pero no se pudo asegurar la administración de la antibioterapia ni los días exactos de la duración. Intentando disminuir este sesgo de información, solamente se incluyó a los pacientes en los que estaba registrada la compra de la medicación.
Dada la necesidad de la disminución de las tasas de resistencia bacteriana, consideramos que este tipo de estudios, cuyo objetivo es optimizar la prescripción antibiótica, son necesarios. Ensayos clínicos que exploren la duración precisa del tratamiento con betalactámicos en la FAS pediátrica deberían aportar bases sólidas definitivas a una necesaria reducción de la duración del tratamiento. Queda pendiente también una valoración precisa de las repercusiones del estado de portador en la infectividad, tanto en el paciente colonizado como en su entorno.
FinanciaciónLa investigación no ha recibido ninguna financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Ana Belén Salinas Bastarras, estadístico.