Introducción
El síndrome de Turner se define como el conjunto de rasgos fenotípicos que resulta de una anomalía cualitativa o cuantitativa de un cromosoma X. Incluye, entre otros, hipogonadismo por disgenesia gonadal, estatura baja y otros trastornos del desarrollo esquelético que hacen de este síndrome una auténtica displasia ósea.
El proceso de mineralización es paralelo al de crecimiento, siendo durante los primeros años de la vida y durante el desarrollo puberal cuando se produce una mayor aposición mineral del esqueleto1,2, lo cual sugiere que los esteroides sexuales representan un factor importante en la adquisición del pico de masa ósea (PMO).
Los datos existentes en la literatura médica acerca de la masa ósea en niñas con síndrome de Turner, aunque sugieren que ésta se encuentra disminuida, son en ocasiones contradictorios. En general se ha observado una disminución de la masa ósea tanto evaluada mediante la cortical y el diámetro de los metacarpianos3-5 como por absorciometría monofotónica que ha constatado una disminución del contenido mineral óseo del 25,4 % en relación a los controles de la misma edad, sexo y talla6, o del 21 %7 en el tercio medio del radio. Por absorciometría bifotónica se ha comunicado una disminución de la densidad mineral ósea (DMO) en la columna lumbar del 16-34 %8,9. Sin embargo, la pérdida de contenido mineral óseo es menor si se compara con controles de la misma edad ósea7 o de la misma talla9. Por el contrario, otros autores, comparando los resultados con niñas sanas de talla similar, no confirmaron estos hallazgos, y encontraron una longitud mayor del segundo metacarpiano, un diámetro mayor y una cortical más engrosada10.
Dado que el síndrome de Turner es un trastorno que afecta a distintos órganos y sistemas, su tratamiento debe ser multidisciplinar. La oxandrolona fue en el pasado el tratamiento más utilizado para mejorar la baja talla y sus efectos androgénicos han sido minimizados al reducir la dosis inicial de 0,1 a 0,05 mg/kg/día. En la actualidad se ha relegado a un segundo plano al demostrarse la eficacia de la hormona de crecimiento (GH). La dosis que se debe utilizar debería ser de 0,05-0,0625 mg/kg/día y se recomienda su uso a partir de los 9 años de edad cuando se compruebe una atenuación de la respuesta a la GH. La GH de origen recombinante es el tratamiento fundamental para mejorar la baja talla; en la actualidad se aconseja una dosis ajustada a 0,33 mg/kg/semana, y fraccionada en siete inyecciones semanales. El tratamiento con estrógenos (E2) persigue inducir la aparición de caracteres sexuales secundarios. Existen diferentes pautas de estrogenización, bien con etinilestradiol, parches de 17, β -estradiol o E2 conjugados equinos.
Distintos autores han observado que el tratamiento con GH en niñas con síndrome de Turner incrementa la masa ósea8,11,12 aunque esto no ocurre en todos los casos11. La osteopenia persiste en la edad adulta, con disminución del PMO13 a pesar del prolongado tratamiento con E26,13,14. El fallo del tratamiento con E2 o GH en normalizar totalmente la masa ósea, sugiere que estas hormonas no son las únicas causantes de la osteopenia, ya que todo ello se produce en el contexto de una posible alteración intrínseca del órgano diana que determinaría una cierta insensibilidad a los factores de crecimiento locales y asociado a una alteración cromosómica con los efectos que una aneuploidía puede causar en el crecimiento y diferenciación celular.
Los objetivos de este trabajo son determinar el estado de la masa ósea espontánea evaluada mediante la media de la cortical y el diámetro metacarpianos y evaluar el efecto del tratamiento con oxandrolona, GH y E2 en combinación con los anteriores.
Pacientes y métodos
Se evaluaron 42 niñas con síndrome de Turner, diagnosticadas por estudio citogenético. Las fórmulas cromosómicas fueron: 16 monosomías (45X); 10 mosaicos (46XX/45X); 7 isocromosomas 46Xi(Xq); 1 deleción (46XXp-), y por último, fórmulas complejas: 1 mosaico 45X/47XXX, 2 mosaicos 45X/46Xi(Xq), 1 mosaico 45X/46XXq-, 1 translocación inactiva 45X/46Xt(X3), 1 mosaico 45X/46XY 45X/46Xi(Xq), 1 mosaico 45X/46XX y 1 mosaico 46Xi(Xq) 45X/47XXX.
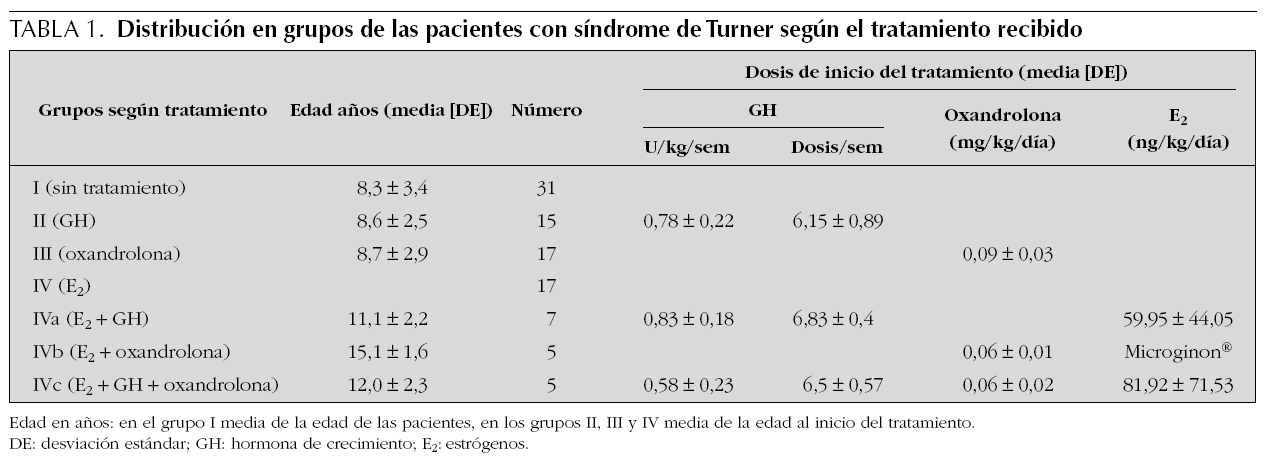
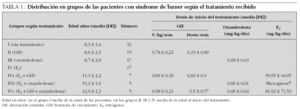
Las pacientes se distribuyeron en los siguientes grupos (tabla 1):
Grupo I
Se incluyeron 31 pacientes que no habían recibido previamente tratamiento con objeto de evaluar la evolución transversal espontánea de la masa ósea. Edad (media ± DE): 8,3 ± 3,4 años (límites: 3-15 años).
Grupo II
Quince pacientes tratadas con GH. Edad de inicio del tratamiento (media ± DE): 8,6 ± 2,5 años (límites: 5,2-14,8 años). Siete niñas habían recibido previamente tratamiento con oxandrolona. El punto cero es el momento en el que se inicia el tratamiento con GH. La dosis media suministrada al inicio del tratamiento fue de 0,78 ± 0,22 U/ kg/semana, con una media de 6,15 ± 0,89 dosis semanales (n = 14). La dosis media de GH del primer año, segundo, tercero y cuarto, respectivamente, 0,77 ± 0,21 U/kg/semana (n = 15); 0,7 ± 0,15 U/kg/semana (n = 11); 0,73 ± 0,16 U/ kg/semana (n = 10); 0,76 ± 0,18 U/kg/semana (n = 9). La dosis de GH se fraccionó en 6-7 inyecciones semanales.
Grupo III
Diecisiete pacientes tratadas con oxandrolona. Edad de inicio del tratamiento (media ± DE): 8,7 ± 2,9 años (límites: 5,3-15,2 años). La dosis inicial (punto cero) fue de 0,09 ± 0,03 mg/kg/día (n = 15). Las dosis medias del primer, segundo y tercer año fueron respectivamente, 0,07 ± 0,03 mg/kg/día (n = 17); 0,07 ± 0,03 mg/kg/día (n = 11); 0,07 ± 0,02 mg/kg/día (n = 6).
Grupo IV
Diecisiete pacientes tratadas con E2. Excepto dos de ellas, el resto estaban recibiendo diversos tratamientos a los que se añadieron los E2. El punto cero corresponde al momento en que se instaura la terapia estrogénica. En función de los tratamientos comentados, el grupo se dividió en los siguientes subgrupos:
Grupo IVa. Siete pacientes tratadas con E2 y GH. Edad de inicio del tratamiento (media ± DE): 11,1 ± 2,2 años (límites: 6,1 y 12,9 años). De las 7 niñas, dos no habían recibido ningún tratamiento previamente, tres habían sido tratadas con GH y dos con oxandrolona. La dosis media suministrada al inicio del tratamiento fue de GH 0,83 ± 0,18 U/kg/semana, con una media de 6,83 ± 0,4 dosis semanales y de etinil estradiol 59,95 ± 44,05 ng/kg/día (n = 7). En el primer año la dosis media de GH fue de GH 0,83 ± 0,10 U/kg/semana y de etinil estradiol fue de 54,73 ± 39,75 ng/kg/día (n = 6). En el segundo año la dosis media de GH fue de 0,68 ± 0,17 U/kg/semana y de etinil estradiol 31,6 ± 16,40 ng/kg/día; en este punto una de las niñas, no incluida en la media, recibía Microgynon® 1 comprimido 21 días al mes (1 comprimido = 0,03 mg de etinil estradiol) (n = 4).
Grupo IVb. Cinco niñas tratadas con E2 y oxandrolona. Edad de inicio del tratamiento (media ± DE): 15,1 ± 1,6 años (límites: 13,4-17,4 años). Las 5 niñas habían sido tratadas anteriormente con oxandrolona. La dosis media de oxandrolona (mg/kg/día) fue de 0,06 ± 0,01 en el punto cero (n = 5), 0,06 ± 0,02 el primer año (n = 5), 0,08 el segundo año (n = 1) y 0,08 el tercer año (n = 1). En este grupo la estrogenización fue siempre con Microgynon®1 comprimido al día durante 21 días al mes.
Grupo IVc. Cinco niñas tratadas con E2, oxandrolona y GH. Edad de inicio del tratamiento (media ± DE): 12,0 ± 2,3 años (límites: 10,3-16,1 años). De las 5 niñas, una había sido tratada anteriormente con GH, una con oxandrolona y tres con GH y oxandrolona. En el punto cero las dosis fueron de GH 0,58 ± 0,23 U/kg/semana, con una media de 6,5 ± 0,57 dosis semanales; oxandrolona 0,06 ± 0,02 mg/kg/día; y de etinil estradiol 81,92 ± 71,53 ng/kg/día (n = 5). A lo largo del período de estudio, las dosis medias fueron las siguientes: en el primer año GH 0,61 ± 0,22 U/kg/s, administrada en 7 dosis a la semana; oxandrolona 0,05 ± 0,02 mg/kg/día; y etinil estradiol 66 ± 33,41 ng/kg/día (n = 4). En el segundo año GH 0,56 ± 0,12 U/kg/s, administrada en 7 dosis; oxandrolona: 0,05 ± 0,01 mg/kg/día; y etinil estradiol: 65,84 ± 71,4 ng/ kg/día (n = 4). En el tercer año: GH 0,59 ± 0,08 U/kg/s, administrada en 7 dosis a la semana; oxandrolona 0,04 ± 0,00 mg/kg/día y Microgynon® 1 comprimido 21 días al mes (n = 2).
La masa ósea se evaluó midiendo la cortical y el diámetro metacarpianos según el método seguido por Bonnard15 consistente en la medición con una lupa de 8 aumentos reglada en décimas de milímetro (dmm) (Flubache and Co, Hargen, Suiza), del diámetro y cortical de los metacarpianos segundo, tercero y cuarto de la mano izquierda, en la zona más estrecha del hueso. El resultado es la suma de los tres diámetros para el diámetro óseo y de las seis corticales para el espesor cortical. Los resultados se expresan en desviación estándar (DE) con arreglo a los valores de referencia del Centro Andrea Prader de Zaragoza16,17 desde los 0,5 a 9 años de edad y a los estándares de Zurich1,15 a partir de los 10 años. Se han estudiado un total de 247 radiografías, las mismas que sirvieron para la valoración de la edad ósea.
Para la estadística descriptiva se utilizó una hoja de cálculo Excel 5,0. y para la estadística inferencial se realizaron el cálculo de la ecuación de regresión (hoja de cálculo Excel 5,0 y programa de estadística SOLO) y el contraste de medias con la t de Student (hoja de cálculo Excel 5,0 y programa de estadística Rsigma) con un nivel de significación de p < 0,05.
Resultados
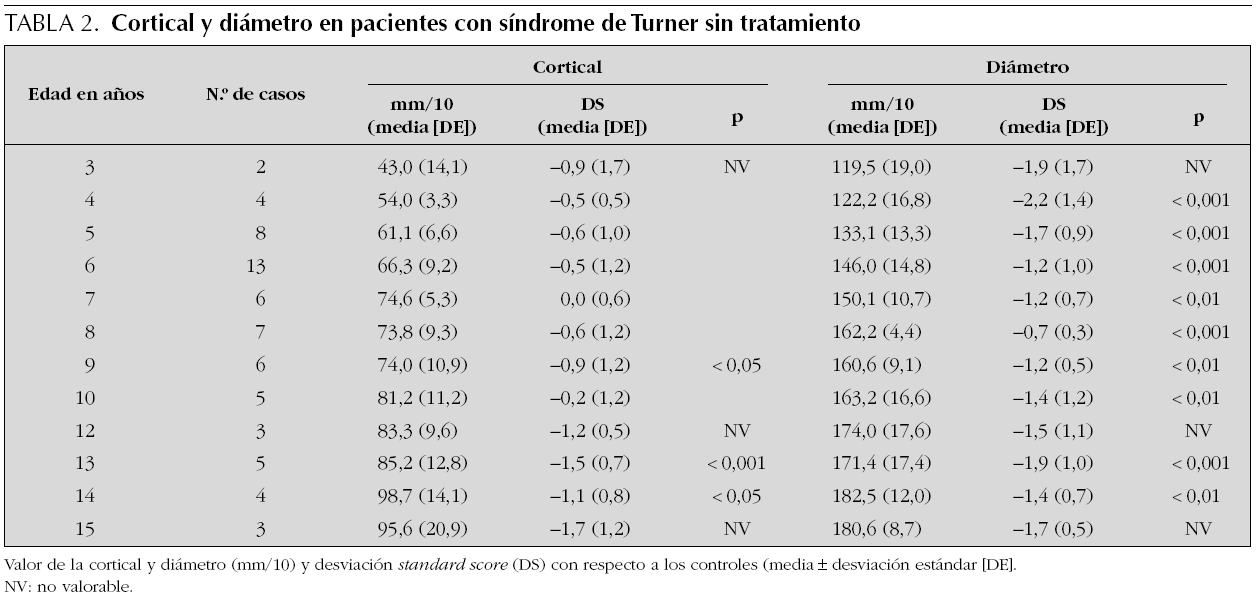
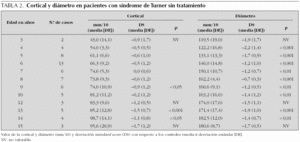
Grupo I. Evolución espontánea (tabla 2)
Cortical. En relación a los controles el valor de la cortical evoluciona por debajo de la media, entre 0,0 DS a los 7 años y 1,7 DS a los 15 años y está disminuida significativamente a los 9, 13 y 14 años. La ecuación de regresión (CTSDS = 0,4708-0,0204 * [TTTO-7]2; R2 = 0,707; T = 4,913; p = 0,0006) indica que la cortical se centra a los 7 años de edad, es decir, aumenta entre los 3 y 7 años y disminuye posteriormente. Sin embargo, a partir de los 10 años la evolución parece aleatoria, con tendencia a disminuir, ya que una recta de regresión lineal del tipo CTSDS = A-B * TTTO, también es significativa (R2 = 0,443; p = 0,018), por lo que es probable un decrecimiento lineal a lo largo de los años.
Diámetro. En relación a los controles, el valor del diámetro oscila entre 0,7 DS a los 8 años y 2,2 DS a los 4 años, estando disminuido durante todo el período de observación, aunque a los 3, 12 y 15 años el tamaño de la muestra no permite una valoración estadística. La ecuación de regresión (DMSDS = 1,691 + 0,0159 * TTTO; R2 = 0,024; T = 0,499; p = 0,628) sugiere que parece producirse una tendencia, aunque no significativa, a la recuperación entre los 4 y los 8 años.
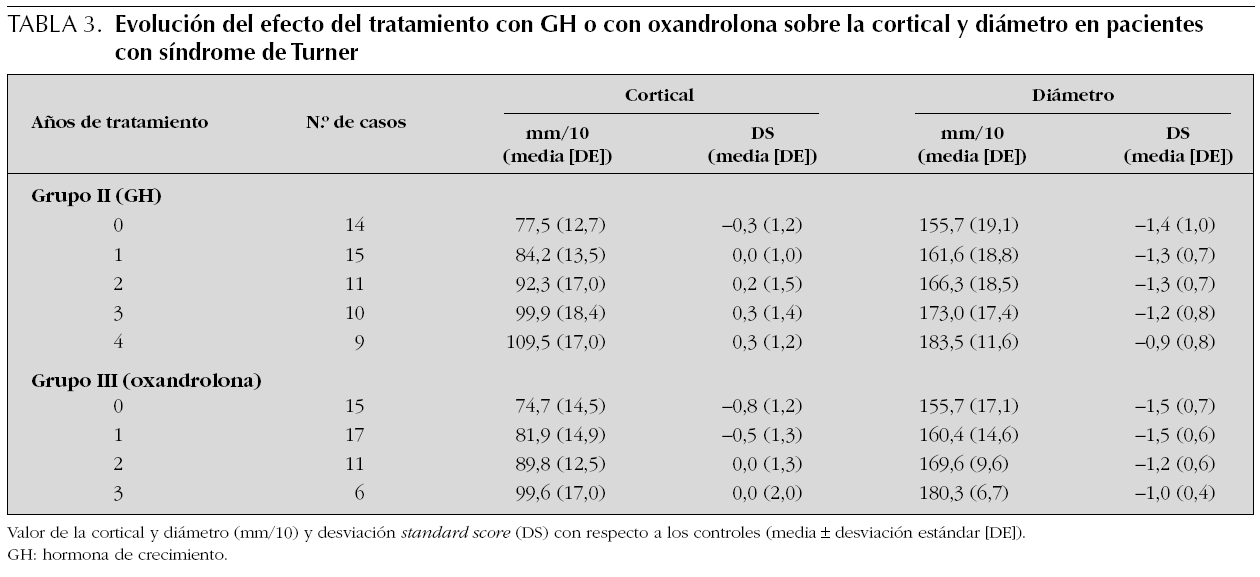
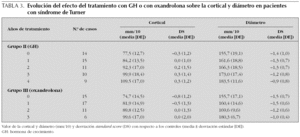
Grupo II. Impacto del tratamiento con hormona de crecimiento (tabla 3)
Cortical. Parte de una media de 0,3 DS antes de iniciarse el tratamiento con GH y se incrementa a 0,3 DS a los 3 y 4 años de tratamiento, sin apreciarse diferencias estadísticamente significativas entre los tiempos. La ecuación de regresión (CTSDS = 0,095 + 0,156 * LOGARITMO [TTTO]; R2 = 0,959; T = 8,394; p = 0,0035) indica que la cortical aumenta bruscamente en el primer año de tratamiento y a continuación se estabiliza.
Diámetro. Se incrementa 0,5 DS desde el inicio del tratamiento (1,4 DS) hasta los 4 años de tratamiento (0,9 DS) y no se encuentran diferencias estadísticas significativas entre el valor obtenido antes del tratamiento y el valor correspondiente a los 1, 2, 3 y 4 años de tratamiento. La ecuación de regresión indica que el diámetro crece de forma lineal (DMSDS = 1,485 + 0,099 * TTTO; R2 = 0,8601; T = 4,295; p = 0,023).
Grupo III. Impacto del tratamiento con oxandrolona (tabla 3)
Cortical. Parte de 0,8 DS antes del tratamiento, se incrementa a 0,0 DS a los 2 y 3 años de tratamiento. No se encuentran diferencias significativas entre los diferentes tiempos. La ecuación de regresión (CTSDS = 0,0304-0,317 * [TTTO-2]; R2 = 0,572; T = 2,0043; p = 0,137) muestra que la cortical aumenta hasta el segundo y tercer año de tratamiento, aunque esta estructura no es significativa.
Diámetro. Se incrementa desde 1,5 DS antes del tratamiento a 1,0 DS a los 3 años de tratamiento. No se encuentran diferencias significativas entre el valor obtenido antes del tratamiento y años sucesivos. La ecuación de regresión (DMSDS = 1,612 + 0,168 * TTTO R2 = 0,918; T = 5,82; p = 0,0101) indica que el diámetro aumenta de forma lineal.
Aplicando la prueba de Newman-Kelus al comparar el valor de la cortical (DS) de los grupos I, II y III, la cortical del grupo II se encontraba significativamente más elevada que la del grupo I y III (p < 0,01 y p < 0,05, respectivamente). Entre el grupo I y III no se detectaron diferencias significativas. En el diámetro no se apreciaron diferencias significativas.
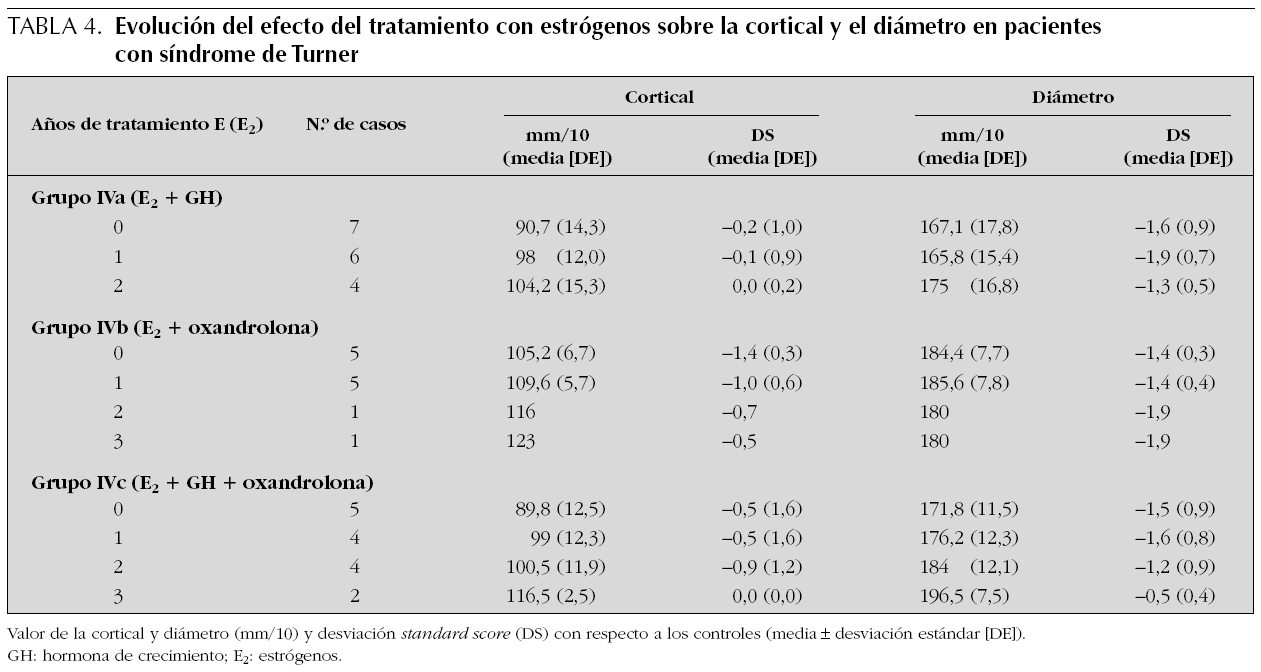
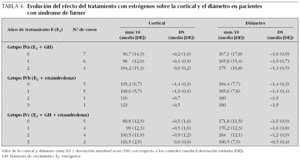
Grupo IV. Impacto del tratamiento con E2 (tabla 4)
Grupo IVa. E2 + GH: la cortical pasa de 0,2 DS antes del tratamiento a 0,0 DS tras 2 años de tratamiento con E2 y el diámetro de 1,6 a 1,3 DS.
Grupo IVb. E2 + oxandrolona: 5 pacientes han recibido E2 durante un año y sólo una paciente durante 2 y 3 años. En los 5 pacientes la cortical evolucionó de 1,4 a 1,0 DS y el diámetro no se modificó (1,4 DS) al terminar el tratamiento.
Grupo IVc. E2 + GH + oxandrolona: la cortical se incrementó 0,5 DS (de 0,5 a 0,0 DS) y el diámetro 1 DS (de 1,5 a 0,5 DS) a los 3 años de tratamiento con E2.
Discusión
Son varios los métodos que pueden usarse para cuantificar la mineralización del esqueleto. La radiogrametría o morfometría metacarpiana es una técnica utilizada para cuantificar la masa ósea cortical; dentro de ella la radiología digital computarizada toma las medidas de forma automática directamente sobre una radiografía de la mano izquierda. La absorciometría monofotónica se aplica en el esqueleto periférico, fundamentalmente en huesos de predominio cortical como la diáfisis intermedia del radio. La absorciometría por energía de rayos X simple es un método similar al anterior excepto que la radiación surge de un tubo de rayos X y la absorciometría bifotónica es un método adecuado para medir el esqueleto central. La absorciometría de rayos X de doble energía (DXA o DEXA) es un método similar pero la radiación surge de un tubo de rayos X; puede medir el contenido mineral óseo en la columna vertebral, fémur, radio, talón y en general en todo el cuerpo.
De todos los métodos descritos, el más desarrollado últimamente es la DXA aplicada con mayor frecuencia en columna lumbar, trocánter mayor y cuello femoral, localizaciones que representan entre el 67 y el 40 % y entre el 20 y el 40 % según autores de hueso trabecular18,19 frente al 5 % en la zona media del radio y fémur20. Si bien el hueso trabecular representa una mayor superficie en relación al volumen óseo, y por ello presenta una mayor actividad metabólica no debemos olvidar que el hueso cortical representa el 80 % del peso del esqueleto y por lo tanto es interesante su evaluación en cualquier caso. Por otro lado, la radiogrametría se ha propuesto como método simple y seguro para detectar osteoporosis21, tan útil como la densitometría de columna22. La radiología digital computarizada tiene una buena correlación con la densitometría23 y las medidas morfométricas metacarpianas realizadas con lupa no difieren de las realizadas con radiología digital computarizada24. Todos estos datos orientan hacia la utilidad de los métodos radiogramétricos en el diagnóstico de osteoporosis.
El método seguido por Bonnard es un método sencillo, económico y sin efectos secundarios, ya que se aplica a la radiografía de la mano y evalúa fundamentalmente hueso cortical, estudio que puede ser complementario al realizado por otros métodos. En el síndrome de Turner parece que está afectado tanto el hueso cortical como el hueso trabecular, y se detecta un descenso de la masa ósea en los metacarpianos3,18, en la zona media del radio6, tercio distal del radio7 y en la columna lumbar8,9, se ha informado que en adolescentes con síndrome de Turner se produce un desequilibrio entre la reabsorción y la aposición endostal3, hecho que hace imprescindible la valoración del espesor cortical durante esta época. En este sentido el método seguido en este trabajo al valorar preferentemente la cortical es un método útil y sobre todo al considerar la experiencia de nuestro grupo en su manejo.
En relación con la evolución espontánea de la masa ósea evaluada mediante la media de la cortical y el diámetro de los metacarpianos, los resultados de nuestro estudio transversal (grupo I de evolución espontánea) (tabla 2) señalan que en las niñas con síndrome de Turner la cortical está por debajo de la media con respecto a los controles (entre 0,0 DS a los 7 años y 1,7 DS a los 15 años de edad), que es significativamente menor a los 9, 13 y 14 años, y que tiene una tendencia decreciente a partir de los 7 años. El diámetro de los metacarpianos también evoluciona por debajo de la media (entre 0,7 DS a los 8 años y 2,2 DS a los 4 años) y es significativamente inferior al de los controles en todas las edades en las que el tamaño de la muestra ha permitido cálculos estadísticos (4 a 10 años y 13, 14 años). Estos datos sugieren la existencia de osteopenia en las niñas con síndrome de Turner, observándose, además, una disminución adicional de la cortical a partir de los 9-12 años de edad.
Los resultados obtenidos están en consonancia con los observados por otros autores que señalan la existencia de osteopenia en el síndrome de Turner ya desde la niñez, o al menos a partir de los 14 años de edad. Barr et al4 detectaron una disminución adicional del espesor de la cortical en las niñas con síndrome de Turner mayores de 11 años. Park et al5 hallaron una disminución del diámetro con respecto a los controles en todas las edades (1 a 25 años) y una cortical menor a partir de los 13 años. Collell y Pavía25 observaron que los valores de la cortical en las niñas con síndrome de Turner se encontraba entre 0,7 y 2,7 DS a los 18 años.
La disminución de la cortical a partir de los 9-12 años observada en el presente estudio pudiera deberse a la falta de incremento de aposición endostal que ocurre normalmente con la llegada de la adolescencia3 lo cual indica un papel importante de los E2 en la adquisición del pico de masa ósea durante la pubertad, entre los 10 y 14 años en las mujeres normales2. Dhuper et al26 han señalado que las niñas sanas con concentraciones de E2 más bajos durante la pubertad tienen una masa ósea menor en hueso cortical y trabecular. Carrascosa et al27 detectan que la densidad mineral ósea en L2-L4 en niñas con síndrome de Turner en pubertad espontánea se encuentra en el rango de lo normal, mientras que las pacientes con pubertad inducida presentan osteopenia, lo cual sugiere que se requiere una función gonadal normal desde la infancia para adquirir un PMO adecuado. De todo esto se deduce que una alteración en el proceso puberal como ocurre en el síndrome de Turner puede tener un efecto negativo sobre la masa ósea. La influencia de los E2 se ha comprobado al constatarse osteopenia en mujeres con hipogonadismo, mujeres posmenopáusicas28, en atletas amenorreicas29 y en el fallo prematuro ovárico30. Por otra parte, el tratamiento con E2 en mujeres posmenopáusicas previene el descenso de la masa ósea y disminuye la incidencia de fracturas31.
La interacción entre E2 y GH y factor de crecimiento insulinoide (IGF-I) puede ser también importante en la adquisición y mantenimiento de la masa ósea. En condiciones normales, durante la pubertad el incremento de los esteroides sexuales produce un aumento de la secreción de GH e IGF-I. En el Síndrome de Turner se considera que la secreción de GH es similar a la de la población prepuberal normal pero existen datos contradictorios en la adolescencia. Mientras unos autores han comunicado una disminución del valor medio de GH de 24 h, de la amplitud y el número de pulsos entre los 9 y 20 años de edad32, otros no han encontrado cambio en la secreción de GH con la edad33. Con respecto al IGF-I, Cuttler et al34 observaron descenso de sus concentraciones a partir de los 10 años sin presentar el incremento fisiológico de la adolescencia35. También se ha constatado que la administración de etinil estradiol incrementa los valores de GH e IGF-I y disminuye cuando se interrumpe el tratamiento32,34,35.
Es posible también que en las mujeres, los andrógenos ováricos y suprarrenales tengan un papel en la adquisición y el mantenimiento de la masa ósea. En el presente trabajo la adrenarquia pudiera ser la causa del incremento observado de la cortical y el diámetro entre los 7 y 8 años de edad. Fisiológicamente la androstendiona ovárica y la deshidroepiandrosterona suprarrenal disminuyen con la edad36 pudiendo estar relacionada con la masa ósea. Se ha observado que los valores de androstendiona están más descendidos en mujeres posmenopáusicas con osteoporosis que en las no osteoporóticas37. Las niñas con síndrome de Turner menores de 10 años no padecen alteraciones en la secreción de andrógenos, pero a partir de esa edad no experimentan incremento en su secreción, siendo a los 13 años los valores de deshidroepiandrosterona entre el 20 y el 30 % más bajos que en las niñas normales y los de testosterona y androstendiona el 50 y 60 %, respectivamente15. El origen de la osteopenia en el síndrome de Turner parece ser de naturaleza multifactorial, ambos factores endórgano y hormonales se ven condicionados por la presencia de una anomalía génica en el cromosoma X.
Con respecto al posible impacto del tratamiento con GH en las pacientes con síndrome de Turner incluidas en nuestro estudio (grupo II) (tabla 3), los resultados obtenidos sugieren un efecto positivo del tratamiento sobre la cortical. Durante el primer año la cortical se incrementa bruscamente y más tarde se estabiliza y según la ecuación de regresión esta evolución es significativa. El incremento obtenido al cuarto año es de 0,6 DS con respecto al momento de iniciar el tratamiento, aunque el contraste de medias no es estadísticamente significativo. A ello habrá que añadir que la GH ha evitado el descenso experimentado de forma espontánea en las pacientes del grupo I en las que a una edad similar su cortical estaba situada en 1,5 DS y en niñas tratadas al cuarto año estaban en 0,3 DS. Un fenómeno similar se ha observado con el diámetro; en los 4 años de tratamiento se produce un incremento de 0,5 DS, quedándose en 0,9 DS, mientras que las niñas del grupo I a similar edad estaban en 1,9 DS. Si el tratamiento con GH puede compensar el déficit de E2 en el hipogonadismo, no es un hecho bien conocido. En experimentación animal, en situación de hipogonadismo farmacológico, el tratamiento con GH preservó la masa ósea38. En niñas adolescentes con síndrome de Turner que han recibido GH, la masa ósea estaba normalizada y al añadir E2 se incrementó12.
Una limitación de nuestro estudio para evaluar el impacto de las diversas terapias en la masa ósea ha sido que algunas de las pacientes con síndrome de Turner habían sido tratadas previamente con otros fármacos. En el grupo que nos ocupa 7 de las 15 niñas tratadas con GH habían recibido tratamiento previo con oxandrolona durante un período de 1 o 2 años, sin que pueda descartarse a priori un efecto a largo plazo de la oxandrolona. En un intento de esclarecer esta cuestión, el contraste de medias entre la cortical de las 7 niñas tratadas previamente con oxandrolona y de las 10 niñas no tratadas previamente, da un resultado no significativo en todos los años (0, 1, 2, 3 y 4 años) siendo las medias, respectivamente de 0,4; 0,1; 0,0; 0,1; 0,5 DS y 0,3; 0,2; 0,4; 0,4; 0,2 DS. Tampoco se han encontrado diferencias en el diámetro de los metacarpianos.
En las niñas con síndrome de Turner tratadas con oxandrolona (grupo III) (tabla 3) la cortical se incrementa durante los primeros 2 años pasando de 0,8 DS antes del tratamiento a 0,0 DS a los 2 y 3 años de tratamiento. El diámetro de los metacarpianos pasa de 1,5 DS a 1,0 DS al tercer año. Estos resultados sugieren un efecto positivo de la oxandrolona sobre la masa ósea durante los primeros 3 años de tratamiento.
No ha sido posible evaluar el impacto del tratamiento con E2 en monoterapia en la masa ósea, debido a que solamente 2 de las 17 niñas con síndrome de Turner (grupo IV) (tabla 4) habían recibido sólo E2. En los subgrupos a, b y c, es decir, en las niñas que además de E2 habían recibido GH, oxandrolona o ambas el escaso número de pacientes impide extraer conclusiones respecto a la efectividad que los E2, solos o en combinación con GH u oxandrolona, ejercen sobre la masa ósea en el síndrome de Turner. Diversos autores4,6,12,25,39-41 han descrito un efecto positivo del tratamiento con E2 sobre la recuperación de la masa ósea, aunque este efecto no se observa en todos los casos9,42, atribuyéndolo al corto período de administración o al inicio del tratamiento en la adolescencia, respectivamente. Pacientes adultas con síndrome de Turner presentan osteopenia a pesar del tratamiento prolongado con E26,13,14, indicando que el déficit de E2 no es el único causante de la osteopenia. El momento de inicio de la terapia con E2 y la dosis a suministrar para normalizar el PMO es controvertido. Mientras que unos autores sugieren el inicio ya en plena adolescencia, debido a que las adolescentes que habían sido tratadas con GH no presentaban osteopenia12, para otros debería iniciarse en la niñez39 ya que las niñas que tomaron E2 antes de los 12 años, tenían una mayor DMO que las tratadas posteriormente, si bien no se evaluaron antes de iniciar el tratamiento para saber si las diferencias ya se encontraban presentes. La tendencia actual es disminuir la dosis y retrasar el inicio del tratamiento, para evitar el efecto negativo que los E2 ocasionarían sobre el crecimiento, siendo que la GH que se les suministra durante la niñez puede actuar como preventivo de la osteopenia. El tratamiento con GH incrementa la aposición ósea en niñas con síndrome de Turner, el tratamiento con E2 si bien se ha mostrado efectivo, presenta más controversia.