La malaria es considerada la cuarta causa de mortalidad infantil después de la neumonía, las complicaciones por parto prematuro y la asfixia perinatal.
Material y métodosEstudio retrospectivo y descriptivo de los casos de paludismo confirmados y tratados en la Unidad de Enfermedades Infecciosas Pediátricas (edad inferior a 15 años) del Hospital La Fe (Valencia) en el período comprendido entre 1993 y 2015.
ResultadosDurante el período 1993-2015 se diagnosticaron 54 casos de malaria infantil, el 51,8% en varones. El 46,2% eran menores de 5 años. La mayoría de los niños procedían de Guinea Ecuatorial (68,5%). Solo en el 5,6% de los pacientes se pudo constatar que recibieran profilaxis antimalárica. Se evidenció que Plasmodium falciparum fue la especie causal del 81,4% de los episodios. Siete casos (13%) presentaron malaria complicada. El tratamiento más empleado fue la quinina, sola o en combinación con otros fármacos: atovacuona-proguanil fue empleada a partir del año 2010 y estuvo indicada en el 20,3% de los pacientes. A partir del año 2013 se inició la utilización de: artesunato, piperaquina y dihidroartemisina. No hubo mortalidad ni efectos adversos relevantes, siendo la respuesta clínica favorable en el 100% de los niños.
ConclusionesLa malaria sigue siendo una enfermedad vigente en nuestra población, consecuencia de la inmigración y del turismo a países endémicos. Debe ser considerada como diagnóstico probable ante un niño febril que procede o ha viajado a un área endémica en el último año.
Malaria is considered to be the fourth leading cause of infant mortality after pneumonia, complications related to premature birth, and perinatal asphyxia.
Material and methodsA retrospective and descriptive study of cases of malaria confirmed and treated by the Paediatric Infectious Diseases Unit (age lower than 15 years) at the La Fe Hospital, Valencia, over the period 1993 to 2015.
ResultsA total of 54 cases of paediatric malaria were diagnosed in the period 1993-2015, with 51.8% of these occurring in males, and 46.2% of patients were aged below 5 years. The majority of children came from Equatorial Guinea (68.5%). Only 5.6% had received antimalarial prophylaxis. Plasmodium falciparum was found to be the causal species in 81.4% of cases. Seven patients (13%) presented with complicated malaria. The most widely used treatment was quinine, either alone or in combination with other drugs. Atovaquone/proguanil was used from 2010 onwards and was indicated in 20.3% of the patients. The combination of artesunate/piperaquine/dihydroartemisinin began to be used in 2013. No deaths or relevant side effects were reported, and the clinical response was favourable in all children (100%).
ConclusionsMalaria is still a prevalent disease in this population, a consequence of immigration, and tourism to endemic countries. Malaria should be considered as a likely diagnosis in a febrile child who comes from, or has travelled to, an endemic region in the past year.
El paludismo es la enfermedad parasitaria de mayor incidencia y mortalidad en el mundo, está causada por protozoos del género Plasmodium y se transmite por la picadura de mosquitos hembra del género Anopheles. Se conocen unas 175 especies de Plasmodium, de las cuales 5 afectan frecuentemente a los seres humanos: P. falciparum, P. vivax, P. ovale, P. malariae y P. knowlesi. Es endémica en 104 países de regiones tropicales y subtropicales de todo el mundo, aunque el número de casos se concentra especialmente en Sudamérica, América Central (República Dominicana, Haití), África y Asia (India, Sudeste Asiático y Oriente Medio).
En 2015 se diagnosticaron 214 millones de casos nuevos en todo el mundo y se produjeron un total de 438.000 muertes (el 78% de las mismas en niños menores de 5 años, según datos de la Organización Mundial de la Salud). El 92% de las muertes ocurrieron en África, seguida de Asia sudoriental (6%) y Mediterráneo oriental (2%). Sin embargo, el 80-90% de los casos y fallecimientos se producen en el África Subsahariana (fundamentalmente Guinea Ecuatorial) y el Sudeste Asiático (sobre todo India) debido a las condiciones higiénico-sanitarias y a la asistencia médica deficitaria de estos países. En este mismo año el número estimado de muertes causadas por la malaria en niños menores de 5 años fue de 303.000 (rango 165.000-450.000). Se considera la cuarta causa de mortalidad infantil después de la neumonía, las complicaciones por parto prematuro y la asfixia perinatal.
En 1964, España fue declarada libre de malaria por la Organización Mundial de la Salud; desde entonces, se notifican entre 400 y 600 casos anuales, la gran mayoría de ellos importados. El aumento de la inmigración y de los viajes internacionales a países donde la malaria es endémica condicionará un aumento en el número de casos anuales en los próximos años1-5.
En el presente estudio se han revisado todos los casos de paludismo en edad pediátrica diagnosticados en el Hospital Universitario y Politécnico (HUP) La Fe (hospital de referencia de la Comunidad Valenciana) en los últimos 22 años (1993-2015) con el objetivo de estudiar las características clínico-epidemiológicas, así como aspectos específicos de las pruebas diagnósticas y los diversos tratamientos utilizados en esta enfermedad.
MétodosSe realizó un estudio con diseño observacional, descriptivo y retrospectivo de los casos de malaria infantil atendidos en el Servicio de Infectología Pediátrica del HUP La Fe (Valencia). Entre los criterios de inclusión se encontraban: la edad de los participantes (un mes-15 años), el período de estudio (1993-2015) y el diagnóstico de la enfermedad, basado en la positividad microbiológica junto con una clínica compatible. Cabe destacar que todos los casos fueron pacientes ingresados en el servicio. Se excluyeron los pacientes con diagnóstico de malaria pero ingresados en otros servicios por ser otra su enfermedad predominante.
El diagnóstico microbiológico se realizó mediante los siguientes métodos: detección de antígenos de Plasmodium por inmunocromatografía (OnSite Malaria Pf/Pan Ag Rapid Test [Blood Specimen], de Biotech, Inc.), visión microscópica de sangre periférica teñida con tinción de Giemsa (frotis fino) con cálculo del índice de parasitación y mediante técnicas de amplificación de ácidos nucleicos, que se basaron en una PCR in house, con amplificación del ADN en un primer paso y posterior visualización de las bandas amplificadas mediante electroforesis en gel de agarosa.
En cada caso se registraron variables demográficas (edad, sexo y país de origen); clínicas (duración de la fiebre hasta el momento del diagnóstico, otros síntomas y signos destacados en la exploración física); hallazgos relevantes en las pruebas complementarias; profilaxis previa recibida; especie de Plasmodium identificada e índice de parasitación. Asimismo, se evaluaron los tratamientos utilizados, la respuesta clínica y los efectos adversos. La revisión de las historias clínicas se realizó utilizando los programas informáticos del HUP, siendo todos los casos estudiados de forma anónima.
ResultadosEl HUP La Fe es el centro de referencia de la Comunidad Valenciana. Cuenta con una población asignada de 280.754 habitantes, de los cuales 40.804 son niños, con una disponibilidad de 146 camas funcionales en el área pediátrica.
Durante el período 1993-2015 se diagnosticaron 54 casos de malaria infantil, con una media de 2 ingresos por año. En el período 1993-1996 solo se registraron 2 casos de malaria. Por otra parte, 2003, 2010 y 2013 fueron los años en los que se evidenció un mayor número de ingresos por año (8, 4 y 5 casos, respectivamente).
El 46,29% (25 casos) fueron menores de 5 años de edad y solo un 18,5% (10 casos) tuvieron más de 10 años. La edad media fue de 6 años, con una desviación estándar (DE) de 3,77. El 51,85% (28 casos) fueron varones.
La mayoría de los pacientes procedían de Guinea Ecuatorial (68,5%) y España (25,9%); minoritariamente su lugar de origen fue Ghana, Gambia y Senegal (con un 1,85% en cada caso).
El 46,3% de los pacientes refería episodios previos de paludismo. En el 5,6% de los pacientes se pudo constatar que recibieron profilaxis antimalárica y en todos ellos se cumplió la pauta completa: cloroquina o mefloquina 2 semanas antes del viaje a zona endémica, durante el viaje y 4 semanas tras el regreso.
Respecto a las comorbilidades, se encontró que un 9,3% refería antecedente de fiebre tifoidea y un 5,6% drepanocitosis. Además, se documentó un caso con antecedente de hepatitis B, otro con cáncer y una niña que fue sometida a ablación genital.
No hubo diferencias en relación con la frecuencia de episodios clínicos posteriores en comparación con los que no recibieron profilaxis o no tenían comorbilidades.
Desde el punto de vista clínico, el síntoma principal fue la fiebre (temperatura registrada en el Servicio de Urgencias del HUP), evidenciada en 52 pacientes (96%). La duración de la fiebre fue variable. Cuando se estudió el tiempo de evolución de la enfermedad, se encontró que los hallazgos más representativos fueron: un 36% presentó un día de fiebre, un 19% presentó 3 días de clínica febril y en el 9% la fiebre duró más de 9 días.
Otras manifestaciones clínicas, en orden de frecuencia, fueron: vómitos (35%), diarrea (31%), cefalea (29%), dolor abdominal (24%) y, en un menor porcentaje, clínica respiratoria y escalofríos. En la exploración física se encontraron los siguientes signos: hepatomegalia (59%) y esplenomegalia (51%). Otros hallazgos menos frecuentes fueron soplo sistólico y palidez.
En las pruebas complementarias, la alteración más frecuente fue la anemia (64,8%), definida como una hemoglobina<11g/dl. La media de hemoglobina en la población de estudio fue de 10g/dl (DE 1,76). Por otra parte, se halló trombocitopenia (<150.000 plaquetas/mm3) en 9 niños (17%). La leucopenia (<5.000 leucocitos/mm3) fue una alteración poco frecuente, detectándose solo en 3 de los pacientes estudiados (5,6%).
Desde el punto de vista bioquímico, el parámetro más importante fue la elevación de los reactantes de fase aguda: proteína C reactiva (37%), con una media de 5mg/dl (DE 5,17), y velocidad de sedimentación globular (27,7%), cuya media fue de 39mm/h (DE 28,7). Otras alteraciones registradas fueron: aumento de la lactato deshidrogenasa (14,8%), con una media de 245UI/l (DE 381), y de la bilirrubina indirecta (5,6%), con una media de 1,4mg/dl (DE 0,9).
En el diagnóstico etiológico se evidenció que P. falciparum fue la especie causal del 81,4% de los episodios, seguida por P. vivax (7,4%) y por P. malariae (1,85%). En 5 episodios (9,3%) se identificó más de una especie de Plasmodium: P. falciparum y P. vivax (4 casos) y P. falciparum y P. ovale (un caso).
El grado de parasitemia objetivado fue variable: 12 casos (22%) cursaron con parasitemias bajas (<1% de hematíes parasitados o<20.000 trofozoítos/l), otro 22% con parasitemias moderadas (1-5% o 20-50.000 trofozoítos/l) y un 13% con parasitemias elevadas (>5% o>50.000 trofozoítos/l). Este último grupo (7 casos) cumplió alguno de los criterios de malaria complicada (tabla 1). No fue posible la recogida de estos datos en 22 pacientes (41%). Ninguno de los pacientes requirió ingreso en la Unidad de Cuidados Intensivos.
Criterios de gravedad en malaria infantil
| Convulsiones de repetición (>2 episodios al día) |
| Distrés respiratorio |
| Hemorragia espontánea |
| Alteración del nivel de conciencia (coma) |
| Hiperparasitemia: >5% en no inmunes y>20% en semiinmunes |
| Anemia severa: Hb<5 g/dl, Hto<15% |
| Hipoglucemia: <40mg/dl |
| Acidosis: pH<7,35, bicarbonato<5mEq/l |
| Fallo renal: diuresis< 0,5 ml/kg/h, creatinina>1,5g/dl |
| Ictericia: bilirrubina sérica>3mg/dl |
| Shock y fallo multiorgánico |
| Hemoglobinuria |
Adaptada de Maitland K, Nadel S, Pollard AJ, et al. Management of severe malaria in children: proposed guidelines for the United Kingdom. BMJ. 2005;331:334-43.
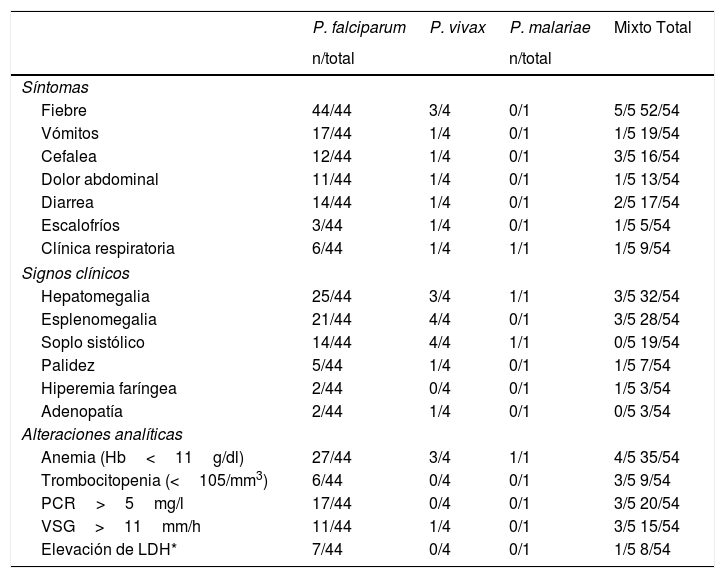
En la tabla 2 se resumen las manifestaciones clínicas, los hallazgos de la exploración física y los resultados analíticos, según el tipo de Plasmodium encontrado en el estudio.
Presentación del cuadro clínico y resultados de las pruebas complementarias según la especie de Plasmodium
| P. falciparum | P. vivax | P. malariae | Mixto Total | |
|---|---|---|---|---|
| n/total | n/total | |||
| Síntomas | ||||
| Fiebre | 44/44 | 3/4 | 0/1 | 5/5 52/54 |
| Vómitos | 17/44 | 1/4 | 0/1 | 1/5 19/54 |
| Cefalea | 12/44 | 1/4 | 0/1 | 3/5 16/54 |
| Dolor abdominal | 11/44 | 1/4 | 0/1 | 1/5 13/54 |
| Diarrea | 14/44 | 1/4 | 0/1 | 2/5 17/54 |
| Escalofríos | 3/44 | 1/4 | 0/1 | 1/5 5/54 |
| Clínica respiratoria | 6/44 | 1/4 | 1/1 | 1/5 9/54 |
| Signos clínicos | ||||
| Hepatomegalia | 25/44 | 3/4 | 1/1 | 3/5 32/54 |
| Esplenomegalia | 21/44 | 4/4 | 0/1 | 3/5 28/54 |
| Soplo sistólico | 14/44 | 4/4 | 1/1 | 0/5 19/54 |
| Palidez | 5/44 | 1/4 | 0/1 | 1/5 7/54 |
| Hiperemia faríngea | 2/44 | 0/4 | 0/1 | 1/5 3/54 |
| Adenopatía | 2/44 | 1/4 | 0/1 | 0/5 3/54 |
| Alteraciones analíticas | ||||
| Anemia (Hb<11g/dl) | 27/44 | 3/4 | 1/1 | 4/5 35/54 |
| Trombocitopenia (<105/mm3) | 6/44 | 0/4 | 0/1 | 3/5 9/54 |
| PCR>5mg/l | 17/44 | 0/4 | 0/1 | 3/5 20/54 |
| VSG>11mm/h | 11/44 | 1/4 | 0/1 | 3/5 15/54 |
| Elevación de LDH* | 7/44 | 0/4 | 0/1 | 1/5 8/54 |
Durante el ingreso hospitalario también se confirmaron otras infecciones parasitarias, destacando la presencia en heces de Trichuris trichiura (15%), Ascaris lumbricoides (15%), Giardia lamblia (7,5%) o Enterobius vermicularis (1,8%), respecto al total de pacientes. Otros hallazgos concomitantes y aislados fueron: impétigo por Streptococcus pyogenes, serología positiva para hepatitis B en el contexto de una hipertransaminasemia, una prueba de la tuberculina positiva y un caso con test de embarazo positivo en una paciente.
El tratamiento más empleado fue la quinina, sola o en combinación con otros fármacos: la asociación con clindamicina se utilizó en 16 casos (29,6%), en uno de ellos asociado a primaquina en el contexto de una parasitación concomitante por P. vivax. La asociación de pirimetamina-sulfadoxina se empleó en 7 pacientes (13%), en un caso junto con primaquina debido a la coexistencia de P. falciparum y P. vivax. Quinina con cloroquina fue el tratamiento utilizado en 6 niños (11,1%), en 3 de ellos se asoció primaquina por infección añadida (P. vivax). La asociación con doxiciclina tuvo lugar en 5 niños (9,3%), en uno de los cuales se empleó además primaquina (por dificultad técnica en conocer la especie de Plasmodium). Se utilizó quinina aislada en 4 pacientes (7,4%), asociándose a mebendazol en un caso por oxiuriasis en heces. La combinación de quinina, sulfadoxina y trimetoprima se utilizó en 3 casos (5,6%).
Atovacuona-proguanil fue empleada a partir del año 2010 y estuvo indicada en el 20,3% de los pacientes. En uno de ellos se empleó cefotaxima por infección bacteriana asociada; en otro se añadió quinina, y en un tercero se asoció primaquina por parasitación mixta de P. falciparum y P. ovale. A partir del año 2013 se inició la utilización de: artesunato, piperaquina y dihidroartemisina (2 casos: 3,7%).
La duración media del tratamiento fue de 8 días. Únicamente 2 pacientes requirieron tratamiento de segunda elección (3,7%). No hubo mortalidad ni efectos adversos relevantes, siendo la respuesta clínica favorable en el 100% de los pacientes.
DiscusiónEl paludismo es una de las enfermedades infecciosas más importantes por su morbimortalidad. Actualmente vivimos un aumento casi exponencial de la población inmigrante, de los niños procedentes de adopción internacional y de los viajeros a países tropicales y en vías de desarrollo. En tal sentido, creemos de interés describir los aspectos clínico-epidemiológicos de esta enfermedad, así como reflejar la evolución del enfoque diagnóstico y terapéutico a lo largo de estos años en Valencia ciudad, una de las poblaciones con más habitantes en España.
En esta revisión se describen las características de los niños ingresados en nuestro hospital (centro de referencia de la Comunidad Valenciana) con el diagnóstico de malaria en los últimos 22 años. Cerca de la mitad de los pacientes fueron menores de 5 años, dato relevante ya que, a nivel mundial, la malaria causa un 8% de todas las muertes en este grupo de edad. El país de procedencia más frecuente fue Guinea Ecuatorial (68,5%), como ocurre en gran parte de las series estudiadas4-7.
También debe destacarse que únicamente el 5,6% de los pacientes completaron la pauta profiláctica, lo cual es similar a otras investigaciones realizadas en nuestro país y en Europa. Este dato puede tener relación con la baja percepción de tener la enfermedad o haber tomado una medicación no adecuada para el país visitado4-9.
Asimismo, es muy importante insistir en la necesidad de completar la profilaxis adecuadamente, ya que es muy común abandonar el tratamiento cuando el paciente regresa a España.
En cuanto a los hallazgos clínicos, los síntomas iniciales fueron inespecíficos en la mayoría de los pacientes (cefalea, náuseas, vómitos, mialgias y dolor abdominal), lo que contribuye al retraso del diagnóstico con la correspondiente implicación pronóstica. Sin embargo, hasta el 96% de los pacientes presentó fiebre en el momento del diagnóstico, hallazgo similar a otros estudios europeos10, por lo que ante un paciente febril que haya viajado recientemente a un país endémico, en la sospecha diagnóstica siempre debe incluirse la malaria. Es importante tener en cuenta que en niños con déficits inmunitarios la ausencia de fiebre no descarta la enfermedad.
Los síntomas gastrointestinales fueron frecuentes y estaban asociados a todas las especies implicadas, a diferencia de lo observado en pacientes adultos. Los síntomas respiratorios se observaron con menos frecuencia y su incidencia fue similar en todas las especies de Plasmodium. Este hecho no debe pasar desapercibido, ya que en niños con malaria, la bronquitis y las complicaciones derivadas de esta son comunes, lo que dificulta en muchas ocasiones el diagnóstico correcto al confundirse con otras infecciones respiratorias11. La afectación pulmonar, el edema pulmonar y el distrés respiratorio agudo suelen ser más frecuentes en casos de malaria grave asociada a P. falciparum. El único niño parasitado por P. malariae presentó solo clínica respiratoria, sin fiebre ni otra sintomatología acompañante, probablemente debido a la característica parasitemia asintomática crónica observada en niños infectados por esta especie.
Por ello, dado que la malaria infantil cursa con sintomatología muy inespecífica y común a otras entidades infecciosas y no infecciosas, la sospecha diagnóstica de malaria debe ser considerada en todo niño con fiebre que proceda de áreas endémicas12.
La clínica clásica de crisis palúdica ayuda a realizar un diagnóstico oportuno (fiebre elevada, escalofríos, cefalea intensa), aunque no está presente en todos los casos y requiere de confirmación microbiológica. Otras manifestaciones que pueden encontrarse son: palidez de la piel y las mucosas, hepatomegalia y esplenomegalia.
En la exploración física, con independencia de la especie implicada, la hepatomegalia fue uno de los hallazgos más frecuentes (>50%), sobre todo en parasitaciones por P. falciparum, ya que esta especie forma protuberancias (knobs) en la superficie de los hematíes que facilitan su adhesión a los receptores endoteliales de los sinusoides hepáticos y produce obstrucción del flujo capilar debido al daño microvascular13,14. Otros mecanismos más inespecíficos relacionados con esta especie son: generación de radicales hidroxilo y colestasis secundaria a la alteración de la excreción biliar, que también explicarían la afectación hepática característica14,15.
Nuestros pacientes desarrollaron esplenomegalia en la mayoría de los episodios causados por P. falciparum, P. ovale y P. vivax. En las parasitaciones por P. vivax y P. ovale el hiperesplenismo se acompaña de un cuadro febril más leve, mientras que en el caso de P. falciparum los hallazgos clínicos incluyen fiebre elevada y hepatomegalia. Indistintamente de la especie implicada, la esplenomegalia se asocia a una respuesta inmune anómala con formación masiva de inmunocomplejos debido a una exagerada producción de IgM policlonal no específica por parte de los linfocitos B12,16.
En relación con los exámenes complementarios, los hallazgos más importantes fueron: anemia hemolítica, trombocitopenia, elevación de lactato deshidrogenasa y bilirrubina indirecta. La anemia, definida como una hemoglobina<11g/dl, fue el hallazgo analítico más frecuente, siendo en la mayoría de los casos de carácter hemolítico y asociada a anisocitosis y reticulocitosis. A diferencia de lo observado en adultos (donde la trombocitopenia es más común), la anemia es una de las complicaciones más frecuentes en niños con paludismo, sobre todo de uno a 3 años de edad, asociándose a una elevada mortalidad, al igual que sucede en las mujeres embarazadas. La anemia durante el curso de la infección es debida a la hemólisis extravascular causada por la activación esplénica y de macrófagos para fagocitar glóbulos rojos tanto infectados como sanos, ya que en estos últimos se producen cambios extrínsecos e intrínsecos que mejoran su reconocimiento y fagocitosis8,9,17.
En nuestros pacientes se observó solo trombocitopenia en los episodios causados por P. falciparum, tanto en las formas mixtas como en las únicas, a diferencia de lo observado en otros estudios, donde dicho hallazgo suele ser el dato más frecuentemente encontrado en el hemograma, tanto en edad pediátrica como adulta, apareciendo hasta en un 85% de los casos. La elevación de los reactantes de fase aguda fue común, destacando el aumento de la proteína C reactiva, la velocidad de sedimentación globular y la lactato deshidrogenasa, al igual que lo observado en otros estudios18,19.
Hasta este punto, se debe recordar que la malaria es una enfermedad producida por el parásito Plasmodium y que es transmitida por la picadura del mosquito Anopheles hembra. Se ha comunicado, además, transmisión vertical materno-fetal, por trasplante de órganos, transfusiones sanguíneas y pinchazo accidental. Tradicionalmente se han descrito 4 formas de Plasmodium que afectan al hombre: P. falciparum, P. vivax, P. ovale y P. malariae. Recientemente se ha descubierto que el P. knowlesi, originario de los primates, es capaz de infectar a humanos, especialmente en la zona de Malasia y Borneo.
En relación con las pruebas de laboratorio utilizadas para el diagnóstico parasitológico, en todos los pacientes se realizó la visión directa mediante tinción con Giemsa de sangre periférica, obteniendo un resultado positivo en el 100% de los casos. Esta prueba debería realizarse en todo paciente con sospecha de malaria para poder establecer un diagnóstico rápido, económico y con una elevada sensibilidad (92-98%) y especificidad (85-99%). Además, es posible diferenciar la especie de Plasmodium implicada, puesto que las alteraciones morfológicas que se producen en el glóbulo rojo son distintas según la especie. No obstante, esta técnica presenta limitaciones, ya que requiere personal cualificado y pueden infradiagnosticarse casos de baja parasitemia y de parasitemia mixta. En casi el 50% de los pacientes se realizó, además, la detección mediante inmunocromatografía del antígeno de Plasmodium, resultando positiva en el 100% de los casos.
La detección mediante técnicas de amplificación de ácidos nucleicos se realizó únicamente en 8 pacientes (15%) debido a que la técnica se implantó en la rutina del laboratorio a partir del 2011, resultando positiva también en todas las muestras estudiadas. La ventaja que ofrece la utilización de técnicas moleculares es que presenta mayor sensibilidad que las técnicas convencionales, resultando muy útil en aquellos casos de parasitemias bajas en los que la visión directa podría ser negativa. Ahora bien, en este contexto es importante tener en cuenta el sesgo de confirmación diagnóstica: los pacientes con mayor sospecha diagnóstica de enfermedad suelen ser en quienes con más frecuencia se usan las técnicas recomendadas y en consecuencia las pruebas positivas se ven sobrerrepresentadas, sobreestimando la sensibilidad de dicha prueba. Se deberían utilizar distintas técnicas para cada caso, con el fin de establecer el diagnóstico de forma más segura y así evitar los posibles sesgos20.
En nuestro estudio, se encontró que la especie predominante fue P. falciparum. Estos hallazgos reflejan la mayoritaria distribución de dicha especie en el continente africano, de donde procedían o habían viajado la mayoría de nuestros pacientes. En otras áreas, como Sudamérica, por ejemplo, adquiere relevancia P. vivax. El criterio de gravedad más frecuentemente encontrado fue la hiperparasitemia (>5% o>50.000 trofozoítos/l), concordante con lo hallado en otros estudios realizados en nuestro país4,5,21.
En relación con la terapéutica, es importante resaltar que según los últimos informes publicados por la Organización Mundial de la Salud en el año 2018 y según protocolos de actuación de reconocidas unidades de infectología en España, se considera que en pacientes con malaria no complicada, con buen estado general y buena tolerancia de la medicación, el tratamiento puede ser ambulatorio con control a las 12-24h. Asimismo, en las últimas recomendaciones de la Sociedad Española de Infectología no se indica el ingreso hospitalario obligatorio en estos pacientes, aunque se debe valorar la hospitalización en los casos con posibilidad de presentar complicaciones o mala tolerancia oral22-25.
A la hora de indicar la pauta de tratamiento, es fundamental conocer la especie de Plasmodium implicada y la zona de procedencia del niño para averiguar la resistencia a antipalúdicos y, de esta forma, obtener una respuesta terapéutica óptima. El objetivo primordial del tratamiento consiste en lograr la eliminación rápida y completa del parásito de la sangre del paciente para prevenir que el paludismo no complicado evolucione hacia enfermedad grave, muerte o infección crónica.
Los tratamientos combinados basados en la artemisinina son la piedra angular de las pautas recomendadas actualmente contra el paludismo por P. falciparum y, como no está previsto, a corto plazo, que se aprueben fármacos alternativos a los derivados de la artemisinina como mínimo durante unos años, es necesario preservar su eficacia, evitando la aparición de resistencias. Las infecciones por P. vivax deberían tratarse con cloroquina en zonas donde este medicamento mantenga su eficacia. Con el fin de reducir la transmisión de la infección, se añadirá al tratamiento antipalúdico una dosis baja y única de primaquina.
El fármaco más empleado en nuestro estudio fue la quinina junto con sulfadoxina-pirimetamina, dado que es retrospectivo y muchos de nuestros casos fueron tratados hace ya varios años, antes de la aparición de los antipalúdicos de elección actuales. La duración media del tratamiento fue de 8 días (similar a lo comunicado en la literatura médica). La respuesta clínica fue favorable en todos nuestros niños, siendo este hallazgo variable según la serie estudiada21,24-28.
Pese a todos los avances en el diagnóstico y el tratamiento de la malaria, no debemos olvidar la importancia de las medidas preventivas (quimioprofilaxis específica, uso de repelentes, campañas de control del vector y vacunas específicas aún en investigación), las cuales tienen un impacto muy importante sobre el control de esta enfermedad2,28.
ConclusionesEl paludismo sigue siendo una enfermedad vigente en nuestro medio, consecuencia de la inmigración y del turismo a países endémicos. Debe ser considerada siempre como diagnóstico probable ante un niño febril que procede o ha viajado a un área endémica en el último año. En general, existe una baja percepción del riesgo de padecer paludismo después de un viaje a las zonas endémicas, lo que se traduce en una baja cobertura profiláctica. Los pacientes que reciben un tratamiento específico y oportuno alcanzan tasas de curación elevadas, tal como se refleja en este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al Servicio de Pediatría y Admisión del Hospital La Fe, por todas las facilidades brindadas para la correcta recogida de datos en el presente trabajo. Agradecemos a Dra. M. Angeles Delás González, Profesora asociada UCH-CEU. Hospital Castellón. Comunidad Valenciana, por su colaboración en el presente trabajo.