Describir el patrón epidemiológico y clínico de la infección por Bordetella pertussis (tosferina) en niños menores de un año hospitalizados en un hospital pediátrico de Gran Canaria.
Pacientes y métodosSe revisaron retrospectivamente las historias clínicas de los pacientes con diagnóstico microbiológico de infección por B. pertussis mediante reacción en cadena de la polimerasa, de enero de 2008 a diciembre de 2016.
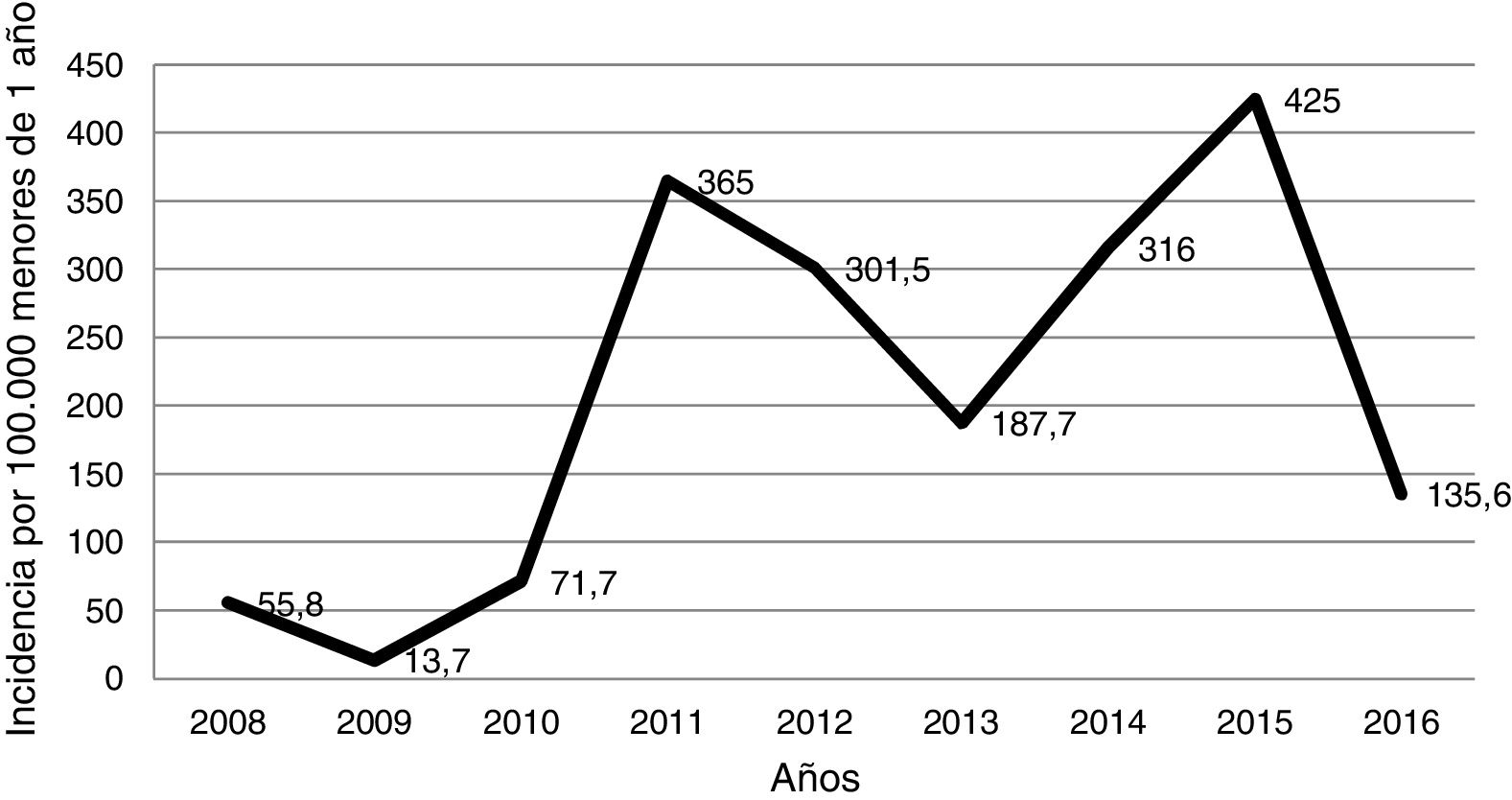
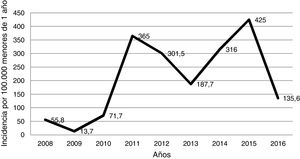
ResultadosSe identificaron 110 pacientes, de los cuales 105 (95,4%) fueron menores de 6 meses y el 59,1% eran varones. La incidencia anual de hospitalización se estimó entre 13,7 y 425,0 casos por cada 100.000 lactantes menores de 12 meses, con 2picos en 2011 y 2015. Los familiares cercanos fueron las principales fuentes de contagio potenciales. Las principales manifestaciones fueron la tos pertusoide asociada con signos catarrales, cianosis y linfocitosis. El 15,4% de los pacientes presentaron complicaciones (principalmente neumonía), pero la evolución fue favorable en todos los casos. La menor edad y la no vacunación se asociaron con un mayor riesgo de desarrollar complicaciones (p < 0,05). La coinfección viral ocurrió en el 31,6% de los pacientes diagnosticados de infección por B. pertussis.
ConclusionesLa incidencia de infección por B. pertussis ha aumentado en los últimos años en nuestra área, con un menor desarrollo de complicaciones y con tasas de mortalidad inferiores al período anterior. La menor edad y la no vacunación previa se consideran factores de riesgo para el desarrollo de complicaciones. La vacunación en mujeres embarazadas probablemente disminuirá la incidencia en el futuro, sobre todo en niños menores de 6 meses.
Describe the epidemiological and clinical pattern of Bordetella pertussis infection (whooping cough) among hospitalised infants less than one year-old in a paediatric hospital in Gran Canaria.
Patients and methodsA retrospective review of the patient hospital records was performed, and recording only those with a microbiological diagnosis of pertussis infection detected using polymerase chain reaction, from January 2008 to December 2016.
ResultsA total of 110 patients were identified, of which 105 (95.4%) were less than 6 months-old, and 59.1% were males. The annual incidence of hospital admissions was estimated between 13.7 to 425.0 cases per 100,000 infants <12 months old, with 2peaks in 2011 and 2015. Household members were the main potential sources of infection. Main clinical features were pertussis cough associated with signs of catarrh, cyanosis, and lymphocytosis. Complications occurred in 15.4% of the patients (mainly pneumonia), but the outcome was favourable in all the cases. A lower age and non-vaccination were associated with an increased risk of developing complications (P<.05). Viral co-infection occurred in 31.6% of infants diagnosed with pertussis.
ConclusionsThe incidence of pertussis has increased in the last years in Gran Canaria, with a lower development of complications and mortality rates compared with the previous period. Lower age and non-vaccination status are considered risk factors for developing complications. Vaccination in pregnant women will probably lead to a decline in the incidence in the future, especially in infants younger than 6 months.
La tosferina es una enfermedad infecciosa producida por Bordetella pertussis (B. pertussis) prevenible por vacunación. En los últimos años se ha documentado un aumento de incidencia en muchos países con amplias coberturas vacunales1,2. Las tasas de incidencia pueden variar como consecuencia de los diferentes sistemas de declaración epidemiológica y por el diferente acceso a las pruebas diagnósticas2-4, pero las mayores tasas se declaran siempre en menores de un año, grupo de edad en el que, además, se produce el mayor número de complicaciones y mortalidad. Canarias es una de las comunidades autónomas en donde se registran las tasas más elevadas de España5. En el período 2003-2007 realizamos un estudio, en el que observamos un alto porcentaje de complicaciones y mortalidad en este grupo de edad6. Por esto, desde el año 2015, en nuestra comunidad, se ha incorporado la vacunación a las mujeres embarazadas. Con el objetivo de conocer la evolución de la infección, hemos realizado un estudio clínico-epidemiológico de todos los casos diagnosticados en menores de un año que acudieron al Servicio de Urgencias del único hospital pediátrico público de la isla de Gran Canaria entre los años 2008 y 2016.
Pacientes y métodosPacientesSe incluyeron en el estudio los 1.040 pacientes menores de un año que acudieron al Servicio de Urgencias del hospital Materno Infantil de Gran Canaria (que cubre una población media de 6.770 menores de un año) con un cuadro clínico por el cual se solicitó descartar la infección por B. pertussis, de enero de 2008 a diciembre de 2016.
MétodosEn todos los pacientes se investigó la presencia de B. pertussis por reacción en cadena de la polimerasa (PCR) (LightMix Kit Bordetella pertussis/parapertussis o Diagenode Bordetella pertussis/parapertussis) en muestras de exudado nasofaríngeo obtenidas con escobillón flexible. En 581 pacientes (55,9%), además, se investigó la presencia de virus en muestras de lavado nasofaríngeo.
Se revisaron retrospectivamente las historias clínicas de los pacientes con un resultado positivo para B. pertussis, analizando las variables demográficas, antecedentes de vacunación, fuente probable de infección (persona con cuadro clínico compatible con tosferina en contacto con el niño), sintomatología, datos de laboratorio y tratamiento.
Para el análisis estadístico de los resultados se utilizó la prueba de Mann-Whitney para comparar variables cuantitativas y la de chi cuadrado para comparar proporciones. Se consideró significación estadística un valor de p < 0,05. El estudio fue aprobado por el Comité Local de Bioética e Investigación.
ResultadosEpidemiologíaEn 110 pacientes (10,6%) se detectó infección por B. pertussis. En otros 269 pacientes (25,7%) se detectó otro patógeno (en 175 virus respiratorio sincitial, en 33 rinovirus, en 32 parainfluenza 3, en 7 metapneumovirus, en 5 citomegalovirus, en 5 influenza A, en 4 influenza B, en 3 enterovirus, en 2parainfluenza 1, en 2parainfluenza 2 y en uno virus Coxsackie B).
De los 110 niños con infección por B. pertussis, 65 eran varones (59,1%), la edad media fue de 83,3 días (rango 14-287) y 105 (95,4%) eran menores de 6 meses. Once niños nacieron prematuros (10,0%).
En la figura 1 se muestra la incidencia anual de casos de tosferina por 100.000 niños menores de un año que acudieron al hospital. La tasa de incidencia anual osciló entre 13,7 casos en el año 2009 y 425,0 casos en el año 2015, con 2picos en los años 2011 y 2015. Desde el año 2010, el año con menor incidencia de casos fue 2016. Por estaciones, el 33,6% de los casos se produjeron en verano, el 29,1% en primavera, el 19,1% en invierno y el 18,2% en otoño.
Con relación al estado vacunal, 56 niños (50,9%) no habían iniciado el calendario de vacunación, 47 (42,7%) habían recibido una dosis, 5 (4,5%) 2dosis y 2(1,8%) 3dosis. Solo uno de los niños no estaba correctamente vacunado para su edad.
En 45 pacientes (40,9%) se documentó la posible fuente de infección, que fue en 44 casos (97,8%) la transmisión familiar y en un caso fue nosocomial.
Diecisiete niños con tosferina nacieron después de la incorporación de la vacunación en la gestante; de estos, en 5 (29,4%) la madre había recibido la vacuna en el tercer trimestre de embarazo (una en la semana 28, una en la semana 31 y en las otras 3 no consta la semana de gestación). La edad media de los 5 niños fue de 2,8 meses (rango 0-5).
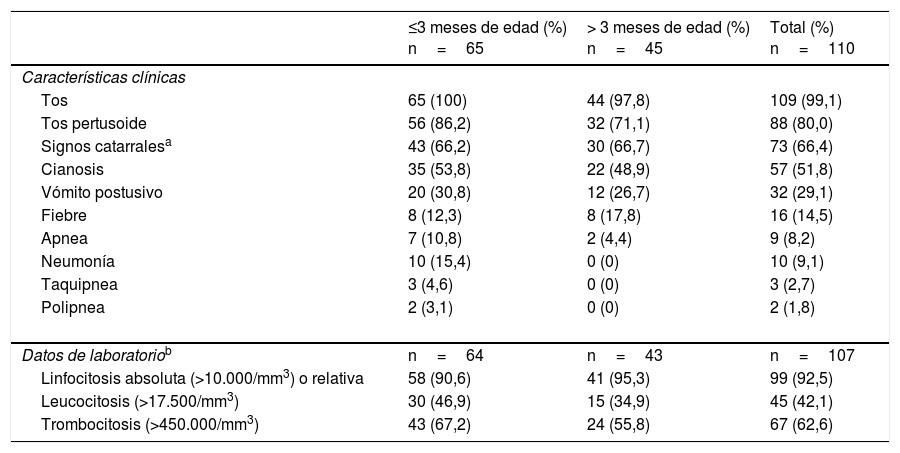
Manifestaciones clínicasEn la tabla 1 se recogen las características clínicas y las alteraciones analíticas de los 110 pacientes. El cuadro clínico típico se caracterizó por la presencia de tos pertusoide, con signos catarrales, cianosis y linfocitosis. La única diferencia con relación a las características clínicas entre los niños mayores y menores de 3 meses fue la neumonía, que se presentó solo en menores de 3 meses (p < 0,01). El tiempo medio desde el inicio de los síntomas hasta que acudieron al Servicio de Urgencias fue de 9,0 ± 5,9 días (rango: 1-28). Ingresaron 107 pacientes (97,3%), con un tiempo medio de ingreso de 10,7±7,3 días (rango: 0-45).
Manifestaciones clínicas y datos analíticos de los 110 pacientes con infección por B. pertussis
| ≤3 meses de edad (%) n=65 | > 3 meses de edad (%) n=45 | Total (%) n=110 | |
|---|---|---|---|
| Características clínicas | |||
| Tos | 65 (100) | 44 (97,8) | 109 (99,1) |
| Tos pertusoide | 56 (86,2) | 32 (71,1) | 88 (80,0) |
| Signos catarralesa | 43 (66,2) | 30 (66,7) | 73 (66,4) |
| Cianosis | 35 (53,8) | 22 (48,9) | 57 (51,8) |
| Vómito postusivo | 20 (30,8) | 12 (26,7) | 32 (29,1) |
| Fiebre | 8 (12,3) | 8 (17,8) | 16 (14,5) |
| Apnea | 7 (10,8) | 2 (4,4) | 9 (8,2) |
| Neumonía | 10 (15,4) | 0 (0) | 10 (9,1) |
| Taquipnea | 3 (4,6) | 0 (0) | 3 (2,7) |
| Polipnea | 2 (3,1) | 0 (0) | 2 (1,8) |
| Datos de laboratoriob | n=64 | n=43 | n=107 |
| Linfocitosis absoluta (>10.000/mm3) o relativa | 58 (90,6) | 41 (95,3) | 99 (92,5) |
| Leucocitosis (>17.500/mm3) | 30 (46,9) | 15 (34,9) | 45 (42,1) |
| Trombocitosis (>450.000/mm3) | 43 (67,2) | 24 (55,8) | 67 (62,6) |
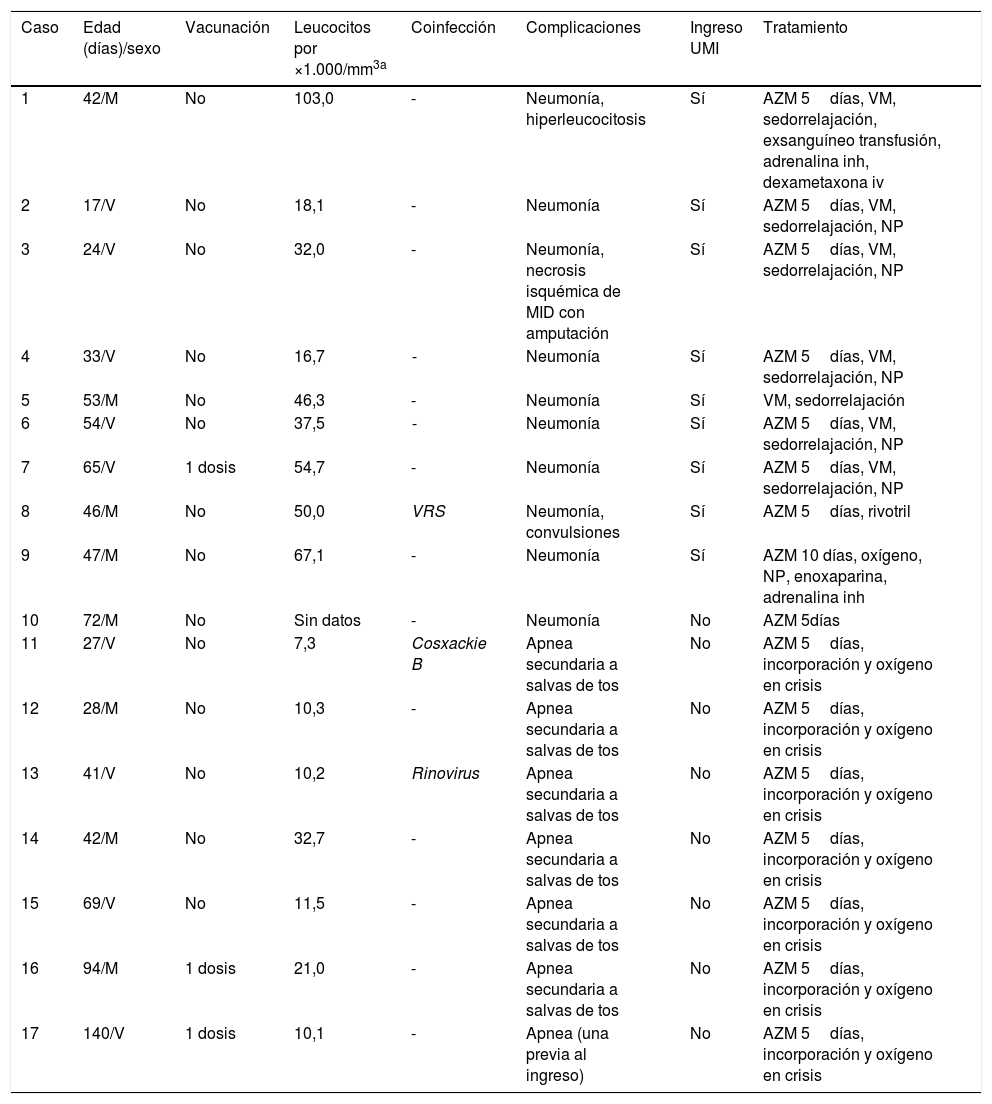
Presentaron complicaciones 17 pacientes (15,4%): 10 casos de neumonía y 7 de apnea. En la tabla 2 se muestran las características de los niños que presentaron complicaciones: el 82,3% de los niños no habían iniciado la vacunación y el resto solo habían recibido una dosis. Nueve niños con neumonía ingresaron en la Unidad de Cuidados Intensivos. Una niña de 42 días (caso 1) que ingresó en dicha unidad presentó inicialmente un recuento de leucocitos de 27.200/μl, pero a los 13 días del cuadro llegó a presentar una hiperleucocitosis (103.000 leucocitos/μl) por lo que se le practicó una exsanguineotransfusión de doble volemia. En la tabla 3 se muestran las diferencias entre los niños que presentaron complicaciones y los que no. En ella se observa que los niños que presentaron complicaciones tenían una edad menor y, en un alto porcentaje, no había iniciado el calendario vacunal.
Características de los pacientes que presentaron complicaciones
| Caso | Edad (días)/sexo | Vacunación | Leucocitos por ×1.000/mm3a | Coinfección | Complicaciones | Ingreso UMI | Tratamiento |
|---|---|---|---|---|---|---|---|
| 1 | 42/M | No | 103,0 | - | Neumonía, hiperleucocitosis | Sí | AZM 5días, VM, sedorrelajación, exsanguíneo transfusión, adrenalina inh, dexametaxona iv |
| 2 | 17/V | No | 18,1 | - | Neumonía | Sí | AZM 5días, VM, sedorrelajación, NP |
| 3 | 24/V | No | 32,0 | - | Neumonía, necrosis isquémica de MID con amputación | Sí | AZM 5días, VM, sedorrelajación, NP |
| 4 | 33/V | No | 16,7 | - | Neumonía | Sí | AZM 5días, VM, sedorrelajación, NP |
| 5 | 53/M | No | 46,3 | - | Neumonía | Sí | VM, sedorrelajación |
| 6 | 54/V | No | 37,5 | - | Neumonía | Sí | AZM 5días, VM, sedorrelajación, NP |
| 7 | 65/V | 1 dosis | 54,7 | - | Neumonía | Sí | AZM 5días, VM, sedorrelajación, NP |
| 8 | 46/M | No | 50,0 | VRS | Neumonía, convulsiones | Sí | AZM 5días, rivotril |
| 9 | 47/M | No | 67,1 | - | Neumonía | Sí | AZM 10 días, oxígeno, NP, enoxaparina, adrenalina inh |
| 10 | 72/M | No | Sin datos | - | Neumonía | No | AZM 5días |
| 11 | 27/V | No | 7,3 | Cosxackie B | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 12 | 28/M | No | 10,3 | - | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 13 | 41/V | No | 10,2 | Rinovirus | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 14 | 42/M | No | 32,7 | - | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 15 | 69/V | No | 11,5 | - | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 16 | 94/M | 1 dosis | 21,0 | - | Apnea secundaria a salvas de tos | No | AZM 5días, incorporación y oxígeno en crisis |
| 17 | 140/V | 1 dosis | 10,1 | - | Apnea (una previa al ingreso) | No | AZM 5días, incorporación y oxígeno en crisis |
AZM: azitromicina; inh: inhalada; iv: intravenosa; M: mujer; MID: miembro inferior derecho; NP: nutrición parenteral; V: varón; VM: ventilación mecánica; VRS: virus respiratorio sincitial.
Factores de riesgo en pacientes que desarrollaron complicaciones y en los que no
| Factor de riesgo | Niños con complicaciones (n=17) | Niños sin complicaciones (n=93) | p |
|---|---|---|---|
| Edad en días, media±DE | 52,6±29,9 | 88±53,7 | 0,003 |
| Prematuridad, n (%) | 2 (11,8) | 14 (15,1) | NS |
| Vacunación no iniciada, n (%) | 14 (82,3) | 42 (45,2) | 0,005 |
| Coinfección, n (%) | 3 (17,6) | 15 (16,1) | NS |
| Leucocitos/μl | 24.125±14.097,0 | 16.823,3±8.701,4 | NS |
NS: no significativo.
Todos los pacientes recibieron tratamiento desde el momento del ingreso con azitromicina (10mg/kg al día) durante 5 días (salvo uno que lo recibió 10 días) y la evolución fue buena.
Coinfecciones con otros patógenosEn 57 pacientes (51,8%) con infección por B. pertussis se investigó la presencia de virus y en 18 (31,6%) se detectó coinfección: 9 con rinovirus, 3parainfluenza 3, 2virus respiratorio sincitial, uno adenovirus, uno virus influenza C, uno citomegalovirus y uno con virus Coxsackie B.
DiscusiónA pesar de la amplia cobertura vacunal en la población pediátrica, la tosferina sigue siendo un problema de salud pública, por lo que, recientemente, se introdujo la vacunación en el embarazo en nuestra comunidad, con el objetivo de proteger a los lactantes más vulnerables7–9. La tosferina es una enfermedad que mantiene un patrón epidémico cíclico, aunque en España a partir de 2010 se está observando que la enfermedad se encuentra en una situación de epidemia sostenida5, hecho que se refleja en nuestro estudio. Esta situación coincide con la reemergencia de la tosferina observada tanto en EE. UU. como en otros países de Europa debido a causas que aún se desconocen, entre las que se postulan la pérdida de inmunidad por el paso del tiempo, los cambios genéticos en las cepas circulantes respecto a aquellas utilizadas para crear la vacuna y la falta de vacunación en determinados grupos de población9-13. En nuestra área, entre los años 2003 y 2010, la incidencia en menores de un año que requirieron hospitalización solo superó los 100 casos en los años 2003 y 2006, con incidencias de 103,9 y 204,5 casos, respectivamente6. Desde el año 2010 la incidencia anual de hospitalizaciones fue mayor de 130 casos por 100.000, con picos de incidencia de 365,0 y 425,0 casos en 2011 y 2015, respectivamente. No obstante, en el 2016, se observó una disminución de la incidencia que coincidió con la incorporación de la vacuna en la mujer embarazada. Este hecho debería analizarse a largo plazo, para ver si esta tendencia se mantiene, ya que también podría ser debida a que nos encontremos en un período interepidémico.
Los datos de incidencia entre países son difícilmente comparables, debido a las diferencias en cuanto a la definición de caso, a las técnicas diagnósticas empleadas y a los sistemas de notificación2,14. Según datos del ECDC, en 2014 la mayor tasa de notificación se produjo en menores de un año, con una incidencia de 51,6 casos por 100.000 a nivel global en Europa. España, Lituania, Países Bajos, Eslovenia y Suecia son los países que tienen las tasas más elevadas, con más de 100 casos por 100.000 habitantes en este grupo de edad15. Según algunos estudios, la tosferina podría estar siendo infradiagnosticada, por lo que la incidencia sería mayor. La definición de caso basado en los datos clínicos podría ser una causa de infradiagnóstico, ya que esta definición está limitada porque los signos y síntomas difieren con la edad, con la vacunación previa y porque, además, aún existe un bajo nivel de sospecha clínica en los médicos, sobre todo en adolescentes y adultos. Recientemente se ha propuesto un algoritmo diagnóstico basado en signos y síntomas según la edad16. Según este algoritmo, se debe sospechar la tosferina en menores de 3 meses cuando presenten tos y coriza, sobre todo cuando la tos aumente en frecuencia y gravedad, independientemente de la duración y de si es o no paroxística, y cuando se presenten con leucocitosis y linfocitosis. En nuestro trabajo, la mayoría de los pacientes presentaron tos, con signos catarrales en 2/3 partes de los casos, y la mayoría presentaron linfocitosis. Hay que destacar que los cuadros de neumonía y apnea se produjeron principalmente en menores de 3 meses, como se describe en otros estudios17, pero no se observaron diferencias en otros signos y síntomas entre los 2grupos de edad.
La población menor de un año es la que presenta un mayor riesgo de complicaciones. Observamos una tasa de complicaciones del 15,4%, en su mayoría, neumonía. La menor edad y la no vacunación fueron los factores de riesgo más importantes asociados al desarrollo de complicaciones, aunque ningún paciente falleció. Con respecto al periodo anterior, se observa una menor tasa de complicaciones (23,4% en el período 2003-2007), así como de fallecidos (6,5% en el período 2003-2007). En otros trabajos, la tasa de complicaciones en este grupo de edad fue superior17. Varios estudios han analizado distintas variables y han observado un mayor riesgo de muerte o enfermedad más grave en niños menores de 4 meses con bajo peso al nacer, hiperleucocitosis (≥100.000 leucocitos/μL), desarrollo de hipertensión pulmonar o convulsiones, y en no vacunados, entre otros18-20, y probablemente el tener un alto índice de sospecha mejore el pronóstico clínico.
En un alto porcentaje de los pacientes en los que se descartó infección por B. pertussis se detectó un virus. El más frecuentemente detectado fue el virus respiratorio sincitial, lo que indica un solapamiento de los signos y síntomas en este grupo de población, hecho ya descrito por otros autores21,22. Además, en un pequeño porcentaje de pacientes se diagnosticó coinfección con virus (los rinovirus son los más frecuentes), de forma similar a otros estudios, en los que los rinovirus y los coronavirus son los más frecuentemente detectados en coinfección22.
En conclusión, en los últimos años se ha observado un aumento de la incidencia de tosferina en nuestro medio en menores de un año, unido a una menor tasa de complicaciones y de mortalidad si comparamos con el periodo anterior. La menor edad y la no vacunación fueron los principales factores de riesgo asociados al desarrollo de complicaciones. La incidencia y las complicaciones deberían disminuir con la vacunación de la mujer gestante, por lo que es importante realizar estudios a largo plazo para ver la efectividad de esta medida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo se ha presentado en el XXI Congreso Nacional de la SEIMC (N.° de comunicación 300).