Los pacientes con errores innatos del metabolismo de las proteínas (EIMP) requieren una dieta con control proteico estricto que puede condicionar su crecimiento y desarrollo. El objetivo del estudio es valorar el estado nutricional y crecimiento en pacientes con EIMP sometidos a tratamiento dietético.
Pacientes y métodosEstudio observacional prospectivo caso-control en 63 pacientes con EIMP y 63 controles sanos emparejados por edad y sexo. Se obtuvieron datos antropométricos de peso, talla, índice de masa corporal (IMC), pliegues tricipital y subescapular, perímetros del brazo y cintura, y se calcularon sus z-score. Se estimó la grasa corporal y se clasificó el estado nutricional.
ResultadosEl análisis global mostró un z-score de talla inferior en pacientes con EIMP, e igual proporción de sobrepeso y obesidad respecto a los controles (30,2%). Al dividir a los pacientes con EIMP en dos grupos (fenilcetonuria [PKU] y otras aminoacidopatías) se observó que aquellos con PKU tuvieron una talla similar a los controles y significativamente superior a la de los pacientes con otras aminoacidopatías. Al clasificar el estado de nutrición, la prevalencia de sobrepeso y obesidad fue superior en el grupo de PKU (45,5%), mientras que los pacientes más desnutridos y con talla baja se encontraron en el grupo de otras aminoacidopatías.
ConclusiónNo todos los pacientes con EIMP siguen un mismo patrón de crecimiento y su composición corporal es variable. En esta muestra, los pacientes con PKU tienen una talla adecuada y mayor incidencia de sobrepeso y obesidad. Sin embargo, otras aminoacidopatías presentan mayores tasas de desnutrición y menor z-score de talla y perímetro del brazo.
Patients with protein metabolism disorders (PMDs) require a diet with strict protein control that can affect their growth and development. The aim of the study was to assess nutritional status and growth in patients with PMDs undergoing dietary treatment.
Patients and methodsProspective observational case-control study in 63 patients with PMDs and 63 healthy controls matched for age and sex. We collected data for anthropometric variables (weight, height, BMI, tricipital and subscapular skinfolds, arm and waist circumference) and calculated the corresponding z scores. We also estimated the body fat mass and classified patients into nutritional status categories.
ResultsThe overall analysis found a lower height z score in patients with PMDs and an equal proportion of overweight and obesity with respect to controls (30.2%). When we divided patients with PMDs into 2 groups (phenylketonuria and other aminoacidopathies), we found that patients with phenylketonuria had a height that was similar to the height of controls and significantly higher compared to patients with other aminoacidopathies. When it came to nutritional status, the prevalence of overweight and obesity was greater in the phenylketonuria group (45.5%), while underweight and short stature were more frequent in the group with other aminoacidopathies.
ConclusionNot all patients with PMDs follow the same growth pattern, and their body composition is variable. In our sample, the group of patients with phenylketonuria had an adequate height but also a higher prevalence of overweight and obesity. On the other hand, patients with other aminoacidopathies had a higher prevalence of underweight and lower z scores for height and arm circumference.
Los errores innatos del metabolismo de las proteínas (EIMP) pertenecen al grupo de enfermedades del metabolismo intermediario, causadas por defectos genéticos en enzimas o cofactores en el metabolismo de las proteínas y aminoácidos. Esto provoca un acúmulo anormal de sustratos o un déficit de productos en aquellas reacciones afectadas, lo cual conlleva la aparición de la sintomatología propia de cada enfermedad1. En la actualidad, gracias al cribado neonatal, es posible realizar un diagnóstico precoz de los EIMP e iniciar el tratamiento de forma temprana2.
El tratamiento de los EIMP consiste principalmente en la restricción de la ingesta de proteínas naturales de alto valor biológico de por vida, por lo que se debe compensar la falta de proteína natural mediante la administración de suplementos de aminoácidos sintéticos de uso médico. Los objetivos del tratamiento dietético son evitar la acumulación de productos tóxicos, mantener la estabilidad metabólica y asegurar un crecimiento y desarrollo óptimos3. Ante periodos de estrés metabólico, como enfermedades intercurrentes o intervenciones quirúrgicas, se deben hacer adaptaciones dietéticas para evitar descompensaciones metabólicas, lo que supone agregar un mínimo de proteínas manteniendo un alto aporte energético4,5.
La influencia de la restricción proteica sobre el estado de nutrición es variable y puede condicionar el crecimiento y desarrollo en los pacientes pediátricos. Por ello, es necesario hacer controles periódicos para conseguir mantener la estabilidad metabólica y evitar estados de malnutrición, tanto por exceso como por defecto.
Con estos antecedentes, el objetivo de este trabajo es valorar el estado nutricional y crecimiento en los pacientes pediátricos con EIMP sometidos a un tratamiento dietético, y comprobar si existen diferencias según la enfermedad.
Pacientes y métodosSe llevó a cabo un estudio observacional prospectivo de casos y controles en pacientes pediátricos con EIMP atendidos en la Unidad de Nutrición y Metabolopatías del Hospital Universitario y Politécnico La Fe de Valencia, acreditada como Unidad de Referencia del Sistema Nacional de Salud (CSUR). El estudio fue aprobado por el Comité de Ética del centro.
Se incluyeron 63 participantes menores de 18 años con diagnóstico de EIMP en tratamiento dietético con control proteico estricto y 63 controles sanos emparejados por edad y sexo. Se excluyeron los pacientes con fenotipos leves de la enfermedad (hiperfenilalaninemias con niveles plasmáticos repetidos de 2 a 6mg/dL de fenilalanina) que no requirieron dietas tan restrictivas en proteína natural, así como los pacientes con fenilcetonuria (PKU) en tratamiento con dihidrocloruro de sapropterina (Kuvan®) por el mismo motivo. Todos los participantes fueron reclutados entre los años 2020 y 2022, firmando el consentimiento informado antes de su inclusión en el estudio. De todos ellos se recogieron los datos de edad, sexo, diagnóstico y medidas de peso, talla, índice de masa corporal (IMC), pliegue tricipital, pliegue subescapular, perímetro del brazo, de la cintura y masa grasa, siguiendo los protocolos estandarizados6. Se calcularon los z-score de peso, talla e IMC según las referencias de la Organización Mundial de la Salud (OMS)7, los z-scores del pliegue tricipital, subescapular y perímetro del brazo según las referencias de Frisancho8, y el z-score del perímetro de la cintura según las referencias del estudio enKid9. El porcentaje de grasa corporal se calculó según la ecuación de Slaughter et al10. Para categorizar el estado de nutrición se aplicaron los criterios de la OMS7.
Análisis estadísticoSe realizó un análisis descriptivo, calculando las medias y desviaciones estándar para las variables cuantitativas. Los cálculos de las medidas antropométricas se efectuaron después de transformarlas en z-score para la edad y el sexo. Las variables categóricas se presentan en forma de frecuencias. En la comparación de las variables de grupos independientes se aplicaron el test t de Student o U de Mann-Whitney, en función de la normalidad de las variables analizadas. En la comparación de más de dos grupos independientes se ha aplicado el test análisis de la varianza (ANOVA) o su alternativa no paramétrica, el test de Kruskal-Wallis para las variables continuas. La comparación de las variables de tipo cualitativo se llevó a cabo mediante el test X2. Se ha utilizado en todos los métodos estadísticos un nivel de significancia de α = 0,05.
Debido al número de participantes en el estudio, siendo la PKU la enfermedad más frecuente, se separó la muestra en dos grupos (PKU y otras aminoacidopatías) para obtener una adecuada potencia estadística.
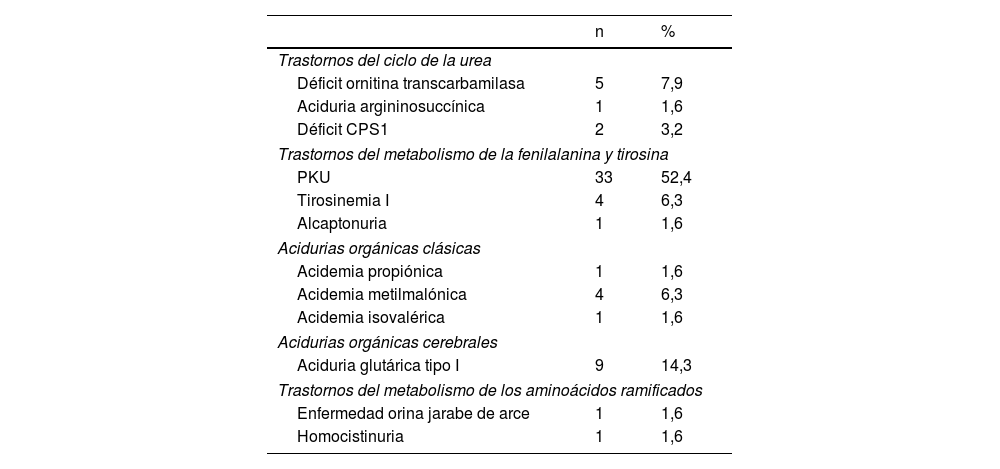
ResultadosSe incluyeron 126 participantes (63 pacientes con EIMP y 63 controles emparejados por edad y sexo) con una edad media de 8,04±4,89 años, siendo un 47,6% niñas. Dentro del grupo con EIMP, la enfermedad más común fue la PKU, representando el 52,4% de los casos (tabla 1).
Número de participantes según el tipo de enfermedad (n=63)
| n | % | |
|---|---|---|
| Trastornos del ciclo de la urea | ||
| Déficit ornitina transcarbamilasa | 5 | 7,9 |
| Aciduria argininosuccínica | 1 | 1,6 |
| Déficit CPS1 | 2 | 3,2 |
| Trastornos del metabolismo de la fenilalanina y tirosina | ||
| PKU | 33 | 52,4 |
| Tirosinemia I | 4 | 6,3 |
| Alcaptonuria | 1 | 1,6 |
| Acidurias orgánicas clásicas | ||
| Acidemia propiónica | 1 | 1,6 |
| Acidemia metilmalónica | 4 | 6,3 |
| Acidemia isovalérica | 1 | 1,6 |
| Acidurias orgánicas cerebrales | ||
| Aciduria glutárica tipo I | 9 | 14,3 |
| Trastornos del metabolismo de los aminoácidos ramificados | ||
| Enfermedad orina jarabe de arce | 1 | 1,6 |
| Homocistinuria | 1 | 1,6 |
Déficit CPS1: déficit de carbamoil fosfato sintetasa 1; PKU: fenilcetonuria.
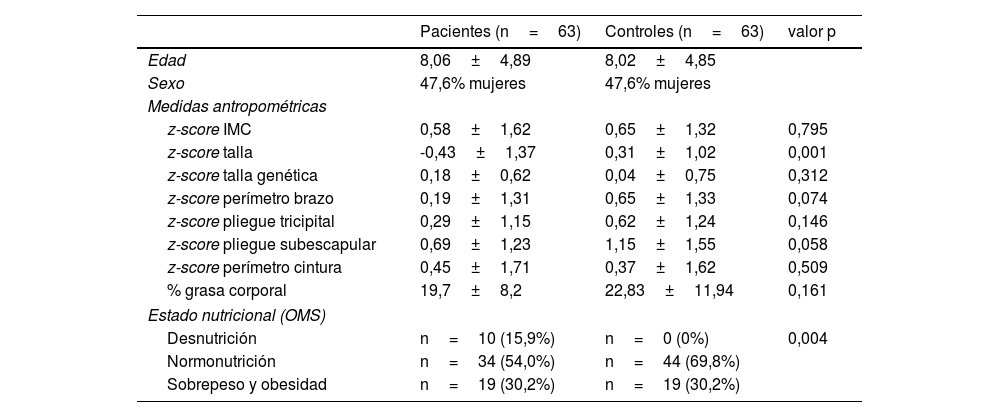
Las medidas antropométricas y la categorización del estado nutricional del grupo de estudio y del grupo control se recogen en la tabla 2. Estas evidenciaron un z-score de la talla significativamente inferior en el grupo de pacientes con EIMP. Para comprobar que esta diferencia en la talla se debía a la enfermedad y no a un componente genético, se estimó la talla diana en ambos grupos (75,4% de la muestra) y no se observaron diferencias significativas entre ellos. En cuanto al resto de las medidas antropométricas analizadas, no se encontraron diferencias significativas. Por otro lado, al comparar el estado nutricional del grupo control con el grupo con EIMP, el porcentaje de sobrepeso y obesidad fue el mismo, mientras que únicamente se detectaron pacientes desnutridos en el grupo con EIMP.
Clasificación del estado nutricional y composición corporal en pacientes y controles
| Pacientes (n=63) | Controles (n=63) | valor p | |
|---|---|---|---|
| Edad | 8,06±4,89 | 8,02±4,85 | |
| Sexo | 47,6% mujeres | 47,6% mujeres | |
| Medidas antropométricas | |||
| z-score IMC | 0,58±1,62 | 0,65±1,32 | 0,795 |
| z-score talla | -0,43±1,37 | 0,31±1,02 | 0,001 |
| z-score talla genética | 0,18±0,62 | 0,04±0,75 | 0,312 |
| z-score perímetro brazo | 0,19±1,31 | 0,65±1,33 | 0,074 |
| z-score pliegue tricipital | 0,29±1,15 | 0,62±1,24 | 0,146 |
| z-score pliegue subescapular | 0,69±1,23 | 1,15±1,55 | 0,058 |
| z-score perímetro cintura | 0,45±1,71 | 0,37±1,62 | 0,509 |
| % grasa corporal | 19,7±8,2 | 22,83±11,94 | 0,161 |
| Estado nutricional (OMS) | |||
| Desnutrición | n=10 (15,9%) | n=0 (0%) | 0,004 |
| Normonutrición | n=34 (54,0%) | n=44 (69,8%) | |
| Sobrepeso y obesidad | n=19 (30,2%) | n=19 (30,2%) | |
IMC: índice de masa corporal; OMS: Organización Mundial de la Salud.
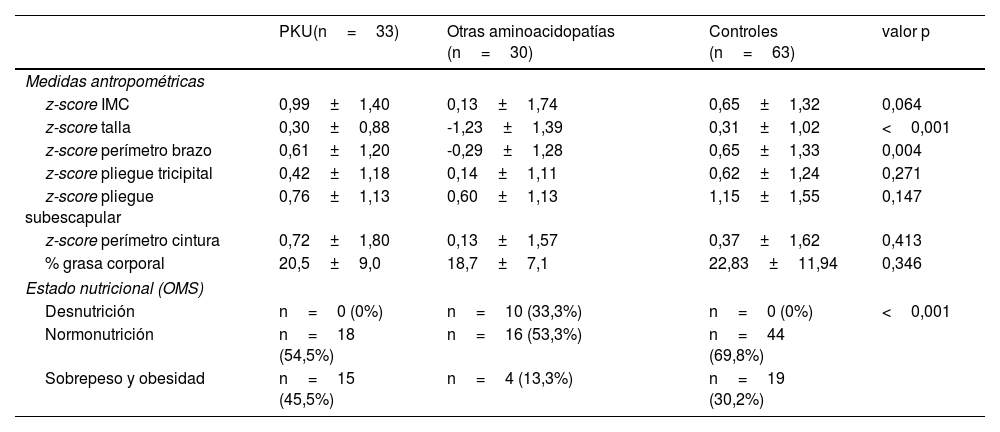
La tabla 3 muestra las medidas antropométricas y el estado nutricional de los pacientes tras la división de la muestra en dos grupos (PKU y otras aminoacidopatías).
Clasificación del estado nutricional y composición corporal en pacientes (clasificados según el grupo de enfermedad) y controles
| PKU(n=33) | Otras aminoacidopatías (n=30) | Controles (n=63) | valor p | |
|---|---|---|---|---|
| Medidas antropométricas | ||||
| z-score IMC | 0,99±1,40 | 0,13±1,74 | 0,65±1,32 | 0,064 |
| z-score talla | 0,30±0,88 | -1,23±1,39 | 0,31±1,02 | <0,001 |
| z-score perímetro brazo | 0,61±1,20 | -0,29±1,28 | 0,65±1,33 | 0,004 |
| z-score pliegue tricipital | 0,42±1,18 | 0,14±1,11 | 0,62±1,24 | 0,271 |
| z-score pliegue subescapular | 0,76±1,13 | 0,60±1,13 | 1,15±1,55 | 0,147 |
| z-score perímetro cintura | 0,72±1,80 | 0,13±1,57 | 0,37±1,62 | 0,413 |
| % grasa corporal | 20,5±9,0 | 18,7±7,1 | 22,83±11,94 | 0,346 |
| Estado nutricional (OMS) | ||||
| Desnutrición | n=0 (0%) | n=10 (33,3%) | n=0 (0%) | <0,001 |
| Normonutrición | n=18 (54,5%) | n=16 (53,3%) | n=44 (69,8%) | |
| Sobrepeso y obesidad | n=15 (45,5%) | n=4 (13,3%) | n=19 (30,2%) | |
IMC: índice de masa corporal; OMS: Organización Mundial de la Salud; PKU: fenilcetonuria.
En la comparación de las medidas antropométricas entre todos los grupos, el z-score de la talla fue significativamente inferior en el grupo de otras aminoacidopatías al contrastarlo con el grupo control (valor p <0,001) y con el de PKU (valor p <0,001), siendo similar entre controles y PKU. El resto de las medidas antropométricas evidenciaron unos parámetros de composición corporal más bajos en el grupo de otras aminoacidopatías respecto a los pacientes con PKU y los controles, alcanzando la significación en el perímetro del brazo. En relación con el estado nutricional, se observó que la proporción de niños con sobrepeso y obesidad en el grupo con PKU fue significativamente superior respecto a la observada en el grupo control y en otras aminoacidopatías. Estos últimos presentaron las mayores tasas de desnutrición entre todos los participantes.
DiscusiónEn este estudio se ha demostrado que los pacientes con EIMP, a pesar de pertenecer a un mismo grupo de enfermedades y con un tratamiento dietético similar, tienen diferentes patrones de crecimiento y estado nutricional. Estos datos son relevantes, ya que dichos enfermos necesitan seguir una dieta con control proteico estricto para prevenir el deterioro neurológico, pero este tipo de alimentación debe conseguir un adecuado patrón de crecimiento11,12. Por ello, lograr un estado nutricional y un crecimiento óptimos se ha convertido en un objetivo fundamental dentro de su tratamiento y seguimiento.
A nivel global, analizando casos y controles, se han encontrado z-score de talla inferiores en los pacientes con EIMP, pero valores similares de sobrepeso y obesidad. Publicaciones previas también mostraron problemas de crecimiento en individuos que padecen este tipo de patologías11–13, probablemente como consecuencia de la limitación en la ingesta de proteína natural que tienen los pacientes durante toda su vida. En cuanto al estado de nutrición, a pesar de haber observado resultados similares de sobrepeso y obesidad entre nuestros casos y controles, los valores de prevalencia obtenidos han sido inferiores (30,2%) respecto a los publicados por De Castro et al.11 (36,4%). No obstante, el porcentaje de pacientes que presentó desnutrición en nuestra muestra fue mayor (15,9%) que el observado en dicho estudio (6,5%), aunque se debe tener en cuenta que De Castro et al. incluyeron pacientes con PKU leve, mientras que en nuestro estudio únicamente participaron aquellos con PKU moderada-grave en tratamiento dietético.
En una segunda parte del estudio, planteamos el análisis de la muestra separando a los pacientes en dos grupos según el tipo de enfermedad (PKU y otras aminoacidopatías) al observar tres comportamientos diferentes: 1) que la talla de los pacientes con PKU fue similar a los controles y significativamente mayor al grupo de otras aminoacidopatías; 2) que la prevalencia de sobrepeso y obesidad fue superior en el grupo de PKU; 3) que los pacientes más desnutridos y con talla baja se encontraban en el grupo de otras aminoacidopatías.
Respecto a la talla, la mayoría de los estudios anteriores han publicado problemas de crecimiento en pacientes con PKU14–16. No obstante, el trabajo de Belanger-Quintana et al.17, de forma similar al nuestro, evidenció tasas de crecimiento normales en dichos pacientes. Atendiendo a nuestros resultados, posiblemente la talla de los pacientes con PKU no se ha visto afectada porque tienen una mayor prevalencia de sobrepeso y obesidad, y el exceso ponderal puede acelerar el crecimiento18. Adicionalmente, en el grupo de otras metabolopatías encontramos mayores índices de talla baja, al igual que otras publicaciones previas12,19–22, posiblemente como consecuencia de la mayor restricción proteica a la que son sometidos dichos pacientes (como en el caso de los trastornos del ciclo de la urea) o la limitación excesiva de un aminoácido esencial (lisina en aciduria glutárica I o tirosina en la tirosinemia I) o a un desequilibrio entre un aminoácido esencial y el aporte proteico total (como es el caso del cociente leucina/proteína en las acidemias metilmalónica o propiónica)19. Este grupo de otras aminoacidopatías también presentó mayores tasas de desnutrición y, por tanto, sería recomendable intensificar su control nutricional con el objetivo de evitar periodos largos de desnutrición que pudieran afectar a la talla final.
En relación con el resto de las medidas antropométricas registradas, los pacientes con PKU mostraron valores más elevados que el grupo de otras aminoacidopatías, aunque solamente se hallaron diferencias significativas en el perímetro del brazo. No se han encontrado en la bibliografía estudios que muestren datos de este parámetro para poder compararlo. En referencia al porcentaje de grasa corporal, algunos autores23–25 señalan valores elevados en pacientes con PKU respecto a grupos control o población de referencia, sin embargo, otras publicaciones26–29 observan valores similares, al igual que el presente estudio. Son pocos los trabajos que han estudiado el porcentaje de grasa en el resto de las aminoacidopatías. Algunos autores han publicado porcentajes elevados (hasta el 40%) de masa grasa en acidemia propiónica y metilmalónica19,22, sin embargo, en nuestra cohorte la media del porcentaje graso en este grupo fue de 18,7%, valores similares a los publicados por Evans et al.12 y al grupo control.
En cuanto al estado de nutrición, analizado por grupo de enfermedad, los pacientes con PKU mostraron tasas de sobrepeso y obesidad significativamente mayores a los controles y otras aminoacidopatías. La literatura muestra diferentes resultados respecto al estado nutricional de pacientes con PKU30, aunque los fenotipos más graves de la enfermedad parecen tender al sobrepeso y la obesidad, especialmente las mujeres y en edades cercanas a la adolescencia24,27,31–35. En este sentido, al haber excluido del estudio a los pacientes con fenotipos leves de la enfermedad, parecen lógicos los resultados obtenidos. No obstante, sería conveniente hacer una adecuada intervención nutricional para prevenir o corregir el exceso de peso. En este sentido, hay estudios que indican que la mayor carga glucémica y el mayor índice glucémico de la dieta de los pacientes con PKU reside en los productos hipoproteicos (pasta, arroz, galletas, etc.), que son procesados, y no en las fórmulas completas sin fenilalanina36. Por lo tanto, sería conveniente hacer un análisis detallado de la calidad de la dieta de los pacientes y mejorar la educación nutricional en relación con el consumo de dichos productos37, favoreciendo la ingesta de alimentos naturales que, de manera libre o controlada, pueden consumir.
Es importante considerar las limitaciones de este estudio, entre las cuales se encuentra la variedad de enfermedades incluidas en el grupo de otras aminoacidopatías y el pequeño número de pacientes que padecen cada una de ellas. No obstante, el número total de participantes en el estudio es adecuado teniendo en cuenta que son enfermedades de muy baja prevalencia. Otra limitación ha sido que no se ha valorado el estadio puberal, y los niños y niñas pueden presentar variabilidad durante la adolescencia.
ConclusionesA pesar de que todas las enfermedades analizadas en el presente estudio se incluyen dentro de los EIMP y siguen un tratamiento dietético con control proteico, no todos los pacientes siguen un mismo patrón de crecimiento y su composición corporal es muy variable.
Los pacientes con PKU alcanzan una talla adecuada, similar a los controles, pero una mayor incidencia de sobrepeso y obesidad. Por otro lado, el grupo de pacientes con otras aminoacidopatías presentan mayores tasas de desnutrición y compromiso del crecimiento.
Estos datos reflejan la importancia de evaluar la calidad de la alimentación y de monitorizar los parámetros de composición corporal de manera rutinaria en el seguimiento de los pacientes con EIMP para asegurar un adecuado crecimiento y estado nutricional.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentación previa en reuniones, congresos o simposios. Presentación en formato póster en el XXIX Congreso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica, del 20 al 22 de abril de 2023 en Córdoba.