El síndrome de distrés respiratorio (SDR) es la causa más frecuente de distrés respiratorio en los recién nacidos prematuros. El surfactante desempeña un papel fundamental en el tratamiento del SDR, pero no existen recomendaciones basadas en la evidencia en neonatos prematuros moderados/tardíos (32-36 semanas).
MétodosUn Comité Científico diseñó un cuestionario con 53 preguntas que abordaban el diagnóstico, el tratamiento, las posibles complicaciones y las tendencias futuras del SDR, específicamente en los recién nacidos prematuros moderados y tardíos. Posteriormente, se llevó a cabo una encuesta Delphi entre neonatólogos con experiencia en el campo.
ResultadosSe alcanzó consenso en 98 de los 109 ítems incluidos. Se recomendó la realización de una ecografía pulmonar y la consideración de la dificultad respiratoria leve, la taquipnea transitoria del recién nacido, la neumonía congénita y la hipertensión pulmonar primaria durante el diagnóstico diferencial. La mayoría de los panelistas coincidieron en la necesidad de realizar estudios para determinar el riesgo/beneficio, el perfil clínico y los métodos de administración de surfactante en neonatos prematuros moderados/tardíos. Se recomendó la técnica MIST con dispositivos específicamente diseñados para la administración de surfactante. La mayoría de los participantes coincidieron en recomendar el uso de procedimientos no farmacológicos de sedación durante el MIST y, en caso de ineficacia, un opiáceo. Todos los encuestados coincidieron en que los prematuros moderados/tardíos presentan mayor riesgo de morbimortalidad neonatal, en particular de problemas respiratorios, y consideraron necesario más monitorización especializada en el seguimiento hospitalario de neonatos con mayor riesgo y/o complicaciones. Por último, todos los encuestados coincidieron en la falta de estudios para identificar factores de riesgo y resultados adversos a medio plazo en neonatos prematuros moderados/tardíos.
ConclusionesEste consenso de expertos será de ayuda en el diagnóstico y manejo del SDR y en la decisión de administrar surfactante en neonatos prematuros moderados/tardíos.
Respiratory distress syndrome (RDS) is the most frequent cause of respiratory distress in preterm neonates. In the management of RDS, surfactant plays a pivotal role, but there are no evidence-based recommendations for moderate/late preterm neonates (32-36 weeks).
MethodsA scientific committee developed a questionnaire with 53 questions addressing diagnosis, treatment, potential complications and future trends in RDS specifically focused on moderate and late preterm neonates. This was followed by the performance of a Delphi survey of expert neonatologists.
ResultsConsensus was reached on 98 of the 109 items. The recommendations for the diagnosis of RDS included performing a lung ultrasound and including mild respiratory distress, transient tachypnoea of the newborn, congenital pneumonia and primary pulmonary hypertension in the differential diagnosis. Most panellists agreed on the need for studies that determine the benefit/harm balance, clinical profile and methods of surfactant administration in moderate/late preterm neonates. All respondents would use the MIST approach with devices specifically designed for surfactant administration. Regarding sedation measures during MIST, most participants agreed on the use of nonpharmacological interventions and, if these proved ineffective, an opioid. All respondents agreed that moderate/late preterm neonates are at increased risk of neonatal morbidity and mortality, particularly respiratory problems, and considered the need for more specialised monitoring in hospital follow-up visits in neonates with associated risk factors or a history of complications in the neonatal period. Finally, all respondents agreed that there is a lack of studies identifying risk factors and medium-term adverse outcomes in moderate/late preterm neonates.
ConclusionThis expert consensus will help with the diagnosis and management of RDS and guide decision-making about surfactant administration in moderate/late preterm neonates.
Cada año, el 10% de los nacimientos a nivel mundial son prematuros (<37 semanas)1. Las complicaciones de la prematuridad son la principal causa de muerte en los niños menores de cinco años2. Entre las complicaciones respiratorias comunes en los recién nacidos prematuros, el síndrome de distrés respiratorio (SDR) es la causa más frecuente de dificultad respiratoria3.
El SDR está causado por una síntesis, secreción, metabolización y/o degradación deficientes o retrasadas del surfactante en el pulmón inmaduro. Su incidencia es inversamente proporcional a la edad gestacional, con una prevalencia que oscila entre el 60% y el 80% en neonatos extremadamente prematuros (<28 semanas) y entre el 15% y el 30% en neonatos moderados/tardíos (32-36 semanas)4.
Casi el 85% de los neonatos que nacen prematuramente cada año son prematuros moderados/tardíos (32-36 semanas de gestación)1. Aunque las tasas de supervivencia en prematuros han aumentado en los países de renta alta, las tasas de nacimiento prematuro también han ido aumentando desde el año 20005. Debido a ello, el número de nacimientos de neonatos prematuros tardíos está aumentando, especialmente en los países occidentales. Los recién nacidos prematuros tardíos tienen un riesgo mayor de mortalidad inmediata y morbilidad respiratoria, incluido el SDR6,7, así como de trastornos a largo plazo, como trastornos del neurodesarrollo, trastornos neuroconductuales y problemas escolares8–14.
En los recién nacidos prematuros, el tratamiento sustitutivo con surfactante es esencial en el manejo del SDR. A pesar de ello, no hay recomendaciones basadas en la evidencia para el uso de surfactante en neonatos prematuros tardíos15,16. El objetivo del presente estudio fue recabar opiniones de expertos sobre el diagnóstico, el tratamiento, las posibles complicaciones y las tendencias futuras del SDR, prestando especial atención a los recién nacidos prematuros moderados y tardíos.
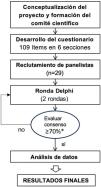
Materiales y métodosDiseño del estudio y participantesPara llevar a cabo el estudio, se aplicó un método Delphi modificado con el objeto de alcanzar un consenso en un panel de especialistas en neonatología con experiencia17. Se llevó a cabo en varias fases, incluyendo la creación del comité científico (CC), el diseño del cuestionario Delphi, la selección del panel de expertos, la administración del cuestionario Delphi y el análisis e interpretación de los datos (fig. 1).
Diagrama de flujo del estudio
*En la primera ronda el consenso sobre un ítem se definió como que el 70% o más de los panelistas eligieran una misma categoría de respuesta de las cuatro disponibles: «totalmente de acuerdo», «básicamente de acuerdo», «básicamente en desacuerdo» y «totalmente en desacuerdo».
Las funciones del CC incluyeron la formulación del cuestionario, el establecimiento de los criterios de selección del panel, la definición de las reglas de consenso, la interpretación de los resultados preliminares y finales y la colaboración en la redacción del manuscrito.
En cuanto a la composición del panel, se invitó a participar a neonatólogos de distintas regiones de España con experiencia en el campo. Los criterios de inclusión fueron ser neonatólogo, trabajar en una unidad neonatal de nivel III B/C en España y un mínimo de 10 años de experiencia. La lista de panelistas participantes se puede consultar en la tabla suplementaria 1.
CuestionarioTras definir los objetivos del estudio, el CC realizó una búsqueda bibliográfica y elaboró el cuestionario inicial. Este incluía 53 preguntas que abordaban seis áreas principales: (i) prevención/administración prenatal de corticoides (10 ítems); (ii) diagnóstico (9 ítems); (iii) tratamiento (72 ítems); (iv) sedación para la terapia mínimamente invasiva con surfactante (MIST, del inglés minimally invasive surfactant therapy) (6 ítems); (v) secuelas y seguimiento (7 ítems) y (vi) tendencias futuras (5 ítems). La tabla suplementaria 2 presenta el cuestionario definitivo. Este cuestionario fue sometido a dos rondas de votación entre febrero de 2023 (primera ronda) y abril de 2023 (segunda ronda). Los participantes cumplimentaron el cuestionario a través de una plataforma digital que garantizaba el anonimato y la confidencialidad de los datos.
Análisis e interpretación de datosTodos los ítems se valoraron en una escala de 4 puntos: 1-totalmente de acuerdo, 2-básicamente de acuerdo, 3-básicamente en desacuerdo y 4-totalmente en desacuerdo. En la primera ronda se definió consenso como la selección de la misma puntuación por al menos el 70% de los panelistas. Los ítems para los que no se alcanzó el consenso en la primera ronda fueron sometidos a una segunda ronda de votación. En la segunda ronda se puso a disposición de los panelistas la puntuación que habían elegido en la primera ronda, así como los resultados agregados de todo panel para cada pregunta. En esta ronda el consenso sobre un ítem se definió como que al menos el 70% de los panelistas seleccionaran una puntuación de 1 o 2 (consenso en acuerdo) o de 3 o 4 (consenso en desacuerdo). Estas categorías de votación se utilizaron en ambas rondas. Se llevó a cabo un análisis estadístico de las respuestas a cada pregunta y se representaron los resultados gráficamente con el software Excel (Microsoft Corporation, Redmond, Washington, USA). El CC estudió y debatió los resultados de la encuesta Delphi.
ResultadosEn el panel participaron 29 neonatólogos expertos distribuidos por el territorio español y completaron las dos rondas de la encuesta Delphi. Al final del proceso Delphi, se alcanzó el consenso en 98 de los 109 ítems incluidos en las 53 preguntas del cuestionario: 76 en «acuerdo» y 22 en «desacuerdo» (fig. 2). De los 11 ítems restantes para los que los panelistas no alcanzaron el consenso, seis se clasificaron como «desacuerdo», dos como «indeterminado-mayoría de acuerdo» y tres como «indeterminado-mayoría en desacuerdo» (fig. 2 y tabla suplementaria 2).
Prevención y administración prenatal de corticoidesEn relación a la administración prenatal de corticoides, el 77% de los panelistas consideraba que la evidencia disponible era insuficiente para establecer adecuadamente el balance riesgo-beneficio en caso de amenaza de parto prematuro entre las 34 y 36 semanas de gestación, y el 73% estuvo de acuerdo en no recomendar la administración de corticoides a partir de la semana 34 (fig. 3 y tabla suplementaria 2). Todos los panelistas se mostraron de acuerdo en no recomendar una dosis adicional de corticoides entre las semanas 34 y 36 de gestación en mujeres con riesgo alto de parto prematuro si ya se había administrado un primer ciclo antes de las 34 semanas. La mayoría de los panelistas estuvieron de acuerdo en que la administración prenatal de corticoides ofrece beneficios respiratorios (76%). Las razones para no recomendar la administración de corticoides entre las semanas 34 y 36 de gestación incluían el aumento en el riesgo de hipoglucemia en el recién nacido (79%) y un posible efecto perjudicial sobre el neurodesarrollo a largo plazo (83%) (fig. 3).
DiagnósticoEn cuanto al diagnóstico del SDR, todos los panelistas (100%) consideraban que la ecografía pulmonar (EP) ofrece ventajas en comparación con la radiografía de tórax y que debería realizarse en las primeras dos horas de vida (100%) (fig. 4 y tabla suplementaria 2).
La mayoría de los panelistas consideraba que el diagnóstico diferencial del SDR debe incluir la taquipnea transitoria del recién nacido (TTRN) (97%), la dificultad respiratoria leve (100%), la neumonía congénita (93%) y la hipertensión pulmonar primaria (HPP) (76%) (fig. 4). También consideraban necesaria la evaluación por un cardiólogo de los recién nacidos prematuros tardíos con sospecha de SDR y evolución clínica desfavorable con el fin de descartar la HPP (fig. 4).
TratamientoDecisión de administrar surfactanteLa mayoría de los panelistas (93%) estuvieron de acuerdo en que se necesitaban estudios para determinar los beneficios y riesgos, el perfil clínico y los métodos de administración de surfactante en neonatos prematuros moderados/tardíos (tabla suplementaria 2). Los factores identificados como más importantes en el momento de decidir si administrar surfactante o no fueron: FiO2 (100% de los panelistas), gravedad del distrés respiratorio (100%), puntuación LUS (del inglés Lung Ultrasound score) (100%), acidosis respiratoria (93%), presión media de la vía aérea previa (93%) y tiempo transcurrido desde el nacimiento hasta el diagnóstico (97%) (tabla suplementaria 2). Los panelistas recomendaron la administración de surfactante entre las dos y seis primeras horas de vida en neonatos con diagnóstico de SDR (86%) si la presión media de la vía aérea previa era igual o superior a 6 mmH2O (83%) y/o la puntuación LUS era igual o superior a 6 (93%) (fig. 5 y tabla suplementaria 2).
La mayoría de los panelistas (83%) recomendaría la administración de surfactante en neonatos prematuros moderados/tardíos con dificultad respiratoria y evolución desfavorable, incluso en el caso de que el diagnóstico de SDR sea incierto (tabla suplementaria 2). Además, la mayoría de los panelistas recomendaría la administración de surfactante para otras patologías, como el síndrome de aspiración de meconio (90%) y la neumonía congénita (83%) (fig. 5). Sin embargo, la mayoría no recomendaría el tratamiento con surfactante en casos de hernia diafragmática congénita, hipoplasia pulmonar o TTRN (tabla suplementaria 2).
Técnica de administración y posibles complicacionesEn cuanto al método de administración de surfactante, todos los encuestados utilizarían la técnica mínimamente invasiva MIST (fig. 5 y tabla suplementaria 2). Los panelistas coincidieron en que la dosis inicial recomendada de surfactante para un neonato prematuro tardío sería de 200mg/kg (97%). No se alcanzó consenso sobre la administración de cafeína previa a la administración de surfactante con la técnica MIST (fig. 5).
Beneficios y riesgos de la administración de surfactante en estos pacientesTodos los panelistas coincidieron en que la administración de surfactante puede reducir el grado de dificultad respiratoria, mejorar los parámetros respiratorios, reducir la duración y la necesidad de ventilación mecánica invasiva (VMI) y acortar la estancia en la unidad de cuidados intensivos (UCI) y/o la estancia hospitalaria. Además, la mayoría coincidió en que la administración de surfactante podría reducir el riesgo de mortalidad (79%), disminuir la necesidad de derivación de un hospital de nivel inferior a uno de atención terciaria (79%) y reducir la incidencia de algunas de las morbilidades típicamente asociadas a la prematuridad (83%). Por otra parte, los panelistas estuvieron de acuerdo en que no administrar surfactante a estos pacientes no aumentaría el riesgo de enterocolitis necrosante (97%), retinopatía del prematuro (100%) o hemorragia intracraneal (93%) (tabla suplementaria 2).
Medidas de sedación para la técnica MISTEn lo respectivo a la sedación, la mayoría de los panelistas utilizarían métodos no farmacológicos como primera opción, tales como la administración de sacarosa (97%) o la lactancia materna (72%) dos minutos antes del procedimiento, ambas acompañadas de medidas de contención (fig. 6 y tabla suplementaria 2). En el caso de que las medidas no farmacológicas no fueran efectivas, tres de cada cuatro encuestados utilizarían un opiáceo como sedante de primera línea para la administración de surfactante vía MIST (fig. 6).
Secuelas y seguimientoTodos los encuestados coincidieron en que los neonatos prematuros moderados/tardíos tienen un riesgo mayor de morbilidad y mortalidad neonatal en comparación con los nacidos a término, y en particular de problemas respiratorios (fig. 7 y tabla suplementaria 2). La mayoría de los neonatólogos (90%) coincidieron en que todos los recién nacidos prematuros tardíos con factores de riesgo perinatal o complicaciones en el periodo neonatal necesitan una monitorización más especializada en las visitas de seguimiento hospitalarias. También hubo consenso en cuanto a que la prevalencia, tanto inmediata como a largo plazo, de patologías respiratorias es mayor en los neonatos prematuros moderados/tardíos en comparación con los nacidos a término. Por último, la mayoría de los encuestados coincidieron en que en los recién nacidos prematuros moderados/tardíos el antecedente de corioamnionitis y la ausencia de lactancia materna son factores de riesgo para el desarrollo de asma o enfermedades pulmonares a largo plazo (fig. 7).
Tendencias futurasTodos los encuestados coincidieron en la falta de estudios longitudinales poblacionales de gran tamaño que identificaran los factores asociados a un mayor riesgo de resultados adversos en neonatos prematuros moderados/tardíos y los factores de riesgo prenatales y postnatales asociados a un aumento de la probabilidad de deterioro de la función pulmonar en la edad escolar (tabla suplementaria 2).
DiscusiónAunque a lo largo de los años se ha reunido un volumen significativo de datos sobre el tratamiento del SDR en recién nacidos prematuros, las recomendaciones tienden a centrarse en los muy prematuros (<32 semanas de gestación)15. Los resultados de nuestro proyecto abordan la laguna existente en este campo, ofreciendo recomendaciones tanto para el diagnóstico del SDR como para su manejo en recién nacidos prematuros moderados/tardíos que puedan orientar la toma de decisiones sobre la administración de surfactante.
En los recién nacidos prematuros de menor edad gestacional (<32 semanas de gestación), la administración prenatal de corticoides ofrece beneficios respiratorios y reduce el riesgo de mortalidad y otras morbilidades (hemorragia intraventricular, enterocolitis necrosante)18. Por otra parte, queda por esclarecer el balance riesgo/beneficio de la administración prenatal de corticoides en recién nacidos prematuros tardíos. En cualquier caso, la administración prenatal de corticoides se ha asociado a un riesgo aumentado de hipoglucemia19–21, y existen dudas sobre sus efectos sobre el neurodesarrollo a largo plazo. Varios estudios han objetivado un riesgo mayor de alteraciones neurocognitivas y conductuales22,23.
Además, existe una importante heterogeneidad entre las recomendaciones internacionales; el American College of Obstetricians and Gynecologists (ACOG) contempla su administración en madres con riesgo alto de parto prematuro en los siguientes siete días entre las semanas 34 y 36 de gestación24, mientras que en Europa esta indicación es más controvertida15. Hubo consenso en cuanto a que no hay datos suficientes para establecer adecuadamente el riesgo/beneficio de la administración de corticoides prenatales. También hubo consenso en no recomendar una dosis adicional de corticoides entre las semanas 34 y 36 de gestación en caso de alto riesgo de parto prematuro, ni entre las semanas 34 y 34+6 de gestación.
En los últimos años, la EP se ha integrado como una técnica útil en el diagnóstico y el tratamiento del SDR. Para el diagnóstico es preferible realizar una EP que una radiografía, ya que la primera es muy sensible y evita la exposición a radiación ionizante25. En cuanto al manejo del SDR, es importante determinar la necesidad de tratamiento y en particular la administración de surfactante. Si se lleva a cabo al poco tiempo del parto, la EP puede predecir las necesidades de asistencia respiratoria o tratamiento con surfactante de los recién nacidos prematuros tardíos26. En este sentido, todos los panelistas estuvieron de acuerdo en realizar una EP en las dos primeras horas de vida, subrayando la importancia de un diagnóstico precoz para obtener el máximo beneficio. La falta de evidencia sobre el uso de la puntuación LUS para guiar la administración de surfactante en recién nacidos prematuros tardíos llevó a los panelistas a establecer un punto de corte de seis horas en el proceso Delphi. Sin embargo, se han publicado datos adicionales desde la elaboración del cuestionario, y De Luca et al. han demostrado que una puntuación LUS superior a 8 ofrece mayor precisión global, lo que respalda su uso para guiar la administración de surfactante. El mismo estudio demostró que una puntuación LUS de 4 o inferior ofrece la sensibilidad más alta, lo que indica que la necesidad de surfactante es poco probable en pacientes con puntuaciones en este intervalo27.
En la actualidad no existen guías específicas para la administración de surfactante en recién nacidos prematuros tardíos; no obstante, varios estudios han demostrado que se trata de una intervención segura que mejora los resultados respiratorios y reduce la mortalidad28,29. En términos generales, faltan estudios sobre la administración de surfactante en recién nacidos prematuros tardíos. Sin embargo, un ensayo en curso, SURFON (SURFactant Or Not), está investigando el uso precoz de surfactante en recién nacidos prematuros tardíos30. En el presente estudio casi todos los panelistas recomendaron la administración de surfactante en prematuros moderados/tardíos, si bien hubo más dudas en relación a su diagnóstico diferencial. Al preguntar a los panelistas sobre la administración de surfactante para otras patologías, la mayoría coincidió en su uso para otros diagnósticos como la neumonía congénita y el síndrome de aspiración de meconio. Una encuesta sobre el uso de surfactante en recién nacidos prematuros tardíos entre neonatólogos belgas destacó su utilización en el manejo del SDR y el síndrome de aspiración de meconio. En cambio, hubo menos unanimidad en cuanto a su uso en la taquipnea transitoria del recién nacido y la neumonía congénita31.
Aunque la administración de surfactante es el principal tratamiento del SDR, el método de administración sigue siendo objeto de debate. Las técnicas mínimamente invasivas (LISA, del inglés Less Invasive Surfactant Administration, o MIST) también aportan beneficios en los recién nacidos prematuros moderados/tardíos15. Su uso consigue una mejoría respiratoria con pocos efectos adversos y reduce de manera significativa la exposición a la ventilación mecánica y la necesidad de traslado a un centro de atención terciaria32, así como una reducción no significativa en la estancia en la UCI neonatal y la estancia hospitalaria33 y una disminución en el riesgo de neumotórax34. En la presente encuesta Delphi hubo unanimidad a favor del uso de MIST, preferiblemente con dispositivos específicamente diseñados para esta técnica. Hubo un consenso amplio en aconsejar la dosis de 200mg/kg, en línea con las recomendaciones más recientes15. No hubo consenso en cuanto a la administración de cafeína previa a la de surfactante.
En la literatura hay un debate considerable en cuanto a la necesidad de sedación/analgesia farmacológica durante la administración de MIST. En el panel hubo consenso a favor de la sedación para los recién nacidos prematuros tardíos, prefiriéndose la sacarosa a la leche materna en el caso de la sedación no farmacológica. A este respecto, en una encuesta reciente realizada en España, todos los hospitales participantes (100%) reportaron el uso de sacarosa35. Cabe destacar que hasta un 70% de los hospitales españoles reportaron el uso de sedación/analgesia farmacológica antes del procedimiento35, en comparación con el 52% en Europa36. En la literatura científica también existe controversia respecto al tipo de fármaco y la dosis adecuados en caso de optar por la sedación farmacológica37. En el presente consenso, la mayoría de los panelistas indicarían la sedación farmacológica, dando preferencia a los derivados de la morfina (76%). De manera similar, varias encuestas han constatado que los agentes más utilizados para la sedación son los opiáceos (23%-63%), seguidos del propofol (5%-23%), las benzodiazepinas (5%-23%), la ketamina (9%) y los relajantes musculares (9%)35,36.
En cuanto al seguimiento, se ha demostrado que los recién nacidos prematuros moderados y tardíos tienen riesgo de sufrir trastornos del neurodesarrollo38–40. En consonancia, los expertos coincidieron en recomendar el seguimiento a largo plazo. Son necesarios estudios para determinar los factores de riesgo de evolución adversa y poder así identificar a los niños que requieran seguimiento especializado. Las secuelas a largo plazo en recién nacidos prematuros tardíos incluyen el deterioro de la función pulmonar en la edad escolar y la adolescencia41. Un estudio prospectivo longitudinal en curso (LaPrem) está evaluando el impacto del nacimiento prematuro (32-36 semanas de gestación) en el neurodesarrollo, el desarrollo cerebral y la salud respiratoria en la edad escolar10. Paralelamente, el grupo de trabajo SEN32-36 de la Sociedad Española de Neonatología está realizando un estudio a nivel nacional con el mismo objetivo.
El tamaño «reducido» del panel podría considerarse una limitación, aunque no se ha establecido el número óptimo de panelistas para un consenso Delphi. Además, los paneles pequeños pueden generar criterios fiables cuando están compuestos por expertos altamente cualificados (como es el caso del presente estudio). Por otra parte, no se pueden obviar las limitaciones intrínsecas del diseño Delphi, como por ejemplo que los resultados deriven de opiniones sin analizarse datos retrospectivos o prospectivos. Además, la realización de estudios con potencia estadística centrados específicamente en prematuros moderados/tardíos ayudará a esclarecer el tratamiento óptimo para estos pacientes y a identificar factores pronósticos. Además, en el futuro sería de sumo interés realizar estudios para evaluar el papel de los corticoides prenatales en los recién nacidos prematuros tardíos, necesitándose además estudios adicionales para identificar los factores de riesgo prenatales y postnatales del deterioro de la función pulmonar en la edad escolar.
A falta de datos concluyentes sobre la prevención, el diagnóstico, el tratamiento y el seguimiento del SDR en prematuros moderados/tardíos, y dado que la mayoría de las reglas de decisión clínica se han extrapolado de estudios realizados en prematuros nacidos antes de las 32 semanas de gestación, el presente estudio puede ayudar a orientar la toma de decisiones, al menos hasta que haya más evidencia disponible.
FinanciaciónChiesi España proporcionó apoyo financiero para el desarrollo y la realización de este estudio, así como apoyo metodológico y de redacción médica.
Conflicto de interesesLos autores no tienen conflictos de interés que declarar.
Nuestro agradecimiento a todos los expertos que participaron en la encuesta Delphi, Jemina Moreto, Ph.D., de Trialance, por su colaboración en la redacción del manuscrito y Carmen González, de GOT IT Consulting, por brindarnos apoyo metodológico.