La masa grasa es mayor en lactantes pretérmino tardíos que en lactantes nacidos a término al mes de vida y esto podría ser un factor de riesgo adicional para el síndrome metabólico en la vida adulta.
ObjetivosPara evaluar la composición corporal (CC) en prematuros tardíos utilizamos el análisis de impedancia bioeléctrica y buscamos determinar qué parámetro antropométrico está asociado con la CC. Nuestra hipótesis es que el peso para la longitud está asociado con el índice de masa grasa (IMG) normalizado por longitud al año de vida.
Materiales y métodosRealizamos un estudio de cohortes prospectivo con 2 grupos: prematuros tardíos y nacidos a término. Los datos de CC se midieron mediante análisis de impedancia bioeléctrica. Se calcularon la masa grasa, el IMG, la masa libre de grasa y el índice de MLG normalizado por talla a los 1, 6 y 12 meses de vida. Luego determinamos la asociación del IMG con los parámetros antropométricos mediante un análisis de regresión lineal múltiple.
ResultadosIncluimos 97 prematuros tardíos y 47 nacidos a término, aunque la evaluación de CC se realizó en 66 y 33 a los 12 meses de vida. Al mes, el contenido de masa libre de grasa fue mayor en los recién nacidos prematuros tardíos (4013 frente a 3524g); a los 6 meses, tuvieron una mayor velocidad de incremento de peso (5480g versus 4604g) y a los 12 meses de vida, el contenido de masa libre de grasa y el índice de MLG de los recién nacidos prematuros tardíos fue menor que el de los recién nacidos a término (7232 versus 7813g; 12,55 versus 13.26). Según el análisis de regresión multivariable, la puntuación z del peso para la talla a los 12 meses se asoció positivamente con el IMG a los 12 meses en todos los lactantes.
ConclusiónLa puntuación z del peso para la talla a los 12 meses está estrechamente relacionada con el IMG al año de vida. Se necesitan más estudios para investigar si un incremento en este parámetro antropométrico puede modular el riesgo de enfermedades crónicas.
The fat mass is greater in late preterm than full term infants at 1 month post birth, which may be an additional risk factor for metabolic syndrome in adulthood.
ObjectivesTo evaluate body composition (BC) in late preterm infants using bioelectrical impedance analysis to determine which anthropometric parameters are associated with BC. Our hypothesis was that weight-for-length is associated with the length-normalized fat mass index (FMI) at 1 year of life.
Materials and methodsWe carried out a prospective cohort study in 2 groups: late preterm infants and full term infants. We obtained BC data by bioelectrical impedance analysis. We calculated the fat mass, FMI, fat-free mass (FFM) and length-normalized FFM index at 1, 6 and 12 months of life. After, we assessed the association of the FMI with anthropometric parameters using multiple linear regression analysis.
ResultsThe study included 97 late preterm and 47 full term infants, although at 12 months of life, the BC assessment was performed on 66 and 33 infants, respectively. Late preterm infants, compared to full term infants, had a higher FFM at 1 month (4013g vs. 3524g), a higher weight velocity at 6 months (5480g vs. 4604g) and a lower FFM (7232g vs. 7813g) and FFM index (12.55 vs. 13.26) at 12 months of life. The multivariate regression analysis showed that the weight-for-length z-core at 12 months was positively associated with the FMI at 12 months in all infants.
ConclusionThe weight-for-length z-score at 12 months is strongly associated with the FMI at 1 year of life. Further studies are needed to investigate whether an increment in this anthropometric parameter may modulate the risk of chronic diseases.
La Academia Americana de Pediatría considera que el crecimiento de los lactantes pretérmino ha de asemejarse al crecimiento fetal intrauterino para conseguir un desarrollo posnatal óptimo1, lo que puede llevar a la sobrealimentación para prevenir o tratar el retraso del crecimiento extrauterino2. El proyecto INTERGROWTH-21 (un estudio poblacional multicéntrico realizado entre 2009 y 2014 en 8 lugares distintos del mundo) sugiere que reducir la ganancia de peso postnatal en prematuros tardíos podría ser beneficioso, aunque esta recomendación aún no se ha adoptado de manera generalizada3. La ganancia de peso total, el parámetro clínico empleado con mayor frecuencia para guiar el manejo nutricional en los prematuros, no diferencia entre ganancias proporcionadas de masa grasa (MG) y masa libre de grasa (MLG). Consideradas por separado, la MLG y la MG son estimadores más exactos del estado nutricional que el peso total. En lactantes, los índices de MG y de MLG (IMG e IMLG) normalizados por longitud podrían ser útiles para comparar la composición corporal (CC) en individuos de distintas tallas, especialmente en lactantes pretérmino4. Más recientemente se ha demostrado que la CC está alterada en lactantes pretérmino, con un contenido mayor de MG y un contenido menor de MLG que los nacidos a término1,2. Además, la CC puede variar en base a la alimentación en los primeros meses de vida (lactancia materna o fórmula artificial) y depende de la edad gestacional (EG) (pretérmino/a término)5–7.
Aún no se sabe con certeza cuál es el patrón de crecimiento óptimo, ya que tanto el rápido crecimiento temprano como el fallo de medro tienen aparentes desventajas. No obstante, se ha demostrado que la calidad del crecimiento en términos de CC es tan importante como su cantidad. Por lo tanto, es esencial que comprendamos cómo evaluar la CC en prematuros en los primeros meses de vida para poder establecer el manejo nutricional necesario para optimizar el desarrollo y la evolución futura8.
El análisis de impedancia bioeléctrica (BIA) es un método indirecto para analizar la CC no invasivo, portátil y seguro que se puede emplear en neonatos y lactantes sin necesidad de extraer sangre o de manipular excesivamente a bebés potencialmente frágiles1. Se basa en el paso de una corriente eléctrica alterna débil a través del sujeto a estudio, midiéndose la oposición de los tejidos al flujo de la corriente. El agua corporal es el principal volumen conductor en humanos, por lo que las mediciones obtenidas mediante BIA reflejan el agua corporal total. Como la práctica mayoría del agua corporal se encuentra en la MLG, el BIA también puede emplearse para estimar la MLG mediante una ecuación predictiva que transforma el valor de impedancia en una estimación de la MLG, normalmente empleando una combinación de talla, peso, sexo y edad1,8. Sus ventajas son la simplicidad y rapidez de la toma de medidas, su bajo coste y un error interobservador bajo9,10. La interpretación del BIA parte del supuesto de que la grasa no es conductiva, pero debido a una mayor vascularización y un mayor contenido de agua en el tejido adiposo al comienzo de la vida, en este período dicho supuesto podría no ser fiable. En bebés, también es complicado evitar artefactos de movimiento, lo que también afecta a su precisión. Los resultados del BIA también se ven afectados por el tamaño corporal, el sexo y la enfermedad, además de que los estudios disponibles han empleado un amplio abanico de frecuencias, modelos y colocaciones de electrodos que limitan su generalización. El interés del BIA radica en el bajo coste y la portabilidad de esta tecnología. Aunque son necesarios estudios de validación adicionales para establecer valores de referencia adecuados para la CC, el BIA es lo suficientemente fiable para su uso en el estudio de la CC en la infancia, aunque no esté listo para su aplicación rutinaria en la práctica clínica habitual8. Su precisión podría mejorarse mediante la aplicación de protocolos de medición estandarizados y asegurando la precisión de las medidas de longitud1.
La mayoría de los estudios han encontrado un contenido de MG y un IMG mayores en prematuros tardíos a la edad corregida a término y al mes de edad corregida, no encontrando diferencias con los nacidos a término a partir de los 3 meses de edad corregida11–16, y pocos estudios han evaluado las diferencias en la CC entre ellos entre los 4 y 12 meses de vida. Además, el estudio de Villar et al. mostró que el depósito de MLG tiene un papel dominante en los cambios de peso fetales al final de la gestación y que la simple relación peso/longitud al nacer según la EG es mejor predictor que el índice de masa corporal (IMC) o el índice ponderal de los parámetros de CC por su mayor correlación con la grasa corporal y la MLG17.
El objetivo del estudio fue describir los cambios en el peso corporal, la MG y la MLG en prematuros tardíos durante los primeros 12 meses de vida por medio del BIA, así como determinar qué parámetro antropométrico está asociado con la CC. Nuestra hipótesis era que la puntuación z del peso para la longitud está asociada con el IMG al año de vida.
MétodosEstudio observacional de cohortes prospectivo realizado en una unidad neonatal (Hospital General Universitario Santa Lucía de Cartagena, España) entre 2014 y 2015.
Los participantes fueron reclutados al nacer y evaluados al mes y a los 6 y 12 meses de vida (empleándose la edad corregida para los prematuros tardíos).
El estudio fue aprobado por el comité ético de investigación clínica del hospital (TI 14/15) y se obtuvo el consentimiento informado por escrito de los padres para la participación de los neonatos en el estudio.
Los grupos de estudio fueron prematuros tardíos y nacidos a término, todos ellos nacidos en el Hospital General Universitario Santa Lucía de Cartagena (España).
Del total de neonatos ingresados en la unidad neonatal entre agosto de 2014 y agosto de 2015, se incluyó a 97 prematuros tardíos en el estudio. El grupo de referencia fue una muestra de conveniencia de 47 nacidos a término. Los criterios de inclusión fueron los siguientes: EG de 34+0/7 a 36+6/7 en pretérminos tardíos, y de 37+0 a 41+6/7 en nacidos a término. Los criterios de exclusión fueron: presencia de anomalía congénita mayor o de enfermedad cardíaca, neurológica, renal, endocrina, gastrointestinal o infecciosa grave, o falta de consentimiento informado firmado por los padres o tutores legales.
Tras obtenerse el consentimiento, se recogió información de los historiales médicos sobre sexo y EG de los lactantes, el IMC y el incremento materno de peso durante la gestación, así como la alimentación con lactancia materna o fórmula artificial en los primeros 2 días de vida y en cada momento de estudio referida por los padres.
En todos los participantes se midieron los parámetros antropométricos sin ropa.
El peso, la longitud en decúbito supino y el perímetro craneal se midieron al nacer, al mes, a los 6 meses y a los 12 meses de vida. El peso se midió con una báscula digital SECA con una precisión de 10g y la longitud con un infantómetro SECA con una precisión de 1mm. El perímetro craneal se midió con una cinta métrica inextensible con una precisión de 1mm. Los indicadores de crecimiento se calcularon en base a las tablas de crecimiento de Olsen en los recién nacidos y a los estándares de crecimiento de la Organización Mundial de la Salud en los lactantes, incluyendo las puntuaciones z del peso para la longitud y de la velocidad de incremento de peso18,19. Las medidas antropométricas se transformaron en puntuaciones z mediante el método LMS (Cole y Green)20.
La CC se evaluó mediante el analizador de bioimpedancia BIA 101 (Akern, Florencia, Italia), un dispositivo portátil no invasivo que se utiliza mediante la colocación de electrodos. Las medidas de CC se tomaron con los bebés vestidos pero sin guantes o calcetines, 2h después de ser alimentados, a una temperatura ambiente de 27°C. Se realizó una medición, que se repitió en los casos de aparición de artefactos o valores erróneos. La ecuación de referencia utilizada es una ecuación genérica derivada en niños mayores y adultos21.
La MG y la MLG se normalizaron según la longitud para obtener el IMG y el IMLG (masa grasa/longitud2 y masa libre de grasa/longitud2).
Análisis estadísticoSe calculó la media y la desviación estándar para las variables continuas, y frecuencias absolutas y porcentajes para las variables categóricas. Las variables categóricas se compararon con la prueba χ2 y las continuas mediante la prueba t de Student o la prueba U de Mann-Whitney dependiendo de si su distribución era normal. En primer lugar, se exploró qué predictores estaban asociados al IMG a los 12 meses (sexo, tipo de alimentación, EG [prematuro tardío/a término] y variables antropométricas) mediante análisis de regresión lineal univariante. Se realizó un análisis de sensibilidad en la muestra estratificada. El coeficiente de correlación de Pearson se utilizó para determinar la asociación entre variables antropométricas como las puntuaciones z del peso para la longitud y de la velocidad de incremento de peso (0-6 meses y 6-12 meses) y el IMG a los 12 meses. La asociación del IMG con variables antropométricas cuantitativas se analizó mediante un modelo de regresión lineal multivariable ajustado (método Enter), incluyendo todas las covariables con un valor de p inferior a 0,05 tras verificarse la ausencia de multicolinealidad entre ellas (test de tolerancia). El análisis de datos se llevó a cabo con el software estadístico SPSS® versión 21 (SPSS Inc., Chicago, Illinois, EE. UU.). El nivel de significación estadística se estableció en 0,05.
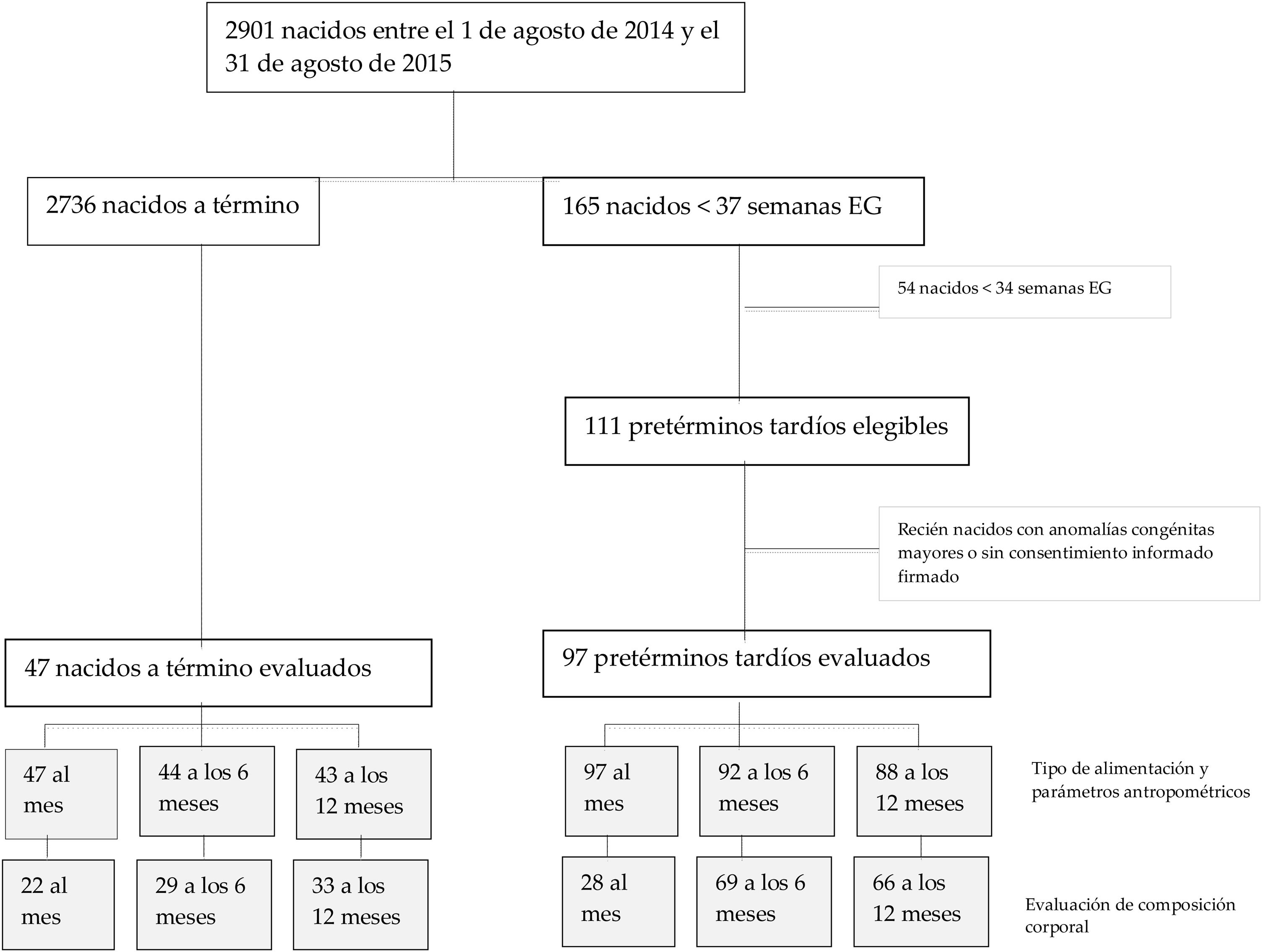
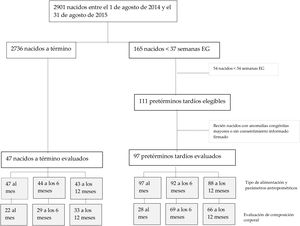
ResultadosHubo un total de 165 nacimientos pretérmino, correspondiendo a 111 pretérminos tardíos y a 54 nacidos antes de las 34 semanas de EG. La evaluación al primer mes de vida se llevó a cabo en 97 pretérminos tardíos y 47 nacidos a término, a los 6 meses de vida en 92 y 44, respectivamente, y a los 12 meses en 88 y 43 (véase la figura 1, que presenta un diagrama de flujo de la muestra de estudio). Las características basales y maternas al nacimiento se muestran en la tabla 1. Ninguno de los recién nacidos requirió diuréticos o ventilación mecánica. El BIA se utilizó para evaluar la CC, sin detectarse efectos adversos, y de media se tuvo que repetir en un 20% de los sujetos por fallos en la medición inicial. La duración del procedimiento fue de unos 3 minutos.
Diagrama de flujo de la muestra de estudio. Los cuadros de la derecha muestran las razones por las que se excluyó a los lactantes del estudio. Las áreas en gris claro corresponden a los lactantes incluidos en el análisis al mes, a los 6 meses y a los 12 meses (con el consentimiento de los padres a su evaluación).
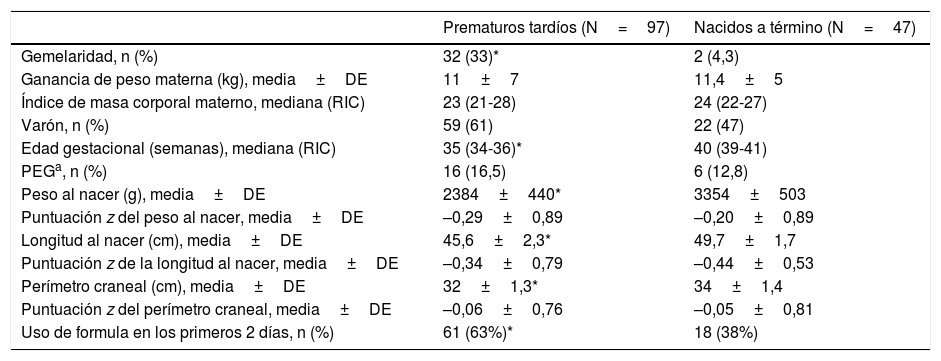
Características basales de los lactantes y maternas en la muestra final
| Prematuros tardíos (N=97) | Nacidos a término (N=47) | |
|---|---|---|
| Gemelaridad, n (%) | 32 (33)* | 2 (4,3) |
| Ganancia de peso materna (kg), media±DE | 11±7 | 11,4±5 |
| Índice de masa corporal materno, mediana (RIC) | 23 (21-28) | 24 (22-27) |
| Varón, n (%) | 59 (61) | 22 (47) |
| Edad gestacional (semanas), mediana (RIC) | 35 (34-36)* | 40 (39-41) |
| PEGa, n (%) | 16 (16,5) | 6 (12,8) |
| Peso al nacer (g), media±DE | 2384±440* | 3354±503 |
| Puntuación z del peso al nacer, media±DE | –0,29±0,89 | –0,20±0,89 |
| Longitud al nacer (cm), media±DE | 45,6±2,3* | 49,7±1,7 |
| Puntuación z de la longitud al nacer, media±DE | –0,34±0,79 | –0,44±0,53 |
| Perímetro craneal (cm), media±DE | 32±1,3* | 34±1,4 |
| Puntuación z del perímetro craneal, media±DE | –0,06±0,76 | –0,05±0,81 |
| Uso de formula en los primeros 2 días, n (%) | 61 (63%)* | 18 (38%) |
DE: desviación estándar; PEG: pequeño para la edad gestacional; RIC: rango intercuartílico.
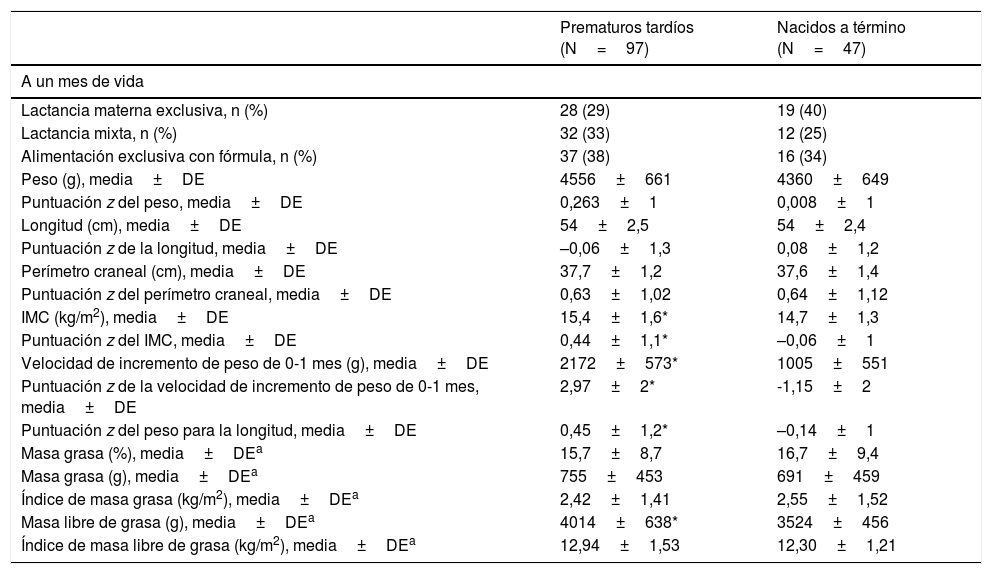
En la primera evaluación, el IMC y la puntuación z del IMC, el peso para la longitud y la velocidad de incremento de peso fueron mayores en los prematuros tardíos que en los nacidos a término. En cuanto a la CC, el contenido de MLG (g) fue significativamente mayor en los prematuros tardíos al mes de vida que en los nacidos a término, mientras que la MG y el IMG fueron similares (tabla 2).
Tipo de alimentación y medidas antropométricas y de composición corporal en cada momento de estudio
| Prematuros tardíos (N=97) | Nacidos a término (N=47) | |
|---|---|---|
| A un mes de vida | ||
| Lactancia materna exclusiva, n (%) | 28 (29) | 19 (40) |
| Lactancia mixta, n (%) | 32 (33) | 12 (25) |
| Alimentación exclusiva con fórmula, n (%) | 37 (38) | 16 (34) |
| Peso (g), media±DE | 4556±661 | 4360±649 |
| Puntuación z del peso, media±DE | 0,263±1 | 0,008±1 |
| Longitud (cm), media±DE | 54±2,5 | 54±2,4 |
| Puntuación z de la longitud, media±DE | –0,06±1,3 | 0,08±1,2 |
| Perímetro craneal (cm), media±DE | 37,7±1,2 | 37,6±1,4 |
| Puntuación z del perímetro craneal, media±DE | 0,63±1,02 | 0,64±1,12 |
| IMC (kg/m2), media±DE | 15,4±1,6* | 14,7±1,3 |
| Puntuación z del IMC, media±DE | 0,44±1,1* | –0,06±1 |
| Velocidad de incremento de peso de 0-1 mes (g), media±DE | 2172±573* | 1005±551 |
| Puntuación z de la velocidad de incremento de peso de 0-1 mes, media±DE | 2,97±2* | -1,15±2 |
| Puntuación z del peso para la longitud, media±DE | 0,45±1,2* | –0,14±1 |
| Masa grasa (%), media±DEa | 15,7±8,7 | 16,7±9,4 |
| Masa grasa (g), media±DEa | 755±453 | 691±459 |
| Índice de masa grasa (kg/m2), media±DEa | 2,42±1,41 | 2,55±1,52 |
| Masa libre de grasa (g), media±DEa | 4014±638* | 3524±456 |
| Índice de masa libre de grasa (kg/m2), media±DEa | 12,94±1,53 | 12,30±1,21 |
| Prematuros tardíos (N=92) | Nacidos a término (N=44) | |
|---|---|---|
| A los 6 meses | ||
| Meses de lactancia materna exclusiva, mediana (RIC) | 3 (0-7) | 2 (1-6) |
| Peso (g), media±DE | 7870±1083 | 7974±792 |
| Puntuación z del peso, media±DE | 0,141±1,13 | 0,386±0,84 |
| Longitud (cm), media±DE | 67,8±2,7 | 67,9±2,4 |
| Puntuación z de la longitud, media±DE | 0,41±1,2 | 0,61±1 |
| Perímetro craneal (cm), mediana (RIC) | 43,5 (42,7-44,5) | 43,5 (42,6-44) |
| Puntuación z del perímetro craneal, mediana (RIC) | 0,54 (–0,24-1,27) | 0,58 (0,13-1,37) |
| IMC (kg/m2), media±DE | 17±1,5 | 17,2±1,4 |
| Puntuación z del IMC, media±DE | –0,12±1,02 | 0,06±0,99 |
| Velocidad de incremento de peso de 0-6 meses (g), media±DE | 5480±988* | 4604±745 |
| Puntuación z de la velocidad de incremento de peso de 0-6 meses, media±DE | 0,82±1,1* | –0,21±1 |
| Puntuación z del peso para la longitud, media±DE | –0,01±1 | 0,17±0,9 |
| Masa grasa (%), media±DEb | 26,3±8,3 | 26±8,7 |
| Masa grasa (g), media±DEb | 2105±797 | 2132±762 |
| Índice de masa grasa (kg/m2), media±DEb | 4,54±1,6 | 4,57±1,6 |
| Masa libre de grasa (g), media±DEb | 5174±1114 | 5986±849 |
| Índice de masa libre de grasa (kg/m2), media±DEb | 12,5±1,3 | 12,8±1,7 |
| Prematuros tardíos (N=88) | Nacidos a término (N=43) | |
|---|---|---|
| A los 12 meses | ||
| Meses de lactancia materna exclusiva, mediana (RIC) | 3,5 (0-9) | 2 (1-9) |
| Peso (g), media±DE | 9719±1350 | 9932±1062 |
| Puntuación z del peso, media±DE | 0,243±1,15 | 0,544±0,89 |
| Longitud (cm), media±DE | 75,8±2,8 | 76,2±2,4 |
| Puntuación z de la longitud, media±DE | 0,34±1,06 | 0,60±0,9 |
| Perímetro craneal (cm), media±DE | 46±1,4 | 46±1,5 |
| Puntuación z del perímetro craneal, mediana (RIC) | 0,33 (–0,05–0,8) | 0,44 (–0,05-1,5) |
| IMC (kg/m2), media±DE | 16,8±1,5 | 17±1,3 |
| Puntuación z del IMC, media±DE | 0,06±1,11 | 0,28±0,91 |
| Velocidad de incremento de peso de 6-12 meses (g), media±DE | 1833±493 | 1969±645 |
| Puntuación z de la velocidad de incremento de peso de 6-12 meses, media±DE | –0,48±0,9 | –0,25±1,1 |
| Puntuación z del peso para la longitud, media±DE | 0,13±1,1 | 0,39±0,9 |
| Masa grasa (%), mediana (RIC)c | 25,3 (20-30) | 23 (19-26) |
| Masa grasa (g), media±DEc | 2442±834 | 2274±870 |
| Índice de masa grasa (kg/m2), media±DEc | 4,2±1,3 | 3,8±1,4 |
| Masa libre de grasa (g), media±DEc | 7232±1086* | 7813±1163 |
| Índice de masa libre de grasa (kg/m2), media±DEc | 12,5±1,3* | 13,2±1,5 |
DE: desviación estándar; IMC: índice de masa corporal; RIC: rango intercuartílico.
Subgrupo de prematuros tardíos y nacidos a término cuya composición corporal fue evaluada (n=28 y n=22, respectivamente).
Subgrupo de prematuros tardíos y nacidos a término cuya composición corporal fue evaluada (n=69 y n=29, respectivamente).
En la segunda evaluación, la velocidad de incremento de peso y su puntuación z fueron superiores en los prematuros tardíos que en los nacidos a término. En el resto de los parámetros antropométricos y de CC y los meses de lactancia materna exclusiva, no se encontraron diferencias significativas entre ambos grupos (tabla 2).
En la última evaluación, el contenido de MLG (g) y el IMLG fueron inferiores en los prematuros tardíos en comparación con los nacidos a término (tabla 2).
El análisis crudo de las asociaciones con los predictores mostró que el sexo, el tipo de alimentación (en las primeras 48h de vida y a un mes, 6 meses y 12 meses de vida) y la EG (prematuro tardío/nacido a término) no se asociaban al IMG al año de vida (p>0,05).
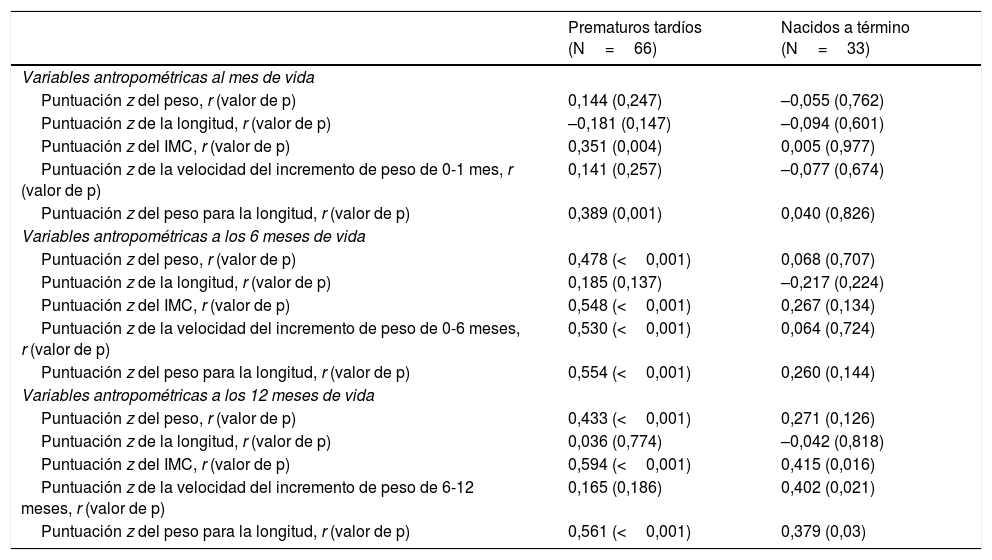
El análisis de regresión lineal simple y el coeficiente de correlación de Pearson Mostraron una asociación significativa entre el IMG a los 12 meses de vida y la puntuación z del peso para la longitud en cada momento de estudio y la puntuación z de la velocidad de incremento peso (0-6 meses y 6-12 meses) (tablas 3 y 4).
Asociación entre el índice de masa grasa a los 12 meses y variables antropométricas (correlación de Pearson)
| Prematuros tardíos (N=66) | Nacidos a término (N=33) | |
|---|---|---|
| Variables antropométricas al mes de vida | ||
| Puntuación z del peso, r (valor de p) | 0,144 (0,247) | –0,055 (0,762) |
| Puntuación z de la longitud, r (valor de p) | –0,181 (0,147) | –0,094 (0,601) |
| Puntuación z del IMC, r (valor de p) | 0,351 (0,004) | 0,005 (0,977) |
| Puntuación z de la velocidad del incremento de peso de 0-1 mes, r (valor de p) | 0,141 (0,257) | –0,077 (0,674) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,389 (0,001) | 0,040 (0,826) |
| Variables antropométricas a los 6 meses de vida | ||
| Puntuación z del peso, r (valor de p) | 0,478 (<0,001) | 0,068 (0,707) |
| Puntuación z de la longitud, r (valor de p) | 0,185 (0,137) | –0,217 (0,224) |
| Puntuación z del IMC, r (valor de p) | 0,548 (<0,001) | 0,267 (0,134) |
| Puntuación z de la velocidad del incremento de peso de 0-6 meses, r (valor de p) | 0,530 (<0,001) | 0,064 (0,724) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,554 (<0,001) | 0,260 (0,144) |
| Variables antropométricas a los 12 meses de vida | ||
| Puntuación z del peso, r (valor de p) | 0,433 (<0,001) | 0,271 (0,126) |
| Puntuación z de la longitud, r (valor de p) | 0,036 (0,774) | –0,042 (0,818) |
| Puntuación z del IMC, r (valor de p) | 0,594 (<0,001) | 0,415 (0,016) |
| Puntuación z de la velocidad del incremento de peso de 6-12 meses, r (valor de p) | 0,165 (0,186) | 0,402 (0,021) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,561 (<0,001) | 0,379 (0,03) |
IMC: índice de masa corporal; r: coeficiente de correlación de Pearson.
Asociación entre el índice de masa grasa a los 12 meses y variables antropométricas (regresión lineal simple)
| Muestra total (99)Beta (valor de p) | |
|---|---|
| Variables antropométricas al mes de vida | |
| Puntuación z del incremento de peso de 0-1 mes, r (valor de p) | 0,126 (0,218) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,293 (0,003) |
| Variables antropométricas a los 6 meses de vida | |
| Puntuación z del incremento de peso de 0-6 meses, r (valor de p) | 0,390 (0,001) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,424 (0,001) |
| Variables antropométricas a los 12 meses de vida | |
| Puntuación z del incremento de peso de 6-12 meses, r (valor de p) | 0,242 (0,016) |
| Puntuación z del peso para la longitud, r (valor de p) | 0,472 (0,001) |
Beta: coeficiente tipificado.
En el análisis de regresión múltiple se incluyeron todas las covariables mencionadas anteriormente con un valor de p inferior a 0,05, y la puntuación z del peso para la longitud a los 12 meses continuó asociándose significativamente (asociación positiva) con el IMG en ambos grupos de lactantes (tabla 5).
Asociaciones de los predictores con el índice de masa grasa a los 12 meses de vida en el análisis multivariable
| Beta | Valor de p | |
|---|---|---|
| Índice de masa grasa a los 12 meses | ||
| Puntuación z del peso para la longitud al mes | 0,067 | 0,530 |
| Puntuación z del incremento de peso de 0-6 meses | –0,046 | 0,775 |
| Puntuación z del peso para la longitud a los 6 meses | 0,007 | 0,971 |
| Puntuación z del incremento de peso de 6-12 meses | –0,138 | 0,390 |
| Puntuación z del peso para la longitud a los 12 meses | 0,604 | 0,033 |
Beta: coeficiente tipificado.
Covariables incluidas en el modelo: Puntuación z del peso para la longitud al mes, puntuación z del incremento de peso de 0-6 meses, puntuación z del peso para la longitud a los 6 meses, puntuación z del incremento de peso de 6-12 meses, puntuación z del peso para la longitud a los 12 meses.
Nuestro estudio demuestra una asociación positiva entre la puntuación z del peso para la longitud a los 12 meses y el IMG al año de vida, apoyando la hipótesis inicial.
Los lactantes prematuros tienen un riesgo mayor de problemas de crecimiento, como el bajo peso, talla baja para la edad y bajo peso para la talla en los primeros 2 años de vida, un contenido menor de MLG y un contenido mayor de MG15,22,23. Este crecimiento desproporcionado puede aumentar el riesgo de obesidad y de síndrome metabólico así como de retraso cognitivo en la infancia tardía y la edad adulta22–25.
El BIA es un método no invasivo y de bajo coste que se utiliza con frecuencia para evaluar la CC y el estado clínico de los pacientes, ya que mide el agua corporal total8,10. Aunque es posible que se produzcan artefactos de movimiento y que sea necesario repetir la prueba, entre sus ventajas se encuentran su simplicidad y su portabilidad.
En el presente estudio encontramos que el aumento significativo en el peso corporal entre el nacimiento y el mes de vida en los prematuros tardíos se debió principalmente a un aumento en el contenido de MLG (g). El uso del peso corporal para la normalización (%MG como peso de masa grasa/peso corporal o %MLG como peso de masa libre de grasa/peso corporal) no tiene en cuenta incrementos de tejidos específicos de manera independiente, ya que el porcentaje de MG depende de la cantidad de MLG y viceversa. Comparado con el IMC o el porcentaje de grasa corporal, el IMG ofrece una sensibilidad mayor para detectar cambios sutiles en los depósitos de grasa y es un método mejor para evaluar el estado nutricional estático y dinámico4. En nuestro estudio, tras ajustar por la longitud, no se observaron diferencias en el IMG entre los grupos. Por el contrario, otros autores han referido que la ganancia de peso posnatal en prematuros tardíos corresponde en gran parte a una acreción predominante de MG que resulta en un aumento de la adiposidad total en la edad corregida a término y al mes de edad corregida, mientras que a los 3 meses no se han encontrado diferencias significativas entre los prematuros tardíos y los nacidos a término, con un crecimiento similar tanto cuantitativa como cualitativamente11–14,16. Esta rápida recuperación posnatal de la MG constituye un mecanismo de adaptación a la vida extrauterina y podría suponer un factor de riesgo adicional para el síndrome metabólico en la edad adulta13–16.
También se estudió la CC a los 6 y 12 meses de edad corregida en los prematuros tardíos. A los 6 meses no se encontraron diferencias en la CC entre los 2 grupos, pero a los 12 meses el contenido de MLG y el IMLG fueron menores en los prematuros tardíos que en los nacidos a término. También encontramos que la puntuación z del peso para la longitud a los 12 meses, tras ajustar por distintas covariables, se asociaba estrechamente al IMG a los 12 meses de vida, de modo que nuestros resultados podrían ampliar los hallazgos de Villar et al., que realizaron la evaluación al nacimiento, ya que en el presente estudio se evaluó a los lactantes en distintos momentos17.
En lo concerniente a otras variables antropométricas, observamos que los prematuros tardíos tenían mayores puntuaciones z de IMC y de peso para la longitud al mes de edad corregida en comparación con los nacidos a término, así como puntuaciones z superiores de la velocidad de incremento de peso en los primeros 6 meses de vida. A los 12 meses de vida no se detectaron diferencias entre ambos grupos. Hay estudios que describen una asociación entre el nacimiento pretérmino tardío y el bajo peso al año de nacer22,23. Hay asimismo muchos estudios que han encontrado que el incremento de peso corporal entre el nacimiento y el mes de vida se caracteriza por un predominio de la deposición de masa grasa11–14. Nuestros hallazgos difieren de los publicados en otros estudios realizados en prematuros tardíos, lo que consideramos que podría deberse a diferencias en las condiciones socioeconómicas (muestras de distintos países y distintos períodos de estudio) y en los métodos utilizados para evaluar la composición corporal22,23.
Aunque nuestro estudio es de interés clínico, también tiene algunas limitaciones. En primer lugar, el número de lactantes en los que se evaluó la CC fue relativamente pequeño, aunque el seguimiento se extendió hasta los 12 meses. En segundo lugar, no hay ecuaciones validadas en pretérminos y el tejido adiposo contiene más agua al comienzo de la vida. En conclusión, el BIA es factible en prematuros tardíos y la puntuación z del peso para la longitud a los 12 meses está estrechamente relacionada con el IMG al año de vida. Se necesitan más estudios para investigar si un incremento en este parámetro antropométrico puede modular el riesgo de enfermedades crónicas.
FinanciaciónLos autores declaran que no han recibido ninguna financiación para esta investigación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.